в состав ядрышка входит что
Ядрышки – компонент ядра эукариотической клетки
Ядрышки – обязательный компонент ядра эукариотической клетки. Они наблюдаются в ядрах практически всех клеток, но это правило имеет небольшое количество исключений, которые лишь подчеркивают роль ядрышка в жизненном цикле клетки. К таким исключениям относятся клетки яиц, на стадии дробления, здесь ядрышки отсутствуют на ранних этапах эмбриогенеза, и клетки, которые проходят специализацию, как, например, некоторые клетки крови.
Впервые ядрышки были описаны в конце XIX столетия, когда в научных исследованиях стали активно использоваться разнообразные методы окраски ядра. Настоящий прогресс в этом направлении был достигнут при разработке и использовании в цитологии специальных ядрышковых красителей и методов, связанных с применением азотнокислого серебра [1, 2]. В шестидесятых годах прошлого столетия было показано, что ядрышко является основным местом биогенеза рибосом. С этого времени ядрышки стали объектом многих исследований.
В клеточном цикле ядрышки, присутствуют в течение всей интерфазы; в период митоза, в профазе, во время компактизации хромосом, они постепенно исчезают. В метафазе и анафазе ядрышки отсутствуют. Первые признаки новых ядрышек появляются после стадии средней телофазы, когда уже достаточно разрыхлились хромосомы дочерних ядер. В это время близ хромосом, которые деконденсируются, появляются плотные тельца – первичные ядрышки [3]. Обычно, их количество больше, чем в интерфазе. Позднее, в G1-периоде клеточного цикла первичные ядрышки растут, начинают объединяться одно за другим, их общее количество уменьшается, но возрастает объем. Общий объем ядрышка увеличивается вдвое в S- G2- периодах клеточного цикла [4].
Образование ядрышек топографически связано с определенными зонами на ядрышкообразующих хромосомах. Эти зоны называются ядрышковыми организаторами, или ядрышкообразующими районами (ЯОР) хромосом, которые локализованы в области вторичных перетяжек хромосом. В интерфазных ядрах в структуре ядрышка выделяют следующие составляющие: фибриллярные центры, плотный фибриллярный и гранулярный компоненты, ядрышковые вакуоли, и ассоциированный с ядрышком хроматин [4, 5]. Фибриллярные центры окружены плотными фибриллярными и гранулярными компонентами и содержат расплетенную рДНК и рассматриваются как интерфазные “двойники” митотических ЯОР [6]. Исследования последних лет показали, что число и размеры фибриллярных центров существенно варьирует в клетках, и зависит от их (клеток) функционального состояния, в частности, от интенсивности транскрипции рДНК [5, 7]. Что касается гранулярного компонента ядрышка, то принята точка зрения, что он, прежде всего, представлен дозревающими прерибосомами [4, 5]. В состав ядрышка входят также ферменты: РНК-полимераза-1, РНК-метилаза, топоизомераза-1; ядрышковые протеины, наиболее изученными из которых являются нуклеолин, протеины Р80 и Р105, и фосфопротеины С23 и Р100, все они локализуются преимущественно в зоне фибриллярного центра [4, 7]. На протяжении последних лет в ядрышках идентифицировано более чем 400 белков. Исследования молекулярного строения и содержимого ядрышек продолжаются сегодня и помогают понять широкий спектр ядрышковых функций.
Ядрышко представляет собой комплекс амплифицированных генов рРНК и продуктов – предшественников рибосом, и является источником основной массы цитоплазматической РНК, представленной, главным образом, рибосомной РНК.
Структурная организация ядрышка тесно связана с его функциональной активностью, и зависит от интенсивности транскрипции рДНК, скорости процессинга и выхода зрелых субъединиц рибосом из ядрышка в нуклеоплазму [4]. Поэтому, когда транскрипция и/или обработка рРНК замедлены, ядрышко частично, или полностью теряет структурную целостность. Когда транскрипция блокирована, отмечают сегрегацию ядрышковых компонентов [8]. Когда обработка и созревание рРНК ослаблены, но транскрипция рДНК все еще активна, т.е. когда утрачена связь между транскрипцией рДНК и обработкой рРНК, наблюдают рассеивание ядрышек по всей кариоплазме.
Лабильность морфологических показателей ядрышка (числа, формы, размера, микроскопического строения) считают одним из основных его функциональных свойств [4, 5]. Изменчивость морфологических и химических свойств ядрышек определяется основной их функцией – синтезом клеточной РНК, которая была отмечена Т. Касперсоном [2]. Им было показано, что количество РНК и белка в цитоплазме зависит от объема ядрышка и концентрации в нем РНК. Этот вывод позволяет связать изменения морфологических параметров ядрышек с метаболическими особенностями синтеза РНК и белка в клетке. Так, клетки, которые синтезируют большое количество белка, имеют большое ядрышко или много ядрышек [1, 6]. В малоактивных клетках ядрышко маленькое или его вообще тяжело обнаружить. При обычной функциональной нагрузке, которая отвечает нуждам определенной популяции клеток, структура ядрышка остается практически неизменной. Но в ходе клеточного цикла, в процессе дифференцирования и дедифференцирования, при угнетении или активации синтеза рРНК происходят значительные перестройки ядрышка [4].
Согласно литературным данным количество ядрышек в клетке может изменяться, но их число зависит от генного баланса клетки. Он определяется числом ядрышковых организаторов и увеличивается согласно плоидности ядра [1, 7]. Чаще всего в клетках количество ядрышек меньше, чем число ядрышковых организаторов. Это связано с тем, что при новообразовании они могут сливаться одно с другим, таким образом, в образовании одного ядрышка принимают участие несколько ядрышкообразующих районов (ЯОР) хромосом.
Ряд авторов [8-10,] считает, что увеличение количества ядрышек свидетельствует об амплификации рибосомной ДНК, а некоторые утверждают, что количество ядрышек может быть критерием дифференцирования клетки. Отмечена значительная корреляция между общим объемом ядрышек в клетках и их митотической активностью. При угнетении синтеза рРНК значительно снижается количество ядрышек на клетку, а сами ядрышки резко уменьшаются в размере и уплотняются. Подобную реакцию наблюдают, как при действии на клетки разных ингибиторов синтеза рРНК, так и в процессе естественной инактивации рыбосомных генов 10.
Чаще всего для визуализации ядрышек используется методика Ховела и Блэка [12] – она отличается от других применением коллоида желатина, который выступает в качестве стабилизатора и катализатора реакции, которая проходит в слабокислой среде. Разработаны многочисленные модификации данного метода, позволяющие использовать его при исследовании клеток и тканей, разнообразных организмов [13].
Экспериментальные исследования показали, что реакция серебрения базируется на выборочном связывании нитрата серебра с негистоновыми белками хромосом, которые образуют рибонуклеопротеиновые комплексы из только что синтезированной рРНК. Считают, что в ходе реакции происходит восстановление ионов Ag + до металлического серебра, однако при этом нет единой точки зрения относительно того, какие компоненты белков осуществляют процесс восстановления ионов. Наибольшую родственность к серебру проявляют сульфгидрильные и карбоксильные группы [14]. Есть мнение, что взаимодействие с серебром может осуществляться за счет фосфатных групп, которые связаны с серином и треонином в фосфорилированных белках [13].
При окраске препаратов интерфазных клеток методом Ховела и Блека, ядрышковые организаторы видны в виде черных точек (гранул) на желтом фоне ядер или слабоокрашенных хромосом. Сами ядрышки в интерфазных ядрах окрашиваются в коричневый цвет. Специфичность окраски достигается лишь при соблюдении определенных условий (рН, температуры, времени окрашивания и концентрации AgNO3). В связи с тем, что родственность к серебру проявляют практически все компоненты хроматина, изменение условий проведения реакции ведет к выявлению, кроме ЯОР, других структур. Так, при более продолжительном крашении азотнокислым серебром проявляются центромеры хромосом и центриоли [15].
Нитратом серебра окрашиваются лишь те ядрышковые организаторы, которые в данный момент активно функционируют [14, 15]. Поэтому данный метод не только позволяет выявить ЯОР, но и дает возможность оценить функциональное состояние рыбосомных генов в клетке.
Степень аргентофильности ядрышек тесно связана с пролиферативным потенциалом клеток и уровнем их дифференцирования. Это дает возможность использовать явление аргентофильности ядрышек для изучения роста, дифференцирования и других клеточных процессов, при которых происходит изменение функционального состояния клетки, опосредствованное вариацией функциональной активности рыбосомных генов [13]. Вывод о том, что азотнокислым серебром окрашиваются лишь активные ЯОР, получил подтверждение в экспериментах по искусственному усилению и угнетению синтеза рРНК, эмбриогенеза у мышей и птиц, гаметогенеза у млекопитающих, в том числе и человека [14]. С помощью иммуноцитогенетических методов показано, что интерфазные ядрышки и хромосомные ЯОР млекопитающих, которые окрашиваются серебром, прямо отражают транскрипционную активность генов рРНК [15]. Показано, что способность определенного сайта данной хромосомы окрашиваться серебром постоянна у данного индивидуума, но существуют индивидуальные вариации в числе и распределении ЯОР, что заметно при крашении азотнокислым серебром. Установлено, что способность данного сайта окрашиваться серебром или, другими словами, способность данной хромосомы образовывать ядрышко передается наследственно. В связи с этим метод окраски азотнокислым серебром успешно применяют в кариосистематике.
Имеется много работ посвященных изучению изменения ядрышковых характеристик растительных и животных организмов в разных условиях, при влиянии естественных и антропогенных факторов [16].
Показано изменение структуры ядрышек под воздействием цитостатических препаратов в культуре клеток и в экспериментах на лабораторных животных [18]. Авторы отмечают, что данные эффекты характерны для агентов, которые угнетают транскрипцию и процессинг рРНК, блокируют обособление прерыбосом от ядрышка.
Показано увеличение объема ядрышкового материала в клетках растений при воздействии неблагоприятных экологических условий [19]. Более высокую активность ядрышкового аппарата в условиях естественной и антропогенной нагрузок связывают с действием адаптивных механизмов в условиях экстремальности, вызванной природными и антропогенными факторами.
Отмечено влияние малых доз ионизирующей радиации на ядрышковый аппарат зародышей карпа [20]. Показано стимулирующее свойство низких концентраций некоторых мутагенных факторов на гонады рыб и ооциты млекопитающих, следствием, которого является образование большого количества дополнительных ядрышек и усиление биосинтеза белка [21].
При исследовании влияния растворов солей кадмия и хрома на клетки жабр и гепатоцитов рыб Odontesthes bonariensis, показано значительное изменение объема ядрышек в этих клетках в зависимости от концентрации тяжелых металлов [22]. В экспериментах по влиянию растворов кадмия на клетки представителя миксомицет, Physarum polycephalum, отмечено изменение структуры ядрышка, описана его сегрегация, появление множественных ядрышкоподобных телец в ядре и образование кольцевидного ядрышка, при этом наблюдалось значительное снижение синтеза РНК [23]. Подобные изменения наблюдались и при влиянии кадмия на клетки корневой меристемы лука [24]
Приведенный выше обзор, позволяет заключить, что ядрышко – это обязательная структура ядра интерфазной клетки, оно занимает одно из центральных мест в синтезе белка клеткой, и отображает как уровень биосинтетической активности клетки на разных стадиях клеточного цикла, так и функциональное состояние клетки в нормальных условиях и в условиях патологии, или влияния токсичных веществ и других факторов.
Литература:
Фотоматериалы из личного архива автора.

© Наталия Веялкина, кандидат биологических наук, заведующая лабораторией экспериментальных биологических моделей
Размер имеет значение
Размер имеет значение
Ядрышко (Nucleolus) под электронным микроскопом
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Функционирование любого компонента живой клетки контролируется обширной и сложной регуляторной сетью. Не является исключением и ядрышко. Однако механизмы, приводящие к его гипертрофии, были плохо изучены до недавнего времени. Исследование на данную тему представила группа учёных из США и Канады: им удалось выяснить, какие гены влияют на изменение размеров ядрышка.
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Лучшее новостное сообщение».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Что такое ядрышко
Ядрышко — это небольшой субкомпартмент, расположенный в ядре клетки, который осуществляет транскрипцию и процессинг рРНК, а также сборку рибосом. Важность роли, исполняемой ядрышком, можно осознать, обратившись к следующему примеру: активно растущие клетки млекопитающих содержат от 5 до 10 миллионов рибосом каждая, и они должны быть синтезированы всякий раз, как клетка делится [1].
Ядрышки расположены вокруг особых регионов хромосом, гены которых кодируют различные по длине и массе рРНК (5,8S, 18S и 28S рРНК). Эти участки хромосом, пространственно ассоциированные с ядрышком, называют ядрышковыми организаторами. Каждый ядрышковый организатор представляет собой кластер тандемно повторяющихся генов рРНК. Сосредоточенность таких генов в определённом месте ядра, а также интенсивность их транскрипции, обусловливает характерную морфологию ядрышка [2]. ДНК, кодирующую различные варианты рибосомальной РНК, принято называть рДНК. Стоить отметить, что 5,8S, 18S и 28S рРНК транскрибируются в виде единого длинного предшественника, который затем подвергается «разрезанию» на более мелкие (уже функциональные) молекулы, из которых в дальнейшем и собираются сами рибосомы. Реакция эта катализируется ферментом РНК-полимеразой I. 5S же рРНК транскрибируется за пределами ядрышка, а реакция катализируется другим ферментом — РНК-полимеразой III [1].
Однако ядрышко — это не просто транскрибирующаяся рРНК; это рибонуклеопротеиновая частица. Проще говоря, в его состав входят как РНК, так и белок. В структуре ядрышка можно выделить три основные части: гранулярный компонент — это созревающие субъединицы рибосом; фибриллярный компонент — здесь происходит инициация процессинга рРНК; и плотный фибриллярный компонент, где и происходит транскрипция рРНК.
То, что ядрышко способно варьировать в размерах, было известно достаточно давно. К примеру, оно увеличивается в быстрорастущих клетках дрожжей. Что более интересно, гипертрофия ядрышка наблюдается и в раковых клетках человека — это стало одним из основных признаков, характеризующих злокачественную опухоль [3].
Но наблюдаемый размер ядрышка — это лишь вершина айсберга; на деле он прямо зависит от концентрации пре-рРНК в клетке, которая, в свою очередь, положительно коррелирует с активностью РНК-полимеразы I. Синтез рРНК требует больших затрат энергии, и когда клетка испытывает недостаток питания, транскрипция генов рДНК тормозится, и ядрышко уменьшается в размерах. Напротив, в благоприятных условиях клетка начинает активный синтез белка, готовясь к последующему делению, и ей требуется большее число рибосом [4]. Из-за этого она усиливает продукцию рРНК, и ядрышко увеличивает размер. Если мы хотим ответить на вопрос «что влияет на размер ядрышка?», нам стоит понять, что же контролирует активность полимеразы I.
Механизмы регуляции размеров ядрышка
Этим же вопросом задались и биологи из США и Канады, и, чтобы ответить на него, они провели ряд экспериментов. В качестве модельных организмов учёные использовали дрожжи и дрозофилу. Методики исследования для каждого объекта были индивидуальны. Так, для дрожжей была создана генно-инженерная линия, отличная от дикого типа по множеству генов. Гены, не являющиеся жизненно важными, содержали делеции — т.е. они были нерабочими. Жизненно важные же гены состояли из температурно-чувствительных аллелей, и при повышении температуры функционирование их белковых продуктов нарушалось. Для дрозофилы была использована другая методика — здесь гены «глушились» путём РНК-интерференции [5], [6]. Регистрация изменений размера ядрышек производилась схожим образом: в оба организма вводились флуоресцентные белки (посредством репортерных генов), каждый из которых окрашивал цитоплазму, ядро и ядрышко в определённый цвет. Получение и обработка данных осуществлялись посредством автоматизированной конфокальной микроскопии [4].
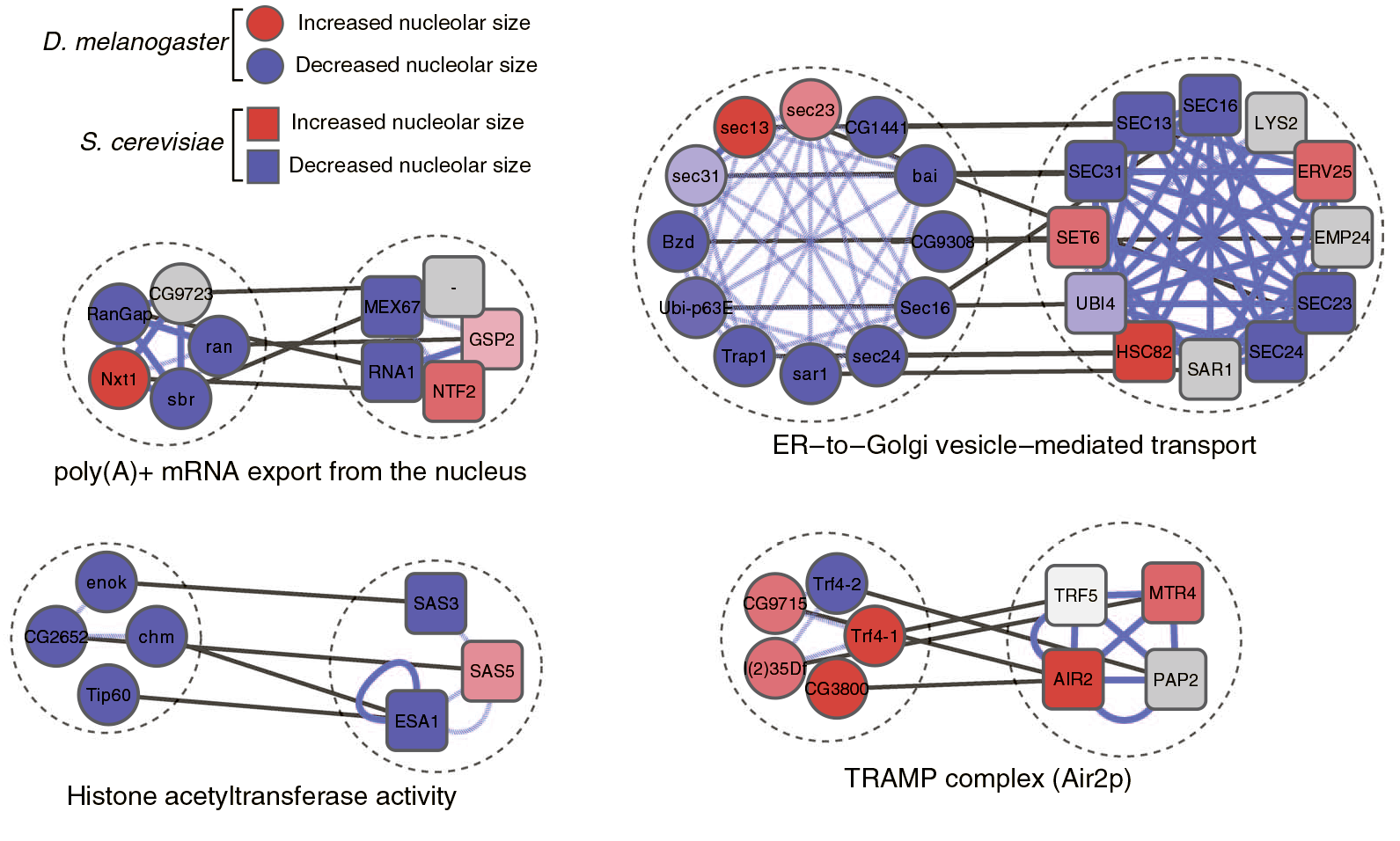
В ходе эксперимента у дрожжей было выявлено 113 генов, мутации в которых вызывали значимые изменения фенотипа ядрышка. И целых 78 из них оказались жизненно важными! Это свидетельствует о том, что корректная регуляция активности полимеразы I крайне важна для жизнеспособности клетки. Если говорить о мухе, то у неё ответственными за изменение размеров ядрышка оказались целых 757 генов. С функциональной точки зрения, белки, кодируемые этими генами, оказались схожими у обоих видов. Более того, белки со схожими функциями, будучи «выключенными», оказывали схожее воздействие на фенотип ядрышка как у дрозофилы, так и у дрожжей (рис. 1).
Рисунок 1. Сравнение мутаций в белках дрожжей (квадраты) и дрозофилы (круги) и их воздействие на фенотип ядрышка. poly(A)+ mRNA export from the nucleus — полиаденилирование и экспорт мРНК из ядра; Histone acetyltransferase activity — ацетилирование гистонов; ER—to—Golgi vesicle—mediated transport — везикулярный транспорт из ЭПР в аппарат Гольджи; TRAMP complex — белковый комплекс, участвующий в процессинге 3′-конца рРНК.
Синим цветом обозначены белки, «выключение» которых уменьшало ядрышко; красным — увеличивало. Интенсивность цвета соответствует степени изменения размеров.
Хорошо заметно, что белки, ответственные за полиаденилирование, экспорт мРНК, ацетилирование гистонов и транспорт, в большинстве случаев вызывают уменьшение размеров ядрышка, в то время как TRAMP увеличивает его. Из этого можно сделать вывод, что TRAMP играет роль супрессора транскрипции рРНК.
К примеру, к увеличению размеров ядрышка приводили мутации в генах, ответственных за регуляцию клеточного цикла, процессинг рибосомальной и матричной РНК и репликацию ДНК. Утрата же функций белками, участвующими в таких фундаментальных процессах, как везикулярный транспорт из ЭР в Гольджи, синтез рРНК, сборка нуклеосом, регуляция транскрипции и ацетилирование гистонов, приводила к фенотипу с уменьшенным ядрышком. Основываясь на этих фактах, можно сделать вывод о том, что регуляция активности полимеразы I — высоко консервативный процесс, который регулируется функционально идентичными белками даже у эволюционно удаленных организмов.
Однако исследователей не удовлетворил этот ответ, и они решили выяснить, имеются ли видоспецифичные регуляторы ядрышкового размера. Таким кандидатом стал белковый комплекс HIR, чьи ортологи содержатся в большинстве эукариотических организмов: от дрожжей до человека. Данный комплекс участвует в целом ряде процессов: сборке нуклеосом, регуляции транскрипции, элонгации, сайленсинге генов и даже старении. Но участие этого белка в транскрипции именно рДНК ранее не было доказано, и исследователи предположили, что HIR в дрожжах обладает такой функцией, и она является видоспецифичной. Учёным удалось найти доказательства своим предположениям: мутации в генах, кодирующих субъединицы комплекса, приводили к повышению концентрации пре-РНК и увеличению ядрышка. Подобный опыт был проведён и для дрозофилы, где мишенью стал HIRA — аналог HIR. Однако в этом случае никакого влияния на размер ядрышка обнаружено не было [4]. Несмотря на высокую консервативность механизмов регуляции активности РНК-полимеразы I, за этот процесс могут быть ответственны и белковые комплексы, часть функций которых специфична для конкретного вида.
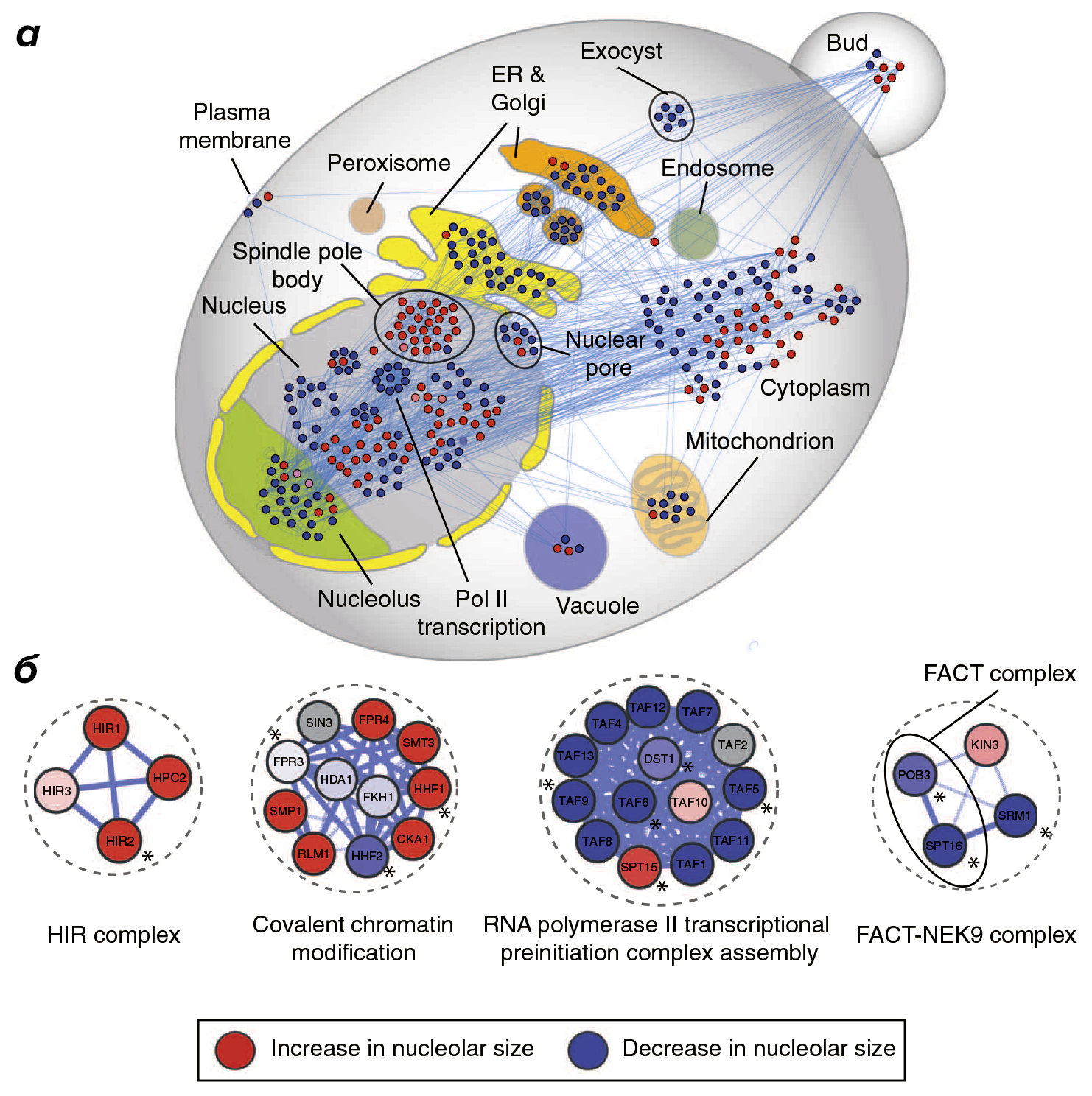
Помимо выяснения функций белков, связанных с активностью полимеразы I, учёные попытались выяснить и их внутриклеточную локализацию. Как оказалось, бóльшая часть из тех, что связана с размером ядрышка, локализована в ядре, ядрышке, эндоплазматическом ретикулуме и аппарате Гольджи (рис. 2), — значит, деятельность этих органелл связана с корректной работой РНК-полимеразы I.
Рисунок 2. Регуляторы транскрипции рДНК у S. cerevisiae. а — Внутриклеточное распределение белков, влияющих на размер ядрышка (на примере дрожжей). Такие белки располагаются во многих органеллах, но больше всего их в ядре и ядрышке. Это согласуется с идеей о том, что варьирование размеров ядрышка вызвано изменением активности РНК-полимеразы I. б — Некоторые белки дрожжей, мутации в которых влияют на фенотип ядрышка. HIR complex — мультифункциональный белковый комплекс, регулирующий транскрипцию, опосредованную полимеразой I. Covalent chromatin modification — белки, ответственные за модификацию хроматина. RNA polymerase II transcriptional preinitiation complex assembly — белки, участвующие в сборке комплекса, необходимого для инициации транскрипции РНК-полимеразой II. FACT—NEK9 complex — белковый комплекс, взаимодействующий с гистонами и влияющий на транскрипцию, осуществляемую РНК-полимеразой II [7].
Легко заметить, что к увеличению ядрышка приводят мутации в тех белках, чьи функции связаны с регуляцией состояния хроматина. В то же время «выключение» белков, влияющих на активность РНК-полимеразы II и, как следствие, на уровень биосинтеза белка, вызывают уменьшение размеров ядрышка.
Как уже отмечалось, для быстрорастущих и делящихся клеток характерно гипертрофированное ядрышко. Здесь учёные и решили выяснить: а всегда ли увеличение размеров ядрышка означает заодно и возрастание скорости роста и деления клеток до аномальных значений? Чтобы ответить на этот вопрос, учёные взяли 50 линий дрожжей с мутациями по не жизненно важным генам, и одну контрольную линию дикого типа. Во время наблюдения не удалось установить никаких значимых различий в скоростях роста и деления между мутантами и диким типом. Из этого можно сделать следующий вывод: увеличенное ядрышко и повышенная активность полимеразы I не являются достаточными факторами для перерождения клетки в раковую.
Фундаментальные исследования — это хорошо, но большинству людей интересно прикладное применение знаний. Так каким же образом данная замечательная работа поможет на практике? Прежде всего, стоит помнить, что не всякое повышение активности РНК-полимеразы I приводит к злокачественному фенотипу, но каждый злокачественный фенотип содержит гиперактивный фермент. Значит, мишенью может служить как сама полимераза, так и гены, контролирующие её работу. К примеру, посредством всё той же РНК-интерференции можно заглушить гены, которые после утраты функций приводят к уменьшению размеров ядрышка, а значит, и к ослаблению синтеза рРНК. Другой путь — непосредственное ингибирование работы РНК-полимеразы I. И такой ингибитор был найден: это препарат CX-3543, обладающий противоопухолевой активностью и проходящий в настоящее время клинические испытания. Действительно, описанная нами работа американских и канадских учёных имеет ценность не только в области фундаментальных исследований, но и помогает найти новые способы терапии рака.
В состав ядрышка входит что
В клеточном цикле ядрышко присутствует в течение всей интерфазы, в профазе по мере компактизации хромосом во время митоза оно постепенно исчезает и отсутствует в мета- и анафазе, вновь появляется в середине телофазы, чтобы сохраняться вплоть до следующего митоза, или до гибели клетки.
Долгое время функциональное значение ядрышка было непонятно. Вплоть до 1950-х годов исследователи считали, что вещество ядрышка представляет собой своего рода запас, который используется и исчезает в момент деления ядра.
Еще в 1930-х годах рядом исследователей (МакКлинток, Хейтц, С.Г. Навашин) было показано, что возникновение ядрышек связано топографически с определенными зонами на особых, ядрышкообразующих хромосомах. Эти зоны были названы ядрышковыми организаторами, а сами ядрышки представлялись как структурное выражение хромосомной активности. Позднее, в 1940-х годах, когда было найдено, что ядрышки содержат РНК, стала понятна их «базофилия», сродство к основным (щелочным) красителям вследствие кислой природы РНК. По данным цитохимических и биохимических исследований, основным компонентом ядрышка является белок: на его долю приходится до 70—80% от сухой массы. Такое большое содержание белка и определяет высокую плотность ядрышек. Кроме белка в составе ядрышка обнаружены нуклеиновые кислоты: РНК (5-14%) и ДНК (2-12%).
Уже в 1950-х годах при изучении ультраструктуры ядрышек в их составе были выявлены гранулы, сходные по своим свойствам с цитоплазматическими гранулами рибонуклеопротеидной природы — с рибосомами. Следующим этапом в изучении ядрышка было открытие принципиального факта — «ядрышковый организатор» является вместилищем генов рибосомных РНК.
Строение рибосом
Рибосома представляет собой элементарную клеточную машину синтеза любых белков клетки. Все они построены в клетке одинаково, имеют одинаковую молекулярную композицию, выполняют одинаковую функцию — синтез белка, поэтому их также можно считать клеточными органоидами. В отличие от других органоидов цитоплазмы (пластид, митохондрий, клеточного центра, мембранной вакуолярной системы и др.) они представлены в клетке огромным числом: за клеточный цикл их образуется 1·10 7 штук. Поэтому основная масса клеточной РНК представляет собой именно рибосомную РНК. РНК рибосом относительно стабильна, рибосомы могут существовать в клетках культуры ткани в течение нескольких клеточных циклов. В печеночных клетках время полужизни рибосом составляет 50-120 ч.
Рибосомы — это сложные рибонуклеопротеидные частицы, в состав которых входит множество молекул индивидуальных (неповторенных) белков и несколько молекул РНК. Рибосомы прокариот и эукариот по своим размерам и молекулярным характеристикам отличаются, хотя и обладают общими принципами организации и функционирования. К настоящему времени методом рентгеноструктурного анализа высокого разрешения полностью расшифрована структура рибосом.
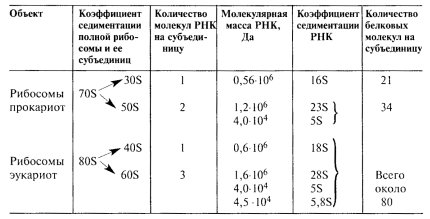
Полная, работающая рибосома состоит из двух неравных субъединиц, которые легко обратимо диссоциируют на большую субъединицу и малую. Размер полной прокариотической рибосомы составляет 20 х 17 х 17 нм, эукариотической — 25 х 20 х 20. Полная прокариотическая рибосома имеет коэффициент седиментации 70S и диссоциирует на две субъединицы: 50S и 30S. Полная эукариотическая рибосома с коэффициентом седиментации 80S диссоциирует на субъединицы 60S и 40S. Форма и детальные очертания рибосом из разнообразных организмов и клеток, включая как прокариотические, так и эукариотические, поразительно похожи, хотя и отличаются рядом деталей. Малая рибосомная субъединица имеет палочковидную форму с несколькими небольшими выступами (рис. 81), ее длина составляет около 23 нм, а ширина — 12 нм. Большая субъединица похожа на полусферу с тремя торчащими выступами. При ассоциации в полную 70S рибосому малая субчастица ложится одним концом на один из выступов 50S частицы, а другим — в ее желобок. В состав малых субъединиц входит по одной молекуле РНК, а в состав большой — несколько: у прокариот — две, а у эукариот — три молекулы. Характеристики молекулярной композиции рибосом даны в табл. 9.
Рис. 81. Рибосомы бактерий в разных проекциях
а — малая субъединица; 6 — большая субъединица; в — полная 70S рибосома (вид сверху и сбоку)
Молекулярная характеристика рибосом
Под действием низких ионных сил, особенно при удалении ионов магния, плотные рибосомные субъединицы могут разворачиваться в рыхлые рибонуклеопротеидные тяжи, где удается наблюдать кластеры отдельных белков, но правильных структур типа нуклеосом нет, так как нет групп из сходных белков: в рибосоме все 80 белков разные.
Для того чтобы образовались рибосомы, необходимо наличие четырех типов рибосомных РНК в эквимолярных отношениях и наличие всех рибосомных белков. Сборка рибосом может происходить спонтанно in vitro, если последовательно добавлять к РНК белки в определенной последовательности.
Следовательно, для биосинтеза рибосом необходим синтез множества специальных рибосомных белков и четырех типов рибосомной РНК. Где эта РНК синтезируется, на каком количестве генов, где эти гены локализованы, как они организованы в составе ДНК хромосом — все эти вопросы в последние десятилетия были успешно разрешены при изучении строения и функции ядрышек.
Чем определяется число ядрышек в клетке
Как уже говорилось, все клетки имеют обязательные внутриядерные структуры — ядрышки. Это правило имеет исключения, которые только подчеркивают важность и необходимость участия ядрышка и жизненных отправлениях клетки. К таким исключениям относятся клетки дробящихся яиц, где ядрышки отсутствуют на ранних этапах эмбриогенеза, или клетки, закончившие развитие и необратимо специализировавшиеся, например некоторые клетки крови.
В остальных случаях в клетках наблюдается 1—5 ядрышек, причем их количество не строго постоянно даже у одного и того же типа клеток. Более того, в некоторых половых клетках (растущие ооциты) число ядрышек может достигать нескольких сотен, т.е. на два порядка выше, чем в соседних соматических клетках. Увеличение числа ядрышек называется амплификацией ядрышек.
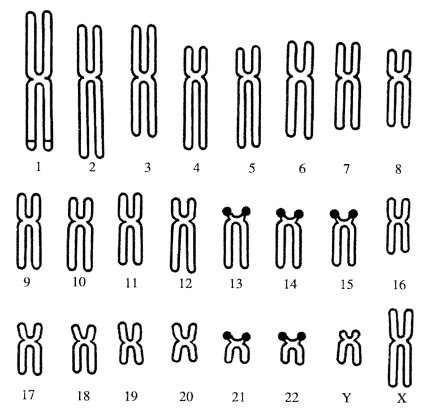
Еще в 1930-х годах было сделано предположение, что число ядрышек зависит от числа «ядрышковых организаторов» — особых участков, на которых в телофазе происходит новообразование ядрышек интерфазного ядра. Часто ядрышковые организаторы локализованы во вторичных перетяжках хромосом (образуют вторичные перетяжки хромосом). Так, у человека ядрышковые организаторы расположены в коротких плечах 13, 14, 15, 21 и 22-й хромосом (10 на диплоидный набор) (рис. 82). У млекопитающих обычно имеется несколько ядрышкообразующих хромосом на диплоидный набор: у кошки — 2; у свиньи — 2; у мыши — 4; у коровы — 8. У хладнокровных позвоночных и у птиц обычно имеется только по одной паре ядрышкообразующих хромосом.
Рис. 82. Хромосомы (13, 14, 15, 21, 22) с ядрышковыми организаторами в кариотипе человека
Таким образом, максимальное число ядрышек в разных клетках определяется числом ядрышковых организаторов и увеличивается согласно плоидности ядра: в крупных полиплоидных ядрах всегда количество ядрышек больше.
Это правило подтверждается прямыми наблюдениями над мутантными особями с разным числом ядрышковых организаторов. Так, у шпорцевой лягушки в норме в диплоидной клетке есть две ядрышкообразующие хромосомы и соответственно 1-2 ядрышка. У гетерозиготной особи с одной ядрышкообразующей хромосомой имеется одно ядрышко, у гомозиготных мутантных личинок, у которых нет ядрышковых организаторов, ядрышки не возникают и не происходит синтез рРНК. Сходные наблюдения были получены на дрозофилах с разным числом ядрышкообразующих хромосом — от 0 до 4.
Локализация ядрышковых организаторов определяется довольно точно на митотических хромосомах с помощью окраски солями серебра, которые имеют специфическое сродство к некоторым ядрышковым белкам. Более точным является определение ядрышковых организаторов с помощью метода молекулярной гибридизации in situ. Так, меченная тритием рРНК при контакте с денатурированной ДНК на препарате митотических хромосом образует ДНК-рРНК-гибрид только в тех местах, где есть последовательности ДНК, комплементарные рРНК.
Множественность рибосомных генов
При изучении числа ядрышек при различных хромосомных абберациях было найдено, что при разрыве хромосомы на месте вторичной перетяжки ядрышки могут возникать на каждом из фрагментов хромосом. Так, при обмене участками между двумя хромосомами в микроспороцитах кукурузы, в том случае, когда разрыв одной из хромосом происходил через ядрышковый организатор, возникали две хромосомы, каждая из которых несла часть исходного ядрышкового организатора. В этом случае обе хромосомы обладали способностью образовывать ядрышки, хотя и в неодинаковой степени. Из этих наблюдений был сделан очень важный вывод (который полностью подтвердился н 1960-х годах на молекулярно-биологическом уровне) о том, что ядрышковый организатор представляет собой не точечный локус хромосомы, а является множественным по своей структуре, содержит несколько одинаковых генных участков, каждый из которых отвечает за образование ядрышка.
Количество рибосомных генов на гаплоидный набор хромосом
С помощью метода молекулярной гибридизации проанализировано не только число рибосомных генов, но и их локализация. Из этих экспериментов следовало, что именно зоны ядрышковых организаторов во вторичных перетяжках хромосом Xenopus содержат рибосомные гены и что в каждом из этих организаторов имеется примерно по 300 генов, т.е. ядрышковые организаторы представляют собой полицистронные участки, содержащие множество одинаковых генов (полиизогенные участки). Следовательно, рибосомные гены собраны вместе в группы, или кластеры.
Наблюдать непосредственно порядок расположения рибосомных генов на ДНК выделенных ядрышек с помощью электронного микроскопа удалось на дополнительных ядрышках ооцитов амфибий.
Амплифицированные ядрышки
Однако существуют случаи, когда гены рРНК подвергаются избыточной репликации. При этом дополнительная репликация генов рРНК происходит в целях обеспечения продукции большого количества рибосом. В результате такого сверхсинтеза генов рРНК их копии могут становиться свободными, экстрахромосомными. Эти внехромосомные копии генов рРНК могут функционировать независимо, в результате чего возникает масса свободных дополнительных ядрышек, но уже не связанных структурно с ядрышкообразующими хромосомами. Это явление получило название амплификации генов рРНК. Особенно подробно это явление изучено на растущих ооцитах амфибий, хотя оно встречается как у животных, так и у растений.
Так, у X. laevis (наиболее подробно изученный и популярный объект) амплификация рДНК происходит в профазе I деления созревания, когда синтез хромосомной ДНК давно закончен. В этом случае количество амплифицированной рДНК (или генов рРНК) становится в 3000 раз больше того, что приходится на гаплоидное количество рДНК, и соответствует 1,5·10 6 генов рРНК. Эти сверхчисленные внехромосомные копии и образуют сотни дополнительных ядрышек в растущих ооцитах. В среднем же на одно дополнительное ядрышко приходится несколько сотен или тысяч генов рРНК.
Амплифицированные ядрышки встречаются также в ооцитах насекомых. Так, у окаймленного плавунца в ооцитах обнаружено 3·10 6 экстрахромосомных копий генов рРНК.
Биологический смысл появления сверхчисленных экстрахромосомных ядрышек при росте ооцитов вполне понятен: для синтеза огромного количества запасных продуктов, которые будут использованы на ранних стадиях эмбриогенеза, необходимо соответственно огромное количество рибосом, которые могут быть синтезированы в клетке на дополнительных матрицах этих многочисленных амплифицированных ядрышек. После периода созревания ооцита при его двух последовательных делениях эти дополнительные ядрышки в состав митотических хромосом не входят, они отделяются от новых ядер и деградируют. Следовательно, амплификация рДНК в ооците представляет собой временное явление, не сказывающееся на постоянстве генома.
У низших эукариотических организмов наблюдаются также экстрахромосомные ядрышки. Например, у Tetrachymena pyriformis в составе гаплоидного генома микронуклеуса имеется только единственный ген рРНК. В макронуклеусе этого организма содержится около 200 гаплоидных эквивалентов в виде экстрахромосомных копий. У дрожжевых клеток также обнаружены экстрахромосомные копии генов рРНК в виде циклических молекул ДНК длиной около 3 мкм, содержащих один ген рРНК.
Строение и функционирование генов рРНК
Итак, в ядрышковых организаторах определенных хромосом локализованы места множественных сгруппированных вместе генов рибосомной РНК. Но как уже говорилось, существуют четыре типа молекул рибосомной РНК, каждый из которых в полной эукариотической рибосоме представлен один раз. Значит ли это, что для каждой из этих РНК (28S рРНК, 18S рРНК, 5,8S рРНК, 5S рРНК) должен существовать отдельный ген, долгое время было неясным. Непонятным было также, как осуществляется в клетках одновременное сбалансированное образование этих разных рРНК. Этот вопрос был решен при исследовании динамики синтеза рибосомных РНК. Обнаружено, что при использовании импульсной короткой метки среди клеточных РНК выявляется быстро синтезирующая РНК с высокой скоростью седиментации — тяжелая 45S РНК. Если после появления этой 45S РНК продолжать наблюдать за распределением метки во фракциях РНК, но уже в отсутствие меченых предшественников, то можно видеть, что по мере убывания метки в зоне 45S РНК она начинает появляться и стабильно накапливаться в зонах 28S, 18S и 5,8S рибосомных РНК. Эти данные говорили о том, что при синтезе рибосомных РНК сначала образуется гигантская молекула-предшественник (45S РНК), которая затем дает начало основным молекулам рибосомной РНК. Найдено, что молекула 45S РНК содержит около 13·10 3 оснований, имеет массу около 4,6·10 6 и может достигать 2—5 мкм в длину. Явление распада молекулы 45S рРНК на фрагменты, соответствующие размерам 28S, 18S и 5,8S РНК, получило название «процессинг», или созревание. Во время процессинга происходит разрыв предшественника на три фрагмента и, кроме того, наблюдается значительная деградация РНК (около 50%, т. е. 6 000 нуклеотидов). Кроме этих данных было вычислено, что молекула 5S РНК синтезируется независимо от 45S РНК и локализация гена 5S рРНК не связана с ядрышковым организатором.
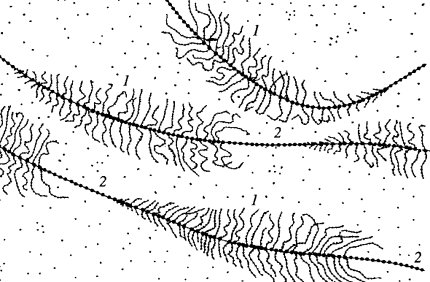
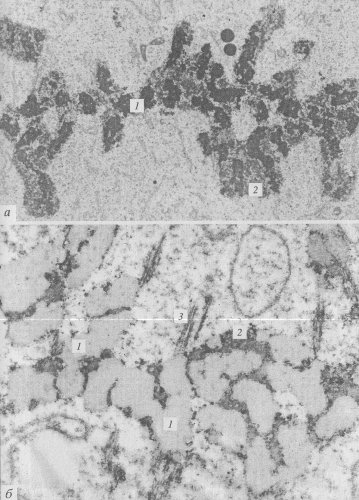
Почти одновременно с получением этих биохимических данных О. Миллеру (1969) удалось с помощью электронного микроскопа увидеть работающие рибосомные гены. Для этого под световым микроскопом вручную выделили ядра из средних ооцитов тритона, микроиглами разорвали ядерную оболочку и в микропипетку втянули многочисленные амплифицированные ядрышки. Такая капля, содержащая ядрышки и кариоплазму, была перенесена в раствор низкой ионной силы со щелочным значением среды. Этот раствор наслаивали на раствор сахарозы с формалином, находящийся в микроячейке центрифужной пробирки, на дно микроячейки помещали сеточку с формваром для электронной микроскопии. Действие низкой ионной силы в щелочной среде приводило к набуханию и диспергированию выделенных ядрышек, они разрыхлялись настолько, что становились плохо различимыми в световом микроскопе. При центрифугировании такие набухшие ядрышки проходили через слой сахарозы, еще больше расправлялись и фиксировались в формалине. Наконец, они достигали дна микроячейки и распластывались на формваровой подложке. После этого сеточки вынимали, обезвоживали, оттеняли металлом и просматривали в электронном микроскопе (рис. 83).
Рис. 83. Рибосомные транскрипты в выделенных и деконденсированных дополнительных ядрышках из ооцитов тритона
1 — транскрибируемый участок (р-ген); 2 — спейсеры
На таком препарате были видны сложно изогнутые и перепутанные длинные осевые молекулы ДНК, на которых через равные промежутки располагались фибриллярные зоны, имеющие вид «елочек». Длина фрагмента ДНК, занятого такой «елочкой», была постоянной и равнялась 5 мкм. На этом отрезке располагалось около 100 плотных гранул величиной около 20 нм, от каждой из которых отходила в сторону тонкая изогнутая нить. Величина такой нити была минимальной на одном конце такого отрезка и максимальной на другом. Эти извитые латеральные нити и образовывали структуру типа «елочки». Доказано, что крупные гранулы на нити ДНК представляют собой молекулы РНК-полимеразы I, ответственной за синтез рРНК, а боковые изогнутые нити — транскрипты, состоящие из синтезируемых молекул РНК. Самые длинные транскрипты находились на одном конце «елочки» и соответствовали 45S предшественнику рРНК. Следовательно, синтез рРНК начинался на конце отрезка с короткими боковыми нитями и заканчивался на участке с длинными нитями РНК. Такой участок ДНК, на котором были видны молекулы рРНК в процессе их удлинения, получил название транскрипционной единицы. Между транскрипционными единицами располагались участки ДНК, лишенные гранул РНК-полимеразы I и транскриптов. Это — зоны так называемых спейсеров, которые не транскрибируются, и, более того, на таких препаратах они имеют нуклеосомное строение, тогда как транскрипционные единицы свободны от нуклеосом. Величина таких спейсерных участков может варьировать не только в данной клетке, но быть различной у разных видов. Длина боковых фибрилл была в 5—10 раз короче, чем 45S РНК, из-за того, что эта новосинтезированная РНК связана с белками, образуя рибонуклеопротеидный тяж — предшественник рибосом.
Исходя из этих работ стало очевидным то, что рибосомный ген состоит из двух участков: нетранскрибируемой последовательности ДНК (nts) — спейсера — и транскрипционной единицы. В состав транскрипционной единицы входят участки, соответствующие 28S, 18S и 5,8S рРНК, разделенные вставками, которые деградируют при процессинге 45S РНК.
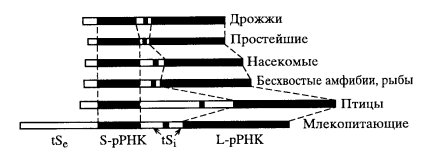
Расшифровка структуры рибосомных генов различных эукариотических объектов показала удивительно универсальный тип их строения:
3′ nts—промотор—tse—18S pPHK—tsi1—5,8S pPHK—tsi2—28S рРНК 5′,
Рис. 84. Строение р-генов разных организмов (А. Хаджиолов)
tSe и tSi — соответственно внешняя и внутренние транскрибируемые последовательности
Транскрипция рРНК идет с помощью двух ферментов: РНК-полимеразы I, которая участвует в синтезе 45S предшественника рРНК и РНК-полимеразы III, ответственной за синтез 5S рРНК. Матрицей для синтеза рРНК по определению должна быть ядрышковая ДНК.
В изолированном р-хроматине обнаружены гистоны, негистоновые белки и белки рибосом. Так, в р-хроматине выявлены основные сердцевинные (кóровые) гистоны, но их количество составляет только 40% по сравнению с таковым в тотальном хроматине.
Первичные транскрипты (морфологически представлены в виде латеральных филаментов на «елочках», образующихся на активных транскрипционных единицах) прогрессивно увеличиваются в длину по мере прохождения РНК-полимеразы I вдоль всего транскрипционного участка гена, начиная с точки начала репликации до терминального участка. Скорость роста цепи пре-рРНК составляет около 20-30 нуклеотидов в секунду, т.е. весь синтез 45S рРНК. занимает около 5-10 мин.
На каждой транскрипционной единице располагается множество (50-100) молекул РНК-полимеразы I, тем самым на каждом гене одновременно происходит синтез множества молекул пре-рРНК, которые находятся на разных стадиях роста полинуклеотидной цепи (рис. 85). Максимальную величину пре-рРНК имеет вблизи терминального участка, где ее молекулярная масса достигает 4,5·10 6 Да (для млекопитающих), а длина должна соответствовать 5,2 мкм. На самом же деле длина латерального транскрипта в 5—10 раз короче этой величины. Это обусловлено тем, что по мере роста транскрипта он связывается сразу же с белками, образуя в конечном участке транскрипции рибонуклеопротеид с коэффициентом седиментации 80S. Такие 80S рРНП составляют до 20% от всех РНП ядрышка. Большая часть белков, которые связываются с 45S РНК, являются белками, входящими в состав малой и большой субъединиц зрелых рибосом. Таким образом, уже на уровне незрелой гигантской молекулы пре-рРНК происходит специфическое связывание с рибосомными белками: около 50% белков большой субъединицы и около 30% малой субъединицы связываются с пре-рРНК во время ее синтеза или вскоре после него. Такая связь 45S РНК с белками приводит к тому, что латеральные транскрипты имеют толщину около 10 нм (после оттеснения металлами), на их свободном конце часто наблюдается крупная гранула (30 нм), что может указывать на высокую степень компактизации РНК и белка на 5′-конце цепи РНК.
Рис. 85. Транскрипция р-генов на циклической ДНК дополнительного ядрышка ооцита жука-плавунца (а) и строение одной транскрипционной единицы (р-гена) (б)
Рис. 86. Процессинг 45S РНК
1—5 — места последовательного расщепления предшественника рибосомных РНК
В интенсивно функционирующих ядрышках происходит синтез огромного числа рибосом: 1500-3000 штук в минуту. Поэтому в ядрышке насчитывается около 5·10 4 предшественников рибосом.
Структура ядрышка
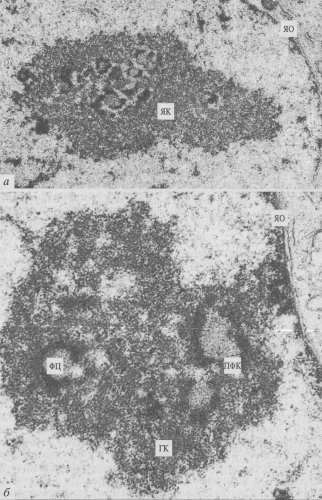
Рис. 87. Строение ядрышка клеток культуры СПЭВ при малом (а) и большом (б) увеличении (фото О.В. Зацепиной)
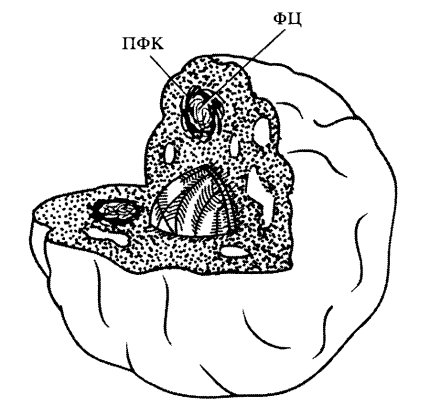
Рис. 88. Схема компонентов ядрышка
1 — гранулярный компонент (нуклеолонема); 2 — фибриллярные центры; 3 — плотный фибриллярный компонент; 4 — околоядрышковый хроматин
Кроме гранул и фибриллярных участков в структуре ядрышка обнаруживаются хроматиновые компоненты: такие как околоядрышковый хроматин, который может примыкать к ядрышку и даже окружать его. Часто 30-нанометровые фибриллы хроматина по периферии ядрышка заходят в лакуны между нуклеолонемными участками.
Наконец, в составе ядрышка выявляется белковый остов — матрикс. На ультратонких срезах необработанных ядрышек матрикс не выявляется в виде отдельного компонента, но если экстрагировать из ядрышек РНК, ДНК и белки, связанные с ними, то можно видеть, что ядрышко как таковое не распадается, не теряет своей общей формы. После таких обработок структура ядрышка представлена рыхлой фибриллярной сетью, заполняющей объем ядрышка.
Таким образом, в структуре ядрышек можно различить следующие пять компонентов: гранулярный, фибриллярные центры, плотный фибриллярный компонент, хроматин, белковый сетчатый матрикс.
Так, при короткой пульсовой метке тритированным уридином ( 3 Н-уридин) первые следы мечения обнаруживались сначала (через 1 — 15 мин) в плотном фибриллярном компоненте (ПФК), а затем (до 30 мин) меченым оказывался гранулярный компонент (ГК). Важно отметить, что в фибриллярных центрах (ФЦ) метка не обнаруживалась. Из этого наблюдения был сделан вывод, что 45S пре-рРНК синтезируется в области плотного фибриллярного компонента, а гранулярный компонент ядрышка соответствует прерибосомным частицам (55S-, 40S РНП).
Оставался открытым вопрос о природе фибриллярных центров, окруженных плотными РНК-содержащими фибриллами. Различными методами (специфическое окрашивание с помощью осмий-амина, ДНКазы, меченной золотом, связыванием меченого актиномицина, прямой молекулярной гибридизацией с меченой рДНК) обнаружено, что в составе фибриллярных центров находится ДНК, ответственная за синтез рРНК. Зоны фибриллярных центров отличаются от остального хроматина тем, что состоят из тонких хроматиновых фибрилл, значительно обедненных гистоном H1 (что показано с помощью меченных коллоидным золотом антител).
Эти исследования позволили связать друг с другом данные молекулярной организации транскрибируемых рибосомных генов с данными морфологии ядрышек и выяснить топологию в объеме ядрышка процесса синтеза рибосомной РНК и образования рибосом.
По модели, предложенной Жоссеном (1984), в фибриллярных центрах расположены неактивные рибосомные гены и, возможно, спейсерные участки. Транскрипция пре-рРНК происходит по периферии фибриллярных центров, где плотный фибриллярный компонент представляет собой 45S пре-рРНК, располагающиеся в виде «елочек» на деконденсированных участках рДНК (рис. 89). После завершения транскрипции 45S РНК теряет связь с транскрипционной единицей на ДНК в зоне плотного фибриллярного компонента, каким-то еще непонятным образом переходит в гранулярную зону, где и происходят процессинг рРНК, образование и созревание рибосомных субъединиц.
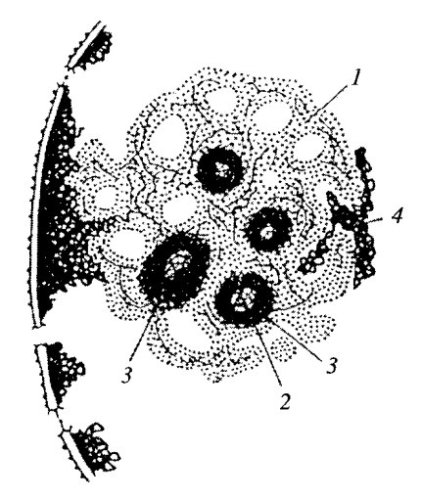
Рис. 89. Трехмерная реконструкция ядрышка и одного фибриллярного центра
Транскрипты рРНК соответствуют плотному фибриллярному компоненту (ПФК). рДНК, «спейсеры» и неактивные цистроны расположены внутри фибриллярного центра (ФЦ)
Фибриллярный центр и ядрышковый организатор
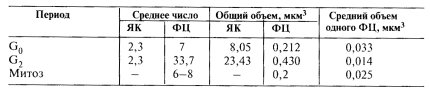
Строение и химические характеристики фибриллярных центров (ФЦ) оказались практически одинаковыми с таковыми ядрышковых организаторов митотических хромосом. И те и другие построены из тесно ассоциированных фибрилл толщиной 6—10 нм и обладают характерной особенностью — окрашиваются солями серебра, что зависит от наличия особых ядрышковых белков, а также содержат РНК- полимеразу I. Однако число ФЦ в интерфазных ядрышках не соответствует числу ядрышковых организаторов в митозе. Так, в клетках культуры СПЭВ число ФЦ может быть в 2—4 раза выше, чем число ядрышковых организаторов (табл. 11).
Количество ядрышек (ЯК), фибриллярных центров (ФЦ) в G0— и G2-периодах и во время митоза
Более того, количество ФЦ возрастает по мере увеличения плоидности клетки (G2, 4n) и транскрипционной ее активности. При этом уменьшается величина каждого отдельного фибриллярного центра. Однако суммарные объемы ФЦ при пересчете на гаплоидный хромосомный набор остаются постоянными в интерфазе, но превышают это число вдвое по сравнению с метафазой. Другими словами, при активации синтеза рРНК наблюдается такое изменение числа ФЦ и их размеров, которое может говорить о какой-то фрагментации исходных ФЦ в относительно малоактивных ядрышках.
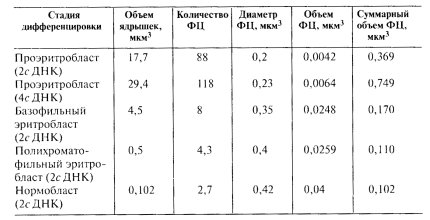
Противоположная картина наблюдается при затухании синтетических процессов в дифференцирующихся клетках эритроидного ряда мышей (табл. 12). При этом видно, что в размножающихся и активно синтезирующих гемоглобин проэритробластах количество фибриллярных центров зависит от плоидности клетки (88 в G1-фазе и 118 в G2-фазе клеточного цикла), размер индивидуальных ФЦ изменяется мало. После прекращения размножения этих клеток и падения их синтетической активности резко меняются параметры ядрышка. Их объем, начиная со стадии базофильного эритробласта, уменьшается в 4—5 раз, а на конечной стадии дифференцировки (нормобласт) — в сотню раз. При этом резко падает число ФЦ (10-40 раз) и почти в 10 раз возрастает величина отдельного фибриллярного центра.
Количество фибриллярных центров и значения их размеров при эритропоэзе в печени зародышей мыши (приводятся средние значения)
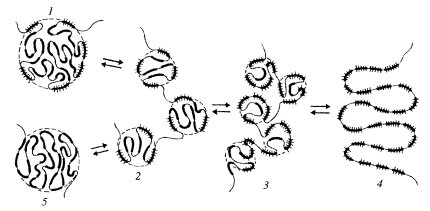
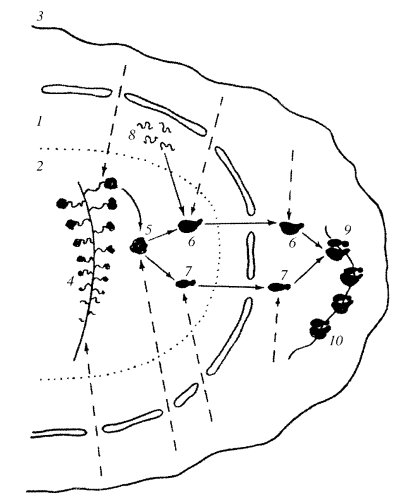
Исходя из этих наблюдений, можно так представить общую схему активации и инактивации ядрышка (рис. 90) на примере одного ядрышкового организатора. В неактивной форме ядрышковый организатор представлен в виде одного крупного фибриллярного центра, включающего в себя компактно уложенную часть цепи хромосомной ДНК, несущей тандемно расположенные рибосомные гены (транскрипционные единицы). В начале активации ядрышка происходит деконденсация р-генов на периферии такого фибриллярного центра. Эти р-гены начинают транскрибироваться, на них образуются РНП-транскрипты, которые при созревании дают начало появлению гранул — предшественников рибосом по периферии активированного ядрышка. По мере усиления транскрипции единый фибриллярный центр как бы распадается на ряд более мелких фибриллярных центров, связанных друг с другом полностью декомпактизованными участками рДНК. Чем выше транскрипционная активность ядрышка, тем больше число мелких, связанных друг с другом фибриллярных центров, окруженных плотным фибриллярным компонентом (ПФК), содержащим 45S рРНК. При полной активации ядрышка все мелкие фибриллярные центры деконденсируются; в этом случае зоны плотного фибриллярного компонента содержат всю рДНК, находящуюся в активном состоянии. Такая структура наблюдается у амплифицированных ядрышек растущих ооцитов. В случае инактивации ядрышка происходит постепенная конденсация рДНК, снова образуются фибриллярные центры, они объединяются друг с другом, величина их растет параллельно уменьшению доли ПФК. При полной инактивации, как в случае нормобластов, ядрышко представлено одним крупным (4-5 мкм) сферическим ФЦ без сопутствующего транскрипции ПФК: оно окружено зоной конденсированного хроматина. Такое инактивированное ядрышко сходно по своим структурным особенностям с ядрышковым организатором в составе митотических хромосом.
Рис. 90. Схема активации и инактивации ядрышкового организатора
1 — начало активации — «елочки» появляются по периферии одного крупного ФЦ (ЯОР-хромосомы); 2, 3 — дальнейшая активация приводит к образованию множественных ФЦ; 4 — полная активация; 5 — полная инактивация
Структурные типы ядрышек
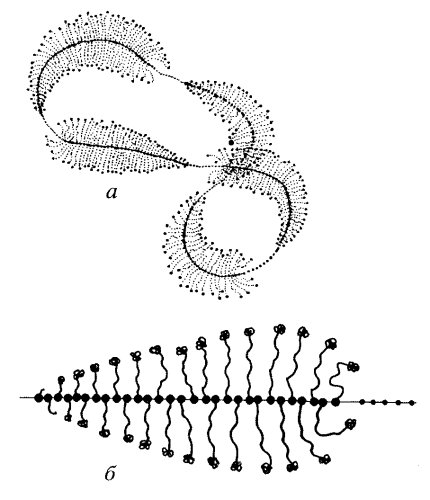
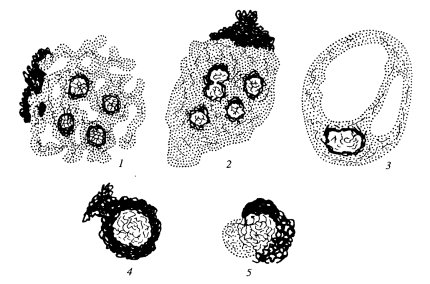
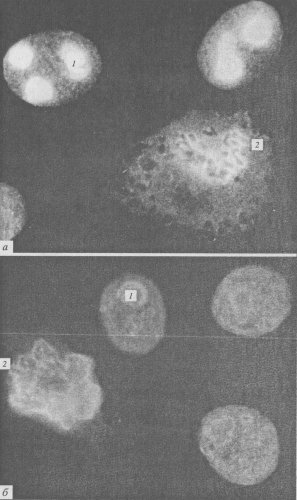
Приведенные выше описания дают основу для понимания разнообразия строения ядрышек в клетках с соответствующим уровнем синтеза рРНК. Однако кроме различной степени выраженности гранулярного и фибриллярных компонентов существуют и иные варианты структурной организации ядрышек. Обычно различают несколько структурных типов ядрышек: ретикулярный, или нуклеолонемный, компактный, кольцевидный, остаточный (покоящийся), сегрегированный (рис. 91).
Рис. 91. Структурные типы ядрышек
1 — ретикулярный; 2 — компактный; 3 — вакуолярный; 4 — кольцевидный; 5 — сегрегированный
Ретикулярный тип ядрышка наиболее характерен для большинства клеток, для него свойственно нуклеолонемное строение, обилие гранул и фибриллярного плотного материала. Во многих случаях фибриллярные центры выявляются плохо, вероятно, из-за высокого уровня транскрипции. Этот тип ядрышек встречается в клетках животных и растений. Так, ретикулярный тип ядрышка гигантских политенных хромосом двукрылых насекомых и гигантских хромосом антиподиальных клеток ячменя очень сходен.
Компактный тип ядрышка отличается от предыдущего меньшей выраженностью нуклеолонемы, большей частотой встречаемости фибриллярных центров. Такие ядрышки характерны для активно размножающихся клеток (клетки растительных меристем, клетки культуры ткани и др.). Вероятно, оба эти типа могут переходить друг в друга, во всяком случае, они чаще всего встречаются в клетках с высоким уровнем синтеза РНК и белка.
Остаточные ядрышки характерны для клеток, полностью потерявших способность к синтезу рРНК (нормобласты, дифференцированные энтероциты, клетки шиповатого слоя кожного эпителия и др.). Часто они настолько малы и так окружены конденсированным хроматином, что с трудом обнаруживаются в световом микроскопе. В ряде случаев они могут снова активироваться и переходить в компактную или ретикулярную форму.
Сегрегированные ядрышки характерны для клеток, обработанных различными антибиотиками или химическими веществами, вызывающими прекращение синтеза рРНК (актиномицин Д, амфотерицин и др.), а также антибиотиками, влияющими на синтез ДНК и белков (митомицин, пуромицин, многие канцерогены и т.д.). Термин «сегрегация» используется в данном случае в связи с тем, что происходит как бы разделение, обособление разных компонентов ядрышек, сопровождающиеся прогрессивным уменьшением его объема. При этом обособляются друг от друга крупные фибриллярные центры и гранулярно-фибриллярный компонент.
Белки ядрышек
До 60% сухой массы выделенных ядрышек приходится на белки, число которых может составлять несколько сотен разных видов. Помимо белков ассоциированного с ядрышками хроматина в состав ядрышек входят белки рибосом и специфические ядрышковые белки, связанные с транскрипцией рибосомных генов, с процессингом 45S рРНК, такие как РНК-полимераза I, факторы транскрипции, топоизомеразы, метилазы, нуклеазы, протеинкиназы, фосфатазы. Часть ядрышковых белков имеет сродство к серебру (аргентофильные белки): РНК-полимераза I, фактор транскрипции UBF, нуклеолин (С-23), нуклеофозмин (ньюматрин, или В-23).
Аргентофилия характерна для белков, обогащенных сульфгидрильными, дисульфидными связями. Как уже указывалось, четкой аргентофилией обладают интерфазные ядрышки и зоны ядрышковых организаторов на митотических хромосомах.
Собственно ядрышковые белки расположены в специфических местах их активности. Так, РНК-полимераза I и фактор транскрипции рРНК UBF располагаются в фибриллярных центрах (ФЦ) и/или в плотном фибриллярном компоненте (ПФК).
Аргентофильным является также белок с молекулярной массой 195 кДа, представляющий собой большую субъединицу РНК-полимеразы I, участвующую в синтезе рРНК. Этот белок локализуется в зоне фибриллярных центров, по их периферии. На плоскостных препаратах ядрышек аргентофилией обладают участки над осевой частью «елочек», непосредственно над расположением гранул РНК-полимеразы I. Кроме того, с помощью иммуноморфологических методов РНК-полимераза I обнаруживается в зоне ядрышковых организаторов митотических хромосом. Это обстоятельство не противоречит данным о том, что во время митоза транскрипция полностью прекращается. Вероятно, что во время митоза гены, нагруженные неактивной РНК-полимеразой I, переносятся вместе с нею в области ядрышковых организаторов из одной клеточной генерации в другую.
Специфический для ядрышек белок фибрилларин (В-36, мол. масса 34 кДа) располагается в ПФК, где он осуществляет процессинг пре-рРНК в комплексе с другими РНП, в состав которых входит U3 мяРНК, необходимая для начального этапа процессинга 45S рРНК. Фибрилларин обнаруживается также в остаточных ядрышках — в «ядрышковом матриксе».
Белок С23 (110 кДа), или «нуклеолин», локализуется в зоне плотного фибриллярного компонента и в фибриллярных центрах ядрышек, но также и в зонах ядрышковых организаторов митотических хромосом. Следовательно, он обнаруживается как на транскрибируемых, так и на неактивных участках рибосомных генов. В препаратах распластанных ядрышек он выявляется над транскрипционными единицами («елочками»). Он обнаружен во фракциях, содержащих предшественники рибосом. Функции его до конца не ясны, хотя стало известно, что белок С23 может играть важную структурную роль в процессе транскрипции: своим N-концом, на котором находятся лизиновые группы, он связывается с ядрышковым хроматином, а С-концом — с транскрибируемым спейсером (tsi) на 45S рРНК. Обнаружено, что этот белок связывается не с ДНК транскрипционной единицы, а с ДНК, имеющей нуклеосомное строение (вероятно, со спейсерными участками).
Белок В-23 (нуклеофозин, мол. масса 37 кДа) с помощью иммуноцитохимических методов локализован в области ПФК и главным образом в зоне гранулярного компонента. Считается, что В-23 участвует в промежуточных и терминальных стадиях биогенеза рибосом и в транспорте пре-рибосом.
Общая схема работы ядрышка как специального локуса синтеза рибосом
Рис. 92. Общая схема работы ядрышка
Новые, неканонические функции ядрышек
Последние данные показывают, что кроме синтеза рРНК ядрышко участвует во многих других аспектах экспрессии генов.
Первые намеки (1965 г.) на признаки полифункциональности ядрышек были получены при изучении гетерокарионов. Так, при слиянии человеческих клеток HeLa с эритроцитами кур были получены гетерокарионы с первоначально совершенно разными ядрами. Ядра клеток HeLa были функционально активны, в них шел синтез разнообразных РНК. Исходные ядра эритроцитов кур содержали сверхконденсированный хроматин, не содержали ядрышек и не транскрибировались. В гетерокарионе после слияния с клетками HeLa в ядрах эритроцитов кур хроматин начинал деконденсироваться, активировалась транскрипция, появлялись ядрышки. Иммуноцитохимическими методами изучалось появление в гетерокарионах белков, характерных для куриных клеток. Несмотря на то что в клетках HeLa имелась готовая система функционирования рибосом и были сформированы ядрышки, появление куриных белков откладывалось до тех пор, пока не возникали ядрышки в ядрах эритроцитов. Это означало, что ядрышко куриного эритроцита как-то должно вовлекаться в образование куриных иРНК, т.е. ядрышко должно играть какую-то роль в продукции куриных иРНК.
Позднее были накоплены данные в поддержку этой гипотезы. Было обнаружено, что созревание (сплайсирование) с-mус иРНК в клетках млекопитающих происходит в ядрышках. В ядрышках были выявлены сплайсосомные малые РНК (sn РНК), факторы сплайсинга пре-иРНК.
Ядрышко во время митоза: периферический хромосомный материал
С помощью световой микроскопии ядрышко выявляется во время интерфазы, в митотических клетках оно исчезает. При использовании цейтраферной микрокиносъемки можно наблюдать в живых клетках как по мере конденсации хромосом в интерфазе происходит исчезновение ядрышка. Сначала оно слегка уплотняется, но затем ко времени разрыва ядерной оболочки начинает быстро терять плотность, становится рыхлым и на глазах быстро исчезает, как бы тает. При этом видно, что часть ядрышкового материала растекается между хромосомами. В метафазе и анафазе ядрышки как таковые отсутствуют. Первые признаки новых ядрышек появляются после средней телофазы, когда уже достаточно разрыхлились хромосомы дочерних ядер, имеющие новую ядерную оболочку. В это время вблизи деконденсирующихся хромосом появляются плотные тельца — предъядрышки. Обычно их число выше, чем число ядрышек в интерфазе. Позднее, уже в G1-периоде клеточного цикла предъядрышки растут, начинают объединяться друг с другом, их общее число падает, но суммарный объем возрастает. Общий объем ядрышка удваивается в S-G2-фазах. В некоторых случаях в профазе (культуры клеток человека) при конденсации хромосом крупные ядрышки распадаются на более мелкие, которые в митозе исчезают.
На самом деле никакого полного исчезновения, или «растворения», ядрышка нет: происходит изменение его структуры, редукция одной части его компонентов при сохранении другой. Так, было показано, что аргентофильные гранулы в интерфазных ядрышках, обнаруживаемые в световом микроскопе, начинают в профазе сливаться друг с другом, одновременно уменьшаясь в объеме, минимальный размер они занимают в метафазе, локализуясь в зонах ядрышковых организаторов хромосом. В таком виде они существуют до средней телофазы, когда выявляются в виде отдельных множественных предъядрышек, разбросанных среди деконденсированных хромосом. Уже в конце телофазы такие аргентофильные предъядрышки начинают расти. Таким образом, можно видеть, что во время митоза исчезновению подвергается только часть ядрышкового компонента, в то время как аргентофильный компонент сохраняется, постоянно существует во время митоза и переносится на хромосомах в дочерние ядра.
Радиоавтографическими исследованиями показано, что исчезновение ядрышек совпадает с прекращением синтеза клеточной (в основном рибосомной) РНК, который возобновляется в поздней телофазе, совпадая по времени с появлением новых ядрышек.
Кроме того, обнаружено, что активность РНК-полимеразы I также исчезает на средних стадиях митоза. Это дало основание считать, что новообразование ядрышек связано с восстановление синтеза рРНК в дочерних клетках.
Но в то же время существуют факты, указывающие на перманентное, постоянное присутствие ядрышковых компонентов в течение всего клеточного цикла. Это в первую очередь относится к аргентофильному материалу ядрышек.
Цитологи в начале XX века часто наблюдали во время митоза появление какого-то нехроматинового материала, окружающего каждую хромосому. Этот материал, или «матрикс», митотических хромосом, как считали, мог иметь ядрышковое происхождение, и его роль могла заключаться в том, что он может служить источником новых ядрышек в дочерних ядрах после митоза.
Рис. 93. Микрофотография периферического хромосомного материала (ПХМ) в делящихся клетках эндосперма пшеницы, полученная с помощью электронного микроскопа (фото В.В. Буракова)
а — метафаза, каждая хромосома окружена ПХМ; б — то же при окраске на РНП по Бернхарду.
1 — хромосомы; 2 — ПХМ; 3 — микротрубочки веретена
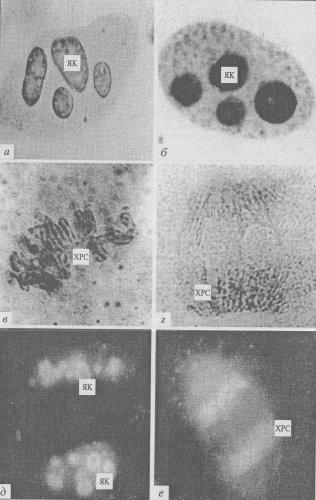
Новый этап в изучении периферического материала митотических хромосом связан с использованием иммуноцитохимических методов выявления ядрышковых белков. Было показано, что митотические хромосомы действительно участвуют в переносе в дочерние клетки белков ядрышек, белков ядерного остова и различных РНП. Например, установлено, что ядрышковые белки, участвующие в транскрипции рРНК (РНК-полимераза I, топоизомераза I, фактор инициации транскрипции UBF и др.), аккумулируются в зоне ядрышкового организатора, в то время как белки, связанные с процессингом пре-рРНК (фибрилларин, нуклеолин, В-23), а также некоторая часть пре-рРНК и малые ядрышковые РНП переносятся поверхностью хромосом в составе периферического хромосомного материала (рис. 94).
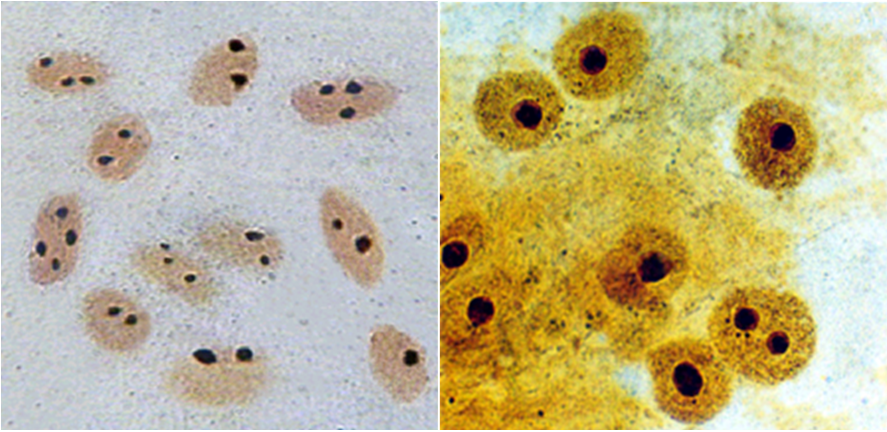
Рис. 94. Микрофотография периферического хромосомного материала в делящихся клетках эндосперма пшеницы, полученная с помощью светового микроскопа (фото Е.М. Лазаревой).
а-г — окраска AgNO3 : а — интерфаза, 6 — ранняя профаза, в — метафаза, г — поздняя анафаза; д,е — окраска антителами к ядрышковому белку фибрилларину: д — ранняя интерфаза, е — анафаза.
ЯК — ядрышки; ХРС — хромосомы
Кроме того, в состав ПХМ могут входить некоторые негистоновые белки из состава ядерного интерфазного остова (рис. 95).
Рис. 95. Микрофотография периферического хромосомного материала (ПХМ) в клетках СПЭВ, полученная с помощью светового микроскопа (фото М.И. Мурашовой)
а — окраска флуоресциируюшими антителами к ядрышковому белку В-23; б — окраска антителами к белку 40 кДа ядерного матрикса.
1 — ядрышки в интерфазных клетках; 2 — поверхностное окрашивание хромосом (ПХМ)
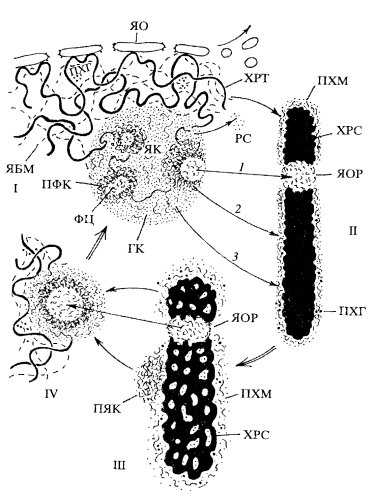
Рис. 96. Участие периферического хромосомного материала (ПХМ) в переносе хромосомами компонентов ядрышка и ядерного белкового матрикса на разных стадиях ядерного цикла
I — интерфаза; II — метафаза; III — телофаза; IV — ранняя интерфаза.
1 — компоненты транскрипционного комплекса синтеза рРНК (рДНК, РНК-полимераза I, факторы транскрипции); 2 — компоненты процессипга рРНК.; 3 — предшественники рибосом и белки матрикса ядрышка.
Биологический смысл появления ПХМ на поверхности митотических хромосом может заключаться в том, что переносимые хромосомами белки не являются случайными «пассажирами», а представляют собой комплекс белков разного происхождения: ферменты и факторы ядрышковой транскрипции, процессинга рРНК, сборки рибосом, незрелые предшественники рибосом и, кроме того, белки ядерного и ядрышкового матрикса, также содержащие малые ядерные РНП и все компоненты, связанные с образованием нерибосомных РНК, с их сплайсингом и др. Другими словами, ПХМ переносит в новые ядра многие белковые компоненты и ферменты, что создает условия, необходимые для форсированного возобновления синтеза и созревания рибосом, а также синтеза информационных РНК. Митотическая хромосома переносит в новое ядро не только генетическую информацию в виде ДНК хроматина, но и необходимые компоненты синтетического аппарата, готового к активации транскрипции в новом клеточном цикле. Хромосома при клеточном делении «все свое несет с собой», как гласит латинская поговорка.
Величко В.В. © Copyright 2008.