вирус бонзифи что это такое
Современные подходы к лечению Эпштейна–Барр-вирусной инфекции у взрослых
Одной из актуальных проблем современной медицины является высокая инфицированность населения одним из представителей оппортунистических возбудителей — вирусом Эпштейна–Барр (ВЭБ).
Одной из актуальных проблем современной медицины является высокая инфицированность населения одним из представителей оппортунистических возбудителей — вирусом Эпштейна–Барр (ВЭБ). Практикующие врачи в своей повседневной практике чаще сталкиваются с клинически манифестными формами первичной Эпштейна–Барр-вирусной инфекции (ЭБВИ) в виде острой, как правило, не верифицированной респираторной инфекцией (более 40% случаев) или инфекционным мононуклеозом (около 18% всех заболеваний) [1, 2]. В большинстве случаев эти заболевания протекают доброкачественно и заканчиваются выздоровлением, но с пожизненной персистенцией ВЭБ в организме переболевшего [1, 3–5].
Однако в 10–25% случаев первичное инфицирование ВЭБ, протекающее бессимптомно, и острая ЭБВИ могут иметь неблагоприятные последствия [6–9] с формированием лимфопролиферативных и онкологических заболеваний, синдрома хронической усталости, ВЭБ-ассоциированного гемофагоцитарного синдрома и др. [7, 9, 11–14].
До настоящего времени нет четких критериев, позволяющих прогнозировать исход первичного инфицирования ВЭБ. Перед врачом, к которому обращается пациент с острой ЭБВИ, всегда встает вопрос: что предпринять в каждом конкретном случае, чтобы максимально снизить риск развития хронической ЭБВИ и ВЭБ-ассоциированных патологических состояний Этот вопрос не праздный, и ответить на него действительно очень трудно, т. к. до сих пор нет четкой патогенетически обоснованной схемы лечения больных, а имеющиеся рекомендации часто противоречат друг другу.
По мнению многих исследователей, лечение ЭБВИ-мононуклеоза (ЭБВИМ) не требует назначения специфической терапии [15–17]. Лечение больных, как правило, проводится в амбулаторных условиях, изоляция пациента не требуется. Показаниями к госпитализации следует считать длительную лихорадку, выраженный синдром тонзиллита и/или синдром ангины, полилимфаденопатию, желтуху, анемию, обструкцию дыхательных путей, боли в животе и развитие осложнений (хирургических, неврологических, гематологических, со стороны сердечно-сосудистой и дыхательной системы, синдром Рейе).
При легком и среднетяжелом течении ЭБВ ИМ больным целесообразно рекомендовать палатный или общий режим с возвращением к обычной деятельности на адекватном для каждого конкретного больного физическом и энергетическом уровне. Проведенное многоцентровое исследование показало, что необоснованно рекомендуемый строгий постельный режим удлиняет период выздоровления и сопровождается длительным астеническим синдромом, требующим нередко медикаментозного лечения [18].
При легком течении ЭБВ ИМ лечение больных ограничивается поддерживающей терапией, включающей адекватную гидратацию, полоскание ротоглотки раствором антисептиков (с добавлением 2% раствора лидокаина (ксилокаина) при выраженном дискомфорте в глотке), нестероидные противовоспалительные препараты, такие как парацетамол (Ацетаминофен, Тайленол). По мнению ряда авторов назначение блокаторов Н2 рецепторов, витаминов, гепатопротекторов и местная обработка миндалин различными антисептиками являются малоэффективными и необоснованными способами лечения [19, 20]. Из экзотических методов лечения следует упомянуть рекомендуемое Ф. Г. Боковым и соавт. (2006) применение мегадоз бифидобактерий при лечении больных острым мононуклеозом [21].
Мнения о целесообразности назначения антибактериальных препаратов при лечении ЭБВИМ весьма противоречивы. По мнению Gershburg E. (2005) тонзиллит при ИМ часто асептический и назначение антибактериальной терапии не оправдано. Также нет смысла в применении антибактериальных средств при катаральной ангине [4]. Показанием для назначения антибактериальных препаратов является присоединение вторичной бактериальной инфекции (развитие у больного лакунарной или некротической ангины, таких осложнений, как пневмония, плеврит и др.), о чем свидетельствуют сохраняющиеся более трех суток выраженные воспалительные изменения показателей крови и фебрильная лихорадка. Выбор препарата зависит от чувствительности микрофлоры на миндалинах больного к антибиотикам и возможных побочных реакций со стороны органов и систем.
Противопоказаны препараты из группы аминопенициллинов (ампициллин, амоксициллин (Флемоксин Солютаб, Хиконцил), амоксициллин с клавуланатом (Амоксиклав, Моксиклав, Аугментин)) из-за возможности развития аллергической реакции в виде экзантемы. Появление сыпи на аминопенициллины не является IgE-зависимой реакцией, поэтому применение блокаторов Н1 гистаминовых рецепторов не имеет ни профилактического, ни лечебного эффекта [19].
По мнению ряда авторов до настоящего времени сохраняется эмпирический подход к назначению глюкокортикостероидов больным с ЭБВИ [23]. Глюкокортикостероиды (преднизолон, преднизон (Делтазон, Метикортен, Оразон, Ликвид Пред), Солу Кортеф (гидрокортизон), дексаметазон) рекомендуются больным с тяжелым течением ЭБВИМ, с обструкцией дыхательных путей, неврологическими и гематологическими осложнениями (тяжелая тромбоцитопения, гемолитическая анемия) [4, 24]. Суточная доза преднизолона составляет 60–80 мг в течение 3–5 дней (реже 7 дней) с последующей быстрой отменой препарата. Одинаковой точки зрения на назначение этим больным глюкокортикостероидов при развитии миокардита, перикардита и поражениях ЦНС нет.
При тяжелом течении ЭБВИМ показана внутривенная дезинтоксикационная терапия, при разрыве селезенки — хирургическое лечение.
Наиболее дискуссионным остается вопрос о назначении противовирусной терапии больным с ЭБВИ. В настоящее время известен большой перечень препаратов, являющихся ингибиторами ВЭБ репликации в культуре клеток [4, 25–27].
По данным E. Gershburg, J. S. Pagano (2005) все современные «кандидаты» для лечения ЭБВИ могут быть разделены на две группы:
I. Подавляющие активность ДНК-полимеразы ВЭБ:
II. Различные соединения, не ингибирующие вирусной ДНК-полимеразы (механизм изучается): марибавир, бета-L-5 урацил йододиоксолан, индолокарбазол.
Однако проведенный метаанализ пяти рандомизированных контролируемых испытаний с участием 339 больных ЭБВИМ, принимавших ацикловир (Зовиракс), показал неэффективность препарата [28, 29].
Одна из возможных причин кроется в цикле развития ВЭБ, в котором ДНК вируса имеет линейную либо циркулярную (эписома) структуру и размножается в ядре клетки хозяина. Активная репликация вируса происходит при продуктивной (литической) стадии инфекционного процесса (ДНК ВЭБ линейной формы). При острой ЭБВИ и активации хронической ЭБВИ происходит цитолитический цикл развития вируса, при котором он запускает экспрессию собственных ранних антигенов и активирует некоторые гены клеток макроорганизма, продукты которых участвуют в репликации ВЭБ. При латентной ЭБВИ ДНК вируса имеет вид эписомы (круговой суперспиральный геном), находящейся в ядре. Циркулярный геном ДНК ВЭБ характерен для CD21+ лимфоцитов, в которых даже при первичном инфицировании вирусом практически не наблюдается литической стадии инфекционного процесса, а ДНК воспроизводится в виде эписомы синхронно с клеточным делением инфицированных клеток. Гибель пораженных ВЭБ В лимфоцитов связана не с опосредованным вирусом цитолизом, а с действием цитотоксических лимфоцитов [4].
При назначении противовирусных препаратов при ЭБВИ врач должен помнить, что их клиническая эффективность зависит от правильной трактовки клинических проявлений болезни, стадии инфекционного процесса и цикла развития вируса на этой стадии. Однако не менее важным является и тот факт, что большинство симптомов ЭБВИ связаны не с прямым цитопатическим действием вируса в инфицированных тканях, а с опосредованным иммунопатологическим ответом ВЭБ-инфицированных В лимфоцитов, циркулирующих в крови и находящихся в клетках пораженных органов. Именно поэтому аналоги нуклеозидов (ацикловир, ганцикловир и др.) и ингибиторы полимеразы (Фоскарнет), подавляющие репликацию ВЭБ и уменьшающие содержание вируса в слюне (но не санирующие ее полностью [4], не оказывают клинического эффекта на тяжесть и продолжительность симптомов ЭБВИМ.
Показаниями для лечения ЭБВИМ противовирусными препаратами являются: тяжелое, осложненное течение болезни, необходимость профилактики ВЭБ-ассоциированной В-клеточной лимфопролиферации у иммунокомпрометированных пациентов, ВЭБ-ассоциированная лейкоплакия. Bannett N. J., Domachowske J. (2010) рекомендуют применять ацикловир (Зовиракс) внутрь в дозе 800 мг внутрь 5 раз в сутки в течение 10 дней (или 10 мг/кг каждые 8 часов в течение 7–10 дней). При поражениях нервной системы предпочтителен внутривенный способ введения препарата в дозе 30 мг/кг/сут 3 раза в сутки в течение 7–10 дней.
По мнению E. Gershburg, J. S. Pagano (2005), если под действием каких-либо факторов (например, иммуномодуляторов, при ВЭБ-ассоциированных злокачественных опухолях — применение лучевой терапии, гемцитабина, доксорубицина, аргинина бутирата и др.) удается перевести ДНК ВЭБ из эписомы в активную репликативную форму, т. е. активировать литический цикл вируса, то в этом случае можно ожидать клинический эффект от противовирусной терапии.
В комплексной терапии рекомендуется внутривенное введение иммуноглобулинов (Гаммар-П, Полигам, Сандоглобулин, Альфаглобин и др.) 400 мг/кг/сут, № 4–5.
В последние годы все чаще для лечения ЭБВИ стали применять рекомбинантные альфа-интерфероны (Интрон А, Роферон-А, Реаферон-ЕС) по 1 млн ME в/м в течение 5–7 дней или через день; при хронической активной ЭБВИ — 3 млн ME в/м 3 раза в неделю, курс 12–36 недель.
В качестве индуктора интерферона при тяжелом течении ЭБВИ рекомендуется использовать Циклоферон по 250 мг (12,5% 2,0 мл) в/м, 1 раз в сутки, № 10 (первые двое суток ежедневно, затем через день) или по схеме: 250 мг/сут, в/м на 1-й, 2-й, 4-й, 6-й, 8-й, 11-й, 14-й, 17-й, 20-й, 23-й, 26-й и 29-й день в сочетании с этиотропной терапией. Перорально Циклоферон назначается по 0,6 г/сут, курсовая доза (6–12 г, т. е. 20–40 таблеток).
Медикаментозная коррекция астенического синдрома при хронической ЭБВИ включает назначение адаптогенов, высоких доз витаминов группы В, ноотропных препаратов, антидепрессантов, психостимуляторов, препаратов с прохолинергическим механизмом действия и корректоров клеточного метаболизма [30–32].
Залогом успешного лечения больного с ЭБВИ являются комплексная терапия и строго индивидуальная тактика ведения как в стационаре, так и во время диспансерного наблюдения.
Литература
Паниковать не стоит, но лечиться надо. Что мы знаем о вирусе Эпштейна-Барр?
От него не скроешься. Рано или поздно с ним встречается каждый человек. Надо ли его бояться? А может, инфекция совсем безобидна? Паниковать не стоит, но и легкомысленное отношение – ошибка.
О вирусе Эпштейна-Барр рассказала врач-инфекционист «Клиники Эксперт» Тула Елена Геннадьевна Королёва.
— Елена Геннадьевна, что такое вирус Эпштейна-Барр?
— Среди герпес-вирусов насчитывают 8 типов, вызывающих патологии у вида Homo sapiens, то есть у людей. Вирус Эпштейна-Барр – герпес-вирус IV типа. После заражения вирусом Эпштейна-Барр инфекция остаётся в организме навсегда и никогда его не покидает.
Вирус Эпштейна-Барр – один из самых распространённых герпес-вирусов у людей. Восприимчивость к нему человека высока. Многие дети инфицируются до достижения годовалого возраста, а к 40-50 годам инфекция есть в организме практически у каждого.
— Как происходит заражение вирусом Эпштейна-Барр?
— Источник инфекции – вирусоносители, а также больные с типичными (манифестными) и стёртыми формами заболевания. Наиболее распространённый путь передачи – воздушно-капельный: с частицами слюны при разговоре, чихании, кашле. Возможна передача вируса при поцелуе (именно поэтому в некоторых источниках вызванный им инфекционный мононуклеоз называют «болезнью поцелуев»). Возможен и контактный путь заражения (например, через предметы домашнего обихода).
Вирус Эпштейна-Барр проникает в организм через верхние дыхательные пути, и уже оттуда распространяется в лимфоидную ткань, вызывая поражения лимфоузлов, миндалин, селезёнки и печени.
При размножении в организме вирус Эпштейна-Барр воздействует на иммунную систему. Механизм воздействия сложен, но в конечном результате за счёт поражения В-лимфоцитов и угнетения Т-клеточного иммунитета происходит подавление выработки интерферона – белка, отвечающего за противовирусную защиту организма.
В современном мире у детей отмечается всплеск заболеваемости, особенно в городах. Наиболее высока вероятность заразиться в местах скопления людей.
— А бессимптомный носитель может быть опасен?
— Чаще всего источником инфекции становится человек в острой стадии болезни. Но передача от бессимптомного носителя не исключена.
— Какую болезнь вызывает вирус Эпштейна-Барр?
— Классическое проявление – инфекционный мононуклеоз. Для него характерны общие интоксикационные симптомы: высокая температура тела, сонливость, вялость, головные боли, боль в горле, увеличение лимфоузлов (или лимфопролиферативный синдром).
Лимфопролиферативный синдром сочетает:
В общем анализе крови определяется наличие атипичных мононуклеаров. Что это такое? Атипичные мононуклеары (другое их название – «вироциты») – это изменённые одноядерные клетки крови. При течении инфекционного мононуклеоза количество атипичных мононуклеаров в крови повышается значительно (больше 10 %). Может снижаться общее количество тромбоцитов и лейкоцитов, что говорит о тяжести переносимой инфекции.
Есть особенности проявления вируса Эпштейна-Барр у детей. Инфицированные попадают в такую категорию, как «часто болеющие дети». Из-за ослабления иммунитета регулярно возникают заболевания ЛОР-органов, трудности при выздоровлении (подкашливание, постоянно красное горло), бывает храп (из-за разрастания миндалин). При таком течении к взрослому возрасту иммунитет учится противостоять инфекции, взрослые болеют уже не так часто. Показания к оперативному удалению аденоидов у детей практически всегда связаны с непролеченным вирусом Эпштейна-Барр. И это очень печально: ничего лишнего в организме нет, а при своевременном лечении удаления можно было бы избежать.
Читайте материалы по теме:
Знать, что ребёнок инфицирован, важно и по другой причине. Вирус Эпштейна-Барр может изменить реакцию на некоторые антибиотики, спровоцировать токсикоаллергическую реакцию. Поэтому следует обязательно своевременно выявлять вирус и сообщать о нём лечащим врачам, они будут подбирать антибиотики с учётом этого факта.
Тяжёлые последствия возникают, если первичное заражение происходит у женщины в период беременности. Вирус Эпштейна-Барр преодолевает плацентарный барьер, это грозит гибелью плода или значительными дефектами развития.
«После первичного инфицирования некоторые из этих инфекций организм не покидают. Они «спят» в определенных клетках, если с иммунной системой все в порядке и она хорошо контролирует их «сон». Цитата из материала «Чем опасны ТОРЧ-инфекции»
— Есть мнение, что вирус Эпштейна-Барр вызывает гепатит и даже лимфому. Это правда?
— Герпетические вирусы кровотоком разносятся по всему организму, поражают все группы лимфатических узлов. И печень, и селезёнка при остром течении мононуклеоза увеличены. При этом течение болезни обычно благоприятное, здоровье печени полностью восстанавливается.
Утверждать, что вирус Эпштейна-Барр непременно приводит к лимфоме, нельзя. Обнаружить вирус недостаточно: если инфицировано практически всё население планеты, естественно, анализы обнаружат наличие вируса в организме, но ведь лимфомой заболевает далеко не каждый. Конечно, хроническое подавление иммунной системы может приводить к разным нарушениям, в том числе к онкологическим заболеваниям. Но достоверной связи нет. А скомпенсировать иммунные нарушения современная медицина в силах.
Паниковать точно не стоит. Но и надеяться на самостоятельное излечение не надо. Когда ребёнок постоянно болеет, родители зачастую впадают в отчаяние. И хотя избавиться от герпес-вирусов навсегда невозможно, вполне можно облегчить состояние и в разы уменьшить частоту заболеваний. Лечиться можно и нужно.
Подробнее о гепатитах читайте в наших статьях:
— Какими методами можно проверить, присутствует ли в организме вирус Эпштейна-Барр? Какие анализы его выявляют?
— В нашем арсенале два метода: иммуноферментный анализ (ИФА) и полимеразная цепная реакция (ПЦР). Преимущество метода ПЦР – возможность определить ДНК вируса в слюне, соскобе из носоглотки. Благодаря этому можно не брать кровь и не нервировать ребёнка. Но если нет обострения, такой анализ может дать ложноотрицательный результат. Это значит, что вирус в организме есть, но он «спит», и, соответственно, в мазке из носоглотки может отсутствовать. А поскольку с помощью ПЦР ищут сам вирус, точнее, его нуклеиновые кислоты (ДНК), то и анализ будет отрицательным. Нередки также искажения из-за того, что мазок взят неправильно.
Метод ИФА точнее, он в любом случае покажет и наличие инфекции, и выраженность инфекционного процесса. Выводы в данном случае делают по присутствию в крови специфических иммуноглобулинов (антител) к вирусу. Например, если обнаружены иммуноглобулины класса М (IgM), можно говорить об острой фазе инфекции (первичном заражении либо реактивации вируса, когда-то попавшего в организм). Если найдена определённая фракция иммуноглобулина класса G (IgG), это свидетельствует, что организм в прошлом уже сталкивался с инфекцией. Поэтому для определения диагностического метода нужна консультация врача.
— Какими методами лечения вируса Эпштейна-Барр располагает современная медицина?
— Это сложная задача. Если для герпес-вирусов I и II типа (вирусов простого герпеса) есть специфические противовирусные средства, то для вируса Эпштейна-Барр и цитомегаловируса специфической терапии пока не разработали. При лёгком течении болезнь может пройти сама, но при тяжёлом течении с поражением костного мозга медицинская помощь необходима. Лечение направлено на стимуляцию иммунитета, применяются интерфероны. Схему лечения выбирают, исходя из множества факторов, определять её должен только врач.
После излечения вирус продолжает жить в организме. Периодически могут возникать обострения: из-за переохлаждения, длительного пребывания под солнцем, стресса и т. д. Проявления инфекции – всегда повод идти к врачу.
Беседовала Дарья Ушкова
Редакция рекомендует:
Для справки:
Королёва Елена Геннадьевна
Что такое инфекция цитомегаловирусная? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 13 лет.
Определение болезни. Причины заболевания
Цитомегаловирусная болезнь (ЦМВИ, цитомегалия, вирусная болезнь слюнных желёз, болезнь с включениями) — это общее системное инфекционное заболевание, вызываемое вирусом семейства герпесов V типа — цитомегаловирусом, который специфически поражает лейкоциты и клетки различных органов (слюнных желёз, почек, лёгких, печени, головного мозга и другие).
Клинически характеризуется многообразием проявлений — от бессимптомного течения до генерализованных (распространённых) форм с поражением внутренних органов и центральной нервной системы, а также пожизненного пребывания в организме.
Этиология
Вид — Cytomegalovirus hominis (открыт в 1956 году)
Является древним человеческим вирусом (предположительно с Кембрийского периода), который в ассоциации с другими герпесвирусами оказал значительное влияние на формирование иммунитета современного человека.
Внутривидовая структура неоднородна. Известно о трёх штаммах вируса: Davis, АД 169, Kerr и Towne. Они могут иметь различия в тропизме к тканям человека, различаться по степени вирулентности и патогенности.
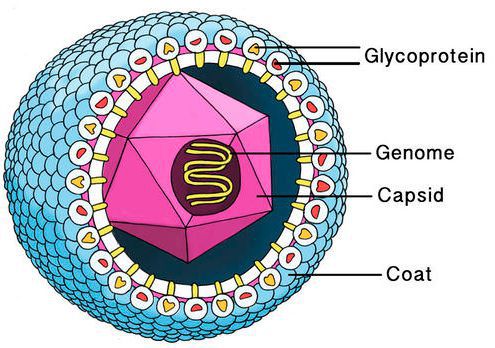
Цитомегаловирус имеет внешнюю гликопротеиновую оболочку, в составе которой есть B и H звенья — к ним формируются антитела. Представляет собой двухцепочечный ДНК-содержащий крупный вирус с диаметром нуклеокпсида до 180 нм.
Вирус способен поражать практически любую ткань человеческого организма, т.е. обладает политропностью. При развитии в ядрах инфицированных клеток образует включения (незрелые вирионы), описываемые как «глаз совы».
Вызывает цитомегалию (увеличение) клеток, не приводя к их гибели. Способен при активном течении значительно снижать иммунитет. Возможна трансплацентарная передача вируса с развитием врождённой инфекции.
Культивируется на культуре фибробластов (клеток соединительной ткани) человека. Изменения хромосомного набора клеток не вызывает. Очень чувствительны к ЦМВ клетки плода и новорождённого.
Малоустойчив в окружающей среде, быстро погибает при повышении температуры до 56°С и действии дезинфицирующих средств, теряет заражающие свойства при замораживании. В условиях комнатной температуры способен сохраняться в течение нескольких дней. [1] [3] [4] [8]
Эпидемиология
Антропоноз. Источник инфекции — только человек (больной различными формами и носитель), причём выделение вируса возможно в течение всей жизни человека и зависит от его индивидуальных иммунологических особенностей. Возможно заражение различными штаммами ЦМВ, роль этого в изменении патологии и клинической картине пока не выяснена.
Как передаётся цитомегаловирус
Механизмы передачи вируса:
Факторами передачи вируса выступают слюна (преимущественно), моча, кровь, вагинальный секрет, слёзы, сперма, фекалии, грудное молоко.
Восприимчивость среди населения высокая, наибольшее количество заражённых выявляется в детском и подростковом возрасте, когда происходит повышение контактных взаимодействий между людьми. Во взрослом состоянии ЦМВ инфицировано до 95% населения планеты, которые являются пожизненными носителями вируса. [1] [2] [3] [8]
Симптомы цитомегаловирусной инфекции
Инкубационный период — от 15 дней до трёх месяцев (при манифестной, т. е. явно выраженной форме).
Врождённая форма цитомегаловирусной инфекции
Цитомегаловирусную инфекцию выявляют примерно у одного из 200 рождённых детей, каждый пятый из них имеет или будет иметь проблемы со здоровьем. Сразу после рождения выявляются низкая масса тела, увеличение печени и селезёнки, желтуха, увеличение всех групп лимфоузлов, высыпания геморрагического характера, различные органные поражения, резкие изменения гемограммы и функциональных тестов. В крови, слюне и моче выявляется вирусная ДНК (в ряде случаев выделение вируса продолжается на протяжении нескольких лет).
Прогноз серьёзен и зависит от тяжести поражения и объёма проводимых лечебных мероприятий. В более поздние сроки инфицирования беременной вероятность тяжёлых проявлений заболевания существенно ниже, и новорождённые, как правило, не имеют симптомов врождённой ЦМВ-инфекции на начальных этапах после родов, однако это не говорит о полном клиническом благополучии в будущем — возможно поражение нервной системы различной степени выраженности и нейросенсорная тугоухость. Поэтому такие дети нуждаются в обследовании и наблюдении профильных специалистов, а при необходимости — в лечении. [1] [2] [3] [5] [8] [10]
Приобретённая форма цитомегаловирусной инфекции
При приобретённых формах заболевание чаще всего протекает в детском или подростковом возрастах. В эти периоды отмечается наибольшая лабильность иммунной системы (имеет значение при группе «детских инфекций»).
Чаще всего первичное инфицирование протекает или бессимптомно, или по типу ОРЗ нетяжёлого течения. Наблюдаются лёгкая слабость, субфебрилитет (температура 37,1-38,0°С), дискомфорт в мышцах, першение в горле, иногда насморк, увеличение лимфатических узлов шеи, увеличение и болезненность слюнных желёз.
Зачастую такие проявления не вызывают настороженности в плане ЦМВ и самостоятельно купируются в течение 1-2 недель — болезнь переходит в стадию латентного течения (носительство).
При инфицировании в более позднем возрасте (взрослые люди), а также у некоторых детей (с нарушением иммунитета) и ослабленных больных заболевание, как правило, протекает с явными морфофункциональными нарушениями и гораздо тяжелее, чем у первой группы лиц. Наблюдается:
Синдром тонзиллита не характерен. Увеличивается печень и селезёнка, значимо изменяются показатели гемограммы и функциональных печёночных проб.
В зависимости от состояния иммунной системы и возможностей её коррекции клинически значимая первичная инфекция у данной группы людей продолжается в течение 1-3 месяцев и, как правило, завершается победой организма над вирусной экспансией с последующим формированием вирусоносительства без каких-либо явных клинических проявлений.
В некоторых случаях (ВИЧ-инфекция, онкологические заболевания, длительный приём цитостатических препаратов, генетические дефекты иммунной системы) может наблюдаться длительное волнообразное течение первичной инфекции или реактивация (обострение) имеющегося носительства вируса (латентной формы). В этом случае отмечается:
Мононуклеозоподобный синдром
При выраженной форме болезни может развиться мононуклеозоподобный синдром — слабость, субфебрильная температура (37,1—38,0 °C), увеличение и чувствительность лимфоузлов, увеличение печени и селезёнки, изменения крови вирусного характера.
Симптомы цитомегаловируса у мужчин и женщин
Цитомегаловирусная инфекция поражает людей всех возрастов и полов. Принципиальных отличий в симптомах у мужчин и женщин нет, за исключением поражения половых органов.
Цитомегаловирусная инфекция у беременных
У беременных первичная инфекция может протекать бессимптомно или с ограниченными клиническими проявлениями (чаще всего). При заражении ребёнка (плода) до родов в зависимости от сроков первичного инфицирования женщины (иногда истинной реактивации ЦМВ при СПИДе) возможно развитие врождённой цитомегаловирусной инфекции.
Риск внутриутробной передачи — до 90% от всех случаев инфицирования на любом сроке беременности.
При заражении в ранние сроки беременности высок риск самопроизвольного выкидыша, мертворождения или рождения детей с явными пороками развития (патологии лёгких, головного мозга, почек, сердца, сосудов, органа слуха, психоневрологическими нарушениями).
Интересной особенностью является влияние возраста беременной, на котором произошло первичное инфицирование, на частоту передачи инфекции: у женщин до 20 лет риск передачи в три раза выше и не зависит от сроков беременности, а после 20 лет риск внутриутробного инфицирования существенно ниже
Симптомы хронической цитомегаловирусной инфекции
Болезнь становится хронической, если вирус долго находится в организме и иммунная система не может ему противостоять. Характерны длительная субфебрильная температура (37,1—38,0 °C) и слабость. Может увеличиться печень, лимфоузлы (чаще нескольких разных групп), иногда селезёнка, возникает поражение глаз и миокардит.
Цитомегаловирусная инфекция у людей с нормальным иммунитетом
Заболевание носит всеобщий характер и чаще всего не сопровождается сколько-нибудь значимыми отклонениями в жизнедеятельности человека, т.е. иммунная система среднестатистического жителя планеты способна самостоятельно найти достойный выход из ситуации.
Цитомегаловирусная инфекция при СПИДе
При СПИДе болезнь протекает крайне тяжело — может развиться генерализованная форма инфекции, т. е. поражаются различные органы:
Прогноз часто неблагоприятен. Генерализованная форма цитомегаловирусной инфекции может также развиваться у пациентов с ослабленным иммунитетом и младенцев.
Патогенез цитомегаловирусной инфекции
Входные ворота — слизистая оболочка различных органов, преимущественно ротоглотки и верхних дыхательных путей (также желудочно-кишечного тракта, мочеполовой системы и других органов).
В месте внедрения никаких структурных и воспалительных изменений не наблюдается. После проникновения вируса в организм он атакует свои главные мишени — лимфо- и моноциты, эпителиальные клетки слюнных желёз, лёгких, почек и других органов.
Поражённые клетки увеличиваются в размерах в 3-4 раза (цитомегалия), в ядре клетки формируются включения (незрелые вирионы), в результате чего клетка приобретает вид «совиного глаза». При активном течении болезни развивается депрессия большинства звеньев иммунитета, в том чичле и белка ИНФ-α.
В дальнейшем в ответ на проникновение ЦМВ развивается защитная реакция в виде образования специфических антител различных классов, активации Т-киллеров и развития реакций гиперчувствительности замедленного типа, проявляющейся в поражённых органах образованием узелковых лимфомоноцитарных инфильтратов.
Однако инфицированные клетки не погибают, а продолжают функционировать и выделяют специальный слизисто-белковый секрет, который, обволакивая вирионы, обеспечивает маскировку вируса от иммунной системы человека. Это выражается в слабом иммунном ответе и переходу острого заболевания в длительный латентный процесс (носительство).
При слабой репликации и равновесных отношениях с иммунитетом вирус может длительно (пожизненно) сохранятся в организме в состоянии относительной стабильности, не вызывать никаких органных поражений и не причинять никаких неудобств человеку. Вирусную ДНК при таком состоянии в крови выявить не удаётся, однако в эпителии слюнных желёз и моче вирус можно обнаружить (обычно в незначительном количестве).
При значительном снижении иммунитета (ВИЧ, онкологические заболевания, пересадка органов, длительный приём цитостатиков) происходит активизация вирусной репликации, вирус попадает в кровь и вновь атакует различные органы. [1] [3] [10]
Классификация и стадии развития цитомегаловирусной инфекции
Общепринятой классификации не существует, она разнится в зависимости от особенностей медицинского подхода к проблематике заболевания.
Классификация по клинической форме:
1. Приобретённая ЦМВ:
○ генерализованная (мононуклеозоподобная, лёгочная, церебральная и почечная, печёночный гепатит, с поражением ЖКТ, комбинированного вида);
Отдельно выделяют цитомегаловирусную болезнь у ВИЧ-инфицированных.
Классификация по МКБ-10:
Классификация по степени тяжести:
Осложнения цитомегаловирусной инфекции
Осложнения при цитомегалии бывают специфическими неспецифическими.
Специфические осложнения:
Неспецифические осложнения обусловлены наслоением вторичной бактериальной флоры. Это гнойные осложнения — повышение температуры тела до 41°С, соответствующие симптомы поражения определенных органов, нейтрофильный лейкоцитоз. [1] [3] [9] [10]
Диагностика цитомегаловирусной инфекции
Лабораторная диагностика:
Также проводится инструментальная диагностика:
Дифференциальная диагностика:
Лечение цитомегаловирусной инфекции
Лечение бессимптомной цитомегаловирусной инфекции
Бессимптомные носители цитомегаловирусной инфекции, как правило, не нуждаются в лечении. Исключением могут быть пациенты, которые получают сильную терапию, выраженно угнетающую иммунную систему. В таком случае может возникнуть опасное обострение инфекции, т. е. лечение проводится для профилактики.
Лечение цитомегаловирусной инфекции лёгкой степени тяжести
Лечения проводится в амбулаторных условиях. Важно отметить, что заболевание носит всеобщий характер и чаще всего не сопровождается сколько-нибудь значимыми отклонениями в жизнедеятельности человека. Это определяет основную лечебно-диагностическую тактику при выявлении активной (острой) ЦМВ-инфекции (при отсутствии тяжёлого течения и осложнений) — это здоровое питание, полноценный отдых и динамическое наблюдение. Лишь в случаях упорного течения и выраженных отклонений клинико-лабораторного характера следует подключать средства медикаментозного лечения.
Лечение средней и тяжёлой формы цитомегаловирусной инфекции
Больные средней тяжести, тяжёлые пациенты и дети неонатального возраста подлежат стационарному обследованию, наблюдению и лечению.
Принципы лечения цитомегаловируса должны отвечать следующим требованиям:
Медикаментозное лечение
С учётом индивидуальных особенностей проводится этиотропная терапия, направленная на ослабление вируса, прекращение его генерализованной циркуляции (персистенции) и патогенного потенциала.
В зависимости от условий могут применяться специфические цитомегаловирусные иммуноглобулины, специфические противовирусные препараты прямого противоцитомегаловирусного действия (в основном в условиях реанимации и интенсивной терапии).
В целях повышения сопротивляемости организма показано назначение средств иммунокоррекции и иммунотерапии, патогенетическое и симптоматическое лекарственное обеспечение.
Диета
Питание больных осуществляется согласно тяжести заболевания, проявлениям и возрастному фону. В общем показана диета №5 по Певзнеру с отказом от жирной, жареной, острой и раздражающей пищи, механически и химически щадящие питание.
Диспансерное наблюдение
После выписки за переболевшими устанавливается диспансерное наблюдение в течении 6-12 месяцев с периодическими осмотрами профильных специалистов и обследованием, объём и кратность которого определяется лечащим врачом. [1] [2] [5] [8] [10]
Прогноз. Профилактика
Прогноз, как правило, благоприятный (переход в неактивное носительство).
Специальной профилактики заражения не существует.
В очаге заболевания противоэпидемические мероприятия не проводятся, карантина нет.
После клинического выздоровления дети допускаются в коллективы без ограничительных мероприятий.
В целях выявления источников повышенной опасности ЦМВ проводятся обследования донорам крови, органов и тканей, а также беременным женщинам. Если беременная не имеет специфических антител IgG к ЦМВ, за ней следует установить более тщательное наблюдение с трёхкратным обследованием на ЦМВ за время беременности. В это время ей следует по возможности минимизировать общение с детьми, не пользоваться чужой посудой и не целоваться с новыми людьми.
Рекомендовано назначение профилактического лечения больным СПИДом и после трансплантации органов препаратами прямого противовирусного действия.
Вакцина для предотвращения врождённого ЦМВ находится в стадии разработки. [1] [2] [9]