гастроинтестинальные стромальные опухоли что это
Гастроинтестинальные стромальные опухоли
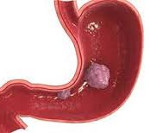
Гастроинтестинальные стромальные опухоли – группа редких злокачественных новообразований желудочно-кишечного тракта мезенхимального происхождения. Клинические проявления зависят от локализации неоплазии. Возможны ощущение быстрого насыщения, боли, вздутие живота, кровотечения и явления кишечной непроходимости. На поздних стадиях выявляются снижение веса, лихорадка, анемия, гипертермия и нарушения функции органов, пораженных отдаленными метастазами. Диагноз выставляют на основании жалоб, данных объективного осмотра, КТ, УЗИ, эндоскопического исследования и результатов биопсии. Лечение – операция, химиотерапия.
Общие сведения
На момент обнаружения некоторые новообразования данной группы могут выглядеть доброкачественными, однако специалисты всегда рассматривают подобные опухоли как потенциально злокачественные. Нередко наблюдается агрессивное течение, на момент постановки диагноза у 15-50% пациентов выявляется метастатическое поражение печени или брюшины. Реже гастроинтестинальные стромальные опухоли метастазируют в кости, плевру и легкие. Основной причиной развития считают наследственную предрасположенность. Некоторые исследователи указывают на связь между видом мутации и уровнем расположения неоплазии. Лечение осуществляют специалисты в области онкологии, гастроэнтерологии и абдоминальной хирургии.
Классификация гастроинтестинальных стромальных опухолей
До 80-х годов прошлого века специалисты считали, что новообразования данной группы происходят из гладкомышечной ткани и рассматривали подобные опухоли как леомиосаркомы, лейомиомы и лейомиобластомы. После внедрения в клиническую практику иммунногистохимических методик и электронной микроскопии было установлено, что клетки гастроинтестинальных стромальных опухолей происходят из интерстициальных клеток Кахаля, представляющих собой связующее звено между интрамуральными узлами периферической нервной системы и клетками гладких мышц полых органов ЖКТ. Одной из основных функций таких клеток является координация перистальтики стенки пищевода, желудка и кишечника.
Макроскопически гастроинтестинальные стромальные опухоли представляют собой рыхлые мягкие узлы розоватого, серого или светло-коричневого цвета с участками ослизнения. Диаметр узлов может колебаться от 1 до 35 см. В процессе роста такие новообразования могут сливаться, образуя конгломераты или кистозные структуры. В центре крупных неоплазий обычно обнаруживаются участки некроза, в ткани новообразований видны кистозные полости с кровоизлияниями.
При микроскопическом исследовании образца гастроинтестинальной стромальной опухоли обнаруживаются веретенообразные и эпителиолидные клетки, располагающиеся на расстоянии друг от друга либо группирующиеся в скопления, разделенные тонкими прослойками соединительной ткани. Отмечается полиморфизм клеток. Веретенообразные клетки образуют пучки и завитки. Эпителиолидные клетки имеют более четкие границы, форма таких клеток округлая или полигональная. Цитоплазма веретенообразных и эпителиоидных клеток светлая, ядра клеток округлые или овальные.
С учетом особенностей гистологического строения выделяют следующие типы гастроинтестинальных стромальных опухолей:
Кроме того, выделяют редко встречающиеся онкоцитарные, мезотелиомоподобные и перстневидноклеточные ГИСО.
Симптомы гастроинтестинальных стромальных опухолей
Патогномоничные симптомы отсутствуют, клиническая картина определяется расположением новообразования. Возможны затруднения глотания, чувство преждевременного насыщения, вздутие или боли в животе. У 20% больных гастроинтестинальная стромальная опухоль на начальных стадиях протекает бессимптомно. Из-за неспецифичности и неяркой выраженности проявлений пациенты обращаются к врачу в среднем через 4-6 месяцев после появления первых признаков болезни. Нередко такие неоплазии становятся случайной находкой при проведении КТ, эзофагогастродуоденоскопии и других исследований. Иногда гастроинтестинальные стромальные опухоли обнаруживают во время хирургического вмешательства по поводу другого заболевания.
При прогрессировании онкологического процесса более чем у половины больных наблюдаются желудочно-кишечные кровотечения, сопровождающиеся меленой или кровавой рвотой. У многих пациентов развивается постгеморрагическая анемия. Высокая вероятность кровотечений при ГИСО объясняется частым изъязвлением новообразования. У 10-30% больных гастроинтестинальными стромальными опухолями отмечаются признаки кишечной непроходимости. На поздних стадиях выявляются снижение массы тела, потеря аппетита, слабость и увеличение живота, обусловленное асцитом и/или растущим новообразованием. При пальпации живота определяется опухолевидное образование. При метастазировании в печень возможно увеличение органа и желтуха той или иной степени выраженности.
Диагностика гастроинтестинальных стромальных опухолей
Диагноз выставляют с учетом клинических симптомов, данных внешнего осмотра и объективных исследований. Пациентам назначают рентгенографию органов брюшной полости, УЗИ и контрастную КТ органов брюшной полости. При низко расположенных опухолях больных направляют на МРТ. При поражении желудка осуществляют гастроскопию, при поражении толстого кишечника – колоноскопию. При подозрении на метастазирование гастроинтестинальной стромальной опухоли проводят рентгенографию грудной клетки, КТ грудной клетки, рентгенографию позвоночника, сцинтиграфию костей скелета и другие исследования.
При возможности используют ПЭТ-КТ, позволяющую точно определять распространенность гастроинтестинальной стромальной опухоли и выявлять небольшие метастазы, не обнаруживаемые при помощи других методик. Окончательный диагноз устанавливают на основании гистологического и иммунохимического исследования образца ткани, взятого при проведении эндоскопического исследования. Дифференциальную диагностику осуществляют с другими новообразованиями ЖКТ.
Лечение гастроинтестинальных стромальных опухолей
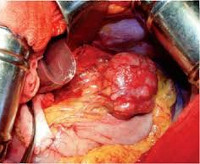
Основным методом лечения ГИСО является хирургическое вмешательство. Объем операции определяется в зависимости от локализации и распространенности неоплазии. Стандартом является радикальная резекция патологических очагов вместе с 1-2 см окружающих здоровых тканей. Удаленную гастроинтестинальную стромальную опухоль отправляют на срочное микроскопическое исследование, при выявлении злокачественных клеток по линии разреза осуществляют иссечение пораженного участка.
Из-за редкого лимфогенного метастазирования лимфаденэктомию не производят (за исключением гастроинтестинальных стромальных опухолей прямой кишки, которые в 25-30% случаев метастазируют в лимфоузлы). При единичных метастазах в печени выполняют радиочастотную термоабляцию или оперативное удаление вторичной опухоли. При неоперабельных новообразованиях назначают предоперационную химиотерапию, затем проводят повторное обследование. При появлении признаков резектабельности новообразование иссекают, в остальных случаях продолжают лечение химиопрепаратами.
Прогноз зависит от расположения, распространенности и размера гастроинтестинальной стромальной опухоли. Средняя пятилетняя выживаемость составляет 48%. До 5 лет с момента радикального хирургического вмешательства удается дожить 50% больных, при опухолях диаметром более 10 см этот показатель снижается до 20%. Отмечается высокая вероятность рецидивирования, в течение 2 лет после радикальной резекции рецидивы выявляются у 80% пациентов. Средняя продолжительность жизни при неоперабельных гастроинтестинальных стромальных опухолях по различным данным колеблется от 10 до 21 месяца.
Гастроинтестинальные стромальные опухоли что это
Отличием от других мезенхимальных опухолей ЖКТ (например, лейомиомы, шванномы и т.д.) является наличие специфических маркеров GIST с экспрессией, равной наблюдаемой в интерстициальных клетках Кахаля, и выявляемых при иммуногистохимическом анализе:
• CD117 (KIT): генный продукт c-kit протоонкогена рецептора фактора роста стволовой клетки.
• CD34: антиген гемопоэтических клеток-предшественников.
• PDGF альфа-рецептор (PDGFRA): альтернативный с c-kit механизм онкогенеза.
Злокачественный потенциал GIST сложен для оценки:
• Благоприятные факторы прогноза: локализация в желудке, диаметр 10 см, митотический индекс > 10 митозов на 10 полей зрения при большом увеличении, инвазия в соседние органы, признаки отсевов по брюшине или отдаленные метастазы.
Гастроинтестинальные стромальные опухоли (GIST) высокорезистентны к обычной химиотерапии. Лечение в основном хирургическое: резекция локализованной GIST, если опухоль резектабельна.
б) Симптомы. Неспецифические симптомы: боль, обструкция, кровотечение или видимая/пальпируемая опухоль. Случайные находки при обследовании с помощью методов лучевой визуализации, эндоскопии.
в) Дифференциальный диагноз:
• Другие доброкачественные мезенхимальные опухоли: лейомиома, липома, нейрофиброма (шваннома).
• Другие злокачественные мезенхимальные опухоли: лейомиосаркома, нейрофибросаркома и т.д.
• Эпителиальные опухоли.
г) Патоморфология гастроинтерстициальных стромальных опухолей
Микроскопическое исследование:
• Веретеновидноклеточные, эпителиоидные или плеоморфные (смешанные) опухоли => ультраструктурные и иммуногистохимические отличия от лейомиомы, лейомиосаркомы или шванномы.
Иммуногистохимическое исследование:
• CD117 (KIT): 75-80% (цитоплазма).
• CD34 (антиген гемопоэтических клеток-предшественников): 60-70%.
• PDGFRA: 5-10%.
Обычные прогностические параметры:
1) размер опухоли;
2) митотический индекс (митозы/число полей зрения при большом увеличении). Выраженность KIT коррелирует с ответом на иматиниб.
д) Обследование при гастроинтерстициальной стромальной опухоли
Необходимый минимальный стандарт:
• Полное обследование толстой кишки (предпочтительно колоноскопия) в обязательном порядке при плановых операциях для выявления мультифокальных опухолей, синхронных раковых опухолей или полипов, а также сопутствующих заболеваний толстой кишки.
• Методы лучевой визуализации: КТ, ПЭТ, МРТ для оценки местной распространенности и выявления отдаленных метастазов.
Дополнительные исследования (необязательные):
• Такие же, как при КРР.
• ЭГДС.
е) Классификация:
• Иммуногистохимическая: KIT-положительные (GIST 85-95%) или KIT-отрицательные (GIST 5-15%).
• Характер опухоли: доброкачественные GIST/злокачественные GIST.
• Операбельные/неоперабельные или мультифокальные/метастатические GIST.
ж) Лечение без операции гастроинтерстициальной стромальной опухоли (GIST) зависит от степени распространенности опухоли:
• Возможная адъювантная химиотерапия во всех случаях?
• (Нео-)адъювантная терапия иматинибом (Gleevec, ингибитор тирозинкиназы) при условно резектабельных GIST.
• Рецидивные, местнораспространенные, нерезектабельные или метастатические GIST: 45-80% первичного ответа на паллиативное лечение Gleevec.
• Роль лучевой терапии не определена.
з) Операця при гастроинтерстициальной стромальной опухоли (GIST)
Показания:
• Любая локализованная форма GIST, при которой возможно полное удаление опухоли без инвалидизации, за исключением случаев абсолютных противопоказаний или множественных метастазов.
• Мультифокальные GIST, только у тщательно отобранных больных (после нео-адъювантной терапии иматинибом).
Хирургический подход. Резекция органа, пораженного опухолью, en-block интактной псевдокапсулой; радикальная лимфаденэктомия показана не во всех случаях.
и) Результаты гастроинтерстициальной стромальной опухоли (GIST):
• Локализованные GIST: выживаемость без признаков заболевания в течение одного года составляет 80-90%, пятилетняя выживаемость после полного хирургического удаления в среднем составляет 50%.
• Метастатические GIST: средняя выживаемость по данным литературы составляет около 20 месяцев, однако 80% больных при назначении иматиниба имеют преимущество в выживаемости.
к) Наблюдение:
• Общее клиническое наблюдение в настоящее время четко не определено.
• Методы лучевой визуализации: КТ, ПЭТ с обычными интервалами.
• Эндоскопия (колоноскопия/ЭГДС), по крайней мере, через каждые 6-12 месяцев.
• В зависимости от локализации: эндоректальная ультрасонография.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в оглавление раздела «Хирургия»
Гастроинтестинальная стромальная опухоль ЖКТ
Гастроинтестинальная стромальная опухоль — это вид онкологического заболевания, поражающее ЖКТ. Она относится к опухолям эпителиального происхождения. На долю ГИСО приходится около 1% всех онкологических патологий органов пищеварения. Средний возраст пациентов с диагностированной ГИСО — от 60 лет и старше.
Акции
Запись на консультацию со скидкой 10%.
Онкоконсилиум может потребоваться как при лечении в «СМ-Клиника», так и пациентам других медицинских учреждений с целью получения альтернативного мнения.
«СМ-Клиника» предоставляет своим пациентам предоперационное обследование со скидкой до 72%!
Консультация врача-хирурга по поводу операции бесплатно!
Содержание статьи:
ГИСО (гастроинтестинальная стромальная опухоль, GIST) — это новообразование, которое локализуется в подслизистом слое органов ЖКТ. Чаще всего опухоль поражает желудок, реже тонкий кишечник. В 5% случаев поражается прямая кишка, реже всего наблюдается стромальная опухоль (ГИСО) пищевода (менее 5%).
Гастроинтестинальные стромальные опухоли встречаются довольно редко и составляют менее 1% от всех случаев рака ЖКТ. Чаще всего заболевание развивается после 40 лет. Пик приходится на возраст 55-60 лет.
На момент выявления некоторые новообразования могут выглядеть доброкачественными, однако онкологи всегда рассматривают опухоли ГИСО как потенциально злокачественные. Заболевание может протекать агрессивно. В этом случае у пациентов выявляют метастазы в брюшине или печени. Реже GIST опухоли дают метастазы в органы дыхания, кости. Терапию заболевания проводят специалисты в области ГИСО онкологии.
Причины и факторы риска ГИСО
Одной из основных причин развития заболевания является наследственная предрасположенность. Некоторые ученые указывают на связь между видом генетической мутации и уровнем локализации неоплазии.
Гастроинтестинальные опухоли кишечника образуются, когда нарушается работа клеток гладкомышечной ткани. Это происходит вследствие мутации генов и приводит к злокачественному перерождению собственных здоровых клеток и их аномальному разрастанию. Провоцировать генные мутации могут следующие факторы риска:
Симптомы GIST
В 20% случаев ГИСО брюшной полости обнаруживают случайно, при проведении планового обследования или диагностики других патологий. В течение долгого времени заболевание протекает бессимптомно и никак не проявляет себя даже, когда опухоль уже довольно большая.
Основная причина отсутствия симптомов – подслизистый рост новообразования, когда опухоль распластывается в стенке внутреннего органа и выбухает в брюшную полость. К моменту выявления образования примерно у каждого третьего пациента уже имеются метастазы в печени, брюшине, иногда в легких. Никаких специфических симптомов при этом нет. Клиника похожа на картину других заболеваний желудочно-кишечного тракта. От появления первых неприятных симптомов до выявления опухоли обычно проходит около полугода.
Симптоматика при ГИСО напоминает гастрит. Пациенты жалуются на чувство распирания под ложечкой, метеоризм, быстро наедаются малыми порциями еды. По мере роста новообразования появляется тошнота и рвота после приема пищи.
Боли бывают не у всех. Они несильные, ноющие, клинической картины «острого живота» не наблюдается. ГИСТ не прорастает в соседние органы, как другие виды рака, а просто оттесняет их с анатомического места. На поздних стадиях примерно у 50% пациентов появляются симптомы желудочного кровотечения (черный жидкий стул, анемия, общая слабость).
Классификация гастроинтестинальных стромальных опухолей ЖКТ
Согласно международной гистологической классификации различают следующие виды ГИСО:
1. Веретеноклеточные опухоли:
2. Эпителиоидноклеточные опухоли:
3. Смешанные ГИСО. Встречаются примерно в 10% случаев.
Стадии
Выявляя стадию заболевания, специалисты оценивают степень распространения опухолевого процесса, который выявляют в результате проведенных диагностических исследований. Крайне важно правильно определить стадию ГИСО, так как от этого зависит выбор тактики лечения, здоровье и жизнь пациента.
Для стадирования ГИСО используют систему TNM, разработанную международным раковым союзом. Буквы в названии классификации означают разные критерии, по которым оценивают рост новообразования. Стадирование необходимо для четкой оценки прогноза и выбора оптимального метода терапии.
Наиболее важными для прогноза факторами при ГИСО являются локализация, размер новообразования, а также митотический индекс.
Символ T (оценивают размер новообразования):
Символ N (оценивают отсутствие или наличие метастазов в лимфоузлах):
Символ М (оценивают наличие отдаленных метастазов в другие органы):
Помимо системы TNM при определении стадии ГИСО учитывают локализацию новообразования и митотический индекс (низкий или высокий). При локализации новообразования в желудке прогноз более благоприятный, поэтому все ГИСО дополнительно делят на две группы — внежелудочные и желудочные. Распределение по стадиям для каждой из этих групп проводится отдельно.
Диагностика ГИСО
Диагноз ставится по результатам данных анамнеза, осмотра пациента, клинической картины, лабораторных и инструментальных исследований.
Основные методы диагностики ГИСО:
При подозрении на наличие метастазов пациенту могут назначить рентгенографию, КТ грудной клетки, рентгенографию позвоночника, сцинтиграфию костей скелета, другие исследования.
Если есть возможность, то используют ПЭТ-КТ. При помощи этого метода диагностики можно точно выявить степень распространенности ГИСО, а также небольшие метастазы, которые не видны при проведении других исследований.
Окончательный диагноз ставится на основании данных иммунохимического и гистологического исследования образцов ткани опухоли, взятых во время проведения эндоскопии. Кроме этого проводится дифференциальная диагностика с другими новообразованиями органов пищеварения.
Методы лечения гастроинтестинальной стромальной опухоли
Основным методом лечения данного типа опухоли является операция. Объем хирургического вмешательства зависит от локализации и степени распространения новообразования. В большинстве случаев проводится радикальное удаление опухоли вместе с несколькими сантиметрами окружающей ее здоровой ткани.
Удаленную опухоль срочно отправляют на гистологию. При обнаружении раковых клеток осуществляют иссечение пораженного участка по линии разреза. При данном заболевании метастазы в лимфоузлы бывают крайне редко, поэтому удаления лимфатических узлов не производят (кроме ГИСО прямой кишки, которая дает метастазы в лимфоузлы в 30% случаев).
При наличии единичных метастазов в печени показано их оперативное удаление или проведение радиочастотной термоабляции.
Если опухоль неоперабельная, то пациенту назначают химиотерапию, после чего проводят повторное обследование. Если новообразование уменьшилось до нужных размеров, то проводят операцию. Во всех остальных случаях продолжают курс химиотерапии.
Прогнозы при ГИСО
Прогноз при ГИСО желудка и опухолях кишечника зависит от размера, локализации и распространенности новообразования. Средняя пятилетняя выживаемость при гисо составляет 48%. До пяти лет с момента операции удается дожить половине пациентов. Если опухоль имеет размер более 10 сантиметров, то показатель выживаемости снижается до 20%.
ГИСО имеет высокую вероятность рецидивирования. Примерно у 80% больных происходят рецидивы заболевания в течение двух лет после операции. При неоперабельных опухолях средняя продолжительность жизни составляет 10-21 месяц.
Профилактика GIST
Основной задачей наблюдения является ранняя диагностика заболевания, что существенно облегчает последующее лечение и улучшает прогноз. После проведения операции по удалению новообразования необходимо посещать врача для проведения планового обследования. В первые два года это нужно делать с периодичностью раз в 3-6 месяцев. Через 3-5 лет специалиста нужно посещать раз в 6-12 месяцев. После 5 лет с момента хирургического вмешательства достаточно посещать доктора раз в год или при появлении проблем со здоровьем.
Плановое обследование обычно включает в себя следующие этапы:
Точные сроки определяет лечащий врач в зависимости от риска прогрессирования заболевания.
Гастроинтестинальные стромальные опухоли что это
ФГБОУ ВО «Казанский государственный медицинский университет» Минздрава РФ, Казань, Россия; ГАУЗ «Республиканский клинический онкологический диспансер» Минздрава Республики Татарстан, Казань, Россия
ФГБОУ ВО «Казанский государственный медицинский университет» Минздрава РФ, Казань, Россия; ГАУЗ «Республиканский клинический онкологический диспансер» Минздрава Республики Татарстан, Казань, Россия; Приволжский филиал РОНЦ им. Н.Н. Блохина Минздрава РФ, Казань, Россия
ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова», Санкт-Петербург, Россия, ГБУЗ «Елизаветинская больница», Санкт-Петербург, Россия.
Клинико-морфологическая характеристика гастроинтестинальных стромальных опухолей
Журнал: Архив патологии. 2017;79(4): 48-55
Халиков Д. Д., Ахметзянов Ф. Ш., Петров С. В. Клинико-морфологическая характеристика гастроинтестинальных стромальных опухолей. Архив патологии. 2017;79(4):48-55.
Khalikov D D, Akhmetzyanov F Sh, Petrov S V. Clinical and morphological characteristics of gastrointestinal stromal tumors. Arkhiv Patologii. 2017;79(4):48-55.
https://doi.org/10.17116/patol201779448-55
ФГБОУ ВО «Казанский государственный медицинский университет» Минздрава РФ, Казань, Россия; ГАУЗ «Республиканский клинический онкологический диспансер» Минздрава Республики Татарстан, Казань, Россия
Гастроинтестинальные стромальные опухоли (ГИСО) являются самыми распространенными мезенхимальными опухолями желудочно-кишечного тракта. Несмотря на это, в структуре онкологических заболеваний пищеварительного тракта ГИСО занимают приблизительно 2%. Они обычно локализуются в желудке, однако могут быть найдены в тонкой кишке — в толстом кишечнике и пищеводе. Хотя примерно в 70% случаев ГИСО состоят из веретеновидных клеток, 20% представлены эпителиоидно-клеточным вариантом, встречаются также смешанные варианты. Такая вариабельность морфологического строения ГИСО усложняет их диагностику.
ФГБОУ ВО «Казанский государственный медицинский университет» Минздрава РФ, Казань, Россия; ГАУЗ «Республиканский клинический онкологический диспансер» Минздрава Республики Татарстан, Казань, Россия
ФГБОУ ВО «Казанский государственный медицинский университет» Минздрава РФ, Казань, Россия; ГАУЗ «Республиканский клинический онкологический диспансер» Минздрава Республики Татарстан, Казань, Россия; Приволжский филиал РОНЦ им. Н.Н. Блохина Минздрава РФ, Казань, Россия
ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова», Санкт-Петербург, Россия, ГБУЗ «Елизаветинская больница», Санкт-Петербург, Россия.
Гастроинтестинальные стромальные опухоли (ГИСО) — это потенциально злокачественные мезенхимальные новообразования, преимущественно локализующиеся в органах пищеварительного тракта, характеризующиеся неоднородностью клинической, патоморфологической и молекулярно-генетической картины [1, 2]. В структуре онкологических заболеваний пищеварительного тракта ГИСО занимают 1—2%, однако они являются самыми распространенными мезенхимальными опухолями этой локализации (80%) [3].
Исторически стромальные опухоли желудочно-кишечного тракта (ЖКТ) относили к гладкомышечным новообразованиям: лейомиомам, лейомиобластомам или саркомам [4, 5]. Однако в ходе дальнейших исследований с применением электронной микроскопии показано, что ультраструктура этих опухолей не соответствует гладкомышечному происхождению и потому их следует рассматривать отдельно [6]. Активное внедрение иммуногистохимии в практику способствовало еще большему укреплению этой точки зрения: ученые обнаружили, что значительная часть опухолей экспрессирует нейрональные антигены, а не гладкомышечные маркеры [7, 8]. M. Mazur, H. Clark [7] впервые использовали термин «гастроинтестинальные стромальные опухоли». В 1994 г. было установлено, что многие ГИСО иммуноположительны по CD34 [9], а CD34 является типичным маркером интерстициальных клеток Кахаля (пейсмекеров ауэрбахова сплетения), что натолкнуло научную мысль на их общее происхождение. Справедливость этой гипотезы подтверждена в дальнейших исследованиях, в ходе которых были описаны другие гомологичные маркеры (CD117) и высокое фенотипическое сходство опухолевых клеток ГИСО и интерстициальных клеток Кахаля [10, 11].
K. Søreidea и соавт. [12] провели обзор 29 популяционных исследований, выполненных в 19 странах мира в промежутке с января 2000 по декабрь 2014 г., так или иначе затрагивающих ГИСО. Они выделяют следующие эпидемиологические особенности ГИСО: медиана возраста на момент постановки диагноза около 65 лет, гендерное распределение равнозначное, в 18% случаев болезнь выявляется инцидентально, ежегодная заболеваемость характеризуется значительной вариабельностью в зависимости от географического положения и в среднем составляет 10—15 случаев на 1 млн человек в год. В РФ подобные исследования не проводились. Некоторые эксперты называют приблизительную цифру 2000 случаев в год [13].
Этиология, патогенез и генетика. В 1998 г. S. Hirota и соавт. [10] впервые обнаружили мутации гена c-kit и гиперэкспрессию тирозинкиназы KIT в клетках ГИСО, что стало огромным шагом в понимании патофизиологии этого заболевания. В 2003 г. М. Heinrich и соавт. [14] описали мутации в другом важнейшем гене — PDGFRA (Platelet-derived growth factor receptor alpha). Продукты экспрессии этих генов относятся к семейству рецепторных тирозинкиназ типа III. В нормальных условиях для активации тирозинкиназы требуется ее взаимодействие с лигандом — фактором роста стволовых клеток [15]. Мутации приобретения функции (gain-of-function mutation) приводят к лиганднезависимой постоянной активации рецептора и его гиперэкспрессии, что усиливает клеточную пролиферацию и запускает опухолевый рост. Идентичный механизм составляет патофизиологическую основу не только ГИСО, но и таких злокачественных новообразований, как хронический миелолейкоз, семинома и др. [16].
Н. Yamamoto и соавт. [17] отмечают, что мутации преимущественно локализуются в экстрацеллюлярном (экзоны 8 и 9 гена c-kit), юкстамембранном (экзон 11 гена c-kit, экзон 12 гена PDGFRA) или каталитическом (экзоны 13 и 17 гена c-kit, экзоны 14 и 18 гена PDGFRA) доменах. В работе отмечено, что наиболее частыми являются мутации в экзонах 11 и 9 гена c-kit (60—70 и 5—10% случаев ГИСО соответственно), а также в экзонах 12 и 18 гена PDGFRA (2 и 8% соответственно). На долю мутаций в остальных экзонах приходится не более 1% случаев ГИСО.
Примерно в 10—15% случаев мутации в генах c-kit и PDGFRA не выявляются (дикий тип). Предполагается, что в этом случае активация тирозинкиназного каскада связана с дисфункцией генов BRAF, HRAS, NRAS или PIK3CA [18].
Совсем недавно установлено, что в патогенезе ГИСО значительную роль играет дизрегуляция так называемого Hedgehog (HH) сигнального пути. В норме этот путь участвует в клеточной дифференциации и пролиферации, в том числе в ходе эмбриогенеза [19]. P. Pelczar и соавт. [20] продемонстрировали, что постоянная активация HH-сигналинга у мышей, достигнутая посредством инактивации рецептора гена PTCH1, приводит к развитию опухолей, подобных ГИСО с точки зрения локализации, гистологического строения и уязвимости к иматинибу. Проведенное иммуногистохимическое исследование выявило гиперэкспрессию PDGFRA, но не KIT. В работе C.-M. Tang и соавт. [21] установлена вариабельная экспрессия некоторых HH-ассоциированных генов в изолированных интерстициальных клетках Кахаля и клетках ГИСО человека и грызунов независимо от мутационного статуса. Кроме того, авторы зафиксировали потенциально значимые геномные альтерации в ключевых генах HH-пути (PTCH1, PTCH2, SMO, SUFU, GLI1) в 10% исследуемых образцов ГИСО. При этом фармакологическая или генетическая блокада определенных звеньев сигналинга (например, GLI½) приводила к снижению экспрессии KIT и жизнеспособности опухолевых клеток, в том числе резистентных к иматинибу. По мнению авторов, полученные результаты свидетельствуют, что HH-путь является перспективной фармакологической мишенью для лечения ГИСО [21].
Клиническая картина. Характерной чертой ГИСО является бессимптомное течение на ранней стадии заболевания [22]. Вслед за увеличением размера опухоли появляются неспецифические симптомы, такие как боль в животе, утомляемость, диспепсия, тошнота, анорексия, потеря массы тела и др. Изъязвление слизистой оболочки может привести к хроническому желудочно-кишечному кровотечению, а в случае распада опухоли возможно развитие массивной кровопотери вплоть до геморрагического шока [23]. Клиническая картина также зависит от локализации опухоли: описаны случаи билиарной обструкции на фоне ГИСО ампулы фатерова соска [24], дисфагии при поражении пищевода [25], констипации, вызванной ГИСО прямой кишки [26], и другие симптомокомплексы. Т. Ueyama и соавт. [27] отмечают, что ГИСО крупного размера могут выявляться при пальпации живота.
В работе R. DeMatteo и соавт. [28] отмечено, что ГИСО метастазируют гематогенным путем преимущественно в печень и/или брюшину, однако в литературе также упоминаются редкие случаи метастазирования в легкие и кости [29].
Результаты зарубежных популяционных исследований свидетельствуют, что наиболее частой локализацией ГИСО является желудок (60% случаев). Распределение по другим отделам ЖКТ выглядит следующим образом: 20—30% в тощей и подвздошной кишке, 5% в двенадцатиперстной, 4% в толстой и прямой кишке. Значительно реже выявляются ГИСО пищевода и аппендикса, а также экстрагастроинтестинальные новообразования [16]. В отечественной литературе приводятся аналогичные цифры [30].
M. Miettinen и соавт. [31], проанализировав 1765 случаев ГИСО, обратили внимание на широчайший диапазон размера опухолей: от 0,5 до 44 см, медиана 6 см. Размер опухоли является важнейшим фактором, обусловливающим характер клинической картины. Так, в ходе крупного популяционного исследования, проведенного в Швеции, установлено, что средний размер опухоли у пациентов с бессимптомным течением ГИСО составляет 2 см, а при наличии симптомов — 6 см [32].
J. Hechtman и соавт. [33] указывают на высокую распространенность сопутствующих неоплазий у пациентов с ГИСО. Они провели ретроспективный анализ данных 260 пациентов с ГИСО и обнаружили, что у 19% ранее выявлялось как минимум одно сопутствующее онкологическое заболевание. Среди факторов, предрасполагающих к развитию сопутствующих новообразований, авторы выделяют мутации в гене KIT в экзоне 11 и высокую митотическую активность в опухолевых клетках.
Существуют различные подходы к стратификации риска ГИСО. Классификация Национального института здоровья США (National Institute of Health, NIH) опирается на два критерия: число митозов в 50 полях зрениях (далее 50 HPF) и размер опухоли. Эта классификация предусматривает четыре группы риска: очень низкий, низкий, промежуточный и высокий. По мнению C. Fletcher и соавт. [34], термин «доброкачественный» неприменим по отношению к ГИСО. Вместо этого они рекомендуют использовать термин «опухоль с низким потенциалом злокачественности». Другая, широко применяемая классификация разработана в Институте патологии вооруженных сил США (Armed Forces Institute of Pathology — AFIP). Ее отличие от системы NIH заключается в том, что она дополнительно учитывает анатомическую локализацию, поскольку, например, ГИСО желудка при прочих равных характеристиках имеют более благоприятный прогноз. М. Miettinen и J. Lasota [35] считают, что принципиальной особенностью системы AFIP является то, что опухоли размером 2 см и менее и числом митозов 5/50 HPF и менее независимо от локализации являются относительно доброкачественными, так как в этой группе авторы не зафиксировали ни одного случая метастазирования или инвазивного роста.
Еще одна распространенная прогностическая система по сути является комбинацией двух предыдущих: в ней ГИСО распределяются на группы риска на основании следующих критериев: размера опухоли, числа митозов в 50 HPF, локализации и разрыва опухолевой капсулы. Наличие последнего сразу переводит ГИСО в группу высокого риска, потому что в этом случае значительно повышается вероятность метастазирования в брюшину [36].
Все три классификации сведены в таблице.

Гистология и патология ГИСO
Общие закономерности
Ключевыми гистологическими вариантами ГИСО являются веретеновидно-клеточный (наиболее распространенный, примерно 70% случаев), эпителиоидно-клеточный (20—25%) и смешанно-клеточный. В отечественной литературе описаны следующие варианты гистологических структур ГИСО: пучковые, палисадообразные, в виде клеточных гнезд, альвеолярные, диффузные, миксоидные, трабекулярные и ряд других [37]. A. Dei Tos [38] отмечает, что явная клеточная атипия нехарактерна для ГИСО, равно как и наличие дедифференцировки: обнаружение любого из этих признаков указывает на необходимость поиска альтернативного диагноза.
Двумя наиболее важными иммуногистохимическими маркерами ГИСО являются белки гена c-kit и аноктамин 1 [39]. Экспрессия KIT весьма специфична для ГИСО по сравнению с другими мезенхимальными опухолями ЖКТ, однако эта тирозинкиназа также обнаруживается в интерстициальных клетках Кахаля, тучных клетках, меланоцитах, а также в клетках некоторых злокачественных новообразований (мастоцитома, семинома, саркома Юинга и др.) [40]. F. Medeiros и соавт. [41] обращают внимание на то, что в редких случаях ГИСО (3—5%) экспрессия KIT выявляется фокально или отсутствует вовсе.
Аноктамин 1, также известный под названием DOG1 (англ.: discovered on GIST — обнаруженный в ГИСО), впервые описан относительно недавно [42]. С точки зрения структуры это трансмембранный белок, выполняющий функцию кальцийзависимого хлоридного канала. Аноктамин 1 выявляется в подавляющем большинстве ГИСО, в том числе при отрицательной экспрессии KIT [43]. Вместе с тем этот маркер также не обладает абсолютной специфичностью, на пример его обнаруживают и в клетках плоскоклеточных карцином ЖКТ.
CD34 — антиген гемопоэтических клеток-предшественников также часто присутствует в клетках ГИСО (60% случаев) [44], однако этот маркер менее специфичен по сравнению с KIT и DOG1. Среди других маркеров, играющих вспомогательную роль в иммуногистохимической диагностике ГИСО, можно отметить виментин, белок S100, гладкомышечный актин, h-кальдесмон и некоторые другие.
В литературе упоминаются случаи ГИСО с неоднородным фенотипом, состоящие из нескольких клеточных популяций, каждая из которых может иметь уникальную иммуногистохимическую картину [45].
ГИСО желудка. Как уже упоминалось ранее, ГИСО наиболее часто локализуется в желудке. В работе M. Miettinen и соавт. [31] подробно описано клиническое и гистопатологическое разнообразие ГИСО этой локализации. Размер опухоли варьирует от микроскопического до гигантского — диаметр более 20 см и массой несколько килограмм [46—48]. Крупные опухоли часто представляют комплексную структуру с внутрипросветным, интрамуральным и внешним компонентами. В некоторых случаях ГИСО желудка имеют полипоидное или кистозное строение. На разрезе эти новообразования в типичных случаях розоватого цвета, напоминающего мясо рыбы, с геморрагическими участками.
Большинство ГИСО желудка имеет веретеновидно-клеточную морфологию. Как правило, эти опухоли характеризуются низкой клеточностью с высоким содержанием коллагенового матрикса, иногда с кальцификатами. Типичными находками являются выраженная перинуклеарная вакуолизация и ядерные палисады.
Меньшая часть опухолей (20—25%) относится к эпителиоидно-клеточному варианту. Гистологически они варьируют в диапазоне от митотически неактивных склерозированных опухолей с низкой клеточностью до новообразований саркоматозного вида с крайне высокой митотической активностью.
Веретеновидно-клеточные ГИСО желудка экспрессируют KIT, аноктамин 1 (DOG1) и CD34; значительно реже определяется и гладкомышечный актин. Похожая иммуногистохимическая картина характерна и для ГИСО эпителиоидно-клеточного строения. В этом случае возможна лишь фокальная экспрессия KIT, а в редких случаях опухоль может быть KIT-отрицательной [49]. Кроме того, лишь 50% эпителиоидно-клеточных ГИСО желудка положительны по CD34.
В большинстве желудочных ГИСО выявляются мутации гена c-kit, из которых наиболее частыми являются делеции на 5’-конце экзона 11 (кодоны 550—560), однонуклеотидные замены (кодоны 557, 559, 560, 576) и тандемные дупликации на 3’-конце экзона 11. Вместе с тем в 20—25% случаев выявляются мутации гена PDGFRA; чаще всего однонуклеотидная замена Asp842Val [24]. J. Lasota и соавт. [50] отмечают, что желудочные ГИСО с мутациями в гене PDGFRA, как правило, характеризуются эпителиоидной морфологией и низким потенциалом злокачественности.
ГИСО тонкой кишки. Интестинальные ГИСО характеризуются более гомогенной гистологической структурой: в подавляющем большинстве случаев они относятся к веретеновидно-клеточному варианту. Опухоли крупного размера обычно имеют внутренний кистозный компонент, сообщающийся с просветом кишки. В литературе описаны так называемые скейноидные волокна (skeinoid fibers): экстрацеллюлярные коллагеновые эозинофильные глобулы, особенно характерные для интестинальных ГИСО с низкой митотической активностью [51]. Другой характерной особенностью ГИСО тонкокишечной локализации являются крупные безъядерные пространства, состоящие из сложных спутанных клеточных отростков. M. Miettinen и соавт. [52] отмечают, что визуально эти образования напоминают тельца Верокаи в шванноме или нейропиль нейробластомы.
Практически все интестинальные ГИСО экспрессируют KIT и аноктамин 1 (DOG1). Примерно 60% опухолей положительны на белок CD34, 30—35% — на гладкомышечный актин. Белок S100 выявляется в 10—20% случаев, что может привести к ошибочному диагнозу опухоли оболочки периферических нервов [39]. В ГИСО тонкой кишки обычно выявляются мутации гена c-kit в экзоне 11, в том числе вышеописанные делеции и однонуклеотидные замены, типичные для желудочных ГИСО. Кроме того, в 5—10% обнаруживаются дупликации двух кодонов в экзоне 9, которые ассоциируются с агрессивным течением [53]. Мутации гена PDGFRA не характерны для тонкокишечных ГИСО.
ГИСО толстой и прямой кишки. Гистологическая и иммуногистохимическая картина почти не отличается от ГИСО тонкой кишки. На момент диагноза большинство опухолей имеет большой размер, прогноз в этом случае неблагоприятный [54]. Макроскопическая картина ГИСО прямой кишки варьирует в диапазоне от интрамуральных узлов малого размера до крупных комплексных новообразований с глубоким распространением в полость малого таза. Ряд авторов описывают случаи тесного прилегания к задним участкам предстательной железы, что клинически и радиологически может напоминать рак простаты [55].
ГИСО пищевода. S. Lott и соавт. [56] приводят следующие ключевые клинико-патологические особенности этого новообразования: типичная локализация в нижних отделах пищевода, наличие симптомов (дисфагия, потеря массы тела, кровотечение) на момент постановки диагноза, веретеновидно-клеточный гистологический вариант, экспрессия KIT и CD34. Кроме того, авторы отмечают крупный размер, высокую митотическую активность и склонность к экзофитному росту в средостение, что обусловливает в целом неблагоприятный прогноз.
Экстрагастроинтестинальные ГИСО. В ранних работах упоминалось, что распространенность ГИСО с локализацией за пределами ЖКТ может достигать 10% [57]. Однако результаты работы A. Agaimy и P. Wunsch [58] свидетельствуют, что значительная часть этих экстрагастроинтестинальных ГИСО (ЭГИСО) на самом деле являются диссеминированными метастазами либо вторичными новообразованиями, которые, вероятно, отделились от первичного очага в ЖКТ в ходе опухолевого роста. Таким образом, истинно экстрагастроинтестинальными может считаться не более 1,5% ГИСО. В литературе [59] описаны случаи ЭГИСО самой различной локализации: поджелудочная железа, селезенка, ретроперитонеальное пространство, плевра, органы малого таза и др. К. Kim и соавт. [60] обращают внимание на то, что, помимо KIT и DOG1, важным иммуногистохимическим маркером ЭГИСО является PKC-θ.
Прочие ГИСО. У пациентов с нейрофиброматозом 1-го типа (далее НФ1) отмечен повышенный (примерно в 200 раз) риск развития ГИСО по сравнению с общей популяцией [39]. Результаты некоторых исследований свидетельствуют, что на аутопсии ГИСО обнаруживают у каждого третьего пациента с НФ1 [61]. В типичных случаях они локализуются в тонкой кишке, характеризуются многочисленностью и малым размером, обнаруживаются случайно в ходе скрининговых обследований или хирургических вмешательств. ГИСО при НФ1 обладают типичными гистологическими признаками тонкокишечных ГИСО: низкой митотической активностью, веретеновидно-клеточной морфологией и высоким содержанием скейноидных волокон. Для иммуногистохимической картины характерны экспрессия KIT, аноктамина 1 и субъединицы-B сукцинатдегидрогеназы. При этом эксперты подчеркивают, что в отличие от спорадических ГИСО для НФ1-ассоциированных опухолей нехарактерны мутации в генах с-kit и PDGFRA (дикий тип) [62].
В педиатрической популяции ГИСО встречаются крайне редко, обладают уникальными клинико-патологическими особенностями [39]. Они значительно чаще выявляются у лиц женского пола. Типичной локализаций является антральный отдел желудка. Большинство педиатрических ГИСО характеризуются индолентным течением, несмотря на тенденцию к метастазированию.
Педиатрические ГИСО могут быть спорадическими или манифестировать в рамках двух тесно связанных синдромов. Желудочная ГИСО в сочетании с хондроматозной гамартомой легкого и вненадпочечниковой параганглиомой образуют так называемую триаду Карнея [63]. Это ненаследуемый синдром, характеризующийся индолентным течением и благоприятным прогнозом. Для синдрома Карнея—Стратакиса характерно сочетание ГИСО желудка и параганглиомы, которые могут развиваться синхронно или метахронно, иногда с интервалом в десятки лет. В отличие от триады Карнея этот синдром характеризуется аутосомно-доминантным типом наследования [64].
Типичными гистологическими признаками педиатрических ГИСО (в том числе в рамках вышеописанных синдромов) является многоочаговость, эпителиоидно-клеточная морфология с высокой клеточностью и вариабельной митотической активностью. Уникальной особенностью, описываемой в литературе, является метастазирование в лимфатические узлы. Кроме того, для этих ГИСО характерно отсутствие типичных мутаций (c-kit и PDGFRA) и экспрессии субъединицы-B сукцинатдегидрогеназы [65].
Диагностика и лечение. В работе А. Серякова [66] отмечено, что рациональный алгоритм диагностики при подозрении на ГИСО включает ряд инструментальных обследований: 1) УЗИ (в том числе эндосонография, которая используется в качестве контроля тонкоигольной биопсии); 2) КТ с контрастированием или МРТ. Они применяются для уточнения локализации опухоли, определения характера метастазирования, планирования объема оперативного вмешательства и контроля эффективности лечения; 3) эндоскопические методы: ФГС, ФКС; 4) ПЭТ КТ является вспомогательным методом для оценки эффективности лечения и выявления отдаленных метастазов.
Современные клинические рекомендации допускают динамическое эндосонографическое наблюдение опухолевых узлов размером менее 2 см в отсутствие явных признаков высокого риска. Однако это не относится к прямокишечным ГИСО, которые рекомендуется лечить безотлагательно [67].
Основным методом лечения локализованных ГИСО является полная хирургическая резекция [1]. По данным R. DeMatteo и соавт. [68], безрецидивная 5-летняя выживаемость в этом случае составляет 63%. Поскольку лимфогенная диссеминация нехарактерна для этих новообразований у взрослых пациентов, лимфаденэктомия в типичных случаях не показана. Результаты серии ретроспективных исследований свидетельствуют, что при размере опухоли менее 5 см допустимо использование лапароскопических методик [69].
Лечение распространенных и рецидивирующих ГИСО ранее представляло собой фактически неразрешимую проблему, поскольку оперативное вмешательство в этом случае не имеет радикального характера, а лучевая терапия и стандартные схемы химиотерапии обладают крайне низкой эффективностью [70]. Ситуация изменилась после внедрения в клиническую практику таргетных препаратов, в частности иматиниба. Он оказывает прямое патогенетическое действие в отношении ГИСО: его ключевой фармакодинамический эффект заключается в избирательном ингибировании активности широкого спектра тирозинкиназ в опухолевых клетках. C. Blanke и соавт. [71] в ходе крупного проспективного исследования показали, что применение иматиниба у пациентов с нерезектабельными или метастатическими ГИСО позволяет добиться почти троекратного увеличения медианы общей выживаемости. Впечатляющие результаты получены также в других клинических исследованиях [72]. Возможно назначение препарата в качестве адъювантной терапии после хирургического лечения ГИСО высокого риска [73]. Вместе с тем в литературе отмечено, что эффективность иматиниба зависит от генотипа опухолевых клеток: наибольшей чувствительностью к препарату обладают ГИСО с мутациями в экзонах 11 и 9 гена c-kit, тогда как, например, опухоли с мутациями в каталитическом домене (экзоны 13 и 17 гена c-kit и экзон 18 гена PDGFRA) демонстрируют резистентность по отношению к иматинибу, потому что в этом случае молекулы препарата не способны связываться с тирозинкиназой [17].
Таргетными препаратами второй и третьей линии, которые назначают при резистентности к иматинибу или его непереносимости, являются сунитиниб и регорафениб, также относящиеся к классу мультикиназных ингибиторов [1].
Заключение
ГИСО — это самые распространенные мезенхимальные опухоли пищеварительного тракта. В настоящий момент считается, что эти новообразования происходят из интерстициальных клеток Кахаля или их предшественников, в пользу чего свидетельствует общность иммуногистохимических и молекулярно-генетических маркеров, а также высокая степень ультраструктурного сходства.
Ключевым механизмом, лежащим в основе патофизиологии ГИСО, является гиперэкспрессия и конститутивная активность рецепторной тирозинкиназы KIT, что приводит к гиперпролиферации и опухолевому росту. Описанная дисфункция фермента преимущественно возникает вследствие активирующих мутаций в генах c-kit или PDGFRA. Мутации чаще всего развиваются спорадически. Однако описаны семейные и наследственные формы ГИСО (например, в рамках НФ1 или синдрома Карнея—Стратакиса).
Клиническая картина отличается значительным разнообразием в зависимости от локализации и размера опухоли. Эти два фактора также являются важнейшими прогностическими критериями наряду с числом митозов в 50 HPF. Согласно одной из имеющихся прогностических систем, опухоли размером 2 см и менее и числом митозом 5/50 HPF и менее можно расценивать как доброкачественные. Однако другие эксперты убеждены, что термин неприменим по отношению к данному заболеванию и все ГИСО следует расценивать как потенциально злокачественные. Точка в этом вопросе еще не поставлена.
Ключевыми гистологическими вариантами ГИСО являются веретеновидно-клеточный, эпителиоидно-клеточный и смешанно-клеточный. Для иммуногистохимической картины характерна экспрессия CD117 (KIT), аноктамина 1 (DOG1), CD34 и ряда других маркеров.
Основным методом лечения локализованных ГИСО является радикальная хирургическая резекция. Стандартная химиотерапия и лучевая терапия обладают крайне низкой эффективностью в отношении ГИСО; нерезектабельные или метастазирующие новообразования требуют назначения таргетных препаратов из группы ингибиторов тирозинкиназ (иматиниб, сунитиниб, регорафениб).
Авторы заявляют об отсутствии конфликта интересов.