высокий гемоглобин и низкий ферритин у женщин что делать
Железодефицитные состояния при гинекологических заболеваниях и способы их коррекции
Рассмотрены роль железа в организме человека, механизмы его усвоения из пищи, клинические признаки железодефицитных состояний и железодефицитной анемии (ЖДА) у женщин, а также подходы к терапии и профилактике ЖДА с применением современных пероральных ферр
Железодефицитная анемия (ЖДА) — гематологический синдром, характеризующийся нарушением синтеза гемоглобина вследствие дефицита железа. В основе анемии лежит тканевая гипоксия, развивающаяся в результате снижения количества гемоглобина вследствие кровопотери, нарушения образования эритроцитов, их деструкции или сочетания этих причин [1, 2].
Дефицит железа встречается почти у 1/3 жителей Земли, а железодефицитная анемия составляет 80–90% среди всех анемий. Распространенность анемий различается от пола, возраста, климато-географических и эколого-производственных причин [1, 3, 4].
Соответствующий дефицит развивается, когда потери железа превышают его поступление 2 мг/сут, и наблюдается при различных физиологических состояниях и заболеваниях [5, 6].
Железодефицитная (гипохромная, микроцитарная) анемия обычно возникает вследствие снижения ресурсов железа в организме при хронической кровопотере или недостаточном внешнем поступлении железа.
Наиболее уязвимы по развитию железодефицитных состояний женщины репродуктивного возраста вследствие ежемесячной физиологической кровопотери во время менструации, беременные по причине высокой потребности в микроэлементах, дети и подростки — из-за высоких потребностей растущего организма, пожилые люди, страдающие хроническими заболеваниями и имеющие плохое питание.
Железо является незаменимым микроэлементом, играющим важную роль в функционировании клеток многих систем организма, основная из которых — участие железа в процессах тканевого дыхания. Общее количество железа в организме женщины достигает 2–3 г, а его концентрация — 40–50 мг на кг массы тела.
Различают два вида железа: гемовое и негемовое. Гемовое железо входит в состав гемоглобина, содержится лишь в мясных продуктах, легко всасывается, и на его всасывание практически не влияет состав пищи.
Негемовое железо находится в свободной ионной форме — двухвалентного или трехвалентного железа. Абсорбция негемового железа (содержится преимущественно в овощах), на которое приходится до 90% железа всего рациона, находится в зависимости от целого ряда факторов. Основная часть железа входит в состав гемоглобина и миоглобина — 70%; депо железа — 18% (внутриклеточное накопление в форме ферритина и гемосидерина); функционирующее железо — 12% (миоглобин и содержащие железо энзимы); транспортируемое железо — 0,1% (железо, связанное с трансферрином) [7–9].
К наиболее важным железосодержащим соединениям относятся: гемопротеины, структурным компонентом которых является гем (гемоглобин, миоглобин, цитохромы, каталаза, пероксидаза), негемовые ферменты (сукцинатдегидрогеназа, ацетил-КоА-дегидрогеназа, ксантиноксидаза), ферритин, гемосидерин, трансферрин.
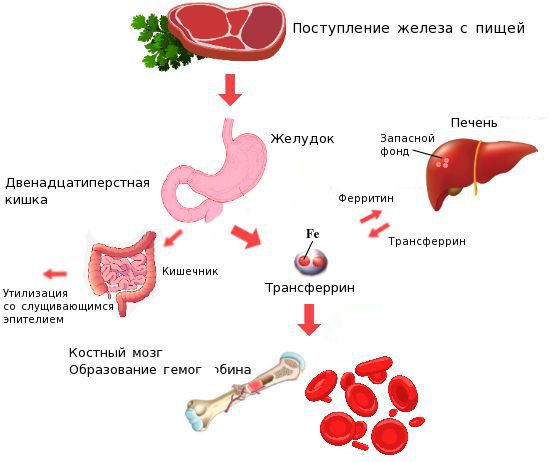
В слизистой оболочке тонкого кишечника из продуктов питания усваивается только двухвалентное негемовое железо. Чтобы железо могло связаться с белками и поступить в клетку, трехвалентное железо восстанавливается в двухвалентное в присутствии кислой среды, основную роль в этом процессе в большинстве случаев играет аскорбиновая кислота [10–13]. Затем для поступления в плазму крови и связывания с трансферрином железо вновь окисляется до трехвалентного. В связанном с трансферрином состоянии железо доставляется тканям посредством эндоцитоза, где оно либо утилизируется клеткой, либо откладывается в составе ферритина. В составе ферритина железо хранится в легкодоступной и нетоксичной форме. Уровень ферритина является «золотым» стандартным показателем количества депонированного железа в организме. Каждый микрограмм ферритина соответствует 8 мг депонированного железа и для женщин в норме составляет 15–150 мг/мл [2, 14–16]. Концентрация же сывороточного железа подвержена значительным суточным колебаниям и составляет в среднем у женщин 6,6–26 мкмоль/л. Поэтому ее определение не имеет первостепенного значения [2].
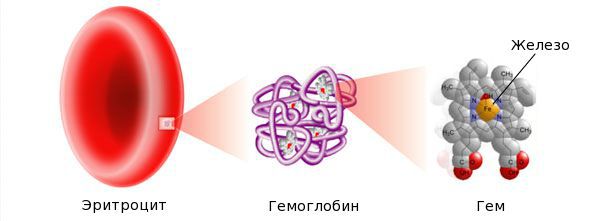
Гемоглобин является транспортным белком для кислорода, содержащим гемовое железо. Гемы объединены в протопорфириновый каркас, в центре которого находится один двухвалентный атом железа. Одна молекула гемоглобина может перенести максимум 4 молекулы кислорода. Таким образом, количество эритроцитов и гемоглобина играет важную роль в транспортировке кислорода [2].
В течении железодефицита выделяют последовательные стадии: латентный дефицит железа, при котором потери железа превышают его поступление без изменений концентрации гемоглобина, и собственно железодефицитную анемию, которую в зависимости от степени выраженности подразделяют на компенсированную, субкомпенсированную и декомпенсированную формы [3].
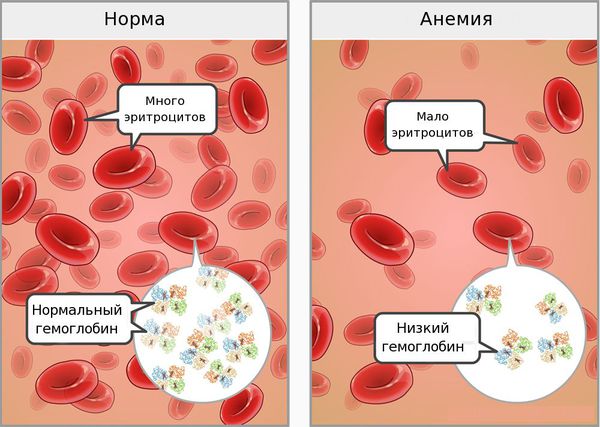
Концентрация гемоглобина выражается в граммах на литр. Нормальным уровнем гемоглобина у женщин считается 115–145 г/л (MCHC, Mean Corpuscular Hemoglobin Concentration — средняя концентрация гемоглобина в клетке 320–360 г/л), об анемии говорят при снижении гемоглобина ниже 110 г/л. О тяжести течения анемии судят по уровню гемоглобина. По степени выраженности анемии выделяют легкую степень — 90–109 г/л, среднюю степень — 70–89 г/л и тяжелую степень — менее 70 г/л [3, 14, 15].
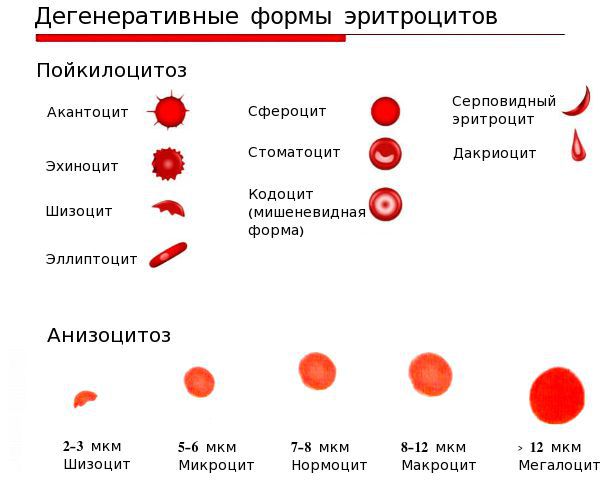
Кроме того, для железодефицитной анемии характерны снижение гематокрита, гипохромия (MCH, Mean Corpuscular Hemoglobin — среднее абсолютное содержание гемоглобина в одном эритроците), микроцитоз (MCV, Mean Corpuscular Volume — средний обьем эритроцита), гипосидероз (снижение количества сывороточного железа, увеличение общей железосвязывающей способности сыворотки крови, снижение уровня ферритина в сыворотке крови и в гемолизате) [3, 5]. Количество эритроцитов, гематокрита и гемоглобина составляют измеряемые величины, а MCV, MCH, MCHC являются производными этих величин [2].
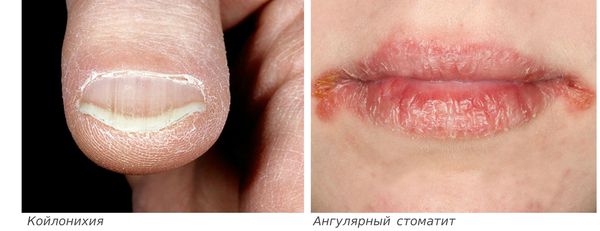
Клиническая картина анемии обусловлена кислородным голоданием тканей, прогрессирующей гемической гипоксией с последующим развитием вторичных метаболических расстройств. Клинические симптомы появляются по мере возрастания тяжести заболевания: общая слабость, головокружение, головная боль, сердцебиение, одышка, обмороки, снижение работоспособности, бессонница. Симптомы, характерные ЖДА, заключаются в изменении кожи, ногтей, волос, мышечной слабости, извращении вкусовых ощущений. Кожа становится сухой, на ней появляются трещины. Вследствие нарушения обмена каротина при дефиците железа возникает желтизна кожи. Изменяется форма ногтей, они уплощаются, становятся вогнутыми и ломкими. Волосы истончаются, ломаются и обильно выпадают, появляется седина. При ЖДА также возможны симптомы поражения сердечно-сосудистой системы: сердцебиение, одышка, боли в груди и иногда отеки на ногах [6, 14].
Основными компенсаторными механизмами являются циркуляторная и вентиляционная адаптация, включающие увеличение сердечного выброса, вазодилатацию, снижение сосудистого сопротивления, увеличение перфузии тканей, перераспределение крови, увеличение минутного объема дыхания, усиление активности эритропоэтина. Острая, тяжелая и некомпенсированная анемия может привести к циркуляторному коллапсу и шоку [2].
Основной причиной развития железодефицитных анемий у женщин являются кровопотери различной этиологии. Дефицит железа у женщин встречается в 6 раз чаще, чем у мужчин. Значительное количество крови теряется во время менструации, беременности, в родах. При обильных менструациях возможна потеря железа в количестве 50–250 мг железа [2]. Чаще всего гиперполименорея связана с наличием миомы матки, аденомиозом, гиперпластическими процессами эндометрия, дисфункциональными маточными кровотечениями. Метроррагии при миоме матки чаще всего связаны с субмукозной локализацией узлов, при которой увеличивается менструирующая поверхность, повышается проницаемость кровоснабжающих миому сосудов, снижается сократительная способность матки. При миоме замедляется регенерация кровоточащей поверхности матки после десквамации эндометрия. При аденомиозе поражается миометрий матки, что приводит к длительным обильным менструациям и к вторичной железодефицитной анемии.
Нарушения менструального цикла возникают у женщин в различные возрастные периоды. К развитию гиперменструального синдрома могут привести разнообразные причины — сильные эмоциональные потрясения, нарушение питания, авитаминозы, ожирение, профессиональные вредности, инфекционные и септические заболевания, незрелость гипоталамических структур в пубертатном возрасте и инволютивная перестройка в пременопаузе. В значительной части случаев менометроррагии у женщин сопровождаются анемией различной степени тяжести, что способствует развитию трофических нарушений в различных органах и тканях. Профилактика и лечение анемий у женщин с нарушением менструального цикла и органическими гинекологическими заболеваниями являются важнейшими факторами восстановления их здоровья [1, 4, 17].
Независимо от причины менометроррагий (миома, эндометриоз, дисфункция яичников) и необходимости воздействия на соответствующий фактор, требуется длительная терапия препаратами железа для приема внутрь. Доза, режим дозирования и конкретный препарат подбираются индивидуально с учетом содержания железа в препарате, его переносимости и т. д.
При выборе конкретного препарата и оптимального режима дозирования необходимо иметь в виду, что адекватный прирост показателей гемоглобина при наличии ЖДА может быть обеспечен поступлением в организм от 30 до 100 мг двухвалентного железа [18]. Одними диетическими мероприятиями нельзя возместить дефицит железа и достичь лечебного эффекта.
Антианемическая терапия должна проводиться препаратами для приема внутрь и не должна прекращаться после нормализации гемоглобина. Показания для парентерального введения достаточно ограничены: патология кишечника с нарушением всасывания, непереносимость препаратов для приема внутрь, социальные причины (использование у пациентов с изменениями личности, душевнобольных). По данным многих исследований парентеральные формы не имеют преимущества перед пероральными, при этом отмечается большое количество серьезных побочных эффектов [4, 10, 19]. Гемотрансфузии при ЖДА должны проводиться только по жизненным показаниям.
Современные пероральные ферропрепараты представляют собой соли двухвалентного железа (в пищеварительном тракте ионы трехвалентного железа не всасываются) или соединения, состоящие из гидроксид-полимальтозного комплекса трехвалентного железа (механизм всасывания отличается от такового ионных препаратов) [20].
Наивысшей биодоступностью обладает сернокислая соль железа, поэтому в основном в ферропрепаратах содержится сульфат железа [19, 21]. Сульфат железа это наиболее изученная, проверенная форма, хорошо зарекомендовавшая себя при длительном применении, поэтому чаще других входит в состав препаратов для приема внутрь. Обладает наибольшей степенью всасывания из всех препаратов железа.
В процессе всасывания двухвалентного железа в кишечнике большое значение имеет аскорбиновая кислота, которая способствует поддержанию железа в двухвалентной форме, поэтому очень важно ее наличие в препарате [22]. В гемопоэзе существенная роль принадлежит фолиевой кислоте, усиливающей нуклеиновый обмен. Для нормального обмена фолиевой кислоты необходим цианокобаламин, который способствует образованию из нее активной формы. Дефицит этих веществ, часто возникающий при анемиях, связанных с кровопотерями, приводит к нарушению синтеза ДНК в кроветворных клетках, тогда как включение этих компонентов в препарат увеличивает активную абсорбцию железа в кишечнике и его дальнейшую утилизацию. Наличие в лекарственном препарате аскорбиновой и фолиевой кислот, а также цианокобаламина значительно увеличивает скорость синтеза гемоглобина и повышает эффективность терапии железодефицитных состояний и железодефицитной анемии [14, 23, 24].
Перечисленные компоненты, повышающие биодоступность железа, входят в состав комплексного антианемического препарата Ферро-Фольгамма® [24], который был разработан и производится в соответствии с рекомендациями Всемирной организации здравоохранения (1998).
В 1 капсуле содержится 112,6 мг сульфата железа (элементарного железа 37 мг), что является оптимальной дозой для терапии и сокращает частоту побочных эффектов.
Абсорбция железа из препаратов солей (Fe2+) происходит в виде пассивной диффузии согласно градиенту концентрации, не зависит от рН и двигательной активности желудочно-кишечного тракта (ЖКТ), что обеспечивает быстрое насыщение.
Аскорбиновая кислота улучшает всасывание железа в кишечнике, предотвращает его переход из двухвалентной формы в трехвалентную, ускоряет транспортировку железа и его включения в гем, а также участвует в процессе высвобождения железа из депо.
Аскорбиновая кислота необходима для образования и сохранения восстановленной формы фолиевой кислоты — тетрагидрофолиевой кислоты.
В свою очередь фолиевая кислота является важнейшим фактором для синтеза ДНК и РНК, метаболизма белков и образования красных кровяных клеток, а также выступает дополнительным стимулятором эритропоэза и гемопоэза [21, 23, 25].
Цианокоболамин необходим для образования гемоглобина, эритроцитов, метаболизма белков, жиров, углеводов, производства энергии.
Ферро-Фольгамма® обладает высокой эффективностью, обеспечивая прирост гемоглобина в среднем 2,5 г/л/сут (наибольшая скорость прироста гемоглобина среди препаратов сульфата железа). При использовании препарата Ферро-Фольгамма® ослабление клинической симптоматики постгеморрагической анемии отмечается в течение первых 10 дней приема [6].
Ферро-Фольгамма® назначается по 1 капсуле 3 раза в день после еды в течение 3–4 недель при легкой форме анемии, при средней форме — по 1 капсуле 3 раза в день 8–12 недель, а при тяжелых формах анемии — по 2 капсулы 3 раза в день в течение 16 недель и более. Во время беременности назначается для профилактики недостаточности фолиевой кислоты и железа по 1 капсуле 3 раза в день во II и III триместрах, в послеродовом периоде во время кормления грудью.
После прекращения лечения препаратом Ферро-Фольгамма® положительный эффект и стабилизация показателей сыворотки крови (уровень гемоглобина, эритроцитов, сывороточного железа, общая железосвязывающая способность сыворотки крови) гарантированно сохраняются минимум на протяжении одного месяца [4].
Активные компоненты препарата Ферро-Фольгамма® находятся в специальной нейтральной оболочке, которая обеспечивает их всасывание в верхнем отделе тонкой кишки, что исключает раздражающее действие на желудок. Компоненты растворены в рапсовом масле, которое позволяет улучшить всасывание железа и одновременно снизить раздражающее влияние железа на слизистую оболочку желудка, способствуя хорошей переносимости препарата со стороны пищеварительного тракта [1, 13]. Благодаря отсутствию агрессивного действия на слизистую оболочку ЖКТ Ферро-Фольгамма® может с успехом применяться для коррекции анемического синдрома, при дефиците витамина В12 и фолиевой кислоты на фоне нарушения всасывания в ЖКТ (атрофия слизистой желудка и двенадцатиперстной кишки).
Кроме того, Ферро-Фольгамма® эффективно применяется при сочетанных железо-фолиево-В12-дефицитных анемиях, вызванных хроническими кровопотерями, хроническим алкоголизмом, инфекциями, приемом противосудорожных и пероральных контрацептивных препаратов, анемии во время беременности и кормления грудью.
Эффективность препарата Ферро-Фольгамма® для лечения и профилактики железодефицитной анемии при хорошей переносимости и благоприятных фармакоэкономических характеристиках (стоимость/доза железа/эффективность) была доказана в нескольких российских исследованиях, которые включали широкий круг пациентов, в т. ч. беременных и женщин с гинекологическими заболеваниями [4, 18, 19]. Показаниями к назначению препарата Ферро-Фольгамма® являются анемии, вызванные сочетанным дефицитом железа, фолиевой кислоты и витамина B12, возникающие на фоне хронических кровопотерь (мено- и метроррагий и др.), а также при хроническом алкоголизме, инфекционных заболеваниях, приеме противосудорожных средств и пероральных контрацептивов. Препарат разрешен для профилактики и лечения дефицита железа и фолиевой кислоты во II и III триместрах беременности, в послеродовом периоде и во время лактации.
Таким образом, антианемическая терапия с применением препарата Ферро-Фольгамма® с оптимальным содержанием железа является высокоэффективной с быстрой скоростью прироста гемоглобина (полная клиническая и гематологическая ремиссия у 93% пациенток после 3 недель терапии). Отмечается хорошая переносимость — отсутствие побочных эффектов у 95% пациентов, аллергических реакций и отрицательного влияния на организм женщин, а также стабильность достигнутых результатов и сохранение положительного эффекта в течение месяца после лечения, что позволяет рекомендовать препарат Ферро-Фольгамма® широкому кругу пациентов.
Литература
ГБОУ ВПО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва
Abstract. The role of Ferrum in human organism has been analyzed, mechanisms of its digestion from food, clinical presentations of hypoferric conditions and women’s hypoferric anemia, as well as approaches to therapy and prophylaxis of hypoferric anemia with modern peroral preparations.
Что такое железодефицитная анемия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Головко О. А., терапевта со стажем в 12 лет.
Определение болезни. Причины заболевания
Основные причины развития ЖДА:
Группы риска по ЖДА:
Симптомы железодефицитной анемии
Сидеропенический синдром связан с недостатком железа в тканях и проявляется нарушениями со стороны кожи и слизистых оболочек:
Анемический синдром проявляется слабостью, быстрой утомляемостью, сонливостью днём и плохим засыпанием ночью, головокружениями, обмороками, частыми головными болями, шумом в ушах, мельканием «мушек» перед глазами, одышкой при физической нагрузке, увеличением частоты сердечных сокращений, неприятными ощущениями в области сердца, пониженным артериальным давлением.
При ЖДА может наблюдаться умеренное повышение температуры тела (до 37,5 ° С), которое исчезает после лечения железосодержащими препаратами.
Зачастую снижение содержания гемоглобина происходит постепенно, при этом многие органы адаптируются к анемии. В связи с этим жалобы больных не всегда соответствуют показателям содержания гемоглобина. Многие пациенты, особенно женщины, свыкаются с неважным самочувствием, приписывая его переутомлению, психическим и физическим перегрузкам.
Патогенез железодефицитной анемии
Железо — жизненно важный для человека микроэлемент, который входит в состав гемоглобина крови, миоглобина мышц, отвечает за транспорт кислорода в организме и протекание многих биохимических реакций.
Железо поступает в организм в виде двухвалентного (мясная пища) и трёхвалентного (растительная пища) ионов. Первый всасывается легко, второй под действием соляной кислоты в желудке должен превратиться в двухвалентный. Далее он поступает в двенадцатиперстную кишку и начальные отделы тощей кишки, затем двухвалентное железо вновь переводится в трёхвалентное. В дальнейшем часть этого железа поступает в депо слизистой оболочки тонкой кишки, а другая всасывается в кровь, где соединяется с трансферрином (белком-переносчиком железа, синтезируемым в печени). Если содержание железа в организме избыточно, то оно задерживается в клетках кишечника и в дальнейшем удаляется из организма вместе со слущивающимся эпителием.
При снижении кислотности в желудке (атрофический гастрит, резекция желудка, приём препаратов, снижающих кислотность, гиповитаминоз С) нарушается ионизация железа в желудке, что ведёт к дальнейшему нарушению всасывания железа и развитию ЖДА. При резекции и хронических заболеваниях кишечника (дуоденит, хронический энтерит, целиакия) нарушается всасывание железа, что опять же приводит к развитию ЖДА.
Ферменты, содержащие железо, принимают участие в синтезе гормонов щитовидной железы и поддержании иммунитета, поэтому при дефиците железа нарушаются защитные и адаптационные силы организма и весь обмен веществ.
Классификация и стадии развития железодефицитной анемии
Выделяют три стадии железодефицитных состояний: прелатентный дефицит железа, латентный дефицит и железодефицитную анемию (ЖДА).
Для прелатентного дефицита железа характерно снижение запасов железа в костном мозге:
На этой стадии симптомов может не быть.
Латентный (скрытый) дефицит железа влияет на тканевой обмен. На этой стадии запасы железа начинают истощаться, но организм ещё не успел отреагировать снижением гемоглобина. Возникают первые проявления заболевания — человека может беспокоить повышенная утомляемость, слабость, одышка при физической нагрузке, ломкость ногтей, сухость кожи, выпадение волос. Но эти симптомы пока выражены незначительно.
Латентный дефицит железа характеризуется:
На третьей стадии (собственно ЖДА) снижается уровень гемоглобина и эритроцитов.
Для железодефицитной анемии характерно:
Для этой стадии характерна ярко выраженная клиническая симптоматика, хотя зачастую люди списывают эти проявления на переутомление.
В норме уровень гемоглобина в крови: у женщин — 120-140 г/л, у мужчин — 130-160 г/л.
Степени тяжести ЖДА (на основании снижения уровня гемоглобина Hb):
Осложнения железодефицитной анемии
У беременных с ЖДА повышается риск преждевременных родов и задержки роста плода. У детей недостаток железа приводит к задержке роста и интеллектуального развития.
Диагностика железодефицитной анемии
Минимальный объём исследований:
Биохимический анализ крови покажет снижение уровня сывороточного железа и ферритина, увеличение общей железосвязывающей способности сыворотки и растворимых трансферриновых рецепторов, снижение коэффициента насыщения трансферрина железом (НТЖ).
Лечение железодефицитной анемии
Лечение проводится железосодержащими препаратами, в основном для приёма внутрь и значительно реже для внутримышечного или внутривенного введения. Препараты нельзя принимать без назначения врача, так как переизбыток железа опасен своими последствиями — поражением зубов, развитием гепатита, цирроза печени, сахарного диабета и сердечно-сосудистых заболеваний. Также возможны тяжёлые аллергические реакции.
При анемии следует изменить рацион питания и включить в него продукты, содержащие железо в наиболее усвояемой форме — телятину, говядину, баранину, мясо кролика, печень, язык. Важно помнить, что из мяса усваивается до 30 % железа, из рыбы — 10 %, а из растительной пищи — всего лишь 3-5 %.
При анемии коррекция дефицита железа не может быть достигнута только изменением питания. Причина этого в том, что усвоение железа из пищи ограничено, а в препаратах оно содержится в большей концентрации.
При анемии лёгкой и средней степени тяжести препараты железа лучше принимать внутрь вместе с аскорбиновой или фолиевой кислотой, так как они улучшают всасываемость железа.
Если препараты железа невозможно применять внутрь (например, при непереносимости или нарушении всасывания железа в кишечнике), то их вводят внутримышечно или внутривенно. Инъекционные препараты железа используют только в стационаре, так как они могут вызывать шоковые реакции. Их нельзя применять во время беременности и лактации.
При тяжёлой анемии (гемоглобин менее 70 г/л) и по жизненным показаниям в условиях стационара проводят переливание эритроцитарной массы.
В качестве лечебно-профилактического средства пациентам, у которых нет сахарного диабета, можно использовать гематоген. В его состав входят железо, связывающее белки, получаемые из крови крупного рогатого скота, а также аскорбиновая кислота и необходимый комплекс белков. Однако это достаточно калорийный продукт — в 100 г гематогена содержится 350–500 килокалорий, об этом следует помнить, включая его в рацион.
Прогноз. Профилактика
Прогноз при ЖДА благоприятный. В большинстве случаев заболевание успешно лечится амбулаторно. Но если не анемию не лечить, то она может прогрессировать, ухудшая общее самочувствие. ЖДА сложно скорректировать в следующих случаях:
Для профилактики ЖДА следует: