врожденное нарушение гликозилирования что это
Врожденное нарушение гликозилирования что это
ВРОЖДЕННЫЕ НАРУШЕНИЯ ГЛИКОЗИЛИРОВАНИЯ CDG СИНДРОМ ТИП Iа
(СИНДРОМ ЖАКЕНА, НЕДОСТАТОЧНОСТЬ ФОСФОМАННОМУТАЗЫ 2, PMM2, СИНДРОМ ГЛИКОПРОТЕИНОВ С КАРБОГИДРАТНОЙ НЕДОСТАТОЧНСОТЬЮ ТИП Iа).
Генетика : Мутации гена фосфоманномутазы (PMM1;MIM *601786). Ген картирован на коротком плече 16 хромомсомы (локус 16р13.). Тип наследования: аутосомно-рецессивный
Тип наследования : аутосомно-рецессивный.
Эпидемиология :Точная частота этого заболеваний не известна, частота в Швеции 1: 40 000 живых новорожденных.
Патогенез :Фосфоманномутаза катализирует в цитозоле клетки вторую реакцию синтеза гуанозин дифосфат маннозы. Известно, что это соединение является донором маннозных единиц, используемых в эндоплазматическом ретикулюме для синтеза олигосахаридов, что приводит к нарушению гликозилирования и недостаточности или дисфункции большого числа гликопротеинов, таких как тироксинсвязывающий глобулин, гаптоглобин, факторы свертывания, антитромбин, холинэстераза, лизосомные ферменты и мембранные гликопротеины.
Клинические проявления :Выделяют несколько клинических стадий заболевания: 1). Младенческая мультисистемная стадия, 2).Детская стадия с атаксией и умственной отсталостью, 3). Подростковая стадия с атрофией нижних конечностей, 4) Взрослая стадия с гипогонадизмом.
Младенческая мультисистемная стадия. Данная стадия заболевания начинается с раннего неонатального периода вплоть до позднего младенчества. Для данного синдрома характерны краниофациальные дизморфии, необычное отложение жира в области верхней челюсти, наружных частей ягодиц и в целом утолщение и изменение кожи по типу «талового сала» или шагреневой кожи, особенно на нижних конечностях. Другими характерными симптомами заболевания являются задержка физического развития, диффузная мышечная гипотония, грубая задержка психомоторного развития. В ряде случаев, отмечаются увеличение печени с повышением уровня печеночных трансаминаз, сердечные нарушения (перикардиальный выпот, тампонада сердца) и расстройства со стороны центральной нервной системы в виде развития угнетения сознания до сопора и комы и /или инсультоподобных эпизодов. Задержка психомоторного развития становится явной в возрасте 4-5 месяцев. У всех пациентов выявляют мозжечковую атаксию.
Стадия детской атаксии с умственной отсталостью ( от 3 до 10 лет) Во время этой стадии заболевания, в клинической картине доминируют интеллектуальные и двигательные расстройства, в то время как, другие симптомы заболевания постепенно нивелируются. Практически у всех пациентов наблюдается умственная отсталость, степень которой различна и в среднем уровень IQ составляет 40-60.
Подростковая стадия, характеризующаяся атрофией нижних конечностей. Эта стадия характеризуется общей стабилизацией состояния, за исключением нарастающей слабости в ногах и кифосколиоза. Неврологические симптомы характеризуется выраженной слабостью и атрофией нижних конечностей с преимущественным поражением двигательного мотонейрона в сочетании с мозжечковой атаксией и координаторными расстройствами. Иногда развиваются экстрапирамидные нарушения в виде хореоатетоидных гиперкинезов. Пигментная дегенерация сетчатки медленно прогрессирует, иногда развивается концентрическое сужение зрения.
Взрослая гипогонадическая стадия. Для данной стадии болезни характерны симптомы преждевременного старения. Обычно неврологические нарушения не нарастают, но наблюдается прогрессирование деформации преимущественно грудного отдела позвоночника.
Диагностика :У всех пациентов с синдромом Жакена при КТ и МРТ головного мозга обнаруживают атрофию мозжечка, моста, субкортикальную и кортикальную атрофию. При исследовании цереброспинальной жидкости у больных выявляют незначительное повышение белка, только на начальных стадиях заболевания, а также нарушения трансферринового обмена, как и в сыворотке крови. Основными методами подтверждения диагноза являются анализ сывороточного трансферрина ( изофокусирование) и методы ДНК-анализа. Диагностика проводится в лаборатории наследственных болезней обмена веществ МГНЦ РАМН (http://www.labnbo.narod.ru).
Лечение : Методов эффективной терапии не разработано. Проводится симптоматическая терапия.
Более 20% пациентов умирают на первом году жизни в результате присоединения серьезных инфекционных осложнений или от несовместимых с жизнью поражением внутренних органов (печени, сердца, почек).
Врожденное нарушение гликозилирования что это
Пресс-конференция состоится: 27 декабря 2021 года с 13:00 до 15:00 (Мск) в Международном мультимедийном пресс-центре МИА «Россия сегодня»
по адресу: г. Москва, Зубовский бульвар, 4 стр. 1 (Стеклянный зал)
В Российской Федерации ребенок имеет возможность в рамках диспансеризации пройти обследование у многих профильных специалистов, основная цель этого мероприятия выявлять заболевания на ранней стадии. Диспансеризация детей, как система, сложилась более 30 лет назад и назрела необходимость ее пересмотра. Современные технологии позволяют провести дополнительные лабораторные тесты, которые дают возможность врачу установить диагноз иногда и очень редкого заболевания, а экспертные системы на основе искусственного интеллекта помогают в принятии клинических решений.
Можем ли мы сегодня сделать диспансеризацию более эффективной? Какие лабораторные исследования необходимо включить в программу? Есть ли место в системе здравоохранения «электронной диспансеризации»? Как облегчить работу врача первого звена? На какие редкие болезни возможно повести скрининг во время профилактических приемов в разном возрасте?
В пресс-конференции принимают участие:
К уцев Сергей Иванович
Доктор медицинских наук, профессор, член-корреспондент РАН, директор ФГБНУ «Медико-генетический научный центр имени академика Н.П. Бочкова», главный внештатный специалист по медицинской генетике Минздрава России, член экспертного совета Фонда «Круг добра»
Румянцев Александр Григорьевич
Академик Российской академии наук, профессор, доктор медицинских наук, Президенту ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Министерства Здравоохранения Российской Федерации
Вашакмадзе Нато Джумберовна
Доктор медицинских наук, профессор кафедры факультетской педиатрии ПФ ФГБОУ ВО «РНИМУ им. Н.И.Пирогова», заведующая отделом орфанных болезней и профилактики инвалидизирующих заболеваний НИИ педиатрии и охраны здоровья детей ЦКБ РАН
Воинова Виктория Юрьевна
Врач-генетик, педиатр, в.н.с. отдела клинической генетики в ФГБОУ ВО НИКИ институт педиатрии им. академика Ю. Е. Вельтищева
Садыкова Динара Ильгизаровна
Доктор медицинских наук, заслуженный врач Республики Татарстан, заведующая кафедрой госпитальной педиатрии ГБОУ ВПО «Казанский ГМУ», генеральный директор ВОО «Ассоциация детских кардиологов России»
Модератор:
Захарова Екатерина Юрьевна
Доктор медицинских наук, профессор, заведующая лабораторией наследственных болезней обмена веществ ФГБНУ «Медико-генетический научный центр имени академика Н.П. Бочкова», председатель экспертного совета ВООЗ
В дискуссии так же примут участие врачи-эксперты из ведущих федеральных клиник, представители пациентских организаций, председатель правления «Всероссийского общества редких (орфанных) заболеваний» (ВООЗ) Ирина Мясникова, руководитель фонда «Гордей» Татьяна Гремякова
Предполагаемый охват участников: 250-300 человек.
К участию в конференции приглашаются представители федеральных и региональных органов исполнительной власти в сфере здравоохранения, чиновники, представители фармацевтических компаний и ассоциаций, общественные организации и объединения.
Правительство расширило перечень лечебных продуктов для детей-инвалидов
С 2022 года перечень продуктов лечебного питания для детей-инвалидов расширится на восемь позиций. Распоряжение об этом подписал Председатель Правительства Михаил Мишустин.
Всего в обновлённом перечне – 94 наименования. В частности, в него добавилось лечебное питание для детей с фенилкетонурией, муковисцидозом, нарушением обмена жирных кислот.
Продукты лечебного питания необходимы детям с орфанными (редкими) заболеваниями. В основном это специализированные жидкие и сухие смеси. Они закупаются за счёт средств федерального бюджета, а затем выдаются бесплатно по рецепту лечащего врача. Их перечень каждый год формирует специальная комиссия Минздрава при участии главного внештатного специалиста по медицинской генетике. Затем документ утверждает Правительство.
«Всё это – продукты, необходимые маленьким пациентам с ограничениями по здоровью. И каждый ребёнок, которому это нужно, должен получать их своевременно», – отметил Михаил Мишустин на заседании Правительства 16 декабря, попросив глав регионов внимательно следить за этим вопросом.
Яровая предложила автоматически оформлять инвалидность при выявлении неизлечимого заболевания
Вице-спикер Госдумы Ирина Яровая в ходе заседания президиума Совета законодателей выступила с предложением ввести автоматическое оформление инвалидности в случае, если у пациента диагностировано неизлечимое заболевание. Она добавила, что для этого необходимо определить список заболеваний, при которых «человек автоматически признается инвалидом». Сейчас такие пациенты после получения направления на медико-социальную экспертизу (МСЭ) самостоятельно собирают документы для установления инвалидности.
В настоящее время для оформления инвалидности пациенту приходится обращаться в различные инстанции, отметила Яровая.
«Есть смысл установить обязанность для медучреждений по автоматическому оформлению инвалидности при диагностике неизлечимого заболевания без предварительного сбора документов гражданином для оформления направления. Сам факт постановки такого диагноза должен означать алгоритм действий медучреждения и оформления инвалидности, потому что с этим связаны и жизненно важные выплаты», – подчеркнула вице-спикер.
Она добавила, что выплаты должны предоставляться не со дня установления инвалидности, а со дня выявления тяжелого заболевания. Также Ирина Яровая предложила предоставлять пациентам справку об установлении инвалидности по электронной почте с их предварительного согласия.
Еще одной проблемой, по мнению Яровой, является отсутствие проактивного оформления услуги по выдаче средств реабилитации детям-инвалидам. Сейчас, если у ребенка подтверждено заболевание, при котором нужны средства реабилитации, то после достижения пациентом пятилетнего возраста родителям требуется снова переоформлять документы на получение таких средств. «Давайте упростим эту ситуацию, чтобы родители не тратили время, усилия и нервы на эту процедуру. Давайте сделаем ее также проактивной», – резюмировала Яровая.
В настоящее время для установления инвалидности пациенты с неизлечимыми заболеваниями должны пройти МСЭ. После получения направления на нее от медорганизации гражданину необходимо подать заявление на проведение МСЭ и приложить туда все необходимые документы, в том числе медицинские, подтверждающие наличие заболевания. Далее проходит сама процедура обследования, после которой по решению специалистов пациента могут направить на допобследования.
Сейчас в России действует временный порядок установления и подтверждения инвалидности, позволяющий проводить МСЭ в заочном формате. Такой порядок предполагает автоматическое продление ранее установленной инвалидности на последующие полгода. Кроме того, он позволяет присваивать инвалидность впервые без личного обращения человека в бюро медико-социальной экспертизы.
Упрощенный порядок был введен в апреле 2020 года в связи с пандемией новой коронавирусной инфекции. Затем его действие несколько раз продлевалось. В сентябре 2021 года правительство объявило, что проведение МСЭ в заочном формате возможно до 1 марта 2022 года.
Наши партнеры
Наши партнеры
Общественные организации
Социальные группы
ВРОЖДЕННЫЕ НАРУШЕНИЯ ГЛИКОЗИЛИРОВАНИЯ CDG СИНДРОМ ТИП Iа
(СИНДРОМ ЖАКЕНА, НЕДОСТАТОЧНОСТЬ ФОСФОМАННОМУТАЗЫ 2, PMM2, СИНДРОМ ГЛИКОПРОТЕИНОВ С КАРБОГИДРАТНОЙ НЕДОСТАТОЧНСОТЬЮ ТИП Iа).
Генетика : Мутации гена фосфоманномутазы (PMM1;MIM *601786). Ген картирован на коротком плече 16 хромомсомы (локус 16р13.). Тип наследования: аутосомно-рецессивный
Тип наследования : аутосомно-рецессивный.
Эпидемиология :Точная частота этого заболеваний не известна, частота в Швеции 1: 40 000 живых новорожденных.
Патогенез :Фосфоманномутаза катализирует в цитозоле клетки вторую реакцию синтеза гуанозин дифосфат маннозы. Известно, что это соединение является донором маннозных единиц, используемых в эндоплазматическом ретикулюме для синтеза олигосахаридов, что приводит к нарушению гликозилирования и недостаточности или дисфункции большого числа гликопротеинов, таких как тироксинсвязывающий глобулин, гаптоглобин, факторы свертывания, антитромбин, холинэстераза, лизосомные ферменты и мембранные гликопротеины.
Клинические проявления :Выделяют несколько клинических стадий заболевания: 1). Младенческая мультисистемная стадия, 2).Детская стадия с атаксией и умственной отсталостью, 3). Подростковая стадия с атрофией нижних конечностей, 4) Взрослая стадия с гипогонадизмом.
Младенческая мультисистемная стадия. Данная стадия заболевания начинается с раннего неонатального периода вплоть до позднего младенчества. Для данного синдрома характерны краниофациальные дизморфии, необычное отложение жира в области верхней челюсти, наружных частей ягодиц и в целом утолщение и изменение кожи по типу «талового сала» или шагреневой кожи, особенно на нижних конечностях. Другими характерными симптомами заболевания являются задержка физического развития, диффузная мышечная гипотония, грубая задержка психомоторного развития. В ряде случаев, отмечаются увеличение печени с повышением уровня печеночных трансаминаз, сердечные нарушения (перикардиальный выпот, тампонада сердца) и расстройства со стороны центральной нервной системы в виде развития угнетения сознания до сопора и комы и /или инсультоподобных эпизодов. Задержка психомоторного развития становится явной в возрасте 4-5 месяцев. У всех пациентов выявляют мозжечковую атаксию.
Стадия детской атаксии с умственной отсталостью ( от 3 до 10 лет) Во время этой стадии заболевания, в клинической картине доминируют интеллектуальные и двигательные расстройства, в то время как, другие симптомы заболевания постепенно нивелируются. Практически у всех пациентов наблюдается умственная отсталость, степень которой различна и в среднем уровень IQ составляет 40-60.
Подростковая стадия, характеризующаяся атрофией нижних конечностей. Эта стадия характеризуется общей стабилизацией состояния, за исключением нарастающей слабости в ногах и кифосколиоза. Неврологические симптомы характеризуется выраженной слабостью и атрофией нижних конечностей с преимущественным поражением двигательного мотонейрона в сочетании с мозжечковой атаксией и координаторными расстройствами. Иногда развиваются экстрапирамидные нарушения в виде хореоатетоидных гиперкинезов. Пигментная дегенерация сетчатки медленно прогрессирует, иногда развивается концентрическое сужение зрения.
Взрослая гипогонадическая стадия. Для данной стадии болезни характерны симптомы преждевременного старения. Обычно неврологические нарушения не нарастают, но наблюдается прогрессирование деформации преимущественно грудного отдела позвоночника.
Диагностика :У всех пациентов с синдромом Жакена при КТ и МРТ головного мозга обнаруживают атрофию мозжечка, моста, субкортикальную и кортикальную атрофию. При исследовании цереброспинальной жидкости у больных выявляют незначительное повышение белка, только на начальных стадиях заболевания, а также нарушения трансферринового обмена, как и в сыворотке крови. Основными методами подтверждения диагноза являются анализ сывороточного трансферрина ( изофокусирование) и методы ДНК-анализа. Диагностика проводится в лаборатории наследственных болезней обмена веществ МГНЦ РАМН (http://www.labnbo.narod.ru).
Лечение : Методов эффективной терапии не разработано. Проводится симптоматическая терапия.
Более 20% пациентов умирают на первом году жизни в результате присоединения серьезных инфекционных осложнений или от несовместимых с жизнью поражением внутренних органов (печени, сердца, почек).
Врожденное нарушение гликозилирования что это
Гликозилирование белков является необходимым этапом котрансляционного созревания растущей полипептидной цепи. Данный процесс необходим для жизнеспособности и нормального развития. Это касается большинства внеклеточных белков, таких как белки сыворотки (трансферрин, α1-антитрипсин, α1-антихимотрипсин, некоторые факторы свертывания, апо-липопротеин С-III), большая часть мембранных белков, таких как рецепторы специализированных клеток, и некоторые внутриклеточные белки, такие как лизосомальные ферменты. Врожденные нарушения гликозилирования были подразделены на нарушения N-и О-гликозилирования.
Нарушения, связанные с дефектами маннозо-а-О-гликозилирования сочетаются с синдромом Уокера-Варбурга и различными формами мышечных дистрофий, таких как болезнь мышц-глазмозга, врожденная дистрофия Фукуяма и сочетанные миопатии (описаны в других разделах) (Muntoni et al., 2004; Martin, 2005). Нарушения N-гликозилирования приводят к мультисистемным аномалиям, которые обычно включают поражение центральной нервной системы. Заболевания данной группы подразделяются на два типа. Тип I врожденных нарушений гликозилирования характеризуется дефектом элонгации гликана, в то время как тип II врожденных нарушений гликозилирования связан с дефектом путей процессинга (см. обзор в работах Leroy, 2006; Sparks, 2006).
а) Биохимические изменения и патогенез. Гликозилирование белков является очень сложным процессом, в котором участвует множество ферментов и транспортеров.
Формирование необходимых олигосахаридов, также называемых гликанами, происходит в эндоплазматической сети. Различные доноры сахаров активируются в качестве связанных с нуклеотидами сахаров и долихил-фосфатами моносахаридов на цитоплазматической стороне эндоплазматической сети. Синтез олигосахаридов инициируется прикреплением двух N-ацетил-глюкозамин-фосфатных единиц к липидному носителю (долихол-фосфату), необходимому для процесса элонгации олигосахаридов.
В дальнейшем ступенчатая элонгация происходит за счет прикрепления маннозных и глюкозных остатков. Каждый шаг катализируется специфическими трансферазами, которые кодируются соответствующими ALG генами. При последнем шаге олигозид переносится на образующийся белок с помощью олигосахарид-протеин-гликозилтрансферазы. Различные врожденные дефекты данного пути являются причиной врожденных нарушений гликозилирования I типа.
После переноса, опосредованного олигосахарид-протеин-гликозилтрансферазой, процесс продолжается в аппарате Гольджи в виде удавления глюкозных и маннозных остатков под действием специфических глюкозидаз и маннозидаз. На данном этапе процесс разделяется на два пути. Один путь заключается в лизосомальном фосфорилировании, а его дефекты являются причиной муколипидоза II типа (болезнь I клеток) и III типа (псевдо-Гурлер синдром). Второй путь обеспечивает специфическую ориентацию белков относительно участка их функционирования, например, внутри плазматической мембраны или для секреции в межклеточное пространство. Данный путь, также называемый укороченным, заключается в удалении маннозных остатков с помощью специфичной маннозидазы и прикреплении двух N-ацетил-глюкозамин-фосфатных единиц с помощью специфичных трансфераз.
В дальнейшем происходит прикрепление одной фукозы, двух сиаловых кислот и двух галактоз. Для данного пути созревания необходимы специфические транспортеры фукозы и сиаловых кислот и галактозилтрансфераза. Дефекты укороченного пути являются причиной врожденных нарушений гликозилирования II типа. Описано два других врожденных нарушения гликозилирования II типа, вызванные дефектами сохраненных олигомеров Гольджи. Сохраненный олигомер Гольджи представляет собой белковый комплекс, фиксированный на мембране Гольджи и участвующий в сохранении и функционировании аппарата Гольджи.
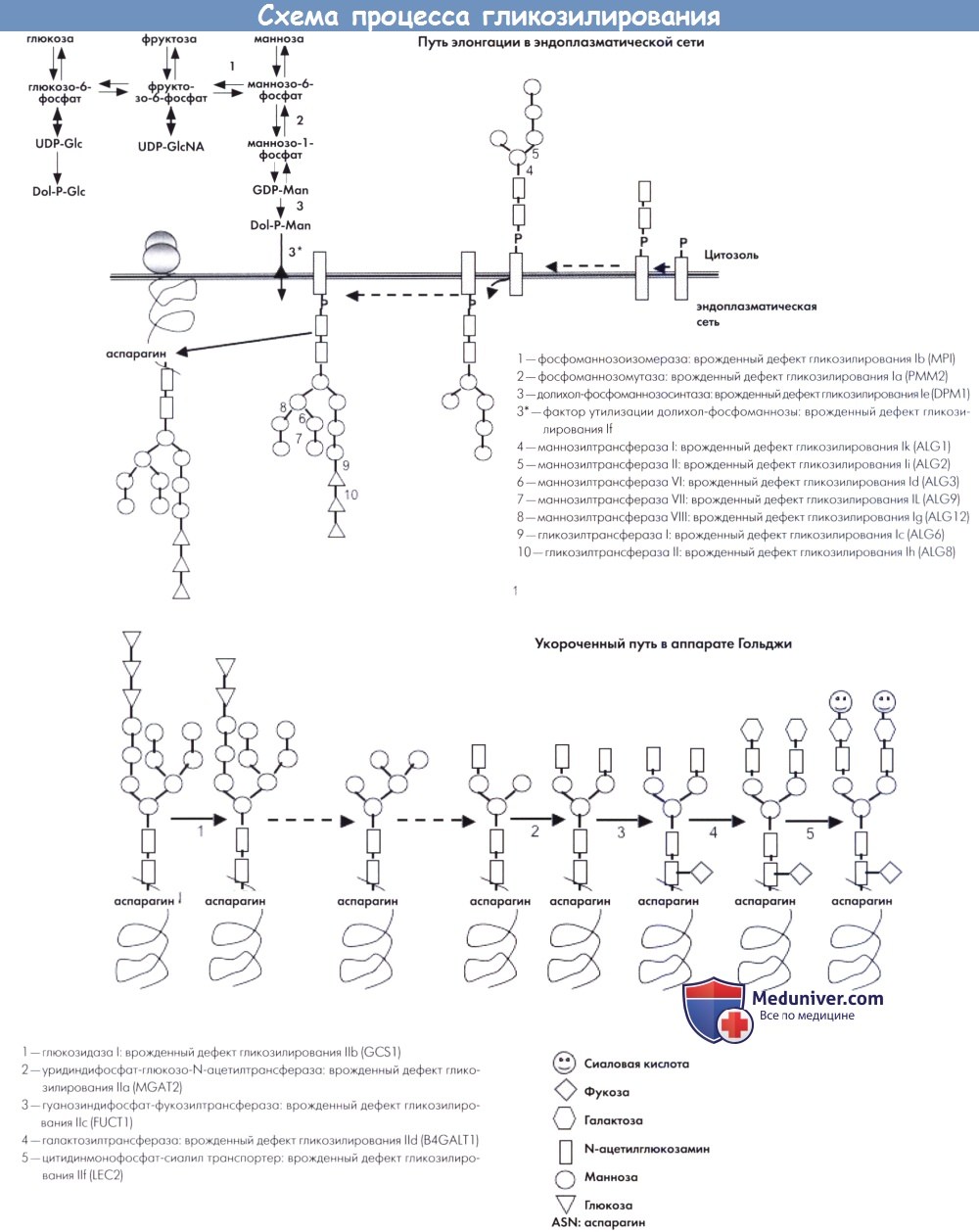
(а) путь элонгации в эндоплазматической сети, (b) укороченный путь в аппарате Гольджи.
б) Диагностика. Диагностика врожденных нарушений гликозилирования проводится путем изоэлектрического фокусирования сывороточного трансферрина. Характеристики делятся на два типа. Тип 1 характеризуется повышением дисиало- и асиалотрансферриновых соединений одновременно со снижением тетрасиалотрансферрина. Тип 2 характеризуется увеличением трисиало- и моносиалотрансферриновых соединений. В дополнение к изофокусированию трансферрина изофокусирование других сиалиновых белков улучшает качество диагностики (Fang et al., 2004). Изоэлектрическое фокусирование аполипопротеина С-III используется для скрининга дефектов О-гликозилирования в отдельности или в сочетании с дефектами N-гликозилирования.
Выделяется три типа изоформ: аполипопротеин С-III0, аполипопротеин С-III1, аполипопротеин С-III2, в зависимости от количества остатков сиаловой кислоты, прикрепленных к гликопротеину (Wopereis et al., 2007).
в) Врожденные дефекты гликозилирования 1 типа. Врожденный дефект гликозилирования 1а типа (ВДГ-Iа) ВДГ-Ia является наиболее частым и наиболее изученным заболеванием из группы врожденных дефектов гликозилирования с частотой около 1 на 50000. Классические формы заболевания являются прогрессирующими и представлены тремя стадиями, развивающимися с возрастом (Hagberg et al., 1993; Stibler et al., 1994).
В младенческом периоде преобладают заметные мультисистемные поражения, которые прогрессируют от периода новорожденности до позднего младенческого возраста. Заболевание характеризуется плохим питанием, плохой прибавкой в весе и мышечной вялостью. Ранняя задержка психомоторного развития отмечается у всех пациентов в виде выраженной задержки развития крупной моторики, явной аксиальной гипотонии, мышечной слабости; позднее появляются признаки нарушения равновесия или истинной мозжечковой атаксии. Нормальная окружность головы при рождении может трансформироваться в приобретенную микроцефалию. Сухожильные рефлексы изначально слабые, арефлексия формируется в течение первых 2-3 лет жизни. Часто встречается зрительная невнимательность, блуждание взора и внутреннее косоглазие.
Врожденная катаракта встречалась в редких случаях. В большинстве случаев отмечался некоторый дисморфизм лица, втянутые соски и характерное строение тела с ограничением движений в суставах конечностей, деформацией грудной клетки и необычной липодистрофией со скоплением жира на ягодицах, в области промежности и/или на пальцах рук. Часто отмечаются липоатрофические полоски и бляшки. Слабо выраженная гепатомегалия сочетается с фиброзом печени или гигантоклеточным гепатитом. Отмечены случаи увеличения почек и протеинурии. Во многих случаях могут развиваться опасные эпизоды полиорганной недостаточности, которые включают тяжелые инфекции, печеночную недостаточность, выпот в перикард с тампонадой сердца и ступор, в отдельных случаях сочетающийся с припадками и внутричерепным кровоизлиянием. Данные острые эпизоды ухудшения являются причиной высокой детской смертности (15-20%).
В детском возрасте отмечается непрогрессирующая задержка умственного развития различной степени. У большинства пациентов коэффициенты DQ/IQ составляют около 50. Мозжечковая атаксия и периферическая нейропатия, способствующая мышечной атрофии, в большинстве случаев препятствуют самостоятельному передвижению. Возможны рецидивирующие эпизоды дискинетических или хореоатетозных движений. Обычно развивается косоглазие и пигментный ретинит. Инсультоподобные эпизоды, связанные с частичным тромбозом мозговых сосудов, развиваются у половины пациентов в возрасте после 4-5 лет и проявляются комой, припадками и транзиторной слепотой. Приблизительно у половины пациентов формируется эпилепсия.
В подростковом и взрослом возрасте состояние стабилизируется. Большинство пациентов овладевает рядом социальных навыков, но остаются иждивенцами.
Описанное течение заболевания касается большинства пациентов, тем не менее, описаны фенотипы с легкими или необычными проявлениями (Neumann et al., 2003; Coman et al., 2005; Noelle et al., 2005).
На ранних стадиях возможно умеренное повышение содержания белка в спинномозговой жидкости. Параметры электроэнцефалограммы неспецифичны. При электроретинографии отмечается прогрессирующее снижение ответа сетчатки (Andreasson et al., 1991). Зрительные, слуховые стволовые и соматосенсорные вызванные потенциалы могут отличаться от нормы. Скорость проводимости нерва снижена в моторных и сенсорных нервах, постепенное снижение отмечается вплоть до подросткового возраста.
При нейровизуализации у большинства пациентов в течение первого года жизни выявляется стремительно прогрессирующая гипоплазия мозжечка и ствола. Супратенториальные структуры обычно не отличаются от нормы, тем не менее, у трети пациентов отмечается центральная и/или корковая атрофия. Практически всегда отмечается оливопонтоцеребеллярная атрофия и миелиноподобные накопления в лизосомах (Eyskens et al., 1994). У двух близнецов, умерших в возрасте 4 месяцев и 6 лет, атрофия была более выражена при большей продолжительности жизни, что предполагает прогрессирование дегенеративного процесса. Очаговые инфаркты головного мозга предполагают окклюзию сосудов. При микроскопии выявляется полная утрата клеток Пуркинье, почти полная утрата гранулярных клеток в коре мозжечка и глиозядра моста (Stromme et al., 1991).
При биопсии икроножного нерва были выявлены аномальные слои миелина (Nordborg et al., 1991); отмечены лизосомальные накопления в клетках передних рогов (Eyskens et al., 1994), а также гепатоцитах, что свидетельствует об изменениях метаболизма миелина.
г) Другие врожденные нарушения гликозилирования 1 типа. Выявлено еще 11 вариантов нарушения путей элонгации олигосахаридов. Данным заболеваниям названия присвоены в алфавитном порядке (Ia—II) в соответствии с порядком описания. Аномалии развития и функции центральной нервной системы отмечаются при всех вариантах нарушений, за исключением одного (врожденное нарушение гликозилирования Ib). Врожденное нарушение гликозилирования-Ic является вторым по частоте заболеванием с клиническим фенотипом, сходным с врожденным нарушением гликози-лирования-Ia. Другие клинические фенотипы в настоящее время недостаточно описаны в связи с небольшим количеством пациентов в каждой группе. Некоторые характеризуются задержкой развития (от легкой до умеренной) с гипотонией, атаксией, косоглазием, нистагмом и припадками, варьирующими от фебрильных эпизодов до эпилепсии. У большинства пациентов отмечается тяжелая энцефалопатия новорожденных в сочетании с признаками, напоминающими врожденное нарушение гликозилирования-Iа.
У некоторых пациентов отмечается нейросенсорная тугоухость, слепота, колобома радужки и катаракта. Среди экстраневрологических симптомов часто встречается плохая прибавка веса, поражение скелета, кардиомиопатия или перикардиальный выпот, фиброз или цирроз печени и почечная недостаточность. В некоторых случаях выявляется водянка плода. Результаты МРТ могут быть нормальными или свидетельствовать о корковой и подкорковой атрофии, гипоплазии мозолистого тела или гипомиелинизации. Описаны случаи гипоплазии мозжечка, но данное проявление не является обязательным.
Врожденные нарушения гликозилирования 1 типа могут приводить к повреждению различных сывороточных гликопротеинов, оценка которых может способствовать диагностике. Низкое содержание свертывающих факторов и ингибиторов (фактора XI, антитромбина III, протеина С, протеина S, кофактора гепарина) может служить объяснением инсультоподобных эпизодов. В связи с неспецифическим просачиванием в сыворотку отмечается повышение содержание нескольких лизосомальных (например, аурилсульфатазы А, бета-гексаминидазы) и нелизосомальных ферментов (например, трансаминаз). Изменения также затрагивают многие транспортные белки (например, апопротеин В), гликопротеиновые гормоны (например, инсулиноподобный фактор роста-1) и факторы комплемента. Окончательный диагноз врожденного дефекта гликозилирования-1 подтверждается наличием сывороточных изоформ трансферрина 1 типа.
Учитывая данное обстоятельство, наиболее распространенные врожденные дефекты гликозилирования-Ia, Ib и Iс обычно диагностируются с помощью ферментных и молекулярных методов исследования. Другие типы заболевания диагностировались по результатам исследований, когда другие методы оказались неэффективны.
Врожденные нарушения гликозилирования I типа являются аутосомно-рецессивными заболеваниями, связанными с нарушением этапов сборки олигосахаридов. Все известные дефектные ферменты или транспортеры кодируются соответствующими генами; патогенетические мутации идентифицированы. Данная информация позволяет осуществлять достоверную пренатальную диагностику путем анализа мутаций в хорионической ДНК.
Эффективного лечения не существует.
д) Врожденные дефекты гликозилирования 2 типа. Врожденные дефекты гликозилирования 2 типа являются группой заболеваний, при которых затронут укороченный путь гликозилирования в аппарате Гольджи.
Врожденный дефект гликозилирования 2а типа Врожденный дефект гликозилирования 2а типа был первым описанным заболеванием данной группы. У небольшого количества пациентов отмечалась тяжелая задержка развития, отсутствие периферической нейропатии и нормальное строение мозжечка на МРТ. У пациентов отмечалась гипотония с младенческого возраста, генерализованные припадки с детского возраста и аномальное поведение со стереотипными движениями в виде потирания рук, давления языком и ударов головой. Все пациенты характеризовались низким ростом, скелетными деформациями, гипогонадизмом и небольшой печеночной недостаточностью. С биохимической точки зрения отмечается углеводный дефицит трансферрина со изоформой трансферрина 2 типа. Склонность к кровотечениям объясняется снижением содержания фактора свертывания XI. Недостаточность активности уридиндифосфат-глюкозо-N-ацетилтрансферазы II связана с мутациями гена MGAT2, расположенного на 14q21 хромосоме (Cormier-Daire et al., 2000).
Другие врожденные дефекты гликозилирования 2 типа Четыре других типа были связаны с дефектом действия глюкозидазы (IIb), галактозилтрансферазы (IId) и фукозы или транспортеров сиаловых кислот (IIc, IIf). Каждая группа заболеваний была представлена небольшим количеством или даже одним пациентом. Неврологические симптомы имели выраженный характер при IIb и IId типах заболевания и проявлялись в виде тяжелой энцефалопатии, некупируемых припадков и нормальной МРТ головного мозга (IIb) или умеренной задержки развития, мышечной слабости и мальформации Денди-Уокера (по результатам нейровизуализации) (IId). Тяжелые гематологические симптомы выявлялись при IIс и IIf типах заболевания. Результаты изоэлектрического фокусирования не отличались от нормы при всех типах заболевания, за исключением одного; врожденный дефект гликозилирования IIf типа сочетался с изменениями апопротеина-С-III1 (Wopereis et al., 2007).
Три других дефекта связаны с аномалиями комплекса сохраненного олигомера Гольджи (COG): CDG-IIe/COG7, CDG-IIg/COG1 и CDG-IIh/COG8. Результаты изоэлектрического фокусирования трансферрина плазмы 2 типа и свойств аполипопротеина-С-III0 свидетельствовали о повреждении N- и О-гликозилирования. Первое заболевание было описано у двух новорожденных сибсов, страдавших смертельной полиорганной недостаточностью и некупируемыми припадками. Дефект COG1 был выявлен у одного ребенка с дисморфическими проявлениями, некоторой задержкой развития и умеренной атрофией мозга и мозжечка при визуализации, выполненной в возрасте двух лет. У пациента с дефицитом COG8 отмечалась тяжелая энцефалопатия (Kranz et al., 2007).
Пероральное применение фукозы могло приводить к уменьшению выраженности гематологических изменений среди пациентов, страдающих врожденным дефектом гликозилирования Нс типа, но не оказывало воздействия на неврологический статус (Leroy, 2006). Для других типов заболевания специфического лечения не существует.
Ясно, что данная группа заболеваний недостаточно исследована и фенотипическая вариабельность среди уже описанных типов, а также дополнительные формы еще будут выделены после того, как станут известны все ферменты и соответствующие гены, задействованные в сложном процессинге гликозилирования.
Редактор: Искандер Милевски. Дата публикации: 12.12.2018














