воспаление вилочковой железы у взрослых что это
ЗАБОЛЕВАНИЯ ВИЛОЧКОВОЙ ЖЕЛЕЗЫ И ИХ ЛЕЧЕНИЕ
В. Л. Маневич, В. Д. Стоногин, Т. Н. Ширшова, И. В. Шуплов, С. В. Момотюк
Публикация посвящается памяти Василия Дмитриевича Стоногина (1933-2005)
Заболевания вилочковой железы изучаются врачами различных специальностей: невропатологами, эндокринологами, иммунологами, гемато¬логами, хирургами, патогистологами и др. Проблема миастении является относительно изученной; в последние годы установлено участие вилочковой железы в таком жизненно важном процессе, как выработка (регулировка) иммунитета.
Опухоли и кисты вилочковой железы, миастения и некоторые аутоиммунные заболевания требуют хирургического лечения. Значительный вклад в этот сложный раздел внесли отечественные и зарубежные хирурги (А. Н. Бакулев и Р. С. Колесникова; В. Р. Брайцев; Б. К. Осипов; Б. В. Петровский; М. И. Кузин и соавт.; С. А. Гаджиев и В. Васильев; Viets, и др.).
Из 66 больных 65 были оперированы: 62 произведена радикальная и 3 эксплоративная операция.
Клиника миастении хорошо известна, однако правильный диагноз больному с миастенией нередко ставят после продолжительного наблюдения. У 32 из 44 наших больных правильный диагноз был поставлен только через 6-8 месяцев после появления первых признаков заболевания. Это объяс¬няется малой выраженностью клинической картины миастении в начальной стадии и плохой осведомленностью практических врачей, к которым впервые обращаются за помощью больные миастенией (невропатологи, окулисты, отоларингологи, терапевты).
При выраженной генерализованной форме миастении диагноз не труден. В начальной стадии и в случаях, когда миастения носит локализован¬ный характер (бульбарная, глазная, скелетно-мышечная, глоточно-лицевая), у наших больных предполагались самые разнообразные диагнозы, вплоть до подозрения на симуляцию. Считаем необходимым подчеркнуть особую важность прозериновой пробы, имеющей дифференциально-диагностическое значение. У больных миастенией внутримышечная инъекция 1-2 мл 0,05% раствора прозерина устраняет мышечную слабость и быструю утомляемость, в то время как при миопатиях и мышечной слабости, вызванных другими причинами, инъекция прозерина не дает эффекта. Имеют значение динамометрия, эргометрия и электромиография.
Общепризнано, что лечение миастении должно проводиться комплексно с участием 3-4 специалистов: невропатолога, терапевта-эндокринолога, анестезиолога-реаниматолога и хирурга. На основании большого клинического материала (сотни оперированных и наблюдаемых в отдаленном периоде) авторы подчеркивают преимущество оперативного лечения миастении перед консервативным (М. И. Кузин; А. С. Гаджиев и соавт., и др.). Результаты оперативного лечения лучше, если операцию производят впервые 2-2,5 года от начала заболевания. В более поздние сроки операция оказывается менее эффективной. Отсюда вытекает особая важность ранней диагностики миастении.
Наличие у больного выраженной клинической картины прогрессирующей миастении является показанием к операции, так как все консервативные методы лечения, включая и рентгенотерапию, дают лишь временное улучшение.
Вопрос о необходимости предоперационной рентгенотерапии нельзя считать окончательно решенным. Только 5 из наших больных перед операцией получали рентгеновское облучение, причем каких-либо улучшений в течении послеоперационного периода мы у них не отметили. У больных, оперированных по поводу злокачественной тимомы с явлениями миастении, предоперационное облучение играет важную роль в ближайшем исходе операции и в какой-то степени влияет на сроки наступления рецидива заболевания (М. И. Кузин и соавт.).
Большинство операций по поводу миастении нами выполнено из переднего доступа путем полной срединной продольной стернотомии. Наиболее ответственным моментом операции является отделение железы от левой плечеголовной вены. Ранение этого сосуда опасно из-за массивного кровотечения и возможной воздушной эмболии. В одном случае произошло ранение этой вены, закончившееся благополучно (был наложен боковой сосудистый шов). При операции следует избегать наложения зажимов на железистую ткань, раздавливания её.
У 3 наших больных было сочетание миастении и загрудинного зоба. Произведены тимэктомия и субтотальная струмэктомия.
У 26 больных во время операции была повреждена медиастинальная плевра, в том числе у 8 больных с обеих сторон. Осложнений, связанных с операционным пневмотораксом, не было. Если во время операции плевра не повреждена, переднее средостение дренируется одной резиновой трубкой, конец которой выводят в нижний угол раны или через отдельный прокол ниже мечевидного отростка и соединяют с отсосом. Вслед за тимэктомией трахеостома (превентивно) была наложена 5 больным.
Если сама операция тимэктомии по сравнению с другими торакальными операциями не представляет особой сложности, то течение послеоперационного периода у ряда больных сопровождается осложнениями, на 1-м месте среди которых стоит миастенический криз. Поэтому операции по поводу миастении возможны только в тех учреждениях, где можно обеспечить круглосуточное наблюдение анестезиолога-реаниматолога, а также многодневную аппаратную вентиляцию лёгких.
Вопрос о назначении антихолинэстеразных препаратов в послеоперационном периоде окончательно не решен. С целью уменьшения гиперсекреции бронхов лучше назначать прозерин с небольшими дозами атропина.
Тяжелый миастенический криз с расстройством дыхания, сердечной деятельности, глотания и т. д. наблюдали в первые дни после операции у 26 больных. Вывести из криза консервативными мероприятиями удалось 7 больных; 19 больным была наложена трахеостома с переводом их на аппаратное дыхание, длительность которого составляла от 3 до 40 суток. Через трахеостому систематически круглосуточно аспирируют слизь из трахеобронхиального дерева. Питание больных, находящихся на аппаратном дыхании, осуществляется через зонд. Помимо медикаментозного лече¬ния, применения кислорода, использования дыхательной гимнастики, в последние годы всем больным миастенией в послеоперационном периоде проводится лечебный массаж всего тела, повторяемый несколько раз в день.
Трахеостомическую трубку удаляют после того, как у больного стойко восстанавливается самостоятельное дыхание.
Среди наших больных мы наблюдали 3 (2 мужчин и 1 женщину, все старше 40 лет) с липотимомой. У них опухоль была небольших размеров, с ровными четкими границами; опухоль была расценена нами как доброкачественная. Заболевание сопровождалось умеренно выраженными явлениями миастении. Один из этих больных поступил с жалобами на слабость и быструю утомляемость; при дальнейшем обследовании у него была выявлена тяжелая гипопластическая анемия. Больной оперирован; в ближайшем послеоперационном периоде отмечены благоприятные результаты.
Из 15 наших больных с доброкачественными тимомами у 9 (4 мужчин и 5 женщин) были явления миастении, у остальных опухоль ничем себя не проявляла и была выявлена случайно.
Больной М., 19 лет, поступил 17.III.1966 года. Жалоб нет. После окончания средней школы при прохождении медицинского обследования для поступления в учебное заведение у него рентгенологически было выявлено опухолевое образование в переднем средостении. Признаков миастении нет. Пневмомедиастинография: в переднем средостении со всех сторон окутанное газом образование продолговатой формы размером 15*5 см, с участками просветления в центре; заключение: опухоль вилочковой железы, возможно, с участками распада. Произведена тимэктомия. Гистологически: злокачественная тимома ретинулоклеточного типа. Проведена послеоперационная рентгенотерапия. Осмотрен через 4 года после операции:, жалоб нет, состояние хорошее, признаков рецидива нет.
Дифференциальный диагноз доброкачественных и злокачественных тимом нередко бывает трудным. Злокачественная тимома по рентгенологическим признакам напоминает лимфогранулематоз и лимфосаркому. В отличие от этих образований тимома располагается непосредственно за грудиной, обычно бывает овально-сплющенной или конусовидной формы. Всякая тимома, протекает она с явлениями миастении или без них, подлежит удалению, В литературе имеются указания, что каждую тимому следует рассматривать как потенциально злокачественную опухоль (Б. В. Петровский; Seybold и соавт., и др.).
Вопрос о возможности изолированного поражения вилочковой железы лимфогранулематозом представляется спорным. Мы наблюдали 2 больных, у которых до операции был установлен диагноз “опухоль вилочковой железы”. После операции, при гистологическом исследовании препаратов, диагноз был изменен: изолированное поражение лимфогранулематозом вилочковой железы. Принимая во внимание указания о возможности изолированного поражения вилочковой железы на ранних стадиях заболевания (С. А. Гаджиев и В. В. Васильев), оба эти наблюдения мы отнесли к патологии вилочковой железы. После операции за больными ведётся наблюдение в течение 5 лет. Признаков рецидива и генерализации процесса нет.
Заболевание, заключающееся в сочетании патологии вилочковой желе¬зы и гипопластической анемии, которая возникает вследствие избирательного поражения костного мозга без изменения продукции лейкоцитов и тромбоцитов, впервые описано Кацнельсоном в 1922 году. Позже было предположено, что вилочковая железа влияет на гемопоэтическую функцию костного мозга, регуляцию состава белковых фракций, состояние лимфоидной системы и т. д. (Soutter и соавт.). С тех пор опубликованы данные некоторых авторов об отдельных операциях на вилочковой железе при различных болезнях крови (А. Н. Бакулев, 1958; Chaemers и Boheimer, и др.). К настоящему времени нами произведены 4 операции тимэктомии у больных гипопластической анемией. О результатах этих операций говорить пока рано, так как после них прошел небольшой срок. Ближайшие результаты удовлетворительные у 3 больных.
1) Бакулев А. Н., Колесникова Р. С. Хирургическое лечение опухолей и кист средостения. М., 1967.
2) Брайцев В. Р. Врожденные дизонтогенетические образования средостения и легких. М., 1960.
3) Гаджиев С. А., Догель Л. В., Ваневский В. Л. Диагностика и хирургическое лечение миастении. Л., 1971.
4) Гаджиев С. А., Васильев В. Мед газета, 1973, №15.
5) Кузин М. И. Клин мед, 1969, № 11, с. 6.
6) Кузин М. И., Успенский Л. В., Волков Б. П. Вести, хир., 1972, №7, с.48.
7) Осипов Б. К. Хирургические заболевания легких и средостения. М., 1961.
8) Петровский Б. В. Хирургия средостения. М., 1960.
9) Andгus W., Fооt N., J. thorac. Surg., 1937, v. 6. p. 648.
10) Chaemers G., Boheimer K., Brit. med. J., 1954, v.2, p.1514.
11) Pope R., О s g о о d R., Am. J. Path., 1953, v. 20, p. 85.
12) S е у b о 1 d W., D о n a 1 d М. С., J. thorac. Surg. Clagett C. et al., 1950, v. 20, p.195.
13) Soutter G., Sommers Sh. R e 1 m о n Ch. et al. Ann. Surg., 1957, v. 146, p. 426.
14) Viets H., Brit. med. J., 1950, v. 1, p.139.
| 1) Виктор Львович Маневич – профессор, доктор медицинских наук, 2-я кафедра клинической хирургии ЦОЛИУв. |  |
| 2) Василий Дмитриевич Стоногин – доцент 2-й кафедры хирургии ЦОЛИУв, заведующий учебной частью кафедры, кандидат медицинских наук. E-mail: svas70@mail.ru |  |
Любое копирование материала запрещено без письменного разрешения авторов и редактора.
Работа защищена Федеральным законом о защите авторских прав РФ.
ТИМОМЕГАЛИЯ И СИНДРОМ ПЛАТТЕРА
История относительно интенсивного изучения вилочковой железы ( glandula thymus, thymus ) насчитывает около 400 лет. Начало его относится к 1614 г., когда профессор Базельского университета Феликс Платтер описал происшедшую у него
В середине XIX в. профессор Венского университета Карл Рокитанский высказал предположение об инкреторной функции вилочковой железы. Данная концепция была положена в основу представлений о тимико-лимфатическом статусе [1, 2] как врожденной особенности конституции, предрасполагающей к внезапной смерти от незначительных причин. В симптомокомплекс тимико-лимфатического статуса включались первичная гиперфункция вилочковой железы, гипоплазия надпочечников, сердца и аорты [1–5]. С этого времени причиной тимической смерти стали считать острую надпочечниковую недостаточность [3, 4]. Однако отсутствие характерных для тимико-лимфатического состояния признаков во многих случаях при такой смерти, в том числе и симптомов надпочечниковой недостаточности, позволило поставить под сомнение и данную концепцию.
В начале 1960-х гг. было доказано, что тимус является центральным органом иммунной системы. С этого времени вилочковая железа рассматривается в качестве железы внутренней секреции, действие гормонов которой направлено на дифференцировку тимических лимфоцитов. Открытие основной функции вилочковой железы — продукции Т-лимфоцитов и регуляции иммунитета, а также принадлежность ее к системе эндокринных желез позволяют рассматривать данный орган как коммутатор иммунной и эндокринной систем. В серии работ отечественных исследователей последних 20 лет доказывается, что дети с большой вилочковой железой относятся к числу иммунодефицитных лиц.
В 1970 г. проф. Т. Е. Ивановской [6] для обозначения увеличенной вилочковой железы вместо вышеуказанных терминов был предложен термин «тимомегалия». Под тимомегалией российские морфологи понимают увеличение объема и массы тимуса выше предельных возрастных значений с сохранением нормальной гистоархитектоники органа. Начиная с 1970 г., этот термин стал широко использоваться как морфологами, так и клиницистами.
Однако проведенные исследования показали, что тимомегалия является лишь одним из симптомов того состояния, которое существует у детей, имеющих увеличенную вилочковую железу [7]. В связи с отсутствием другого термина, отражающего сущность состояния, которое имеет место у детей с увеличенной вилочковой железой (соответствующей тимомегалии в понимании патологоанатомов), предлагаем называть его синдромом Платтера.
Термином «синдром Платтера» следует обозначать состояние, при котором клинические и параклинические методы обследования позволяют выявить у детей и подростков ряд специфических изменений организма, сочетающихся с первичной длительно сохраняющейся тимомегалией. Клиническое понимание тимомегалии при синдроме Платтера отражает морфологическое состояние вилочковой железы, при котором масса и объем тимуса превышают предельные возрастные значения при сохранении нормальной гистоархитектоники органа.
Диагностика тимомегалии в клинической практике
Ориентировочная диагностика тимомегалии может быть проведена с помощью объективного исследования: осмотра, пальпации, перкуссии. Однако оценка результатов во многом субъективна и зависит от опыта исследователя [7].
Из инструментальных методов, позволяющих объективно выявить тимомегалию, используются рентгенодиагностика и ультразвуковое исследование (УЗИ).
Рентгенодиагностика. Методологической основой рентгенодиагностики увеличенного тимуса является следующее положение: в норме у детей любого возраста на стандартных рентгенограммах грудной клетки в прямой проекции тень тимуса не должна выходить за пределы тени сосудистого пучка и сердца.
В целях диагностики тимомегалии на рентгенограммах грудной клетки в прямой проекции мы применяли кардио-тимико-торакальный индекс (КТТИ) по J. Gewolb [8] и вазокардиальный индекс (ВКИ) [7]. Оба индекса определяются на стандартных рентгенограммах грудной клетки в прямой проекции. КТТИ представляет собой частное от деления ширины сосудистого пучка на уровне бифуркации трахеи (точка carina) на ширину грудной клетки на уровне купола диафрагмы. ВКИ представляет собой частное от деления ширины сосудистого пучка на уровне бифуркации трахеи (точка carina) на максимальную ширину тени сердца. Максимальная ширина тени сердца определяется как сумма двух перпендикулярных отрезков, опущенных на вертикальную линию (проведенную через середину позвоночного столба) из максимально удаленных от нее точек сердца слева и справа (рис. 1).
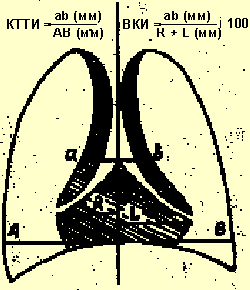 |
| Рисунок 1. Схема вычисления индексов КТТИ и ВКИ |
Выявление в средостении характерной овальной, треугольной или лентовидной тени с прямым, волнообразным или неровным контуром, расположенной с одной или обеих сторон сосудистого пучка, искажающей линию «сердечной талии» слева и/или вазокардиальный угол справа, позволяет сделать заключение о существовании у пациента тимомегалии. Наличие увеличенных значений КТТИ и ВКИ подтверждает данный диагноз. Рентгенологический метод, однако, информативен только для детей грудного и раннего возраста, поскольку у детей в возрасте старше 3 лет, как правило, тимус располагается за тенью сосудистого пучка и сердца. В таблице 1 приведены значения КТТИ и ВКИ у детей первых 3 лет жизни при разных степенях увеличения тимуса.
УЗИ. УЗИ тимуса в нашей стране впервые было проведено у новорожденных детей С. М. Воеводиным [9]. Путем клинико-морфологических сопоставлений нами были разработаны коэффициенты пересчета линейных параметров тимуса в более привычные для клиницистов формы (объема и массы органа). Округленные величины указанных коэффициентов, по нашим данным, равны 0,7 (для массы) и 0,5 (для объема). Таким образом, величины массы и объема тимуса при ультразвуковом сканировании вычисляются следующим образом:
М = 0,7 в a в b в c;
V = 0,5 в a в b в c,
где a, b, c — линейные параметры тимуса (ширина, длина, передне-задний размер, выраженные в см); 0,7 и 0,5 коэффициенты пересчета линейных параметров на массу и объем органа соответственно [10]. Для практических целей массу и объем вилочковой железы достаточно определять так, как это указано выше: без вычисления объема и массы отдельных долей.
Методом центильного распределения нами были определены нормальные значения массы и объема тимуса для детей в возрасте 1–24 мес (табл. 2). При превышении массы и объема тимуса выше верхних предельных значений нормы состояние ребенка следует расценивать как тимомегалию.
На основании анализа более 5000 рентгенограмм, выполненных у детей грудного возраста при подозрении на пневмонию, диагноз которой рентгенологически не был подтвержден, тимомегалия нами была выявлена у 35% пациентов 1 — 3 мес, у 15% детей в возрасте 3–6 мес, у 8% — в возрасте 7–15 мес, у 2% — в возрасте 16 — 36 мес, а в популяции детей старше 3 лет частота выявления тимомегалии не превышала 0,5% [8].
Наблюдение за одними и теми же детьми на протяжении длительного отрезка времени позволило нам сделать вывод, что тимомегалия в детском возрасте может быть как транзиторной, так и стойкой.
В 1993 г. нами совместно с О. В. Зайратьянцем была предложена классификация тимомегалии в детском возрасте на основе клинико-морфологических данных. Несколько измененный вариант указанной классификации приведен в табл. 3 (см. рубрику «Под стекло»). Наиболее частым вариантом тимомегалии в детском возрасте является синдром Платтера.
Анализ родословных позволил выявить у родственников первой и второй линии родства детей с синдромом Платтера высокую частоту встречаемости злокачественных новообразований, аутоиммунных заболеваний и заболеваний системы эндокринных органов. Так, злокачественные новообразования встречаются в каждой третьей семье, где есть дети с синдромом Платтера, с такой же частотой в этих семьях регистрируются эндокринные заболевания (преимущественно сахарный диабет и заболевания щитовидной железы). В семьях детей с синдромом Платтера статистически чаще, чем в семьях детей из выборки общей популяции, распространены аутоиммунные заболевания (диффузные болезни соединительной ткани) и туберкулез. Помимо этого, многие родители детей с указанным синдромом в дошкольном и младшем школьном возрасте относились к группе часто болеющих, т. е. к группе детей имевших повышенную склонность к острым респираторным вирусным инфекциям (ОРВИ).
Характер перечисленных заболеваний (склонность к вирусным, аутоиммунным, онкологическим заболеваниям, туберкулезу) может указывать на существование у близких родственников детей с синдромом Платтера недостаточной активности клеточного звена иммунной системы, поскольку, согласно современным воззрениям, все перечисленные заболевания находятся под контролем Т-клеточного иммунитета, формируемого вилочковой железой. При этом не совсем ясно, чем объясняется высокая отягощенность родственников детей с синдромом Платтера болезнями системы эндокринных органов. Однако не следует забывать о том, что эндокринные заболевания (в том числе сахарный диабет, диффузный токсический зоб, гипотиреоз) могут иметь аутоиммунный генез.
В таком случае у близких родственников детей с синдромом Платтера отчетливо просматривается тенденция к заболеваниям, связанным с иммунными механизмами клеточного типа, контролирующимися вилочковой железой. Это позволяет предполагать возможность передачи детям, у которых развился синдром Платтера, какого-то дефекта Т-звена иммунной системы.
Антенатальный период у большинства детей с синдромом Платтера осложняется хронической гипоксией, обусловленной острыми инфекционными заболеваниями или обострением хронических экстрагенитальных заболеваний матерей, наличием у них сосудистой дистонии, анемии, гестозов.
Осложненное течение интранатального периода отмечается не менее чем у 2/3 детей с синдромом Платтера. Наиболее частыми осложнениями этого периода явились стремительные или затяжные роды, приведшие к наложению щипцов или экстренному кесареву сечению.
Группа детей с указанным синдромом по фенотипу гетерогенна. 90% детей имеют мягкие округлые формы тела, некоторую пастозность тканей, относительно крупные черты уплощенного лица, прямой тип лба, широкоовальные глаза, относительно короткий нос с низким переносьем, средней величины или толстые губы, слабый изгиб профиля, короткую шею. Дети этой группы имеют как бы увеличенные поперечные размеры тела: широкое лицо, широкая грудная клетка, широкие плечи, широкие ладони и стопы, относительно короткие и широкие пальцы. Около 3/4 детей-европеоидов этой подгруппы имеют нежную, но несколько утолщенную, слабопигментированную белую кожу, для которой характерно быстрое развитие ожога после инсоляции, светлую окраску волос и глаз, слабое развитие мускулатуры, сниженную физическую активность. Дети данной подгруппы отличаются хорошим (и даже избыточным) аппетитом и высокими темпами роста.
В дошкольном и младшем школьном возрасте у них отмечаются хорошее развитие подкожного жирового слоя, слабое развитие мускулатуры, снижение общего тонуса и тургора тканей, а также физической активности, замедленная реакция на внешние раздражители, замедленное образование новых условных рефлексов, ослабление процессов внутреннего торможения с преобладанием реакций внешнего торможения.
Клиническая характеристика детей с синдромом Платтера включает характеристику системы лимфоидных органов, которая, согласно мнению большинства исследователей, отличается генерализованной гиперплазией системы лимфоидных органов: лимфатических узлов, лимфатических фолликулов корня языка, задней поверхности глотки, поверхности надгортанника, гипертрофией небных и глоточной миндалин. Наши наблюдения, однако, показали, что состояние периферических лимфоидных органов зависит от воздействия антигенного стимула — при отсутствии такого воздействия генерализованная гиперплазия периферического лимфоидного аппарата не развивается [7].
К числу особенностей физического развития детей грудного и раннего возраста относятся: высокие темпы увеличения длины тела, слабое развитие скелетной мускулатуры, несвоевременность и неправильный порядок прорезывания молочных зубов, относительно позднее начало самостоятельной ходьбы.
В эмоциональной сфере в первые 2–3 мес жизни обращает внимание менее выраженный комплекс оживления (за счет снижения двигательной активности).
Начало становления речи у детей с синдромом Платтера не отличалось от такового у детей соответствующего возраста в популяции в целом: гуление, слоги и первые слова у них появлялись своевременно.
К возрасту 10–11 мес они начинали произносить первые одно- и двусложные слова, к 1 году количество активно произносимых слов достигало 10–12. В дальнейшем 8% детей данной группы до 2-летнего возраста продолжали пользоваться только этими 10–12 словами. В возрасте 4,5–6 лет 25% детей этой группы страдали дислалией, требующей проведения корригирующих логопедических занятий в условиях детской поликлиники или в условиях специализированного детского сада. У отдельных пациентов нарушение, связанное с произношением звуков, сохранялось и в подростковом возрасте.
Состояние здоровья детей с синдромом Платтера. Здесь рассматриваются только те заболевания и патологические состояния, которые достоверно чаще встречались у детей с указанным синдромом, по сравнению с детьми из общей популяции. При анализе структуры выявленных заболеваний наибольшую по численности группу составили аномалии развития (выявлены у 80% наблюдавшихся пациентов) — пороки развития, множественные стигмы дизэмбриогенеза, биохимические дефекты. Пороки развития чаще проявлялись гипоплазией органов и тканей: широкие отверстия паховых каналов и пупочного кольца, септальные дефекты в сердце, гипоплазия аорты, сердца, легких, почек, щитовидной железы и др.
Вторая группа заболеваний была представлена патологическими состояниями нервной системы. Наряду с заболеваниями нервной системы, обусловленными биохимическими дефектами (синдром Менкеса; ганглиозидоз Gm1; фенилкетонурия; галактоземия), обращали на себя внимание такие синдромы, как гипертензионно-гидроцефальный (у 49%), фебрильных судорог (у 20%), мышечной гипотонии (у 18%) и вегетативно-висцеральной дисфункции (у 12,5%). Включение в комплекс обследования электрофизиологических методов, компьютерной и ядерно-магнитно-резонансной томографии привело к существенному увеличению частоты выявления гипертензионно-гидроцефального синдрома (выявлен у 90%). Указанный синдром у 2/3 детей сочетался с синдромами фебрильных судорог и вегетативно-висцеральных дисфункций, однако последние два синдрома у части детей встречались и изолированно.
Изолированный синдром вегетативно-висцеральных дисфункций характеризовался крайне выраженным полиморфизмом проявлений: нарушение терморегуляции, дыхания, сердечной деятельности, функции желудочно-кишечного тракта, пароксизмальное повышение артериального давления и другие расстройства. Мы склонны считать, что синдром вегето-висцеральных дисфункций у детей с синдромом Платтера встречается значительно чаще, чем у указанных 12,5% пациентов. На существование гиподиагностики синдрома вегето-висцеральных дисфункций могут указывать выявленные нами фенотипические особенности детей, в том числе очень хороший (скорее избыточный) аппетит, склонность к задержке жидкости, как бы немотивированный субфебрилитет. Наши наблюдения показали, что у большинства детей с якобы немотивированным субфебрилитетом последний хорошо контролировался мочегонными средствами, что явно указывает на связь этого симптома с ликворной гипертензией, в том числе с повышением давления в области третьего желудочка мозга — месте локализации центра терморегуляции.
У детей с синдромом Платтера обращал на себя внимание и синдром мышечной гипотонии, который у ряда пациентов был настолько сильно выражен, что специалисты высказывали предположение о наличии у них болезни Верднига–Гоффманна или миелодисплазии.
Таким образом, частое выявление у детей с синдромом Платтера внутренней гидроцефалии, изолированного синдрома вегето-висцеральных дисфункций, наличие вегетативных нарушений указывает на возможность нарушения функции диэнцефальной области. Изменения со стороны скелетной мускулатуры трактовать сложнее. Однако если учесть, что средний мозг, примыкающий к области сильвиева водопровода, контролирует регуляцию мышечного тонуса и сигналы к мышцам поступают через ретикулярную формацию по двум ретикулоспинальным путям [11], то это нарушение может быть рассмотрено с позиции существования у данного контингента детей внутренней гидроцефалии и расстройства ликвородинамики, поскольку гипоталамус, таламус и ретикулярная формация являются звеньями единой суперфункциональной системы, корригирующей гомеостатические программы наиболее сложных вегетативных, эндокринных, трофических и психических функций [12].
У 9% пациентов школьного возраста с синдромом Платтера зарегистрированы заболевания нейроэндокринной и эндокринной системы (диэнцефальный синдром, несахарный диабет, транзиторный несахарный диабет, транзиторный гипопаратиреоз, инсулинозависимый сахарный диабет, поликистоз яичников, эутиреоидная струма, диффузный токсический зоб, субкомпенсированный гипокортицизм). У детей с синдромом Платтера, отмечается тенденция к высоким показателям роста и слабой пигментации кожи, что может также указывать на дисфункцию гипоталамо-гипофизарной системы. Кроме того, у этих детей существует ряд симптомов, которые мы назвали торакальными и к числу которых относится синдром сдавления средостения. Этот синдром мы наблюдали только у детей первых 2–2,5 мес жизни при значительном увеличении тимуса.
Все исследователи, занимавшиеся изучением особенностей лиц со стойкой тимомегалией (а основную группу в них, вне всякого сомнения, составляют дети с синдромом Платтера), обращали внимание на их пониженную физическую активность.
При специальном опросе 72 пациентов в возрасте 10–24 лет с синдромом Платтера у 46% из них было отмечено негативное отношение к физическим нагрузкам, особенно к бегу на длинные дистанции и езде на велосипеде. Подростки и лица молодого возраста, способные передать ощущения, появлявшиеся при физической нагрузке, отмечали на ее фоне чувство слабости, ощущение нехватки воздуха.
Когда у 30 подростков с синдромом Платтера, не имевших органических заболеваний сердца, было проведено эхокардиографическое исследование сердца на аппарате 128 х Р — ACUSON (США) с определением массы миокарда левого желудочка сердца, у 27 из них индексированная (относительно массы тела) масса миокарда левого желудочка сердца оказалась достоверно меньше (р
Л. Г. Кузьменко, доктор медицинских наук, профессор
РУДН, Москва