вариабельность ритма резко снижена чем это грозит
Вариабельность ритма резко снижена чем это грозит
При инсульте отмечаются преходящие изменения сердечной деятельности, изменения на ЭКГ, которые в ряде случаев являются отражением имеющейся, но скрытой ранее кардиальной патологии [16]. Развитие этих транзиторных кардиальных нарушений напрямую связано с острым церебральным поражением и обозначается понятием «цереброкардиальный синдром» (ЦКС) [5, 7].
В последние годы возрос интерес к изучению вариабельности ритма сердца (ВРС) как показателя, отражающего автономную регуляцию сердца и определяющего риск внезапной сердечной смерти. ВРС представляет собой изменение частоты сердечных сокращений (длительности интервалов RR) вовремени.Снижение ВРС является высокоинформативным независимым предиктором желудочковой тахикардии, фибрилляции желудочков и внезапной смерти у больных инфарктом миокарда [8].
Литературные данные о прогностической значимости ВРС при остром инсульте неоднозначны. У больных с различным течением инсульта встречаются разные варианты изменений вегетативной регуляции и неодинаковая степень их выраженности, что позволяет использовать оценку изменений обоих отделов вегетативной нервной системы для прогнозирования тяжести и исхода заболевания [20]. Есть данные, указывающие и о необходимости переоценки значений ВРС при инсульте [19].
ВРС является одним из механизмов адаптации организма к изменению внешних и внутренних факторов и отражает степень напряжения регуляторных систем на стрессорное воздействие [1, 11]. При ухудшении здоровья пациента или появлении дискомфорта в его состоянии, связанного с началом заболевания, возникновением осложнений в течение заболевания, наличием долговременного стресса ВРС снижается, при улучшении состояния организма (выздоровлении, исчезновении источника стресса) ВРС увеличивается [11].
Острое нарушение мозгового кровообращения приводит не только к повышению уровня катехоламинов плазмы, но и изменениям автономной регуляции сердечно-сосудистой системы, нарушению ВРС, что может негативно влиять на электрическую нестабильность миокарда, провоцировать аритмии, которые могут ухудшать гемодинамику и негативно влиять на репаративные процессы в зоне церебральной ишемии [16, 21]. При развитии ишемического инсульта отмечалась положительная корреляция между частотными показателями ВРС и уровнями систолического и диастолического артериального давления(АД) в дневные и ночные часы, что свидетельствует о едином механизме, участвующем в регуляции работы сердечно-сосудистой системы, и его нарушении у больных в остром периоде ишемического инсульта [2]. При инсульте наблюдалось большее, чем у пациентов с гипертоническим кризом, снижение вегетативного контроля ритма сердца. Так, показатель SDNN был понижен по сравнению с пациентами с гипертоническим кризом на 12,8 % (р
Научная электронная библиотека
Прекина В И, Самолькина О Г,
1.1. Вариабельность ритма сердца
Для оценки риска развития неблагоприятных сердечных событий широко используется анализ вариабельности ритма сердца (ВРС), которая представляет собой временные колебания интервалов между последовательными ударами сердца (интервалов RR) и рассматривается как маркер активности вегетативной нервной системы (ВНС) [206]. ВРС – количественное выражение, мера синусовой аритмии. В последние годы возрос интерес к изучению ВРС как показателя, отражающего автономную регуляцию сердца и определяющего риск внезапной сердечной смерти [100, 226, 228]. В настоящее время ВРС признана наиболее информативным и доступным методом оценки вегетативной регуляции сердечного ритма и является неотъемлемой частью обследования кардиологических больных [227].
Несмотря на большое количество исследований, свидетельствующих о взаимосвязи симпатики, парасимпатики, барорефлекса, системы терморегуляции, гуморальных влияний с определенными временными и спектральными показателями ВРС, к настоящему времени накоплен большой фактический материал, не позволяющий однозначно рассматривать ВРС как метод оценки вагосимпатического баланса. Так, эксперты клиники Мэйо (США), проанализировав работы за 20-летний период в области ВРС, отметили, что, учитывая множественный характер эндо- и экзогенных факторов, влияющих на формирование структуры ритма сердца, параметры ВРС не отражают истинное состояние ВНС у больных с кардиоваскулярной патологией.
Основной целью исследования ВРС при суточном мониторировании ЭКГ (на длительных промежутках времени) является оценка функционального состояния пациента. Функциональное состояние пациента – это способность и готовность организма выполнять различные функции (по И.К. Анохину, 1975) [5], в частности – поддержание его гомеостаза и интеллектуального состояния [11]. Общей мерой для всех этих функций можно считать энергию, затраченную на их выполнение. Живой организм при взаимодействии с внешней средой стремится достигнуть полезного результата с наименьшими энергетическими затратами.
Одним из показателей нормального функционирования систем является нормальная ВРС. Высокая ЧСС, снижение ВРС и синусовой аритмии являются неблагоприятными факторами при оценке функционального состояния пациента [4, 123, 224]. Преобладание симпатической активности характерно для состояния стресса и неблагоприятно сказывается на деятельности сердечно-сосудистой системы, приводит к развитию тахикардии, сердечных аритмий, ишемии миокарда, гипертонических кризов [28, 113, 222, 223]. У пациентов с АГ и цереброваскулярными заболеваниями имеются изменения ВРС с преобладанием активности симпатической нервной системы [108]. Снижение ВРС связано с возрастом [21, 87].
Инсульт приводит не только к повышению уровня катехоламинов плазмы, но и изменениям автономной регуляции сердечно-сосудистой системы, нарушению ВРС, что может негативно влиять на электрическую нестабильность миокарда, провоцировать аритмии, которые могут ухудшать гемодинамику и негативно влиять на репаративные процессы в зоне церебральной ишемии [36, 145, 184]. При развитии ишемического инсульта отмечалась положительная корреляция между частотными показателями ВРС и уровнями систолического и диастолического АД в дневные и ночные часы, что свидетельствует о едином механизме, участвующем в регуляции работы сердечно-сосудистой системы, и его нарушении у больных в остром периоде ИИ [24]. Дисфункция вегетативной регуляции сердечно-сосудистой системы влияет на выживаемость после инсульта [193, 264].
В острейшем периоде ИИ происходит угнетение вегетативной регуляции сердца со снижением всех параметров ВРС и циркадного
индекса (ЦИ) ЧСС. Выявлена прямая связь между суммарной вегетативной активностью (SDNN) и тяжестью неврологического дефицита в начале и по окончании острого периода [114]. Риск возникновения инсульта коррелирует с низкими показателями SDNN ночью [176]. При наличии депрессии у больных с инсультом SDNN был зна-
чительно ниже [246].
При инсульте наблюдалось большее, чем у пациентов с гипертоническим кризом, снижение временных показателей ВРС и ЦИ [23, 128]. Отмечено снижение ВРС у больных с АГ в острейшем периоде ИИ [23]. К концу острого периода увеличивается выраженность вегетативного дефицита у больных ХСН, что обусловлено диффузными изменениями сердечной мышцы, приводящими к перестройке внутрисердечного вегетативного аппарата [115].
При наличии выраженного неврологического дефицита по окончании раннего восстановительного периода инсульта у больных хронической сердечной недостаточностью I-II ФК в динамике, по сравнению с острым периодом (7–10-й день болезни), выявлено статистически значимое снижение ВРС, нарастание активности симпатико-адреналовой системы. Регресс неврологической симптоматики в раннем восстановительном периоде ишемического МИ сопровождается уменьшением вегетативной дисфункции по данным ВРС [51].
Лакунарный инсульт в остром периоде сопровождается изменениями ВРС [37]. Сниженная парасимпатическая активность коррелирует с неблагоприятным ранним прогнозом у лиц с атеротромботическим
инсультом [182].
В остром периоде инсульта происходит снижение ВРС, обусловленное поражением определенных мозговых структур [210, 211]. К концу острого периода максимальный дефицит вегетативных влияний на ритм сердца сохраняется у больных с инсультом в вертебрально-базилярной системе и при большом очаговом поражении [114]. Проспективное наблюдение на протяжении 1 года состояния вегетативного статуса у больных после инсульта в вертебрально-базилярном бассейне указывает на значительную стойкость выявленных нарушений ВРС [133]. Cнижение ВРС более выраженно при правосторонней локализации церебрального поражения. При этом самые низкие значения ВРС регистрировались при вовлечении в патологический очаг правого островка [265]. При правосторонней локализации инсульта независимо от поражения островковой доли имеется стойкий дефицит вегетативной регуляции, в большей степени за счет парасимпатической составляющей, что может быть связано с более неблагоприятным прогнозом [115].
В острейшем периоде ИИ у больных с преимущественным поражением каротидного бассейна с образованием больших и средних по размеру очагов отмечается стойкое нарушение сердечно-сосудистой автономной регуляции.
Выявлены взаимосвязи церебральной и центральной гемодинамики в остром периоде вертебробазилярного инсульта ишемического генеза, выражающиеся в снижении мозгового кровотока не только в бассейне позвоночных артерий, но и в целом, при одновременном увеличении показателей насосной функции сердца в первые сутки мозговой катастрофы и с последующим её снижением к концу 3-й недели; при этом падение сердечного индекса менее 1,8 являлось прогностически неблагоприятным [42].
К концу острого периода инсульта увеличивается выраженность вегетативного дефицита у больных с хронической сердечной недостаточностью (ХСН), что обусловлено диффузными изменениями сердечной мышцы, приводящими к перестройке внутрисердечного вегетативного аппарата [116]. Регресс неврологической симптоматики в раннем восстановительном периоде ИИ сопровождается уменьшением вегетативной дисфункции по данным ВРС [51].
ЦИ ЧСС характеризует изменчивость ритма в течение суток и является важной характеристикой патологического процесса. Циркадные колебания частоты кардиальных кризов тесно связаны с биоритмами изменений электрофизиологических свойств в миокарде [187]. В первые сутки ИИ отмечается существенное снижение ЦИ, сохраняющееся на протяжении последующих трех недель. При локализации очага в вертебро-базилярной системе снижение ЦИ носит стойкий характер и свидетельствует о стабильности нарушений функциональных резервов сердечно-сосудистой системы, поражение в каротидной системе сопровождается адекватной реакцией ЦИ в процессе восстановления [145]. У больных с различным течением инсульта встречаются разные варианты изменений вегетативной регуляции и неодинаковая степень их выраженности, что позволяет использовать оценку изменений обоих отделов ВНС для прогнозирования тяжести и исхода заболевания [173, 181, 183, 212].
Наиболее информативные критерии ВРС, которые с вероятностью 70–82 % ассоциируются с высоким риском летального исхода при инсульте: SDNN 1,45 (Макаров Л.М., 2011). Незначительное отклонение циркадного профиля от нормы (пограничное значение) считали при значении ЦИ в пределах 1,2–1,23.
Кроме временных показателей ВРС использовали метод «анализа коротких участков» [110]. Интегральное заключение по ВРС проводилось по доле участков с малой вариабельностью: если больше 60 %, то «Резко снижена», от 30 до 60 % – «Умеренно снижена», меньше
30 % – «Норма».
С помощью исследования ВРС можно получить новые дифференциально-диагностические критерии дисфункции сердечно-сосудистой системы, в том числе и в результате сосудистого церебрального поражения. ВРС представляет собой объективный и чувствительный индикатор церебральной функции при инсульте.
В табл. 1.1.1 представлена сравнительная характеристика ЧСС, показателей ВРС и ЦИ пациентов, включенных в исследование. Средняя ЧСС в исследуемых группах была примерно одинаковой. Максимальное снижение SDNN отмечено у пациентов ОГ: на 11,36 % (P ОГ ( n = 108)
О чем вам расскажет вариабельность сердечного ритма: гид
Как один параметр, измеренный с помощью смартфона, определяет состояние вашего организма
Многие ученые считают, что будущее за превентивной медициной: наши гаджеты будут собирать достаточное количество информации о показателях здоровья, чтобы можно было начать принимать меры еще до того, как появится реальная проблема. Пока это во многом мечты: точные замеры по-прежнему делаются в лабораториях и клиниках на дорогом и мощном оборудовании.
Тем не менее кое-что уже можно измерять и с помощью смартфона. Например — вариабельность сердечного ритма (heart rate variability, HRV). Мобильные приложения научились «распаковывать» простую метрику в десятки полезных данных об организме, по которой делаются выводы об уровне стресса, работе центральной нервной системы и многом другом.
Как это возможно? Расскажем в нашем гиде.
Космическая технология
Использовать HRV начали еще в 1960-х. Его придумали как неинвазивный способ измерять уровень стресса в организме, оценивать функциональное состояние, риск заболеть и другие параметры. Изначально HRV применяли, чтобы следить за самочувствием астронавтов. Но вариабельность оказалась таким всеобъемлющим показателем, что вскоре изучать ее стали и за пределами NASA.
Что такое вариабельность сердечного ритма
Если очень упрощать — это показатель, отражающий неравномерность вашего сердцебиения.
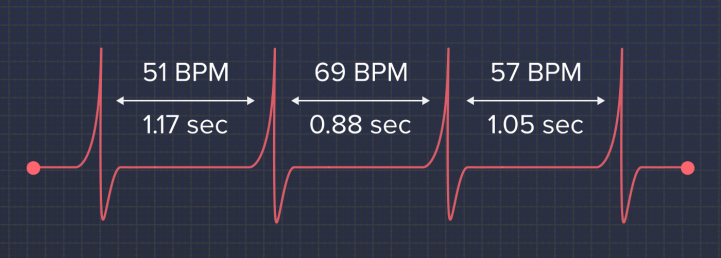
Сердце бьется с неравными интервалами. Если ваш пульс — 60 ударов в минуту, это не значит, что ваше сердце сокращается ровно раз в секунду. На самом деле, ваше сердцебиение выглядит примерно так:
И это совершенно нормально. Сердце и не должно биться равномерно, оно даже не должно к этому «стремиться». Напротив — чем больше неравномерность, она же вариабельность сердечного ритма, тем лучше ваше функциональное состояние.
Как измерить HRV?
Показатели вариабельности рассчитывают различные приложения. Среди них, к примеру, Welltory — один из топовых сервисов в этой сфере с российскими корнями. Есть еще HRV4Training — это приложение заточено под спортсменов и помогает понять, как тренировки влияют на вариабельность (и наоборот). Приложение платное, им пользуются профессиональные спортсмены вроде членов NBA, NHL и участников Олимпийских игр.
Если вы хотите повысить точность измерений, можно подключать к приложениям гаджеты, которые считывают показатель вариабельности сердечного ритма — например, нагрудный датчик, специальный фитнес-браслет или клипсу. Есть и такие приложения — в частности, CardioMood и Elite HRV, — где вариабельность измеряется не с помощью камеры, а исключительно с помощью кардиомониторов.
Также показатель вариабельности самостоятельно измеряют некоторые гаджеты: например, Apple Watch и Oura Ring (кольцо, чья основная цель — мониторинг сна). Результаты можно увидеть в приложениях Apple Health и Oura соответственно. Но тут есть нюанс: эти гаджеты измеряют всего один показатель вариабельности — и поэтому их нельзя использовать для расширенной аналитики, в том числе подключать к приложениям, разработанным именно для анализа вариабельности.
Обратите внимание, что не каждый гаджет подойдет для измерения вариабельности — например, популярные Fitbit и Mi Band не «отдают» значения интервалов между ударами сердца, поэтому на базе их данных нельзя вычислить параметры, связанные с HRV. Список подходящих устройств можно посмотреть, например, тут.
Какие показатели рассчитываются на базе HRV
Один из главных параметров вариабельности сердечного ритма — это SDNN (Standard Deviation of the Normal-to-Normal). Как можно догадаться из названия, он помогает узнать стандартное (среднеквадратичное) отклонение интервалов между ударами сердца — их еще называют RR-интервалами — от среднего значения. Именно этот параметр отслеживают Apple Watch, и его можно увидеть в приложении Apple Health.
Есть еще один важный параметр вариабельности, сходный с SDNN — RMSSD (Root Mean Square of Successive Differences). Для его расчета используется разница между каждым RR-интервалом и предыдущим интервалом — то есть этот показатель дает представление о динамике. Параметр RMSSD использует в измерении вариабельности кольцо Oura Ring — его вы увидите на графике HRV в приложении Oura.
И SDNN, и RMSSD, и RR-интервалы измеряются в миллисекундах (мс).
На базе полученных параметров — SDNN, RMSSD и RR-интервалов — высчитывают и другие показатели. Один из важнейших — это pNN50: он показывает вероятность того, что каждый случайно выбранный интервал будет отличаться от среднего более чем на 50 мс. Сравнивая здоровых людей с теми, у кого, например, есть проблемы с сердцем, можно увидеть, что у здоровых показатель pNN50 оказывается выше.
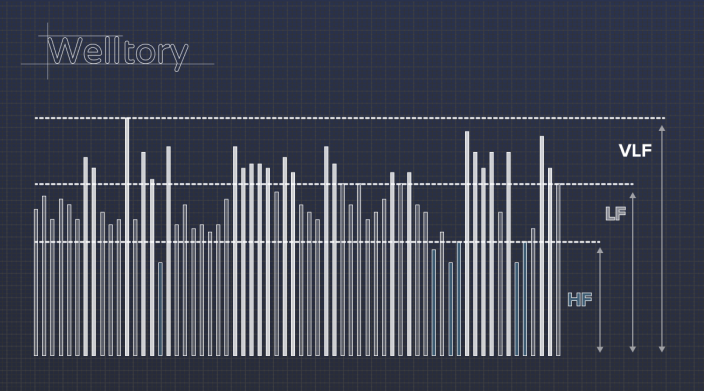
Еще на базе HRV рассчитываются «волны». Не будем углубляться в детали — просто представьте, что все RR-интервалы выстроили в столбики, и стали считать маленькие колебания волнами с высокой частотой (high frequency, HF), а большие — с низкой (low frequency, LF и very low frequency, VLF).
Какое отношение к здоровью имеют эти цифры?
Это главный вопрос. Речь здесь идет не прямом соответствии показателя состоянию организма (сдаешь анализ на кортизол –> понимаешь, какой у тебя уровень стресса), а о корреляции. Но — корреляции, подкрепленной большой статистикой.
Наблюдая, например, за показателем SDNN в течение длительных — суточных — измерений, ученые выяснили, что вариация этого показателя отражает, насколько хорошо в целом организм контролирует работу сердца. Это косвенно говорит о том, эффективна ли вегетативная (автономная) нервная регуляция организма. Обнаружили они это математически — проследив за корреляциями показателя SDNN и параметров, отражающих работу вегетатики.
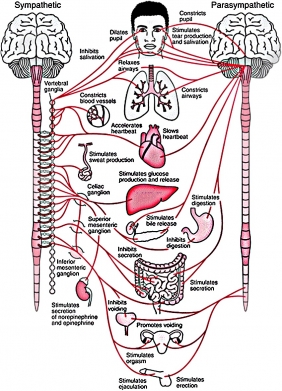
Вегетативная система регулирует работу желез и внутренних органов в автономном режиме — в том смысле, что не зависит от воли человека: мы не можем усилием мысли заставить сердце биться быстрее или сузить зрачки. Состоит из двух дополняющих друг друга частей — симпатической и парасимпатической. Первая, вопреки названию, обычно не сулит ничего хорошего — это система, реагирующая на стресс. Вторая — регулирует работу организма в расслабленном, спокойном состоянии. Проще всего представить работу двух систем на примере травоядного животного — скажем, зебры: пока она мирно пасется, работает парасимпатическая система, при виде хищника включается система симпатическая. Чрезмерная, незатихающая активность симпатической системы у человека — признак хронического стресса.
Что делает с нами симпатическая и парасимпатическая нервная система. Источник: Silvia Bunge, ResearchGate
С RMSSD, который достаточно точен даже при краткосрочных замерах — около 5 минут, другая история. Ученые во время своих экспериментов, тоже математически, выяснили, что в коротких промежутках на разнице между соседними ударами сердца и вариабельности сердечного ритма больше сказывается парасимпатика — та часть автономной нервной системы, что отвечает за расслабление. Именно поэтому параметр RMSSD можно использовать для того, чтобы оценить, насколько хорошо организм сейчас восстанавливается.
В итоге: RMSSD — более точный параметр для краткосрочных замеров, больше реагирует на парасимпатику, позволяет прямо сейчас оценить восстановление; SDNN — менее точный в быстрых замерах, имеет смысл наблюдать за ним в динамике, чтобы оценить, насколько вы в стрессе, сбалансирована ли автономная нервная система и не является ли ваша симпатика чересчур активированной.
Про упомянутые выше «волны» установили такие соответствия: HF—волны отвечают в большей степени за работу парасимпатической системы и за дыхание. Если они в данный момент сильны, значит, вы активно восстанавливаетесь. Мощность HF-волн недостаточна? Возможно, организм работает из последних сил, и нужно сесть и расслабиться, помедитировать и подышать.
А вот LF-волны, напротив, отражают активность симпатической нервной системы — той самой, что отвечает мобилизацией на стресс. Если их мощность достаточна, значит, вы в тонусе. Слишком высокий показатель может говорить о том, что вы перенапряглись, и нужно сбавить обороты. Низкая активность LF волн — показатель того, что вы чересчур расслаблены, и надо собраться и добавить здорового стресса в жизнь.
Еще один важный показатель — это соотношение LF/HF. Оно отражает то, насколько сбалансирована работа вегетативной нервной системы между двумя ее отделами — симпатическим и парасимпатическим. В норме это соотношение должно быть не ниже единицы.
Показатель VLF тоже говорит скорее о состоянии организма в целом. Он помогает определить, справляется ли автономная нервная система с регуляцией вашего состояния — или для борьбы со стрессом уже приходится подключать центральную нервную систему.
Как это работает: пример
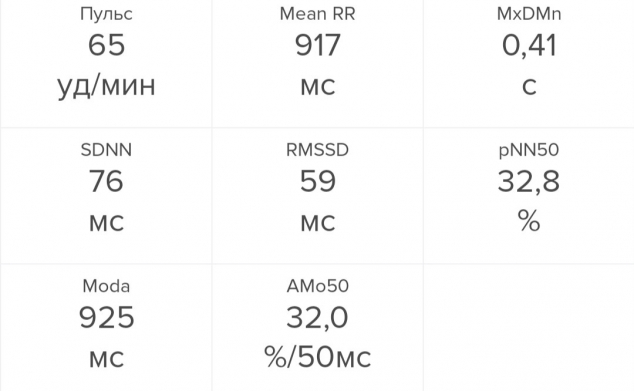
Я измерила вариабельность сердечного ритма во время написания этого текста. Все показатели оказались в порядке: SDNN равен 76 мс (это даже лучше, чем в среднем у женщин моего возраста — 25–35 лет), RMSSD — 59 мс, тоже чуть лучше, чем в среднем. Если же брать нормативные диапазоны, то я буду на верхней границе нормы — отличный результат. И pNN50, который у меня равен 32,8%, находится ровно на уровне среднего здорового молодого человека.
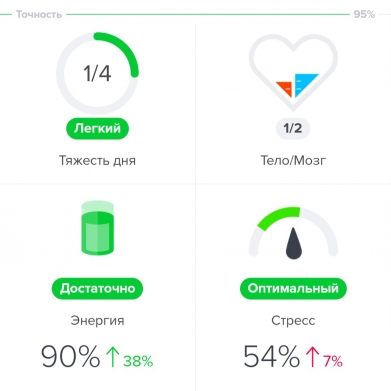
Приложение, которое я использовала — Welltory — выдало мне вердикт: сейчас вы в хорошем состоянии, у вас много энергии, а стресс оптимален. Поэтому, например, я могу сегодня пойти на силовую тренировку или взяться за сложную задачу по работе (чем я, собственно, и занимаюсь).
Но завтра мои параметры могут быть совсем иными — а значит, я получу другие советы и буду корректировать нагрузку в соответствии со своим состоянием.
Другой пример. Вчера я сделала измерение HRV перед сном.
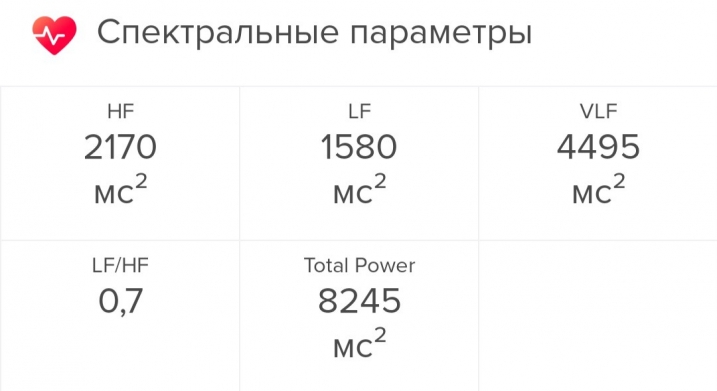
Показатель HF-волн был на уровне 2170 мc2, LF — 1580 мc2. Соответственно, соотношение LF/HF было равно 0,7 — вроде бы ниже нормы. Но, как выяснилось, для позднего вечера это в самый раз: это значило лишь, что я хорошо восстанавливаюсь, и организм вошел в режим расслабления перед сном.
Показатель VLF оказался равен 4495 мc2. Приложение сказало мне, что это очень много — я, видимо, слишком вымоталась, и «из-за повышенного физического или эмоционального возбуждения автономная нервная система уже не справляется с управлением ритмом вашего сердца». В этот день я прошла около 12 тысяч шагов — это почти в два раза больше, чем я хожу обычно. Наверно, проблема была в этом.
Можно проще?
Для тех, кому лень разбираться во всем многообразии сложных параметров вариабельности, приложения предлагают простой «вердикт» — для этого показатели HRV переводятся в интуитивно понятные всем факторы. В случае с Welltory, которым пользуюсь я, это стресс, энергия и продуктивность (в вечернее время параметр «продуктивность» меняется на «тяжесть дня»).
Как рассчитываются эти факторы? Все довольно просто.
Есть готовые формулы, которые исследователи вывели математически, изучая разные параметры HRV, объективные и субъективные факторы самочувствия человека. Оказалось, что уровень стресса коррелирует с SDNN и LF — показателями, связанными с симпатикой. Энергия рассчитывается на базе работы парасимпатики, то есть параметров RMSSD и HF: чем хуже работает парасимпатическая нервная система, тем больше усталости копится — и энергии становится меньше. Наконец, показатель продуктивности/тяжести дня скоррелирован с работой префронтальной коры: чем больше она вынуждена вмешиваться в контроль за работой сердца, тем меньше ресурса остается для продуктивной работы. И определить это можно с помощью параметра VLF.
А как все эти готовые формулы применимы к жизни конкретного человека? Вот как: эти формулы «калибруются» под каждого пользователя приложения. Понятно, что мы все разные — и предсказать самочувствие любого случайного человека по одной и той же формуле было бы нереально. Поэтому приложение использует самообучающийся алгоритм — и в качестве исходных данных берет ваши замеры и обратную связь о самочувствии (картинка в правом верхнем углу).
Как применять это на практике?
Вариабельность сердечного ритма — хороший способ быстро и достаточно точно оценить функциональное состояние организма. В отличие от пульса, который в большей степени отражает реакцию организма на физическую активность, HRV учитывает также ментальную и эмоциональную нагрузку. Поэтому, измерив вариабельность сердечного ритма, вы можете в целом оценить, как ваше тело переносит все происходящее в вашей жизни.
Показатели, связанные с HRV, нестабильны. Поэтому интереснее всего наблюдать за ними в динамике. Если уж решите измерять вариабельность сердечного ритма, делайте это регулярно, желательно — в одно и то же время. Хотя бы 4–5 замеров в неделю — и со временем вы сможете увидеть какие-то тренды, заметить корреляцию параметров с образом жизни и, возможно, внести в него какие-то изменения.
Наверное, не стоит относиться к показателям вариабельности слишком серьезно. Замеры не должны заменять здравый смысл и ощущения, но они могут помочь в некоторых ситуациях. Например, так.