в полости пп сеть хиари что это
В полости пп сеть хиари что это
Клиническая картина характеризуется выраженными симптомами право- или левожелудочковой недостаточности. У части больных появляется выпот в полости перикарда, при ЭхоКГ отмечается также сравнительно небольшой объем желудочков, обусловленный выраженной инфильтрацией эндокарда желудочков и значительными фибринозными и тромботическими наложениями. Несмотря на повышение давления наполнения желудочков, систолическая функция их вначале сохраняется. Кроме того, при ЭхоКГ предсердия часто расширены, отмечается недостаточность митрального клапана и клапана легочной артерии.
б) Внутренние структуры правых отделов сердца. В правом предсердии имеются анатомические структуры, которые можно принять за объемное образование, поэтому их следует включить в дифференциальный диагноз. К таким структурам относятся евстахиева заслонка, пограничный гребень, сеть Хиари и мышечный пучок в устье верхней полой вены.
1. Сеть Хиари. Сеть, или пластинка Хиари представляет собой продырявленную мембрану, которая при нарушении процесса обратного развития правой заслонки венозного синуса сохраняется в правом предсердии в качестве анатомического варианта его строения. Сеть Хиари при ЭхоКГ была впервые описана в 1981 г. в виде очень подвижного образования со значительной вариабельностью места прикрепления. При ЧПЭ сеть Хиари, как правило, имеет вид перепончатого флотирующего образования в правом предсердии, которое прикрепляется к его медиальной и латеральной стенкам. Для исследования этого образования датчик, находящийся в пищеводе, проталкивают примерно на 4 см от плоскости четырех камер и поворачивают.
Частота выявления сети Хиари при ЧПЭ такая же, как при аутопсии, и составляет 5%. Несмотря на отдельные сообщения в литературе о связи сети Хиари с тромбозом правого предсердия, нарушением ритма сердца или образованием аневризмы межпредсердной перегородки, а также несмотря на казуистические случаи обвития тромба или катетера сетью Хиари, эта аномалия развития, как правило, не имеет клинического значения. Эхокардиография в таких случаях позволяет отдифференцировать сеть Хиари от других патологических образований правого предсердия, в частности тромба, вегетаций, инородного тела и редко аневризмы синуса Вальсальвы.
2. Трехпредсердное сердце (удвоение правого предсердия). Персистенция правой заслонки венозного синуса может привести к образованию патологической мембраны и удвоению правого предсердия (правое трехпредсердное сердце).
3. Евстахиева заслонка. Евстахиева заслонка, или евстахиев клапан, расположена в устье нижней полой вены и хорошо визуализируется при лоцировании сердца вдоль длинной оси из чреспищеводного доступа.
4. Тебезиев клапан (заслонка) и пограничный гребень. Вблизи венозного синуса расположены также тебезиев клапан и пограничный гребень. Тебезиев клапан прикрепляется к устью коронарного синуса, а пограничный гребень расположен на латеральной стенке правого предсердия. Для идентификации этих структур правого предсердия и дифференцирования их от перечисленных выше объемных образований, как правило, необходимо выполнение многопроекционного УЗИ и, по крайней мере, двумерной ЭхоКГ.
5. Гребешковые мышцы и мышечные пучки. Стенки правого предсердия по сравнению с левым имеют более выраженное трабекулярное строение, и иногда отдельные трабекулы или мышечные пучки бывают настолько крупными, что их приходится включать в дифференциальный диагноз, когда у больного подозревают опухоль предсердия. Указанные анатомические структуры могут особенно увеличиваться при гипертрофии предсердий, например при дефекте межпредсердной перегородки. У устья верхней полой вены иногда наблюдается мышечный пучок, который также может затруднить диагностику и должен быть учтен в дифференциальном диагнозе.
В большинстве случаев эти структуры при многопроекционном чреспищеводном исследовании оказываются нормальным анатомическим вариантом; для большей информативности исследования в горизонтальной (поперечной) плоскости датчик желательно продвинуть несколько дальше или же подтянуть.
Менее затруднительна идентификация так называемой модераторной трабекулы в правом желудочке; ее можно выявить и при трансторакальной ЭхоКГ.
6. Тромбы. При образовании тромбов в правом предсердии или желудочке так или иначе нарушается функция этих камер сердца (мерцание предсердий, дилатационная кардиомиопатия). Лишь в исключительных случаях у больных со злокачественной опухолью сердца или нарушением свертывания крови тромбы могут образоваться без нарушения функции пораженного предсердия или желудочка. Тромбы в правые отделы сердца могут мигрировать также из глубоких вен нижних конечностей или из тазовых вен при их тромбозе.
7. Ятрогенные структуры, образующиеся в сердце. Ятрогенными структурами в правых отделах сердца, которые иногда ошибочно принимают за объемное образование, могут быть электрод от электрокардиостимулятора или имплантируемого дефибриллятора, а в исключительно редких случаях также катетеры для эмболизации артерий и кава-фильтры. В этих случаях также необходимо правильно оценить клиническую ситуацию в целом и собрать подробный анамнез.
в) Дополнительные структуры левых отделов сердца:
1. Мышечные пучки и сухожильные хорды. К дополнительным анатомическим структурам левых отделов сердца, которые следует учитывать при проведении дифференциальной диагностики, относятся аномальные сосочковые мышцы и аберрантные сухожильные хорды. Выраженная трабекулярность внутреннего рельефа левых камер сердца или гипертрофия их стенки могут вызвать при ЭхоКГ подозрение на опухоль сердца.
2. Фиброз и обызвествление. В дифференциальной диагностике следует учесть также очаговый фиброз и обызвествление желудочковой стенки, а нередко и области митрального кольца. Полноценное УЗИ, включая трансторакальную ЭхоКГ, в том числе из подреберной позиции датчика, а при необходимости и ЧПЭ, как правило, дает возможность четко дифференцировать эти изменения от опухоли сердца, от тромба и вегетаций.
3. Трехпредсердное сердце (удвоение левого предсердия). Резидуальная ткань общей легочной вены может достигать значительных размеров, располагаясь от устья левой верхней легочной вены до входа в ушко левого предсердия. В результате левое предсердие оказывается как бы разделенным на две камеры (левое трехпредсердное сердце).
4. Другие структуры сердца. За опухоль левого предсердия можно по ошибке принять также грыжу пищеводного отверстия диафрагмы, крупную аневризму коронарной артерии или увеличенный коронарный синус. Локализованная гематома перикарда также может создать впечатление опухоли сердца. В дифференциальный диагноз следует включить также пролапс митрального клапана, вегетации, связанные с эндокардитом, а также разрастания Ламбла на митральном клапане(см. рис. 22.10).
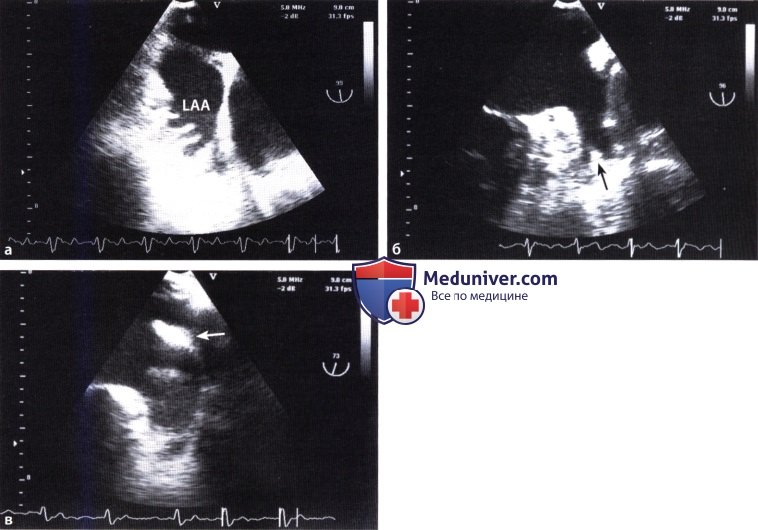
а ЧПЭ: гребешковые мышцы в левом ушке.
б Ушко левого предсердия, разделенное перегородкой (стрелка).
в Утолщенная складка свободной стенки правого желудочка (симптом «ватной палочки») (стрелка).
5. Тромбы. Диагностику тромба в левом предсердии могут усложнить гипертрофированные гребешковые мышцы, патологические эхо-сигналы от крыши левого предсердия в области входа в ушко или резидуальная ткань у устья левой верхней легочной вены. Для проведения дифференциальной диагностики следует выполнить многопроекционную ЧПЭ, а также допплерографию в импульсном режиме, которая позволяет измерить скорость кровотока в ушке левого предсердия. В присутствии тромба кровоток в левом ушке отчетливо снижается и составляет значительно меньше 25 см/с.
Для распознавания тромбоза левого ушка и проведения дифференциальной диагностики следует знать морфологические особенности левого предсердия. Нередко левое ушко состоит из двух или трех отделов, отделенных перегородками, которые также могут создать ложное впечатление тромбоза ушка. Источником диагностической ошибки может стать также образование складки (симптом «ватной палочки») на свободной стенке левого предсердия, впечатление тромбоза может создать также сканирование в косой плоскости к стенеи левого предсердия при переходе ее в крышу предсердия. Во многих случаях ошибочной диагностике тромбоза способствует недостаточный опыт врача-сонолога. Частота ошибочных диагнозов может достигать 60-70%.

г) Аневризмы межпредсердной перегородки:
Согласно определению, под аневризмой обычно понимают выпячивание межпредсердной перегородки в правое или левое предсердие более чем на 10 мм, хотя нередко наблюдаются случаи, когда межпредсердная перегородка смещается в сторону то одного, то другого предсердия. Аневризма может охватывать всю межпредсердную перегородку или только область овальной ямки.
2. Эхокардиография. По данным одного исследования, охватившего 195 больных, аневризму межпредсердной перегородки менее чем в 50% случаев диагностируют с помощью трансторакальной ЭхоКГ и в большинстве случаев диагноз ставят по результатам ЧПЭ. Из 195 больных у половины аневризма охватывала всю межпредсердную перегородку. Более чем в 50% случаев наблюдался сброс крови преимущественно через овальное окно. В отдельных случаях отмечены множественные перфорации аневризматически измененной межпредсердной перегородки, которая напоминала «швейцарский сыр».
3. Эмболии. У 44% больных с аневризмой межпредсердной перегородки и сбросом крови на уровне предсердий в анамнезе отмечаются эпизоды эмболии. У четверти больных, перенесших эмболию, помимо аневризмы межпредсердной перегородки, других возможных источников кардиогенной эмболии не выявляют. Ни размер аневризмы, ни степень ее выпячивания на частоту эмболии не влияют. Но у больных, перенесших эмболию, сброс крови через аневризму межпредсердной перегородки наблюдается существенно чаще. По данным специального исследования «Patent Foramen Ovale and Atrial Septal Aneurysm», при одном лишь открытом овальном окне риск повторного инсульта составляет 2,3%.
Если имеется также аневризма межпредсердной перегородки, риск возрастает до 15,2%. Эти данные говорят об особенно важном клиническом значении парадоксальной эмболии при аневризме межпредсердной перегородки со сбросом крови. В то же время тромбоз аневризмы как источник эмболии существенной роли не играет, так как лишь у 2 больных из 195 был выявлен тромб. Поэтому поиск аневризмы межпредсердной перегородки у лиц молодого возраста, перенесших инсульт, имеет основополагающее значение в установлении этиологического диагноза и особенно для правильного лечения.
Редактор: Искандер Милевски. Дата публикации: 11.1.2020
В полости пп сеть хиари что это
ФГБУ «Федеральный научный центр трансплантологии и искусственных органов им. акад. В.И. Шумакова» Минздрава России, Москва
ФГБУ «Федеральный научный центр трансплантологии и искусственных органов им. акад. В.И. Шумакова» Минздрава России, Москва
ФГБУ ФНЦ «Федеральный научный центр трансплантологии и искусственных органов им. акад. В.И. Шумакова» Минздрава России, Москва
ФГБУ «Федеральный научный центр трансплантологии и искусственных органов им. акад. В.И. Шумакова» Минздрава России, Москва
ФГБУ «Федеральный научный центр трансплантологии и искусственных органов им. акад. В.И. Шумакова» Минздрава России, Москва
ФНЦ трансплантологии и искусственных органов им. акад. В.И. Шумакова, Москва
ФГБУ «Федеральный научный центр трансплантологии и искусственных органов им. акад. В.И. Шумакова» Минздрава России, Москва
ФГБУ «Федеральный научный центр трансплантологии и искусственных органов им. акад. В.И. Шумакова» Минздрава России, Москва
Тромбоз сети Киари правого предсердия после коррекции врожденного порока сердца
Журнал: Кардиология и сердечно-сосудистая хирургия. 2013;6(6): 99-101
Иванов А. С., Гламазда С. В., Родионов А. С., Лебедева А. В., Кузьмин В. В., Абрамова Н. Н., Ильинский И. М., Можейко Н. П. Тромбоз сети Киари правого предсердия после коррекции врожденного порока сердца. Кардиология и сердечно-сосудистая хирургия. 2013;6(6):99-101.
Ivanov A S, Glamazda S V, Rodionov A S, Lebedeva A V, Kuz’min V V, Abramova N N, Il’inskiĭ I M, Mozheĭko N P. Chiari network thrombosis of the right atrium after correction of congenital heart disease. Kardiologiya i Serdechno-Sosudistaya Khirurgiya. 2013;6(6):99-101.
ФГБУ «Федеральный научный центр трансплантологии и искусственных органов им. акад. В.И. Шумакова» Минздрава России, Москва
ФГБУ «Федеральный научный центр трансплантологии и искусственных органов им. акад. В.И. Шумакова» Минздрава России, Москва
ФГБУ «Федеральный научный центр трансплантологии и искусственных органов им. акад. В.И. Шумакова» Минздрава России, Москва
ФГБУ ФНЦ «Федеральный научный центр трансплантологии и искусственных органов им. акад. В.И. Шумакова» Минздрава России, Москва
ФГБУ «Федеральный научный центр трансплантологии и искусственных органов им. акад. В.И. Шумакова» Минздрава России, Москва
ФГБУ «Федеральный научный центр трансплантологии и искусственных органов им. акад. В.И. Шумакова» Минздрава России, Москва
ФНЦ трансплантологии и искусственных органов им. акад. В.И. Шумакова, Москва
ФГБУ «Федеральный научный центр трансплантологии и искусственных органов им. акад. В.И. Шумакова» Минздрава России, Москва
ФГБУ «Федеральный научный центр трансплантологии и искусственных органов им. акад. В.И. Шумакова» Минздрава России, Москва
Тромбозы камер сердца после хирургических вмешательств в условиях искусственного кровообращения (ИК) — редкая и малоизученная патология. Чаще всего данные состояния встречаются при антифосфолипидном синдроме (АФС) и других тромбофилиях.
Основными предрасполагающими факторами для тромбообразования в полостях сердца являются наличие препятствия кровотоку, септальные дефекты (врожденные и приобретенные пороки сердца и магистральных сосудов), нарушения ритма сердца (мерцание, трепетание предсердий), наличие интравенозного катетера, эндокардиальных электродов, изменения свертывающей системы крови, в том числе транзиторные. В ряде наблюдений причина остается не выявленной [5]. К одной из механических причин тромбообразования и патологических тромбоэмболий относят развитую сеть Киари (не полностью редуцированные остатки клапана венозного синуса в правом предсердии (ПП) в области устья нижней полой вены). Она может служить «ловушкой» для тромбоэмболов и в последующем местом формирования тромба [6].
Разные авторы [1—3, 5] для лечения пациентов с тромбозами полостей сердца предлагают использовать консервативную (тромболитическую, антиагрегантную и антикоагулянтную) терапию с разной степенью эффективности, а также хирургическую коррекцию.
В доступной литературе [3, 4] мы нашли описания 4 наблюдений тромбоза ПП с местом фиксации тромба к сети Киари, возникших в отсроченный период после коррекции врожденного порока сердца — дефекта межпредсердной перегородки (МПП) в условиях ИК.
Приводим собственное описание редкого наблюдения тромбоза ПП в области сети Киари после коррекции врожденного порока сердца.
Пациентка К., 14 лет, поступила в ФГБУ ФНЦ трансплантологии и искусственных органов с диагнозом: врожденный порок сердца — дефект МПП. Предъявляла жалобы на слабость, быструю утомляемость при физической нагрузке.
По данным рентгенографии, сердце увеличено в объеме за счет правых отделов, признаки гиперволемии малого круга кровообращения.
На ЭКГ ритм синусовый, частота сердечных сокращений до 80 уд/мин, нормальное положение электрической оси сердца, неполная блокада правой ножки пучка Гиса.
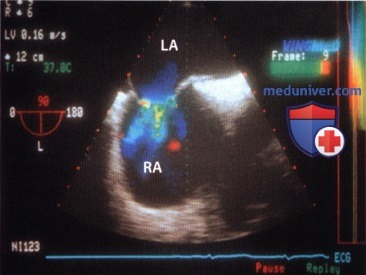
По данным эхокардиографии (масса тела 53 кг, рост 160 см, площадь поверхности тела 1,54 м2): конечный диастолический размер (КДР) правого желудочка (ПЖ) 3,3 см; ПП 3,7×3,6 см; КДР левого желудочка (ЛЖ) 4,3 см, конечный систолический размер (КСР) 2,8 см, фракция изгнания (ФИ) 66%; толщина межжелудочковой перегородки (МЖП) 0,8 см; толщина задней стенки левого желудочка (ЗСЛЖ) 0,8 см; диаметр аорты на уровне фиброзного кольца 1,7 см; давление в легочной артерии (ЛА) 30 мм рт.ст.; скорость кровотока в аорте 0,96 м/с; скорость кровотока в ЛА 1,36 м/с. В области МПП у ее нижнего края при цветовом допплеровском картировании лоцируется турбулентный косонаправленный поток в полость ПП, диаметром до 2,1 см со сбросом крови слева направо.
Коагулограмма до операции: активированное частичное тромбопластиновое время (АЧТВ) 32 с, протромбиновый индекс 86%, фибриноген 2600 мг/л, растворимые комплексы фибрин-мономера (РКФМ) 5 мг%. Агрегация тромбоцитов с адреналином 97% против 72%, c АДФ — 99% против 87%.
Общий анализ крови, общий анализ мочи, биохимический анализ крови без особенностей.
Порок являлся гемодинамически значимым и подлежал хирургической коррекции.
10.01.13 выполнена операция — пластика дефекта МПП заплатой из ксеноперикарда в условиях ИК. Интраоперационно при ревизии дефект МПП без нижнего края, размером 1,8×3,0 см. В области устья нижней полой вены (НПВ) перегородка шириной 5 мм, истончена, с множественными фенестрациями. Выполнено иссечение перфорированной части перегородки. Дефект закрыт заплатой из ксеноперикарда, фиксированной четырьмя П-образными швами (пролен 4/0) по задней полуокружности НПВ и непрерывным обвивным швом по остальному периметру. При проверке МПП герметична.
Послеоперационный период протекал без осложнений. Проводилась антибактериальная, противовоспалительная, десенсибилизирующая терапия. На 8-е сутки в удовлетворительном состоянии пациентка выписана под наблюдение педиатра и кардиолога по месту жительства. По данным контрольного обследования: на ЭКГ ритм синусовый, правильный, частота сердечных сокращений 91 уд/мин, неполная блокада правой ножки пучка Гиса. При эхокардиографии КДР ПЖ 1,8 см; ПП 2,9×3,2 см; КДР ЛЖ 4,3 см, КСР ЛЖ 2,8 см; ФИ 66%; МЖП 0,8 см; давление в ЛА 25 мм рт.ст.; скорость кровотока в аорте 1,1 м/с; скорость кровотока в ЛА 1,12 м/с. Патологические потоки в области МПП не определяются. Рекомендована консультация в клинике через 6 мес.
Дома через 2 мес после выписки в течение 2 дней отмечались эпизоды повышения температуры до 37,3 °С на фоне катаральных явлений. Проводилась симптоматическая терапия с положительным эффектом.
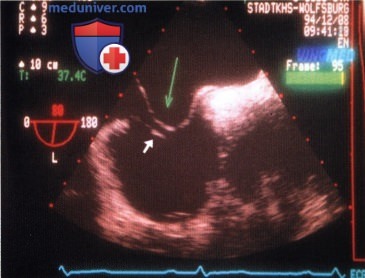
При плановой контрольной эхокардиографии через 6 мес после операции выявлено КДР ПЖ 1,8 см, ПП 4,4×3,8 см, ФИ 67%, область МПП интактна, визуализируется подвижное объемное образование ПП на ножке (2,5×1,7 см), пролабирующее в трехстворчатый клапан (рис.1). 
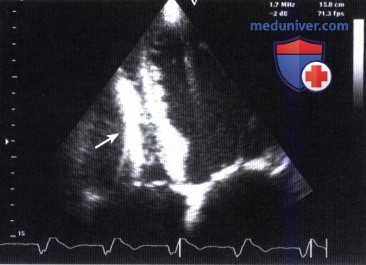
Пациентка в срочном порядке госпитализирована. При поступлении состояние удовлетворительное, жалоб нет. По данным рентгеновской мультиспиральной компьютерной томографии и магнитно-резонансной томографии органов грудной клетки в полости ПП определяется дополнительное мягкотканное образование неправильной «гроздевидной» формы размером 45×30×25 мм, подвижное, нависающее над устьем НПВ и пролабирующее в трехстворчатый клапан (рис. 2). 
Проводилась дифференциальная диагностика между тромбом и новообразованием ПП.
Коагулограмма: АЧТВ 32 с, протромбиновый индекс 82%, фибриноген 3090 мг/л, РКФМ 22 мг%, агрегация тромбоцитов с адреналином 88% против 44%, c АДФ — 86% против 57%, с ристомицином — 94% против 72%, антитромбин-3 97% (норма 75—125%), плазминоген 99% (норма 75—150%), D-димер 523 нг/мл (норма ≤500 нг/мл), протеин C 94% (норма 70—130%).
Повышение уровня D-димера могло указывать на возможное наличие в организме организованного тромба в стадии лизиса. Образование было расценено как флотирующий тромб ПП и пациентка по витальным показаниям (в связи с возможной тромбоэмболией легочной артерии) была оперирована.
Интраоперационно: в связи с риском разрушения тромба и тромбоэмболии легочной артерии канюляция НПВ произведена под контролем зрения через вскрытое ПП. Вмешательство выполняли на работающем сердце (длительность ИК 17 мин) и нормотермии. При ревизии ПП в области устья НПВ выражена сеть Киари, к которой фиксировано многодольчатое образование (4,2×2,9×1,2 см) плотной консистенции, имеющее вид цветной капусты (см. рис. 3 на цв. вклейке). 
По данным патоморфологического исследования, иссеченное во время операции образование имело на разрезе пестрый вид от розового до серо-белого цвета с отходящим от него тонким тяжом сети Киари.
При гистологическом исследовании (см. рис. 4 на цв. вклейке) 
Послеоперационный период протекал без осложнений. Со 2-х суток после операции профилактически начата антикоагулянтная (фрагмин) и антиагрегантная (кардиомагнил) терапия, с 4-х суток начат прием варфарина. При достижении целевого значения международного нормализованного отношения (МНО) 2,0—2,5 фрагмин отменен. На 7-е сутки удален центральный венозный катетер, сняты швы.
Пациентка обследована для выявления АФС и наследственных тромбофилий. Титры антител к фосфолипидам IgG, фосфолипидам IgM, кардиолипину, IgG, кардиолипину, IgM, b2 гликопротеину I, IgG, b2 гликопротеину I, IgM, аннексину V, IgG, аннексину V, IgM были ниже референсных значений, что позволило исключить АФС. Данных, подтверждающих генетическую патологию (лейденовская мутация, мутация гена протромбина), не получено.
При ультразвуковом исследовании вен нижних конечностей и таза данных, свидетельствующих о тромбозе, не получено.
На 10-е сутки пациентка в удовлетворительном состоянии выписана из стационара под наблюдение кардиолога и гематолога по месту жительства. При выписке АЧТВ 34 с, протромбиновый индекс 59%, фибриноген 3102 мг/л, РКФМ 28 мг%, агрегация тромбоцитов с адреналином 25% против 20%, с АДФ — 78% против 40%, D-димер 1082 нг/мл (
