в чем содержится карбоновая кислота
Роль карбоновых кислот в жизни человека и их применение: описание
Содержание:
Карбоновые кислоты – органические соединения, которые содержат карбоксильную группу –СООН. Функциональная группа состоит из карбонильной =С=О и гидроксильной –ОН групп. Карбоновые кислоты в жизни человека играют важную роль.
Классификация карбоновых кислот
Также карбоновые кислоты можно разделить на несколько групп по строению углеводородного радикала на предельные, непредельные, ароматические и циклические.
Нахождение кислот в природе
Области применения карбоновых кислот
Предельные одноосновные кислоты
Уксусная кислота СН3СООН необходима для производства красителей. В составе продуктов она обозначается как Е260. Уксусную кислоту применяют при консервировании овощей, грибов и т. д.
Предельные двухосновные кислоты
Янтарная кислота НООС−СН₂−СН₂−СООН внутри организма участвует в метаболических процессах. С ее помощью осуществляется клеточное дыхание и синтез белков. Янтарная кислота выводит отравляющие вещества и уменьшает вредное действие алкоголя в организме.
Жирные ненасыщенные кислоты
Линолевая кислота С₁₇H₃₁COOH участвует в регуляции обмена белка и жиров, предотвращении накопления холестерина в организме. Она защищает клетки от преждевременного старения.
Применение карбоновых кислот в медицине
Масляная кислота СH₃(CH₂)₂СООН используется при лечении заболеваний ЖКТ. В кишечнике она образует кислую среду, в которой погибают патогенные микробы и развиваются полезные бактерии.
Карбоновые кислоты
Классификация карбоновых кислот
Высшие карбоновые кислоты называют жирными кислотами. Более подробно мы изучим их теме, посвященной жирам, в состав которых они входят.
Номенклатура и изомерия карбоновых кислот
Названия карбоновых кислот формируются путем добавления суффикса «овая» к названию алкана с соответствующим числом атомов углерода и слова кислота: метановая кислота, этановая кислота, пропановая кислота, и т.д.
Для предельных карбоновых кислот характерна структурная изомерия: углеродного скелета, межклассовая изомерия со сложными эфирами.
Получение карбоновых кислот
При повышенной температуре и в присутствии катализатора становится возможным неполное окисление алканов, в результате которого образуются кислоты.
При реакции спиртов с сильными окислителями, такими как подкисленный раствор перманганата калия, спирты окисляются до соответствующих кислот.
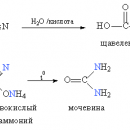
Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли.
При дальнейшей обработке формиата серной кислотой образуется муравьиная кислота.
Специфичность синтеза уксусной кислоты заключается в реакции угарного газа с метанолом, в результате которой она образуется.
Также уксусную кислоту можно получить другим путем: сначала провести реакцию Кучерова, в ходе которой образуется уксусный альдегид. Окислить его до уксусной кислоты можно аммиачным раствором оксида серебра или гидроксидом меди II.
Химические свойства карбоновых кислот
Для карбоновых кислот не характерны реакции присоединения. Карбоновые кислоты обладают более выраженными кислотными свойствами, чем спирты.
Карбоновые кислоты вступают в реакции с металлами, которые способны вытеснить водород (стоят левее водорода в ряду напряжений металлов) из кислоты. Реагируют также с основаниями, с солями более слабых кислот, например, угольной кислоты.
Перераспределение электронной плотности в молекулах этих кислот для лучшего запоминания лучше увидеть наглядно. Это перераспределение обусловлено большей электроотрицательностью хлора, который притягивает электронную плотность.
Муравьиная кислота отличается от своих гомологов. За счет наличия у нее альдегидной группы, она, единственная из карбоновых кислот, способна вступать в реакцию серебряного зеркала.
В такой реакции идет ее окисление до нестойкой угольной кислоты, которая распадается на углекислый газ и воду.
При нагревании и в присутствии серной кислоты (водоотнимающего компонента) муравьиная кислота распадается на воду и угарный газ.
Сложные эфиры
Ангидриды
Хлорангидриды карбоновых кислот образуются в реакции карбоновых кислот с хлоридом фосфора V.
Следующая реакция не имеет отношения к ангидридам, однако (из-за их схожести) вы увидите ее здесь для наилучшего запоминания. Это реакция галогенирования гидроксикислот, в результате которой гидроксогруппа в радикале меняется на атом галогена.
Непредельные карбоновые кислоты
Распределение электронной плотности в молекулах творит чудеса: иногда реакции идут против правила Марковникова. Так происходит в непредельной акриловой кислоте.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Карбоновые кислоты: история открытия, классификация. свойства
Карбоновыми кислотами называют органические вещества, 
К карбоновым кислотам относятся уксусная и муравьиная кислоты, известные достаточно давно. Об уксусе человек узнал с тех пор, как научился делать вино. Алхимики умели получать уксусную кислоту методом перегонки древесины без доступа воздуха уже в XVII веке, но правильного представления о характере этого вещества у них не было. Лишь в начале XIX века знаменитый химик Берцелиус точно определил строение уксусной кислоты.
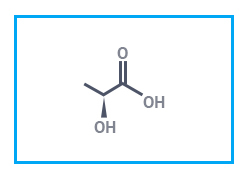 | 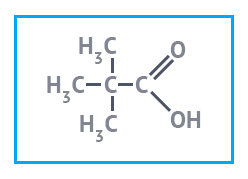 | 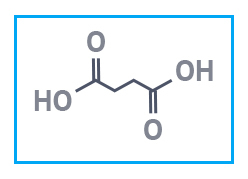 |
| Молочная кислота, 80% | Пивалевая кислота | Янтарная кислота |
Карбоновые кислоты делят на группы в зависимости от признака, взятого за основу:
Агрегатное состояние кислот в нормальных условиях зависит от размера молекулы. Низшие кислоты — легкоподвижные жидкости, без цвета, с сильным запахом, легко растворяющиеся в воде. Средние кислоты — маслянистые, жидкие, запах неприятный. Высшие — твердые, не водорастворимы. Как и большинство органических веществ, карбоновые кислоты способны к изомеризации (изомеры имеют одинаковый состав атомов, но разное их расположение в пространстве).
Реактивы относятся к слабым кислотам, самые сильные из них — уксусная и муравьиная кислоты. Взаимодействуют с металлами, оксидами и щелочами с образованием солей. Вступают в реакции с солями, образованными более слабой кислотой; с галогенами. Реакции со спиртами позволяют получать сложные эфиры, имеющие большое практическое значение. Также большое значение имеют реакции с литийорганическими соединениями, в результате которых получают кетоны.
Карбоновые кислоты — это органические соединения, 
КАРБОНОВЫЕ КИСЛОТЫ
КАРБОНОВЫЕ КИСЛОТЫ – органические соединения, содержащие одну или несколько карбоксильных групп –СООН. Название происходит от лат. carbo – уголь и греч. oxys – кислый. По числу этих групп различают моно-, ди, три- и тетракарбоновые кислоты (большее число групп –СООН в одной молекуле встречается редко). Карбоновые кислоты могут быть алифатическими – с нормальной и разветвленной цепью, циклическими и ароматическими, предельными и непредельными, содержать атомы галогенов и различные функциональные группы: ОН (оксикислоты), NH2 (аминокислоты), СО (кетокислоты) и т.д. Многие карбоновые кислоты в свободном состоянии, а также в виде различных производных (солей, эфиров) широко распространены в природе и играют важнейшую роль в жизнедеятельности растений и животных.
Алифатические монокарбоновые кислоты: названия и физические свойства.
Алифатические (от греч. aleiphar – жир) карбоновые кислоты с числом атомов углерода больше 6 называют также жирными кислотами, поскольку в виде сложных эфиров они входят в состав природных жиров и масел. Многие из них имеют тривиальные названия (см. ТРИВИАЛЬНЫЕ НАЗВАНИЯ ВЕЩЕСТВ), эти названия указывают на источник, в котором кислота встречается в заметных количествах или из которого она впервые была выделена. В таблице приведены названия некоторых алифатических монокарбоновых кислот СnH2n+1СООН (или CnH2nO2) от n = 1 до n = 30 (n – число атомов углерода в молекуле кислоты), их температуры плавления и кипения (перегонка кислот с n > 13 при атмосферном давлении сопровождается разложением).
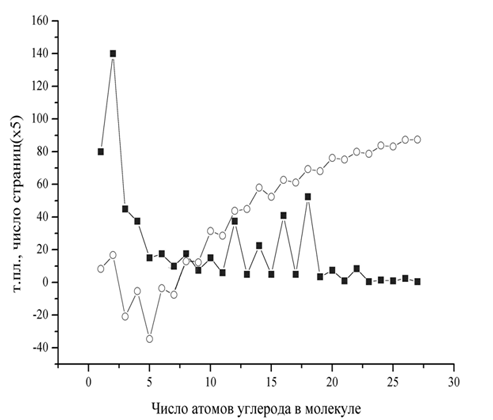
В последнем столбце указано число страниц, отведенных каждой кислоте в 4-м дополнении к самому большому справочнику по органической химии Бейльштейна. Впервые этот справочник написал и издал (на немецком языке) в 1881 петербургский академик Фридрих Конрад (Федор Федорович) Бейльштейн (1838–1906). Первое издание состояло из двух томов, которые включали краткие сведения о всех известных к тому моменту органических соединениях. В последующем этот справочник непрерывно расширялся. Сам Бейльштейн опубликовал три издания. Последнее, 4-е издание было начато в 1918, оно содержит 31 том и продолжается до настоящего времени. Включая дополнения, оно состоит уже из сотен увесистых томов, которые занимают несколько больших книжных шкафов. Конечно, такая работа стала непосильной для одного человека, и еще при жизни Бейльштейна, и с 1990-х сбор всего материала по органическим соединениям, издание справочника и дополнений к нему приняло на себя Немецкое химическое общество, а с 1951 этим занимается специально созданный для этой цели Институт Бейльштейна во Франкфурте-на-Майне.
| № | Название кислоты | Тпл, °С | Ткип, °С | Число страниц |
| 1 | Муравьиная | 8,3 | 100,8 | 16 |
| 2 | Уксусная | 16,8 | 118,1 | 28 |
| 3 | Пропионовая | –20,8 | 141,1 | 9 |
| 4 | Масляная | –5,3 | 163,5 | 7,5 |
| 5 | Валериановая | –34,5 | 185,4 | 3 |
| 6 | Капроновая | –3,4 | 205,4 | 3,5 |
| 7 | Энантовая | –7,5 | 223 | 2 |
| 8 | Каприловая | 16,3 | 239,3 | 3,5 |
| 9 | Пеларгоновая | 12,3 | 254 | 1,5 |
| 10 | Каприновая | 31,2 | 270 | 3 |
| 11 | Ундециловая | 28,6 | 284 | 1,2 |
| 12 | Лауриновая | 43,9 | 299 | 7,5 |
| 13 | Тридециловая | 41,8 | 312 | 1 |
| 14 | Миристиновая | 58 | 4,5 | |
| 15 | Пентадециловая | 52,3 | 1 | |
| 16 | Пальмитиновая | 62,8 | 8,2 | |
| 17 | Маргариновая | 61,2 | 1 | |
| 18 | Стеариновая | 69,4 | 10,5 | |
| 19 | Нонадециловая | 68,2 | 0,7 | |
| 20 | Арахиновая | 76,2 | 1,5 | |
| 21 | Генэйкозановая | 75,2 | 0,2 | |
| 22 | Бегеновая | 80,0 | 1,7 | |
| 23 | Трикозановая | 78,7 | 0,1 | |
| 24 | Лигноцериновая | 83,9 | 0,3 | |
| 25 | Пентакозановая | 83,2 | 0,2 | |
| 26 | Церотиновая | 87,4 | 0,5 | |
| 27 | Гептакозановая | 87,5 | 0,1 |
Рассматривая таблицу, можно видеть характерные особенности, которые могут, на первый взгляд, показаться странными и удивительными. Во-первых, в первой десятке все кислоты имеют тривиальные названия, тогда как далее они есть только у «четных» кислот, то есть кислот с четным числом атомов углерода в молекуле. Единственное исключение – маргариновая кислота. У остальных же нечетных кислот названия образованы от греческих числительных, как и названия соответствующих углеводородов. Например, ундециловая значит просто «одиннадцатая».
Во-вторых, по мере удлинения углеродной (вернее, углеводородной) цепи и соответственного увеличения массы молекулы температура кипения вещества плавно растет: чем тяжелее молекула, тем труднее ей перейти из жидкой фазы в газовую. А вот температура плавления испытывает странные скачки: все нечетные кислоты плавятся при более низкой температуре, чем ближайшие к ним четные. Если нанести эти значения на график, получится своеобразная «пила». Точно так же вели бы себя теплоты испарения и теплоты плавления этих кислот: первые увеличивались бы плавно, вторые – пилообразно. По мере удлинения цепи такое альтернирование температур и теплот плавления постепенно уменьшается и где-то после С25 практически сходит на нет.
Наконец, самое, наверное, необычное из проявлений четно-нечетного эффекта заключено в последнем столбце таблицы. Особенно разительны отличия у средних членов ряда с С11 по С19. И уж совсем удивительно, что колебания в числе страниц, отведенных каждой кислоте в справочнике, соответствует колебаниям в их температурах плавления! Все это наглядно видно на рисунке.
Как же объяснить такую странную согласованность между названием кислоты, температурой ее плавления и вниманием, которое уделяли химики каждой кислоте в своих исследованиях?
Начнем с «человеческого фактора» – названий кислот и числа страниц в справочнике. Объяснение здесь простое. Первые члены ряда монокарбоновых кислот известны давно и их названия чаще всего указывают на природный источник, из которого они впервые были выделены. Уксусная кислота, например, была известна (в виде водного раствора) уже в античные времена; она получалась при скисании виноградного вина, и само ее название происходит от греческого слова «oxys», что означает «кислый». Так что для древнего грека наше название «уксусная кислота» показалось бы весьма странным: фактически это означает «кислая кислота». Уксусное брожение спиртовых жидкостей (СН3СН2ОН + О2 ® СН3СООН + Н2О) катализируется ферментом алкогольоксидазой и происходит при размножении особого микроорганизма – «уксусного грибка» (Micoderma aceti), который попадает в раствор из воздуха.
Муравьиная кислота стала известна в 17 в., когда ее обнаружили в едких выделениях рыжих муравьев. Большинство других кислот, имеющих свои «собственные» исторически сложившиеся названия, были получены главным образом в 19 в. и названы по природному источнику, в котором они содержатся в значительных количествах или были впервые обнаружены. Например, масляная кислота есть в маслах, в том числе и в обычном сливочном масле – только не в свободном состоянии, а в виде сложного эфира с глицерином. Свободная масляная кислота, как и все карбоновые кислоты с небольшим числом атомов углерода, обладает резким запахом, когда масло портится (прогоркает), масляная и другие кислоты выделяются в свободном состоянии и придают ему неприятный запах и вкус.
В названиях рассмотренных трех кислот используются русские корни. Для производных этих кислот (солей, сложных эфиров и др.) принято использовать латинские корни: формиат – для муравьиной кислоты (лат. formica – муравей), ацетат – для уксусной (лат. acetum – уксус), бутират – для масляной (греч. butyron – масло); эти названия, в том числе и для самих кислот, приняты и в западноевропейских языках.
Другие карбоновые кислоты встречаются в природе в составе сложных эфиров с глицерином и другими многоатомными спиртами – в виде жиров, масел, восков и редко – в свободном состоянии.
Валериановая кислота содержится в валериановом корне. В названиях трех последующих четных кислот (капроновая, каприловая и каприновая) есть общий корень (Capra на латыни – коза), эти кислоты, действительно, содержатся в жире козьего молока (как, впрочем, и коровьего), а в свободном состоянии «пахнут козлом». Содержание этих кислот в молочных жирах не очень велико – от 7 до 14% от суммы всех жирных кислот.
Пеларгоновая кислота содержится в летучем масле пеларгонии розовой и других растений семейства гераниевых. Лауриновая кислота (в старых книгах ее называли лавровой) содержится в больших количествах в лавровом масле (до 45%). Миристиновая кислота преобладает в масле растений семейства миристиковых, например в ароматных семенах мускатного дерева – мускатном орехе. Пальмитиновую кислоту легко выделить из пальмового масла, выжимаемого из ядер кокосового ореха (копры). Это масло почти целиком состоит из глицерида пальмитиновой кислоты. Название стеариновой кислоты происходит от греч. stear – жир, сало. Вместе с пальмитиновой она относится к наиболее важным жирным кислотам и составляет главную часть большинства растительных и животных жиров. Из смеси этих кислот (стеарина) раньше изготовляли свечи.
Арахиновая кислота встречается в масле земляного ореха – арахиса. По масштабам производства оно занимает одно из первых мест среди всех пищевых масел, но собственно арахиновой кислоты в нем мало – всего несколько процентов. Бегеновая кислота содержится в бегеновом масле, которое выжимают из крупных, как орех, семян распространенного в Индонезии растения семейства моринговых. Практически чистую лигноцериновую кислоту (в ее названии легко усмотреть латинские lignum – дерево, древесина и cera – воск) извлекают из смолы букового дерева. Раньше эту кислоту называли также карнаубовой, потому что ее довольно много в карнаубском воске, которыми покрыты листья бразильской восковой пальмы.
Жирные кислоты в составе масел и жиров добываются человеком в огромных количествах, измеряемых ежегодно миллионами тонн. Так что у химиков никогда не было недостатка в природных жирных кислотах для их исследования.
Кислоты с n > 25 встречаются в основном уже в восках, например церотиновая C26H52O2, монтановая C28H56O2, мелиссиновая C30H60O2, лацериновая C32H64O2. В их названиях тоже можно усмотреть природный источник. Так, монтановая кислота содержатся в горном воске (монтан-воске); название происходит от лат. montana – гористые места, горные области. Melissa по-гречески – пчела, мед; мелиссиновая кислота была найдена в воске. В греческой мифологии имя Мелиссы (Мелитты) носят три персонажа, и все связаны с медом и пчелами. Первая Мелисса – дочь критского царя Мелиссея, сестра Амалфеи, которая вскормила младенца Зевса медом. Вторая – нимфа-прародительница пчел. Третья – жрица Деметры, в останках которой после смерти завелись пчелы.
Есть тривиальные названия и у некоторых карбоновых кислот с разветвленной цепью. Примером может служить фтионовая (от греч. phthisis – чахотка) кислота С16Н32О2 (систематическое название – 3,13,19-триметилтрикозановая); она содержится, как и туберкулостеариновая, в оболочке туберкулезной палочки.
Как видно, все представленные в таблице природные высшие жирные кислоты с n > 10 имеют четное число атомов углерода в молекуле. Преобладающее распространение именно таких кислот объясняется особенностями их биосинтеза в организме. Это сложный процесс, идущий в печени, стенке кишечника, легочной ткани, костном мозге и управляемый различными ферментами. Синтез начинается с производного уксусной кислоты – ацетилкофермента А (кофермент – сложное органическое соединение, составная часть в основном белковой молекулы фермента), который обозначают как ацетил-КоА или СН3СО–SКоА, поскольку ацетильная группа СН3СО непосредственно связана с атомом серы. Этот кофермент – один из самых распространенных участников обменных процессов в организме. В клетках две молекулы ацетил-КоА реагируют с образованием ацетоацетил-КоА: 2СН3СО–SКоА ® СН3СОСН2СО–SКоА + Н–SКоА. Затем ферменты восстанавливают это соединение до производного масляной кислоты – бутирил-КоА с четырьмя атомами углерода СН3СН2СН2СО–SКоА, который снова реагирует с ацетил-КоА. В результате многократного повторения этого процесса к растущей цепи каждый раз присоединяется по два углеродных атома. В результате образуются только цепи с четным числом атомов углерода и, как правило, неразветвленные. Когда длина цепи достигнет «нужной» величины, кофермент от цепочки отщепляется; чаще всего это случается, когда n = 16 или 18. Но если случится так, что в первом фрагменте будет нечетное число атомов углерода, начнут синтезироваться исключительно нечетные кислоты. Значит, ферментную систему клетки можно обмануть, «подсунув» ей нечетный первый фрагмент. Именно так был поставлен эксперимент с мышами, которым вводили внутривенно или добавляли в пищу пропионовую кислоту или ее производные; синтез при этом начинался не с ацетил-, а с пропионил-КоА (пропионил содержит три атома углерода). Этот кофермент в небольшом количестве синтезируется в организмах и из него получаются нечетные жирные кислоты.
Теперь понятна «несправедливость» справочника к нечетным кислотам: такие кислоты (с числом углеродных атомов более 10) химики в природе не находили, их приходилось синтезировать в небольших количествах в лабораториях, и называли их просто по названию соответствующего углеводорода. В течение долгого времени эти кислоты не представляли большого интереса; в соответствии с важностью четных и нечетных кислот для живых организмов им посвящено неодинаковое число исследований: свойства четных кислот (особенно миристиновой, пальмитиновой и стеариновой – самых распространенных природных жирных кислот), изучены значительно лучше, чем нечетных, и это нашло отражение в химической литературе.
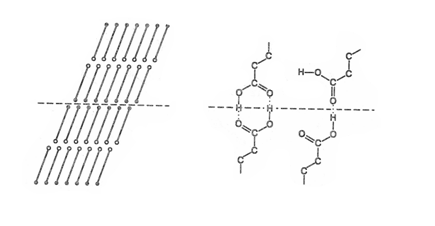
Объяснение альтернирующему изменению физических свойств, в частности температур и теплот плавления, было дано сравнительно недавно, после того как получили развитие физические методы исследования, и в первую очередь рентгеноструктурный анализ. Температура и теплота плавления химического соединения зависят от того, как упакованы молекулы этого соединения в твердом кристаллическом состоянии. Чем прочнее эта упаковка, тем больше энергии надо затратить, чтобы «расшатать» кристалл, отделить молекулы друг от друга и получить таким образом из кристалла жидкость. Прочность упаковки молекул в кристалле зависит как от химического состава вещества, так и от геометрической формы молекул. Например, молекулы бензола С6Н6 – симметричные шестиугольники, которые легко «упаковываются» в кристаллы, поэтому затвердевает бензол при сравнительно высокой температуре (+5,5° C). А ближайший родственник бензола, толуол С6Н5–СН3, уже далеко не такой симметричный: «довесок» к кольцу в виде метильной группы СН3 очень мешает молекулам плотно упаковываться при кристаллизации. Поэтому толуол затвердевает лишь при –95° С – на 100 градусов ниже, чем бензол.
В молекуле жирной кислоты есть цепочка из метиленовых групп СН2, которая на одном конце заканчивается метильной группой –СН3, а на другом – карбоксильной группой –СООН. В кристалле эти цепи образуют параллельные цепочки, при этом две соседние карбоксильные группы притягиваются друг к другу за счет водородных связей гораздо сильнее, чем две метильные или метиленовые группы соседних молекул. В результате межмолекулярных взаимодействий молекулы карбоновых кислот образуют в кристаллах парные слои, в которых карбоксильные группы направлены навстречу друг другу. Углеводородные же цепи располагаются наклонно относительно плоскости, разделяющей два соседних слоя, как показано на рисунке. При этом угол наклона цепей зависит от четности молекулы, т.е. от того, «смотрят» ли концевые группы СН3 и СООН в одну или в разные стороны относительно оси молекулы (от этого зависит «удобство» упаковки цепей). Разный угол наклона цепей приводит к разной энергии взаимодействия между слоями четных и нечетных кислот. Объясняется это тем, что в зависимости от этого угла между карбоксильными группами возможно образование одной или двух водородных связей, как это показано на рисунке. Лишняя водородная связь, да еще умноженная на огромное число молекул в слое, существенно упрочняет кристаллическую решетку.
Когда цепи становятся достаточно длинными, взаимное притяжение двух соседних цепочек друг к другу становится преобладающим (по сравнению с притяжением двух соседних карбоксильных групп); в результате прочность кристаллической решетки практически перестает зависеть от «четности» молекулы и определяется только ее длиной, что и подтверждается экспериментально.
«Приключения» маргариновой кислоты.
В приведенной таблице есть единственное исключение из общего «четно-нечетного» правила для жирных кислот с n > 10. Это исключение – маргариновая кислота (С17). Название это происходит от греческого слова margaron – жемчуг и придумал его в начале 19 в. французский химик Мишель Эжен Шеврёль (см. ЖИРЫ И МАСЛА). В первые годы своей работы над жирами Шеврёль выделил из свиного сала кислоту, которую он назвал маргариновой (капельки вещества блестели, как жемчуг). К тому времени он уже успел стать известным ученым, профессором. Его авторитет в данной области был настолько велик, что в течение долгого времени не позволял сомневаться в полученных им результатах. Однако в 1857 немецкий химик В.Хайнц сообщил, что ему не удалось обнаружить в сале маргариновую кислоту. Он был уверен, что не ошибся, так как незадолго до этого впервые синтезировал эту кислоту. Сам метод синтеза исключал возможность ошибки, хотя был невероятно трудоемким. Суть этого метода (разработанного в 1847 молодым английским химиком Эдуардом Франклендом, который работал тогда под руководством видного немецкого химика-органика Германа Кольбе) заключается в постепенном наращивании углеродной цепочки путем проведения пятистадийного синтеза, в котором ключевой является реакция R–I + KCN ® R–CN + KI, где R – углеводородный радикал. Повторив весь цикл превращений 15 раз и аккуратно, чтобы не сбиться, записывая номер стадии (а также изведя массу цианистого калия), Хайнц из этанола (С2) получил кислоту С17. Через два года ее же синтезировал другой немецкий химик Ф.Крафт с помощью значительно более простой методики: он просто сумел укоротить углеродную цепочку в стеариновой кислоте С18 на одно звено, синтез идет всего в четыре стадии. (По этому поводу Крафт ехидно заметил, что его коллега успешно справился с задачей скорее благодаря своему упорству, чем достоинству примененного им метода синтеза.)
Как бы то ни было, синтетическая маргариновая кислота отличалась от природной, выделенной из жира. Выяснилось, что Шеврёль принял за маргариновую кислоту трудно разделяемую смесь равных количеств пальмитиновой C16 и стеариновой C18 кислот, а по результатам химического анализа этой смеси как раз получается формула С17Н34О2. Ошибались химики и с другими кислотами. Например, обнаруженная в дельфиньем жире «фоценовая кислота» (от греч. phokaina – один из видов дельфинов) C5H10O2 оказалась на самом деле смесью двух кислот – масляной C4 и капроновой C6. В основном томе справочника Бейльштейна (литература до 1909) для монтановой кислоты приведена формула С29Н58О2, а в 1-м дополнении (литература за 1910–1919) – правильная формула С28Н56О2 с четным числом атомов углерода. Но чаще всего «обманывала» химиков маргариновая кислота, так как именно ее ближайшие четные соседки – пальмитиновая и стеариновая – являются наиболее распространенными в природе высшими жирными кислотами, а их смесь (стеарин) – основной продукт омыления многих растительных и животных жиров.
После работы Шеврёля она в течение 40 лет рассматривалась как одна из распространенных в природе жирных кислот. Затем, благодаря Хайнцу и Крафту, термин «маргариновая кислота» вообще исчез из химической литературы (синтетическую кислоту называли гептадециловой). В конце 19 в. ее как будто все же обнаружили в природном источнике – в масле из семян дурмана обыкновенного (Datura stramonium), повсеместно распространенного и очень ядовитого растения, и назвали датуровой кислотой (это название фигурировало и в справочнике Бейльштейна). В изданной в 1926 книге Дж.Д.Элсдона Пищевые масла и жиры прямо сказано, что C17H34O2 – единственная кислота с нечетным числом атомов углерода, присутствие которой в природных источниках было доказано с определенностью.
Но и это утверждение оказалось ошибочным: тщательное исследование показало, что кислоты С17 в семенах дурмана нет! Так, в изданной в Лондоне в 1948 фундаментальной монографии А.У.Ралстона Жирные кислоты и их производные объемом около 1000 страниц про маргариновую кислоту написано: «Хотя некоторые аргументы в пользу присутствия кислоты С17 в маслах и жирах все еще не опровергнуты, можно без большого риска утверждать, что в природе маргариновой кислоты нет». О том же можно прочитать в отечественной монографии С.А.Иванова Химия жиров, изданной еще в довоенные годы: «Жирные кислоты содержат четное число атомов углерода; в естественных жирах нечетное число атомов углерода не найдено. Случаи кислот с нечетным числом атомов углерода были зарегистрированы, но в настоящее время все они признаны неправильными.»
В 1947 группа американских химиков, собрав в парикмахерских 45 кг волос, выделила из них 240 г смеси метиловых эфиров жирных кислот, и среди них оказалось 5 г эфира маргариновой кислоты (и еще 10 г эфиров непредельных кислот С17). В небольшом количестве были выделены и другие нечетные кислоты – C7, C9, C13, C15. Современные высокочувствительные хроматографические методы анализа позволили обнаружить небольшие количества маргариновой кислоты во многих природных источниках. Так, в оливковом, подсолнечном или арахисовом масле ее мало – всего 0,2% от суммы всех жирных кислот, а вот в горчичном масле уже в 10 раз больше – до 2,1%. Примерно столько же ее в говяжьем жире. В сливочном масле маргариновой кислоты чуть больше 1%. По-видимому, маргариновая кислота довольно широко распространена в природе – небольшие ее количества нашли в жире питонов и песцов, в семенах помидоров и апельсинов, в речных водорослях. По иронии природы оказалось, что в «датуровом масле», выделенном из семян дурмана, этой кислоты нет совсем.
Сейчас число известных природных жирных кислот исчисляется многими сотнями, правда, большинство их (в том числе и нечетных) содержится лишь в очень малых количествах. Очевидно, что биосинтез жирных кислот иногда может начинаться не с ацетил-КоА, а с пропионил-КоА – как у подопытных мышей. Нужны ли такие кислоты организму, или это вредный (а может быть, нейтральный) побочный продукт его жизнедеятельности? Однозначный ответ на этот вопрос пока еще не найден.
Ненасыщенные монокарбоновые кислоты.
Простейшая непредельная кислота, акриловая СН2=СНСООН, имеет острый запах (на латыни acris – острый, едкий). Акрилаты (эфиры акриловой кислоты) используются для получения органического стекла, а ее нитрил (акрилонитрил) – для изготовления синтетических волокон.
В природных источниках в виде сложных эфиров содержится множество непредельных кислот. Высшие непредельные кислоты, как правило, содержат четное число атомов углерода и названы по природным источникам. Называя вновь выделенные кислоты, химики нередко дают волю фантазии. Так, название ближайшего гомолога акриловой кислоты, кротоновой СН3–СН=СН–СООН, происходит вовсе не от крота, а от растения Croton tiglium, из масла которого она была выделена. Очень важен синтетический изомер кротоновой кислоты – метакриловая кислота СН2=С(СН3)–СООН, из эфира которой (метилметакрилата), как и из метилакрилата, делают прозрачную пластмассу – оргстекло. Когда были открыты две изомерные кислоты, имеющие строение СН3–СН=С(СН3)–СООН, их назвали ангеликовой и тиглиновой. Ангеликовая кислота была выделена из ангеликового масла, полученного из ангеликового (дягильного) корня растения Angelica officinalis. А тиглиновая – из того же масла Croton tiglium, что и кротоновая кислота, только названа по второй части этого ботанического термина. Другой способ придумать новое название – переставить буквы в уже известном (такой пример будет приведен ниже).
Сорбиновая (2,4-гексадиеновая) кислота СН3–СН=СН–СН=СНСООН была получена из ягод рябины (на латыни – sorbus). Эта кислота – прекрасный консервант, поэтому ягоды рябины не плесневеют. Названия цитронелловой (СН3)2С=СН–(СН2)2–СН(СН3)–СН2–СООН и гераниевой (СН3)2С=СН–(СН2)2–С(СН3)=СН–СООН кислот не требуют пояснений, чего нельзя сказать об изомерных непредельных кислотах состава С21Н41СООН – брассидиновой и эруковой. Эруковая кислота была выделена из масла растения Eruca – того же семейства Brassica, что и капуста, а также из масла репы (Brassica napus). При длительном нагревании с сернистой кислотой эруковая кислота изомеризуется в брассидиновую; интересно, что статья, в которой описана эта реакция, была подписана М.М.Зайцевым, К.М.Зайцевым, и А.М.Зайцевым (последний, Александр Михайлович, широко известен как автор «правила Зайцева»).
Таририновая кислота с ацетиленовой связью СН3–(СН2)10–С є С–(СН2)4–СООН была выделена из горького экстракта коры американского тропического дерева рода Tariri antidesma. Это крайне редкий случай нахождения в природе соединения с тройной связью.
Высокомолекулярные непредельные кислоты часто упоминаются диетологами (они называют их ненасыщенными). Самая распространенная из них – олеиновая СН3–(СН2)7–СН=СН–(СН2)7–СООН (С18Н34О2). Изомерна ей кислота элаидиновая. Особенно важны полиненасыщенные кислоты с несколькими двойными связями: линолевая СН3–(СН2)4–(СН=СН–СН2)2–(СН2)6–СООН (С18Н32О2) с двумя двойными связями, линоленовая СН3–СН2–(СН=СН–СН2)3–(СН2)6–СООН (С18Н30О2) с тремя двойными связями и арахидоновая СН3–(СН2)4–(СН=СН–СН2)4–(СН2)2–СООН (С20Н32О2) с четырьмя двойными связями; их часто называют незаменимыми жирными кислотами. Именно эти кислоты обладают наибольшей биологической активностью: они участвуют в переносе и обмене холестерина, синтезе простагландинов и других жизненно важных веществ, поддерживают структуру клеточных мембран, необходимы для работы зрительного аппарата и нервной системы, влияют на иммунитет. Отсутствие в пище этих кислот тормозит рост животных, угнетает их репродуктивную функцию, вызывает различные заболевания. Линолевую и линоленовую кислоты организм человека сам синтезировать не может и должен получать их готовыми с пищей (как витамины). Для синтеза же арахидоновой кислоты в организме необходима линолевая кислота. Природные кислоты представлены в основном цис-изомерами. Некоторое время велась дискуссия о том, опасны ли транс-изомеры, которые ведут себя иначе; как выяснилось, в природных источниках их содержание невелико и не представляет опасности для человека.
Полиненасыщенные жирные кислоты с 18 атомами углерода в виде эфиров глицерина находятся в так называемых высыхающих маслах – льняном, конопляном, маковом и др. В названиях олеиновой, элаидиновой, линолевой, линоленовой кислот легко усмотреть «масло» (греч. elaion, лат. oleum) и «лён» (лат linum); в льняном масле содержится до 30% линолевой и до 60% линоленовой кислот, а название арахидоновой (как и арахиновой) происходит от арахиса.
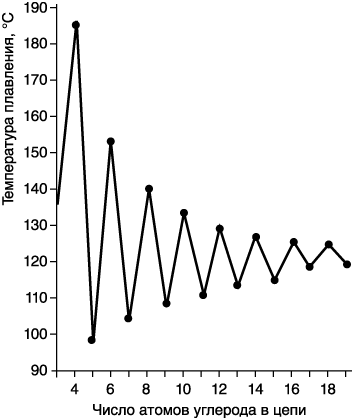
Дикарбоновые (двухосновные) кислоты. Общая формула этих кислот НООС–(СН2)n–СООН. Тривиальные названия имеют только первые члены ряда:
Зависимость температуры плавления от числа атомов углерода в молекулах представляет собой «пилу» с еще более острыми зубцами (см. рисунок). Объяснение такое же, как и для монокарбоновых кислот: разное строение кристаллической решетки для четных и нечетных членов ряда. Для первых семи членов ряда наблюдается также сильное альтернирование величин растворимости кислот в воде. Понятно, что это свойство также связано с кристаллической решеткой: чем она прочнее, тем меньше растворимость.
Простейшая двухосновная щавелевая кислота содержит две соединенные карбоксильные группы НООС–СООН. Ее соли и эфиры называются оксалатами (от греч. oxys – кислый). Эта кислота известна с 17 в., она содержится (в виде калиевой соли) в щавеле (ее там 0,36%), откуда и получила свое название. Есть она и в других овощах и плодах: в шпинате ее 0,32%, в томатах – 0,06%. Избыток щавелевой кислоты может нарушать обмен веществ в организме, способствуя отложению нерастворимого оксалата кальция. Поэтому врачи рекомендуют ограничить потребление продуктов с повышенным содержанием этой кислоты.
Щавелевая кислота – одна из самых сильных органических кислот: при диссоциации по первой ступени она значительно сильнее уксусной. Она образует хорошо растворимые комплексные соединения со многими металлами, что используют для очистки металлов от ржавчины, для выведения ржавых пятен с тканей, сантехнических изделий и т.д. Например, ржавое пятно на белой ткани, смоченное раствором щавелевой кислоты, исчезает прямо на глазах.
Диэтиловый эфир малоновой кислоты (от лат. malum – яблоко) широко применяется в органических ситезах; химики называют его просто «малоновым эфиром». От этого же корня происходят названия непредельной малеиновой кислоты (цис-НООС–СН=СН–СООН) и производных яблочной кислоты – малатов. Интересно название транс-изомера малеиновой кислоты – фумаровой (от лат. fumus – дым). Эта кислота была обнаружена в растении Fumaria officinalis (дымянка), которое в античные времена сжигали, чтобы дымом отогнать злых духов.
Янтарная кислота была получена еще в 17 в. перегонкой янтаря, ее соли и эфиры назваются сукцинатами (лат. succinum – янтарь). Глутаровая кислота впервые была получена из глутаминовой аминокислоты, а та получила свое название от лат. gluten – клей, поскольку была найдена в клейковине пшеницы. Адипиновая кислота образуется при окислении жиров и получила название от лат. adeps – жир, сало. Эту кислоту синтезируют в промышленных масштабах, так как она является исходным веществом для производства полиамидных волокон (найлон-6,6) и смол. Кстати, название этого полимера происходит от первых букв двух городов – New York, London и числа атомов углерода в остатках адипиновой кислоты и гексаметилендиамина H2N –(CH2)6 –NH2, которые соединены поочередно в полимерную цепь. Название пимелиновой кислоты происходит от греч. pimelos – жир, субериновой (пробковой) кислоты – от лат. suber – пробка, себациновой кислоты – от лат. sebum – сало. Азелаиновая кислота была получена действием азотной кислоты на касторовое масло. Соответственно в ее названии можно найти «азо» и греч. elaion – масло.
Двухосновные кислоты с числом атомов углерода более 10 имеют обычно систематические названия. Но есть и исключения: брассиловая кислота была найдена в масле растений семейства Brassica; тапсиевая – в растении тапсия с греческого острова Тапсос, которое употреблялось в древности как лекарственное; японовая НООС–(СН2)19–СООН – выделена из высушенного сока некоторых акаций и пальм, растущих в Юго-Восточной Азии (раньше это вещество называли «японской землей»).
Карбоновые кислоты с функциональными группами.
Известно множество карбоновых кислот с гидроксильными группами ОН, оксогруппами С=О, аминогруппами NH2 и др. Простейшая гидроксикислота – гликолевая СН2ОН–СООН была впервые получена из этиленгликоля НО–СН2–СН2–ОН (греч. glykis – сладкий). Тот же корень у многих других органических соединений сладкого вкуса или их производных; среди них глицерин, гликоли, глицин (гликокол), глиоксаль, глюконовая и глюкуроновая кислота, глиоксим, глицидол, глюкоза, гликозиды и глюкозиды и т.д. и т.п. Названия многих из этих кислот настолько красноречивы, что их происхождение очевидно; примерами могут служить кислоты молочная СН3–СН(ОН)–СООН, яблочная НООС–СН(ОН)–СН2–СООН, винная НООС–СН(ОН)–СН(ОН)–СООН, лимонная НООС–СН2–СН(ОН)(СООН)–СН2–СООН. Названия же солей и эфиров этих кислот имеют латинское или греческое происхождение. Так, производные молочной кислоты – лактаты (от лат. lactis – молоко), винной – тартраты (от старинного названия винного камня, кремортартара, который в виде кислой калиевой соли винной кислоты оседает из виноградного вина при его хранении), лимонной кислоты – цитраты (лат. citrus – лимонное дерево).
Молочная кислота образуется в процессе молочнокислого брожения сахаров и определяет вкус скисшего молока; она же вызывает боль в переутомленных нетренированных мышцах. Яблочной кислоты много в недозрелой рябине, яблоках, винограде, барбарисе. Оптические изомеры винной кислоты сыграли большую роль в установлении пространственного строения органических соединений. Путем сильного нагревания винной кислоты можно получить пирувиновую (пировиноградную) оксокислоту СН3–СО–СООН, название которой происходит от греч. pyr – огонь и лат. uva – виноград.
Отдельный класс представляют карбоновые кислоты с аминогруппой – аминокислоты, из которых построены все животные и растительные белки.
Ароматические карбоновые кислоты.
В большинстве ароматических кислот содержится по крайней мере одно бензольное кольцо. Многие ароматические карбоновые кислоты имеют тривиальные названия: С6Н5СООН – бензойная кислота, СН3С6Н4СООН – орто-, мета— и пара-толуиловые кислоты, пара-НООС–С6Н4–СООН – терефталевая кислота. Все эти кислоты – кристаллические соединения, слабо растворимые в воде и хорошо – в спирте. Бензойная кислота содержится в некоторых природных смолах, входит в состав многих эфирных масел, найдена в ягодах брусники и клюквы, которые могут долго храниться, так как бензойная кислота – природный консервант. Бензойная кислота применяется также в производстве красителей и лекарственных веществ. В органическом синтезе применяют надбензойную кислоту С6Н5–СО–ООН, содержащую пероксидную группу – О–О– (см. ПЕРОКСИДЫ).
Фталевая кислота (ее орто-изомер) используется для синтеза индикаторов и красителей (фенолфталеин, флуоресцеин), полиэфирных смол, растворителей, сахарина, репеллентов; из последних наиболее известны эфиры фталевой кислоты – диметил-, диэтил- и дибутилфталаты, отпугивающие кровососущих насекомых. Из терефталевой кислоты синтезируют прозрачный термостойкий полимер полиэтилентерефталат. Из него делают бутылки (на них можно видеть надпись PET – англ. polyethylene terephthalate), полиэфирное волокно терилен (другое, более распространенное у нас, название – лавсан является сокращением от «ЛАборатория Высокомолекулярных Соединений Академии Наук»).
Интересна бензолгексакарбоновая (меллитовая) кислота С6(СООН)6, в которой все атомы водорода в бензольном кольце замещены карбоксильными группами. Эту кислоту можно получить из ее алюминиевой соли – минерала меллита Al2[C6(COO)6]·18H2O. Меллитовая кислота образуется и при окислении графита концентрированной азотной кислотой.
При введении в бензойную кислоту в орто-положение гидроксильной группы получается салициловая кислота орто-НО–С6Н4–СООН. При замещении атома водорода в гидроксильной группе на ацетильную СН3–СО– образуется известное лекарственное средство ацетилсалициловая кислота (аспирин). Если же заместить атом водорода в карбоксильной группе салициловой кислоты на фенил С6Н5, образуется другое лекарственное средство – антисептик салол, сложный эфир салициловой кислоты и фенола. Сама салициловая кислота также обладает сильным дезинфицирующим действием.
Замена гидроксильной группы в салициловой кислоте на аминогруппу приводит к антраниловой кислоте орто-H2N–С6Н4–СООН; ее название происходит от греч. anthrax – уголь и nili, что на санскрите означает индиго. Впервые эту кислоту выделили из природного индиго, а сейчас, наоборот, индиго и ряд других красителей синтезируют из антраниловой кислоты. Ее же, в свою очередь, получают из нафталина, который содержится в каменноугольной смоле, отсюда и «антра». Метиловый эфир антраниловой кислоты входит в состав эфирного масла цветков жасмина, он обладает запахом земляники и применяется в парфюмерии. Вот так незначительное изменение в молекуле резко изменяет свойства веществ.
Изомер антраниловой кислоты, парааминобензойная кислота, применяется для синтеза анестезина, новокаина, других анестезирующих веществ. А введение аминогруппы в салициловую кислоту приводит к противотурбекулезному лекарственному средству ПАСК – парааминосалициловой кислоте.
К ароматическим карбоновым кислотам относятся и коричная кислота С6Н5–СН=СН–СООН, миндальная кислота С6Н5–СН(ОН)–СООН, которые были найдены в природных источниках.
Бензойная кислота с тремя соседними группами –ОН (3,4,5-тригидроксибензойная, она же галловая кислота) является одной из наиболее распространенных растительных кислот. Она содержится в значительных количествах в растущих на дубовых листьях чернильных орешках – галлах, есть она также в дубовой коре, листьях чая. В течение многих веков галловую кислоту использовали для получения черных чернил. Для этого выжатый из галлов сок смешивали с железным купоросом и оставляли на воздухе, при этом раствор приобретал глубокий фиолетово-черный цвет. Реакция эта очень чувствительная: с ее помощью можно определить даже небольшие концентрации солей железа в воде, например, минеральной. Еще в 17 в. английский физик и химик Роберт Бойль установил, что «одна крупинка купороса, растворенная в таком количестве воды, которое в шесть тысяч раз превышает ее вес, способна дать с дубильным орешком пурпурную настойку». Добавление к чернилам камеди – густого сока некоторых деревьев, например, вишневого – придавало чернилам красивый блеск. Сейчас производные галловой кислоты применяют в качестве дубильных веществ при выделке кож. Соединение галловой кислоты и глюкозы – танины применяются для протравливания тканей при их крашении, а также как противоожоговое средство.
Интересным примером органической кислоты, не содержащий группы СООН, является 2,3,5-тринитробензойная (пикриновая) кислота. Три нитрогруппы придают гидроксильной группе ОН в феноле сильные кислотные свойства. Пикриновая кислота (от греч. pykros – горький) действительно горькая, но не это свойство сделало ее известной. Сначала, в течение длительного времени после ее открытия в конце 18 в., это вещество использовали в качестве желтого красителя для шерсти, шелка, кожи, волос. Затем пикриновая кислота применялась (часто в сплавах с другими взрывчатыми веществами) для снаряжения гранат, мин, снарядов, авиабомб под названием мелинит, лиддит и др. (см. ВЗРЫВЧАТЫЕ ВЕЩЕСТВА). Сейчас пикриновую кислоту используют в основном для синтеза красителей.
Химические свойства карбоновых кислот.
Наличие карбоксильной группы предполагает ряд общих свойств карбоновых кислот. Это прежде всего кислотность. Карбоновые кислоты, как правило, слабые кислоты. Даже самые сильные из них (винная, щавелевая) сравнимы лишь со слабой неорганической сернистой кислотой. Сила кислоты увеличивается при введении в молекулу акцепторных заместителей, которые понижают электронную плотность на группе –СО– карбоксила и таким образом облегчают отщепление иона Н + от группы –ОН. Так, трифторуксусная кислота CF3COOH почти в 35 тысяч раз сильнее уксусной (оставаясь все же значительно слабее серной кислоты), пикриновая (2,4,6-тринитробензойная) кислота в 3000 раз сильнее бензойной С6Н5СООН.
Для карбоновых кислот типичны обычные реакции неорганических кислот, например, в реакции со щелочами, карбонатами, оксидами образуются соли. Карбоновые кислоты обладают также особыми свойствами. Так, при отщеплении молекул воды они образуют ангидриды, например: 2СН3СООН ® Н2О + (СН3СО)2О (уксусный ангидрид). При действии PCl5 и других хлорирующих агентов образуются хлорангидриды: СН3СООН + PCl5 ® CH3COCl + POCl3 + HCl, при действии PBr3 – бромангидриды. В реакции этерификации (взаимодействие кислоты со спиртом) образуются сложные эфиры: СН3–СО–ОН + С2Н5–ОН ® Н2О + СН3–СО–О–С2Н5 (этилацетат). Чтобы выяснить, какие атомы исходных молекул переходят в молекулы воды в ходе этерификации, в реакцию ввели спирт, меченный нуклидом 18 О. Анализ продуктов на радиоактивность показал, что радиоактивная метка перешла в молекулу эфира. Таким образом было доказано, что молекулы воды в этой реакции образуются из гидроксильной группы ОН кислоты и атома водорода спирта, а не наоборот, что поставило точку в давних спорах. Реакция этерификации обратима; обратная реакция гидролиза сложного эфира называется реакцией омыления (именно таким путем образуются мыла).
При действии аммиака на ангидриды, галогенангидриды, сложные эфиры, а также при нагревании аммониевых солей алифатических карбоновых кислот образуются амиды: CH3COONH4 ® Н2О + CH3CONH2 (ацетамид). При отщеплении от амида второй молекулы воды (например, под действием Р2О5) образуется нитрил кислоты: CH3CONH2 ® H2O + CH3CN (ацетонитрил).
Восстановление карбоновых кислот приводит к альдегидам: СН3СООН + 2Н ® Н2О + СН3СНО (уксусный альдегид), реакция идет в присутствии катализатора. При нагревании кальциевых солей образуются кетоны; так, из ацетата кальция получается ацетон: (СН3СОО)2Са ® (СН3)2СО + СаСО3. Эта реакция – один из примеров декарбоксилирования (отщепления СО2) карбоновых кислот. Другой пример – декарбоксилирование щавелевой кислоты при нагревании с образованием муравьиной кислоты: НООС–СООН ® НСООН + СО2. Реакция декарбоксилирования происходит и при сплавлении солей щелочных металлов алифатических карбоновых кислот с твердыми щелочами: в результате разрыва связи С–С образуется углеводород с меньшим числом атомов углерода в молекуле: CH3COONa + NaOH ® CH4 + Na2CO3. При электролизе же растворов этих солей происходит образование углеводорода с удвоенным числом атомов углерода; механизм заключается в анодном окислении анионов кислоты с последующим их сдваиванием (реакция Кольбе): 2CH3COO – – 2е ® C2H6 + 2CO2.
Особыми свойствами обладает муравьиная кислота, поскольку она содержит альдегидную группу. Поэтому эта кислота обладает свойствами восстановителя, например, дает реакцию серебряного зеркала. А нитрил муравьиной кислоты – не что иное как циноводород H–C є N, или синильная кислота.
Ввиду большого разнообразия карбоновых кислот существуют десятки методов их синтеза. Из современных способов следует отметить окисление углеводородов (часто при высокой температуре и в присутствии катализаторов), гидрокарбонилирование (присоединение Н2О и СО) непредельных соединений, гидролиз животных жиров и растительных масел, брожение углеводов (для уксусной и масляных кислот) и др. Соли щелочных металлов жирных кислот называются мылами; натриевые соли обычно твердые, калиевые – жидкие. Соли тяжелых металлов – отвердители масляных красок (сиккативы).
Fatty Acids. Their Chemistry, Properties, Production and Uses. New York: Interscience, 1960, vol. 1–4
Локтев С.М. Высшие жирые кислоты. М., Наука, 1964
Болотин И.М., Милосердов П.Н., Суржа Е.И.. Синтетические жирные кислоты и продукты на их основе. М., Химия, 1970
Фрейдлин Г.Н. Алифатические дикарбоновые кислоты. М., Химия, 1978
Леенсон И.А. Занимательная химия. М., Дрофа, 1996