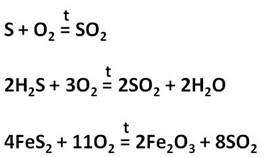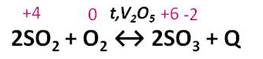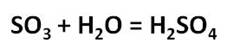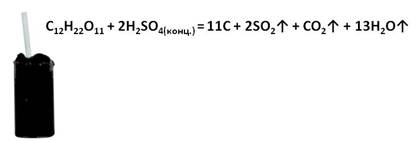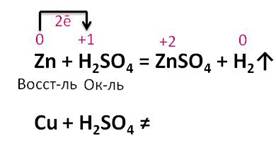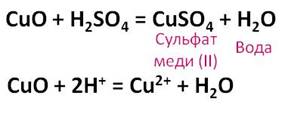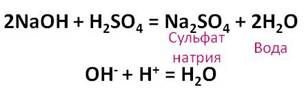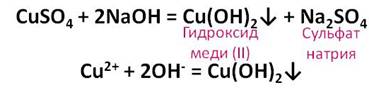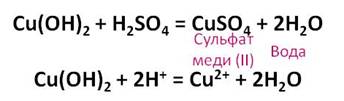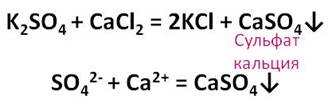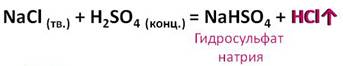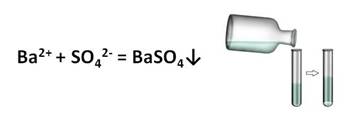в чем разница разбавленной и концентрированной серной кислоты
Серная кислота
Обладает выраженным дегидратационным (водоотнимающим) действием. При попадании на кожу или слизистые оболочки приводит к тяжелым ожогам.
Получение
Известны несколько способов получения серной кислоты. Применяется промышленный (контактный) способ, основанный на сжигании пирита, окислении образовавшегося SO2 до SO3 и последующим взаимодействием с водой.
Нитрозный способ получения основан на взаимодействии сернистого газа с диоксидом азота IV в присутствии воды. Он состоит из нескольких этапов:
В окислительной башне смешивают оксиды азота (II) и (IV) с воздухом:
Смесь газов подается в башни, орошаемые 75-ной% серной кислотой, здесь смесь оксидов азота поглощается с образованием нитрозилсерной кислоты:
В ходе гидролиза нитрозилсерной кислоты получают азотистую кислоту и серную:
В упрощенном виде нитрозный способ можно записать так:
Химические свойства
В водном растворе диссоциирует ступенчато.
С солями реакция идет, если в результате выпадает осадок, образуется газ или слабый электролит (вода). Серная кислота, как и многие другие кислоты, способна растворять осадки.
Подчеркну, что реакции разбавленной серной кислоты с железом и хромом не сопровождаются переходом этих элементов в максимальную степень окисления. Они окисляются до +2.
Cu + H2SO4(разб.) ⇸ (реакция не идет, медь не может вытеснить водород из кислоты)
Холодная концентрированная серная кислота пассивирует Al, Cr, Fe, Ni, Be, Co. При нагревании или амальгамировании данных металлов реакция идет.
Обратите особое внимание, что при реакции железа, хрома с концентрированной серной кислотой достигается степень окисления +3. В подобных реакциях с разбавленной серной кислотой (написаны выше) достигается степень окисления +2.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Серная кислота. Химические свойства разбавленной и
Концентрированной кислоты, техника безопасности при работе.
СЕРНАЯ КИСЛОТА. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА.
Физические свойства: Безводная серная кислота — бесцветная маслянистая жидкость, кристаллизующаяся при 10,5 0 С. С водой смешивается в любых соотношениях. При растворении в воде выделяется большое количество
теплоты. При этом образуются гидраты серной кислоты.
Т.к. растворение Н2SO4 в воде сопровождается выделением большого количества теплоты, необходимо эту операцию проводить с большой осторожностью. Во избежание разбрызгивания разогретого поверхностного слоя раствора следует серную кислоту вливать в воду.
Концентрированная серная кислота энергично поглощает влагу и поэтому применяется для осушки газов.
ХИМИЧЕСКИЕ СВОЙСТВА СЕРНОЙ КИСЛОТЫ.
Она является двухосновной кислотой.
HO O



 |
 |
HO O
Концентрированная серная кислота — энергичныйокислитель:
Например: При взаимодействии с медью и другими малоактивными металлами при нагревании образуется SO2.
Восстановитель окислитель
 |  |
На холоду концентрированная серная кислота (выше 93%) не взаимодей- ствует с такими активными металлами, как алюминий, железо, хром.
Объясняется это явление пассивацией металлов. Такая особенность серной кислоты широко используется для транспортировки последней в железной таре.
2. При кипячении окисляет такие неметаллы, как серу, углерод:
3. Водоотнимающее действие (обугливание).
СВОЙСТВА РАЗБАВЛЕННОЙ СЕРНОЙ КИСЛОТЫ.
1. Изменяет окраску индикатора.
2. Взаимодействует с основными и амфотерными оксидами:
3. С основаниями (реакция нейтрализации):
Выводы :
1.Безводная серная кислота — бесцветная маслянистая жидкость, кристаллизующаяся при 10,5 0 С. С водой смешивается в любых соотношениях.
2.Т.к. растворение Н2SO4 в воде сопровождается выделением большого количества теплоты, необходимо эту операцию проводить с большой осторожностью. Во избежание разбрызгивания разогретого поверхностного слоя раствора следует серную кислоту вливать в воду.
3.Концентрированная серная кислота энергично поглощает влагу и поэтому применяется для осушки газов.
4.Серная кислота является двухосновной кислотой.
5.Концентрированная серная кислота — энергичныйокислитель.
· При кипячении окисляет такие неметаллы, как серу, углерод.
· Водоотнимающее действие (обугливание).
6.СВОЙСТВА РАЗБАВЛЕННОЙ СЕРНОЙ КИСЛОТЫ.
· Изменяет окраску индикатора.
· с основными и амфотерными оксидами.
· С основаниями (реакция нейтрализации).
Сульфаты. Качественная реакция на сульфат- ион
Реактивом на сульфат-ион является хлорид бария.
Хлорид бария BaCl2 осаждает из разбавленных растворов сульфатов белый кристаллический ни в чем нерастворимый осадок сульфата бария:
Техника выполнения: к 2 каплям раствора сульфата натрия Na2SO4 добавляют раствор хлорида бария BaCl2 и наблюдают выпадение осадка.
Выводы :
1.Реактивом на сульфат-ион является хлорид бария.
2.Хлорид бария BaCl2 осаждает из разбавленных растворов сульфатов белый кристаллический ни в чем нерастворимый осадок сульфата бария.
Что делает отдел по эксплуатации и сопровождению ИС? Отвечает за сохранность данных (расписания копирования, копирование и пр.).
ЧТО ТАКОЕ УВЕРЕННОЕ ПОВЕДЕНИЕ В МЕЖЛИЧНОСТНЫХ ОТНОШЕНИЯХ? Исторически существует три основных модели различий, существующих между.
ЧТО ПРОИСХОДИТ, КОГДА МЫ ССОРИМСЯ Не понимая различий, существующих между мужчинами и женщинами, очень легко довести дело до ссоры.
Конфликты в семейной жизни. Как это изменить? Редкий брак и взаимоотношения существуют без конфликтов и напряженности. Через это проходят все.
Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
Серная кислота и её соли
Урок 21. Химия 9 класс ФГОС
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Серная кислота и её соли»
Серная кислота и её соли
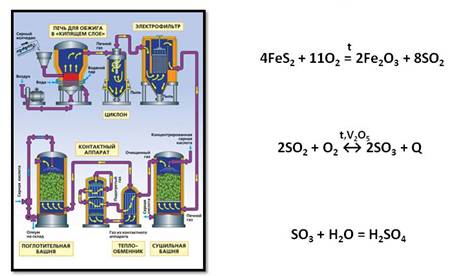
Как получают серную кислоту? Получают серную кислоту в три стадии.
В качестве сырья для получения серной кислоты применяют серу, сероводород или пирит. При обжиге этих соединений образуется сернистый газ.
Затем проводят реакцию окисления оксида серы (IV) до оксида серы (VI). Эта реакция протекает при высокой температуре и в присутствии катализатора – оксида ванадия (V).
Оксид серы (VI) представляет собой летучую бесцветную жидкость с удушливым запахом. Этот оксид при растворении в воде образует серную кислоту.
Однако, при получении серной кислоты оксид серы (VI) растворяют не в воде, а в концентрированной серной кислоте, при этом получается олеум – раствор оксида серы (VI) в безводной серной кислоте.
Поэтому производство серной кислоты идёт в три стадии: на первой стадии из исходного сырья получают оксид серы (IV), на второй стадии из оксида серы (IV) получают оксид серы (VI), а на третьей стадии из оксида серы (VI) получают серную кислоту.
Производство серной кислоты создаёт ряд проблем: выбросы от производств оказывают негативное воздействие на животный и растительный мир, повышается коррозионная стойкость материалов, разрушаются сооружения из мрамора и известняка, а также происходит закисление почв.
Серная кислота – H2SO4 – бесцветная маслянистая и тяжёлая жидкость. Она обладает сильными гигроскопическими, то есть водоотнимающими свойствами, это позволяет использовать её для осушения газов или других веществ.
Концентрированная серная кислота способна отнимать воду у молекул органических веществ, обугливая их. Например, при добавлении к сахару концентрированной серной кислоты сахар чернеет и в виде объёмной массы поднимается вверх.
Помните, при разбавлении концентрированной серной кислоты нельзя приливать воду к кислоте, а следует тоненькой струйкой приливать кислоту в воду, чтобы избежать сильного разогревания раствора.
Химические свойства разбавленной и концентрированной серной кислоты отличаются.
Так разбавленная серная кислота проявляет все характерные свойства кислот. Она изменяет окраску индикаторов: лакмус в растворе кислоты красный, метиловый оранжевый тоже.
Серная кислота вступает во взаимодействие с металлами, стоящими в ряду напряжений металлов до водорода.
Нальём в две пробирки раствора серной кислоты, в первую пробирку поместим гранулу цинка, а во вторую – кусочек меди. Выделение водорода идёт только в первой пробирке, во второй пробирке изменений нет
Цинк, в отличие от меди, стоит в ряду напряжений металлов до водорода, поэтому он вытеснил водород из раствора кислоты. При чем, это окислительно-восстановительная реакция, цинк повышает свою степень окисления с 0 до +2, а водород понижает с +1 до 0. Каждый атом цинка отдаёт по 2 электрона ионам водорода. Поэтому цинк – восстановитель, а водород – окислитель.
Разбавленная серная кислота реагирует с основными и амфотэрными оксидами с образованием соли и воды. Если поместить в пробирку немного чёрного порошка оксида меди (II) и прилить немного раствора серной кислоты, а затем содержимое нагреть на пламени спиртовки, то постепенно чёрный порошок оксида меди (II) начинает растворяться, а раствор меняет свою окраску на голубую.
В результате данной реакции образуется соль – сульфат меди (II) и вода.
Разбавленная серная кислота вступает во взаимодействие с основаниями. Например, к раствору щёлочи добавим несколько капель фенолфталеина, раствор приобретает малиновую окраску. К этому раствору прильём разбавленную серную кислоту до исчезновения окраски. Таким образом, между щёлочью и кислотой прошла реакция нейтрализации, при этом образовалась соль – сульфат натрия и вода.
Разбавленная серная кислота реагирует не только с растворимыми основаниями – щелочами, но и с нерастворимыми. Получим нерастворимое основание – гидроксид меди (II). Для этого, в раствор медного купороса прильём щёлочи – гидроксид натрия, в результате чего образуется гидроксид меди (II) и соль – сульфат натрия.
Теперь, к этому осадку добавим раствор серной кислоты до его исчезновения. В результате данной реакции образуется соль – сульфат меди (II) и вода.
Кроме этого, разбавленная серная кислота реагирует с солями. Прильём к раствору сульфата калия раствор хлорида кальция. В результате образуется малорастворимое вещество белого цвета. Это сульфат кальция.
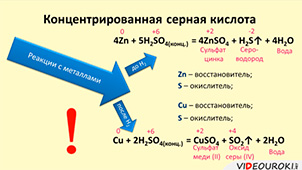
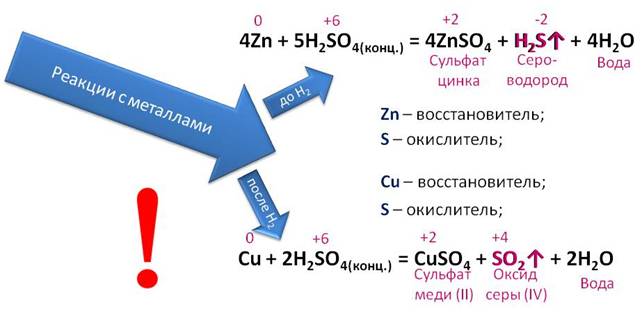
Концентрированная серная кислота также реагирует с металлами. Если металл стоит в ряду напряжений до водорода, то в результате реакции образуется газ сероводород и вода.
В реакции с металлами, стоящими после водорода образуется оксид серы (IV). Например, при взаимодействии меди с концентрированной серной кислотой, образуется соль – сульфат меди (II), оксид серы (IV) и вода. В этой реакции медь повышает свою степень окисления с 0 до +2, а сера понижает с +6 до +4. Поэтому медь восстановитель, а сера – окислитель.
Обратите внимание, что в данных реакциях водород не выделяется, потому что здесь окислителем выступает не водород, а сера.
Железо и алюминий пассивируются концентрированной серной кислотой, потому что покрываются защитной плёнкой, что позволяет перевозить её в стальных и алюминиевых цистернах.
Концентрированная серная кислота вытесняет кислоты из их солей. Например, если к твёрдому хлориду натрия добавить концентрированной серной кислоты, то образуется соль – гидросульфат натрия и хлороводород.
Серная кислота – это двухосновная кислота, поэтому она образует средние и кислые соли. Соли серной кислоты – сульфаты. Например, Na2SO4 – сульфат натрия, NaHSO4 – гидросульфат натрия.
Качественной реакцией на серную кислоту и её соли является ион бария. В результате взаимодействия сульфат-иона и иона бария образуется сульфат бария – осадок белого цвета.
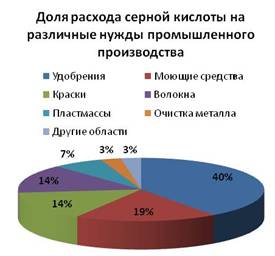
Серная кислота находит широкое применение. Она используется при производстве взрывчатых веществ, минеральных удобрений, электролитической меди, моющих средств, эмалей и красок, искусственного шёлка, лекарств, пластмасс, при очистке нефтепрдуктов, в качестве электролита в аккумуляторах.
Среди солей серной кислоты наиболее распространена глауберова соль – Na2SO4 ∙ 10H2O, гипс – CaSO4 ∙ 2H2O, BaSO4 – сульфат бария и CuSO4 ∙ 5H2O – медный купорос, который используют для борьбы с вредителями и болезнями растений.
Таким образом, серную кислоту получают в три стадии, она представляет собой тяжёлую маслянистую жидкость. При разбавлени концентрированной кислоты следует кислоту приливать к воде, а не наоборот. Свойства разбавленной и концентрированной кислот различаются. Разбавленная серняа кислота реагирует с металлами до водорода, основными и амфотэрными оксидами, с основаниями и солями, а концентрированная серная кислота взаимодействует с металлами и до водорода и после водорода (кроме золота и платины), она пассивирует железо и алюминий, а также реагирует с солями. Серная кислота и её соединения находят широкое применение в промышленности.
Серная кислота — Все что необходимо знать
Вещество серная кислота – токсичный и смертельно опасный реагент. Но без него современное человечество обойтись не может. используют при производстве лекарственных препаратов, химической продукции, металлургии, удобрений, нефтепродуктов. Вещество не имеет особого запаха, бесцветно, вязкой консистенции, но имеет привкус меди. Отлично взаимодействует с водой в любых пропорциях. Из-за хорошего взаимодействия с другими веществами и водой имеет неофициальное название «кровь химии».
Где применяется серная кислота
За год во всем мире используют более 200 миллионов тонн вещества. В основном оно уходит на производство удобрений и химической продукции:
Разбавленная серная кислота – 7 типов солей
Серная кислота используется в концентрированном виде и в виде растворов точнее солей. Смеси различных химических веществ:
Еще разбавленная серная кислота используется при производстве аккумуляторов в виде дистиллята. Так же такой вид раствора как Олеум. Он чаще всего необходим для транспортировки, так как не воздействует со сталью в отличие от концентрированной серной кислоты.
История. Кто начал использовать раствор серной кислоты
Всем, кто имеет дачный участок или дом в деревне известен медный купорос. Изучением и производством растворов с содержанием серной кислоты активно начали заниматься в 13 веке. Химики того времени придумали нагревать алюмокалиевые квасцы. В 15 веке химики продвинулись и придумали «купоросное масло». В 16 веке Иоганн Глаубер придумал другой способ добычи вещества. С помощью горения нитрата калия серы в присутствии водных паров, он получил Серную кислоту. Уже в это время Серную кислоту использовали химики, фармацевты и ювелиры.
В дальнейшем в Англии ученый Джон Робак решил удешевить производство и заменил стеклянные резервуары на освинцованные. Этим способом он получал 65% раствор вещества Н2SO4.
Современный метод добычи открыли в 19 веке. Он получил название «Нитрозный». К концу 19 века в Европе выпускали за год 1 миллион тонн серной кислоты.
В России первые фабрики по производству открылись в Москве в 1805 году.
Как производят серную кислоту в наше время
На сегодняшний день используют два метода Контактный и Нитрозный.
Контактный метод используется по всему миру. Его распространённость обусловлена следующими преимуществами:
При Контактном методе используют следующие виды сырья:
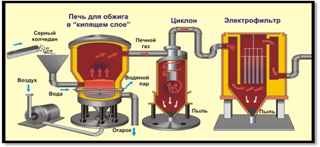
Пирит измельчают для ускорения прохождения химической реакции. Далее измельченные пирит смешивают с водой. Это позволяет удалить не нужные примеси, они остаются на поверхности. Далее под воздействием высокой температуры (800 °C) вода испаряется не нужные взвеси сгорают. Далее Добавляют катализатор и уменьшают температуру (420-550 °C) Происходит процесс окисления и диоксид серы превращается в ангидрид серной кислоты. Далее в поглотительной башне ангидрит отделяется и появляется чистая серная кислота. В процессе производства вырабатывается огромное количество тепла, которое используют как вспомогательный источник энергии. При использовании данного метода получения Н2SO4 почти нет отходов.
Нитрозный метод представлен в двух вариантах камерный и башенный. При его использовании получится 75% серная кислота. В составе остается железо оксид азота, и иных примесей. Данный способ вреден для экологии, но до сих пор достаточно часто применяется, так как он проще и дешевле Контактного метода.
Основные производители серной кислоты в России
В России ежегодно производят около 10 миллионов тонн серной кислоты. Заводы представляют собой комплекс различных производств и поэтому в основном самостоятельно перерабатывают почти все полученное вещество. В основном это производители удобрений, но так же выпускают следующие виды серной кислоты:
Основные крупнейшие производители серной кислоты в России:
Не маловажную роль играют поставщики вещества пирит. В России их добывают на двух горно-обогатительных комбинатах Талнахский и Норильский.
Транспортировка вещества серная кислота
Серная кислота вещество повышенной опасности и требует определенных мер при транспортировке. Вещество взрывоопасно и имеет 8 класс опасности в перевозке грузов. В случае ошибки водителя и аварии велика вероятность разлива серной кислоты и нанесения вреда экологии.
Поэтому для перевозки опасных грузов требуются особе правила. Подпирается специальная устойчивая емкость для перевозки. Цистерны или специальные бочки и ёмкости, которые изготовлены из определённых сплавов, на которые не оказывает воздействие кислоты и яды.
Транспорт обязательно должен иметь соответствующую маркировку предупреждающую других водителей об опасном грузе. Водитель проходит специальное обучение и получает свидетельство АДР. Для каждой транспортировки разрабатывается специальный маршрут следования, которые исключает места большого количества людей и крупные производственные объекты. Чтобы избежать экологической катастрофы в случае ДТП и воздействия опасных химических веществ на людей.
В чем опасность серной кислоты для человека
Н2SO4 очень токсичное вещество. Легко растворяется в воде и вступает в контакт с другими химическими веществами. В чистом виде сильно поглощает влагу и может распространиться в газообразной форме, в случае аварии на производстве или при транспортировке. Серная кислота в большой концентрации взрывоопасна.
В случае если на человека попадут капли вещества на кожу либо он вдохнет пары или что еще хуже каким-то образом выпьет даже несколько капель последствия могут очень плачевными. Серная кислота очень агрессивна плюс в её состав входит мышьяк, который усиливает отравление организма человека. Но существует безвредная доза серной кислоты, содержащаяся в воздухе, 0.3мг на 1 кв. метр. При воздействии серной кислоты на человека часто возникает трахеит, бронхит, ларингит. Если кислота попала на кожный покров, то кожа разъедается, и рана очень долго заживает. При этом если не обратиться за профессиональной медицинской помощью место ожога может разрастись и привести к летальному исходу пострадавшего. Какие признаки отравления серной кислотой бывают:
Последний пункт очень опасный симптом. Человек в этом случае очень близок к удушью и летальному исходу.
Варианты первой помощи при отравлении серной кислотой
Если вы находитесь в зоне, где в воздухе скапливается серная кислота, необходимо немедленно выйти на чистый воздух. Далее обратиться к мед. работникам, вызвать скорую помощь. В момент ожидание помощи, можно попробовать облегчить свое состояние после отравления серной кислотой. Если раствор вещества попал внутрь, то нужно сделать промывание желудка большим количеством теплой воды. Если Н2SO4 попало на слизистую, то необходимо сразу промыть ее чистой водой в большом количестве. Дальнейшую помощь и последующее лечение окажут профессиональные сотрудники мед. учреждений. Самолечение невозможно, так как это может привести к ухудшению состояния человека и к летальному исходу.
Ликвидация разлива серной кислоты
В случае аварии на производстве либо в момент транспортировки может произойти возгорание или разлив серной кислоты. Устранение аварии производят в специальных костюмах химической защиты, например, изолирующие костюмы Стрелец. Газоспасатели в костюмах химзащиты эвакуируют пострадавших в безопасную зону. Устраняют течь и с помощью большого количества воды гасят серную кислоту. В дальнейшем собирают жидкость в специальные емкости и утилизируют. Газоспасателям оказывают помощь пожарные, им так же приходится работать в костюмах химзащиты.