в чем разница между газом и паром
Разница между паром и газом
Вещества в газообразном состоянии широко распространены в природе. Они образуют атмосферу Земли, содержатся в воде океанов, морей и рек в значительных количествах. Газы могут существовать самостоятельно, а могут получаться в результате процессов парообразования.
Определение
Пар представляет газообразное состояние вещества, когда газовая фаза находится в равновесии с жидкой фазой того же вещества.
Газ представляет собой хаотически движущиеся по всем направлениям молекулы, это агрегатное состояние вещества.
Сравнение
Пар получается в результате процесса испарения с поверхности жидкости. Этот процесс называют парообразованием, а обратный процесс, в результате которого пар превращается в жидкость, называют конденсацией. Пар бывает насыщенным или ненасыщенным. Насыщенный пар образовывается в результате процесса кипения и находится в динамическом равновесии с жидкостью. Объем жидкости из-за конденсации пара не увеличивается и не уменьшается из-за ее испарения. Примером насыщенного пара служит небольшое количество воды в сосуде, который герметично закрыт.
Ненасыщенным паром называют пар, у которого со своей жидкостью нет термодинамического равновесия. Давление ненасыщенного пара всегда будет меньше давления насыщенного пара при данной температуре. Если над поверхностью жидкости находится ненасыщенный пар, то процесс парообразования будет преобладать над процессом конденсации. Количество жидкости в сосуде постепенно будет убывать.
Чем же отличается водяной пар от воздуха? В водяном паре присутствуют только частицы воды. А в составе воздуха есть химические элементы в большом количестве, такие как водород, кислород, углекислый газ, азот и в небольшом количестве водяной пар.
Газы — это агрегатное состояние вещества. Молекулы в нем движутся хаотично, независимо друг от друга. Частицы не связаны или связаны слабо силами взаимодействия, а потому движутся свободно. У газа нет собственной формы, он занимают предоставляемый им объем и легко сжимается.
Заметные различия между паром и газом, которые вы должны знать
Разница между паром и газом: пар и газ очень взаимозаменяемы, но это не совсем одно и то же. Основное различие между этими терминами состоит в том, что пар в своем естественном состоянии является твердым или жидким при комнатной температуре. Принимая во внимание, что газ в его естественном состоянии при комнатной температуре все еще будет газом.
Пар просто определяется как фаза газа при температуре, при которой одно и то же вещество может существовать как в жидком, так и в твердом состоянии. Знание того, как рассчитать Vapor с помощью калькулятора давления пара, может быть невероятно полезным.
Газ относится к веществу, имеющему одно определение термодинамическое состояние при комнатной температуре, тогда как пар относится к веществу, которое представляет собой смесь двух фаз при комнатной температуре, а именно газообразной и жидкой фаз.
Пар и газ
Однако важно отметить, что среди четырех состояний вещества есть «газовая фаза», которая не обязательно относится к газу как к отдельному элементу, а скорее представляет различия во взаимоотношениях молекул. В газе отдельные частицы газа сильно отделены друг от друга, что делает газ невидимым для глаза.
Когда вещество находится при температуре ниже его критической температуры, оно находится в «газовой фазе» и поэтому будет пар, Пар может сосуществовать с жидкостью или твердым телом, когда они находятся в равновесном состоянии.
Также чрезвычайно важно отметить, что пар является результатом двух типов испарения жидкости: кипения и испарения, перехода от жидкой фазы к фазе.газовая фаза.
Испарение происходит на поверхности жидкости, когда ее температура ниже температуры кипения при данном давлении. Кипение происходит ниже поверхности жидкости.
Читайте также:
Заметные различия между паром и газом
1. Пар представляет собой смесь двух или более различных фаз при комнатной температуре; эти фазы представляют собой жидкую и газообразную фазы.
2. Газ обычно содержит одно термодинамическое состояние при комнатной температуре.
3. Пар имеет определенную форму газообразных частиц при наблюдении под микроскопом. Однако газ не имеет определенной формы, когда его наблюдают под микроскопом.
5. Обычно пар состоит из случайных молекул и атомов, движущихся случайным образом.
6. Газы обычно образуются выше его критической температуры, но ниже критического давления.
Если вам понравилась эта статья, подпишитесь на вашу электронную почту для связанных материалов. Благодарю.
CSN Team.
Присоединяйтесь к более чем 5 миллионам подписчиков сегодня!
=> ПОСЛЕДУЮЩИЕ США НА INSTAGRAM | FACEBOOK & TWITTER ПОСЛЕДНИЕ ОБНОВЛЕНИЯ
Газ и пар очень похожи между собой. Они представляют собой разновидности газообразного состояния вещества. Это состояние характеризуется слабыми связями между молекулами, значительными расстояниями между ними и высокой подвижностью молекул.
В чём же состоит отличие газа от пара? Согласно русской Википедии (статья «Газ»), разница между газом и паром существенна: газ имеет температуру выше критической или равную ей, а пар — ниже. Поясню, что критическая температура — это наибольшая температура, при которой ещё можно удерживать вещество в жидком состоянии путём максимального повышения давления. Например, у воды критическая температура равна примерно 374 °C (647 К). Всё газообразное вещество воды, которое имеет температуру ниже этого, например, 1 °C или 200 °С, будет именно па́ром, а не газом. А вот водород, кислород, азот, гелий и т. п. при обычных условиях — это газы, так как они имеют температуру выше критической (критическая у каждого из них ниже –100 °C).
Впрочем, есть другая точка зрения, которую я нашёл в современном Интернете. Говорят, что па́ром называют только одно вещество в газообразном состоянии, а именно воду (H2O). Все прочие газообразные вещества нужно называть газами.
Если рассматривать отдельную молекулу, совершенно изолированнную от других, то это просто молекула, и про неё нельзя говорить, в каком она агрегатном состоянии. А вот если рассматривать не одну молекулу, а много молекул в ограниченном объёме, то здесь может быть две ситуации:
На нашей планете, все существующие вещества находятся в трех состояниях – твердом, жидком и газообразном.
Паром по сути является газообразное состояние веществ, которые в естественных условиях являются жидкостью. Такой переход вещества из одного фазового состояния в другое происходит из-за воздействия внешних факторов, например нагревание жидкости.
Газ, это вещества, которые в естественных условиях изначально находятся в газообразном состоянии, которые представляются молекулами, имеющие хаотическое движение в разных направлениях.
Отличия газа и пара можно выразить как:
В быту подобный аэрозоль могут назвать паром при любой температуре: пар над тарелкой супа (туман); пар изо рта в морозную погоду (аэрозоль).
Газ и пар можно рассматривать с разных точек зрения. Чисто в бытовом плане газ это что-то невидимое и иногда дурно пахнущее. А вот с паром другая картина – пар это то, что от кипящего чайника или кастрюли вверх поднимается. Но конечно это не вполне верно чисто в научном плане. Газ это состояние вещества, при котором внутри газовой среды молекулы свободно перемещаются и хаотически друг с другом сталкиваются. Для пара характерно другое. Пар, это такое состояние, при котором с определёнными условиями температуры и давления может существовать как газ и как жидкость в одном объёме, то есть в среде газа воды присутствует жидкая вода (в виде фракций, капелек).
Согласно определению газа:
А пар, в свою очередь, имеет такое определение:
Например, вода может быть жидкой, твердой и газообразной. Поэтому водяной газ называют паром.
В разговорной речи под словом пар обычно подразумевают именно водяной пар.
Пар вещество вызванной испарением жидкости возникающий при высокой температуры воздействия на жидкость как правило не имеющей запаха. Газ вещество образованные выделениями без дополнительных воздействий например огня на воду и как правило имеет запахи, но не всегда.
Газ это одно из возможных аллотропных состояний веществ, которые существуют в природе.
Любое вещество на высоких температурах и в инертной среде является газом.
Насыщенный и ненасыщенный пар
Фазовые переходы: изменение агрегатных состояний вещества
Прежде чем говорить о насыщенном паре, нужно освежить знания об агрегатных состояниях и фазовых переходах между ними. Если вы забыли, какие бывают агрегатные состояния, то можете сбегать в нашу статью про них.
При изменении внешних условий (например, если внутренняя энергия тела увеличивается или уменьшается в результате нагревания или охлаждения) могут происходить фазовые переходы — изменения агрегатных состояний вещества.
Вот какие бывают фазовые переходы:
Переход из твердого состояния в жидкое — плавление;
Переход из жидкого состояния в твердое — кристаллизация;
Переход из газообразного состояния в жидкое — конденсация;
Переход из жидкого состояния в газообразное — парообразование;
Переход из твердого состояния в газообразное, минуя жидкое — сублимация;
Переход из газообразного состояния в твердое, минуя жидкое — десублимация.
На схеме — названия всех фазовых переходов:
Фазовые переходы — важная штука. Все живое не Земле существует лишь благодаря тому, что вода умеет превращаться в лед или пар. С кристаллизацией, плавлением, парообразованием и конденсацией связаны многие процессы в металлургии и микроэлектронике.
Парообразование
Итак, парообразование — это переход из жидкого состояния в газообразное.
При парообразовании всегда происходит поглощение энергии: к веществу необходимо подводить теплоту, чтобы оно испарялось. Из-за этого внутренняя энергия вещества увеличивается.
У процесса парообразования есть две разновидности: испарение и кипение.
Испарение — это превращение или переход жидкости в газ (пар) со свободной поверхности жидкости. Если поверхность жидкости открыта и с нее начинается переход вещества из жидкого состояния в газообразное, это будет называться испарением.
Кипение — процесс интенсивного парообразования, который происходит в жидкости при определенной температуре.
Например, мы заварили себе горячий чай. Над чашкой мы увидим пар, так как вода только что поучаствовала в процессе кипения.
Подождите-ка, мы ведь только что сказали, что кипение и испарение — разные вещи. 🤔 Это действительно так, но при этом оба процесса могут происходить параллельно.
Испарение может происходить и без кипения, просто тогда оно не будет для нас заметно. Например, вода в озере испаряется, хотя мы этого и не замечаем. Кипение по сути своей — это интенсивное испарение, которое вызвали внешними условиями — доведя вещество до температуры кипения.
Физика объясняет испарение тем, что жидкость обычно несколько холоднее окружающего воздуха, и из-за разницы температур происходит испарение.
Если нет каких-то внешних воздействий, испарение жидкостей происходит крайне медленно. Молекулы покидают жидкость из-за явления диффузии.
Направление тепловых потоков при испарении может идти в разной последовательности и комбинациях:
из глубины жидкости к поверхности, а затем в воздух;
только из жидкости к поверхности;
к поверхности из воды и газовой среды одновременно;
к площади поверхности только от воздуха.
Подытожим, чтобы не запутаться, в чем главная разница между испарением и кипением:
при любой температуре
с поверхности жидкости
при определенной температуре
с поверхности жидкости
Температура кипения
При температуре кипения давление насыщенного пара становится равным внешнему давлению на жидкость — чаще всего это атмосферное давление. Значит, чем больше внешнее давление, тем при более высокой температуре начнется кипение.
При нормальном атмосферном давлении, которое приблизительно равно 100 кПа, температура кипения воды равна 100°C. Поэтому можно сразу сказать, что давление насыщенного водяного пара при температуре 100 градусов по Цельсию равно 100 кПа. Это значение пригодится при решении задач.
Чем выше мы поднимаемся, тем меньше становится атмосферное давление, потому что масса атмосферы над нами уменьшается. Так, например, на вершине Эльбруса атмосферное давление составляет 5 × 104 Па — в два раза меньше, чем нормальное атмосферное давление. Поэтому и температура кипения на вершине Эльбруса будет ниже, чем на уровне моря. Вода там закипит при температуре 82°C.
Температура кипения при нормальном атмосферном давлении — это строго определенная величина для каждой жидкости.
Испарение и конденсация
Молекулы в жидкости непрерывно и хаотично движутся. Это значит, что направление движения отдельно взятых молекул — это случайные направления. При этом жидкость сохраняет свой объем. Также молекулы силами притяжения притягиваются друг к другу, из-за чего не могут покинуть Омск жидкость.
Значения скоростей молекул случайны. Из-за этого среди всех молекул обязательно есть те, что движутся очень быстро. Если такая молекула окажется вблизи поверхности раздела жидкости и окружающей среды, то ее кинетическая энергия может достигнуть большого значения, и молекула покинет жидкость.
Собственно, именно так происходит процесс испарения (мы говорили о нем выше, когда речь шла о фазовых переходах). Когда испарившихся молекул становится много, образуется пар.
Обратный процесс тоже возможен: вырвавшиеся за пределы жидкости молекулы вернутся в жидкость. Это конденсация, о ней мы тоже говорили.
Если открыть сосуд с жидкостью, то испарившиеся молекулы будут покидать пространство над жидкостью и не возвращаться обратно. Количество жидкости таким образом будет уменьшаться. То есть жидкость испаряется, а пар обратно не конденсируется (потому что молекулы этого пара удаляются от жидкости) — так происходит высыхание.
Испарение может происходить с разной скоростью. Чем больше силы притяжения молекул друг к другу, тем меньшее число молекул в единицу времени окажется в состоянии преодолеть эти силы притяжения и вылететь наружу, и тем меньше скорость испарения.
Быстро испаряются такие жидкости, как эфир, ацетон, спирт. Из-за этого свойства их иногда называют летучими жидкостями. Медленнее — вода. Намного медленнее воды испаряются масло и ртуть.
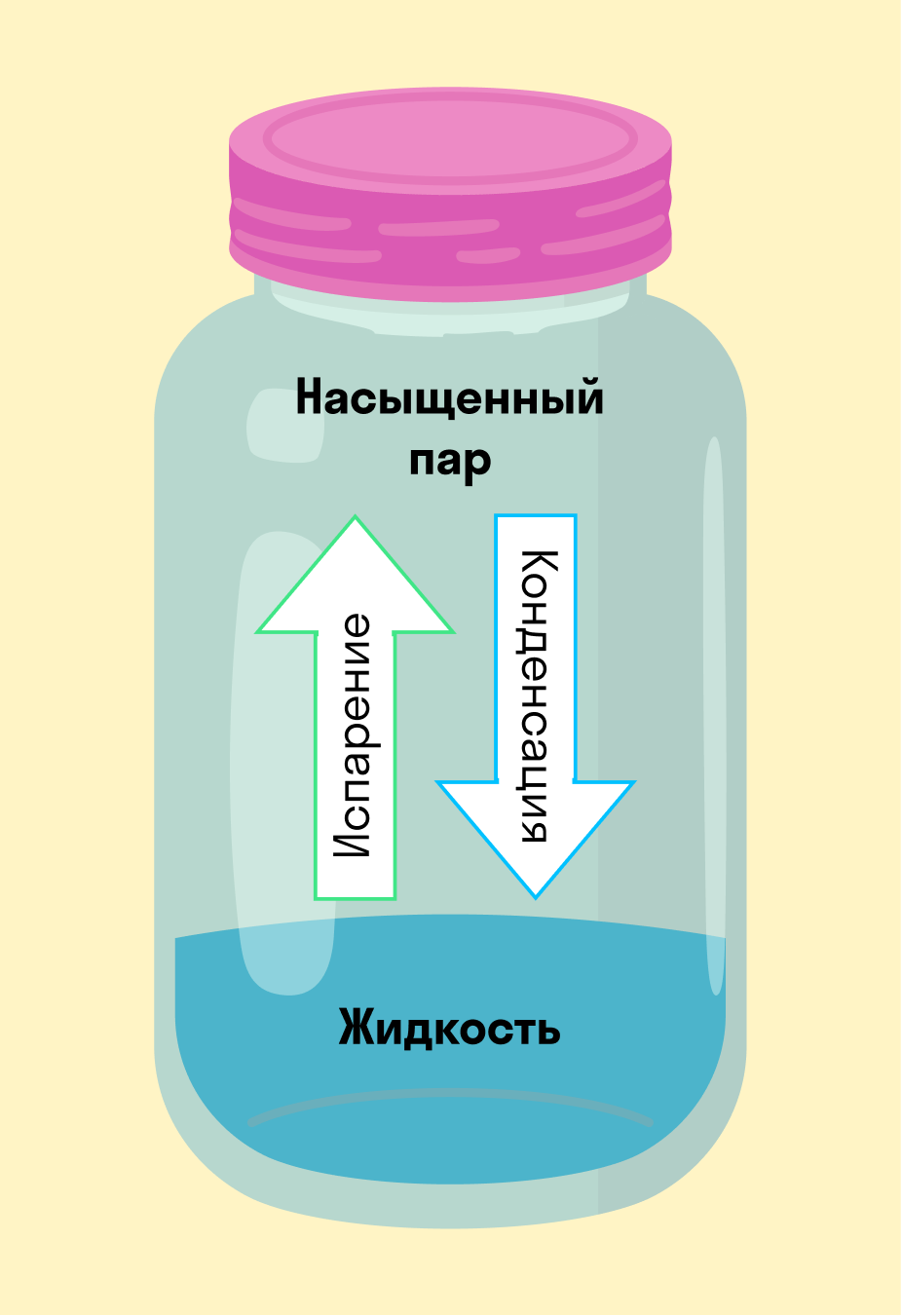
Определение насыщенного пара
Оставим стакан воды на столе и будем замерять уровень воды в нем каждый день. Если записать эти измерения и сравнить их, станет очевидно: уровень воды стал меньше, то есть вода испарилась.
Теперь давайте накроем стакан сверху. Молекулы пара уже не смогут покидать пространство над жидкостью, по мере испарения их количество начнет расти, а значит, будет расти и количество молекул, которые конденсируются в единицу времени.
Сначала количество конденсирующихся молекул за единицу времени будет меньше количества испаряющихся молекул. Но по мере роста концентрации пара (то есть увеличении количества молекул в единице объема пара) поток конденсирующихся молекул вырастет. Это приведет к состоянию, которое называется динамическим равновесием.
Пар, находящейся в динамическом равновесии, называют насыщенным.
Представьте себе огромный бизнес-центр с не менее огромными дверями. У сотрудников бизнес-центра разный график работы, поэтому люди одновременно заходят в здание и выходят из него в произвольном количестве. Допустим, в 6 часов вечера 100 человек заходят в здание, чтобы попасть на деловую встречу, а другие 100 человек уже закончили работать и идут домой. Количество заходящих в бизнес-центр и выходящих из него будет одинаковым — это и есть состояние насыщения.
Значение давления насыщенного пара и его плотности являются максимальными при заданном значении температуры. Если это не так, то пар ненасыщенный.
Свойства насыщенного пара
При постоянной температуре плотность насыщенного пара не зависит от его объема.
Представьте, что объем сосуда с насыщенным паром уменьшили, не изменив температуры.
Количество молекул, переходящих от пара к жидкости, превысит количество испаряющихся молекул, но при этом часть пара сконденсируется, а оставшийся пар снова придет в динамическое равновесие. В итоге плотность этого пара будет равна начальной плотности.
Давление насыщенного пара не зависит от его объема.
Это связано с тем, что давление и плотность связаны через уравнение Менделеева-Клапейрона, и следует из первого свойства насыщенного пара.
Кстати, уравнение Менделеева-Клапейрона справедливо для насыщенного пара. При этом нужно быть внимательным с частными случаями. Так, например, закон Бойля-Мариотта для насыщенного пара не выполняется.
pV = νRT
p — давление газа [Па]
V — объем [м3]
ν — количество вещества [моль]
T — температура [К]
R — универсальная газовая постоянная
При неизменном объеме плотность насыщенного пара растет с повышением температуры и уменьшается с понижением температуры.
В начальный момент испарения динамическое равновесие будет нарушено (некоторая часть жидкости испарится дополнительно). Плотность пара будет расти, пока динамическое равновесие не восстановится.
Давление и температура насыщенного пара растут быстрее, чем по линейному закону, который справедлив для идеального газа.
В случае идеального газа рост давления обусловлен только ростом температуры, а в случае с насыщенном паром имеют значение два фактора: температура и масса пара.
В случае нагревания насыщенного пара молекулы начинают ударяться чаще, так как их в целом стало больше, потому что пара стало больше.
Главное отличие насыщенного пара от идеального газа: пар сам по себе не является замкнутой системой, а находится в постоянном контакте с жидкостью.
Решение задач по теме «Насыщенный пар»
Применим свойства насыщенного пара при решении задач.
Задачка раз
В цилиндрическом сосуде под поршнем длительное время находятся вода и ее пар. Поршень начинают вдвигать в сосуд. При этом температура воды и пара остается неизменной. Как будет меняться при этом масса жидкости в сосуде? Ответ поясните.
Решение
Так как пар и вода находятся в контакте длительное время, пар является насыщенным. При уменьшении объема сосуда давление насыщенного пара не меняется. Из уравнения Менделеева-Клапейрона следует, что для того, чтобы давление пара не менялось, его количество вещества (а значит и масса) должно уменьшаться.
В этом процессе происходит конденсация, часть молекул пара переходят в жидкость, поэтому масса жидкости увеличивается.
Ответ
Масса жидкости увеличивается.
Задачка два
Какова плотность насыщенного пара при температуре 100°С?
Решение
При нормальном давлении (p = 105 Па) 100°С — это температура кипения воды. Значит, давление насыщенного пара при этой температуре равно атмосферному давлению.
Найдем связь между давлением и плотностью через уравнение Менделеева-Клапейрона.
Подставим значение давления в уравнение состояния идеального газа, предварительно переведя температуру в Кельвины: T = 100 + 273 = 373 K
Испарение
Испарение: что это за процесс
Процесс перехода из жидкого состояния в газообразное называется парообразованием. У этого процесса есть две разновидности: испарение и кипение.
Например, мы заварили себе горячий чай. Над чашкой мы точно увидим пар, так как вода только что поучаствовала в процессе кипения.
Подождите-ка, мы ведь только что сказали, что кипение и испарение — разные вещи. Это действительно так, при этом эти два процесса могут происходить параллельно.
Испарение может происходить и без кипения, просто тогда оно не будет для нас заметно. Например, вода в озере испаряется, хотя мы этого и не замечаем. Кипение по сути своей — это интенсивное испарение, которое вызвали внешними условиями — доведя вещество до температуры кипения.
Если нет каких-то внешних воздействий, испарение жидкостей происходит крайне медленно. Молекулы покидают жидкость из-за явления диффузии.
Интересно то, что направление тепловых потоков при испарении может идти в разной последовательности и комбинациях:
Подытожим, чтобы не запутаться: в чем главная разница между испарением и кипением:
| Испарение | Кипение |
| При любой температуре, с поверхности жидкости | При определенной температуре, во всем объеме жидкости |
Испарение на уровне молекул
Давайте вспомним об особенностях разных агрегатных состояний вещества.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
близко друг к другу
малоподвижны, при нагревании скорость движения молекул увеличивается
занимают предоставленный объем
больше размеров молекул
хаотичное и непрерывное
Из этой таблицы видно, что молекулы в жидкостях находятся близко друг другу, но хаотично, то есть не имеют кристаллической решетки, как в твердых телах. Эти молекулы движутся (причем, чем выше температура, тем быстрее движутся) и в ходе движения сталкиваются. Столкновения меняют направление и скорость движения — из-за этого молекулы иногда быстро устремляются к поверхности жидкости и вылетают из нее. Это и есть испарение.
В предыдущем абзаце мы не случайно заметили, что молекулы движутся быстрее при увеличении температуры — ведь из-за этого испарение идет интенсивнее. В этом случае происходит охлаждение: нагретую жидкость уже покинули все самые быстрые молекулы и температура самой жидкости понижается.
Интенсивность испарения
Интенсивностью испарения называют количество воды, которое испаряется с поверхности площадью 1 см2 за одну секунду.
Интенсивность испарения зависит от следующих факторов:
Скорость испарения — количество жидкости, которая испаряется со свободной поверхности в единицу времени.
Интенсивность испарения — количество жидкости, которая испаряется с единицы площади поверхности в единицу времени.
По сути, это два очень близких друг к другу понятия, поэтому разница будет лишь в величинах и единицах измерения, а суть процесса отражают обе формулировки.
Насыщенный пар
Процесс испарения напрямую связан с круговоротом воды в природе. Вода, испаряясь, превращается в водяной пар и поднимается вверх, где происходит конденсация пара, образуются облака, и вода возвращается на землю в виде осадков.
Вследствие конденсации водяного пара, который живет в воздухе, образуются облака и туман. По этой же причине холодное стекло запотевает, соприкасаясь с теплым воздухом.
На рисунке — процессы испарения и конденсации в плотно закрытом сосуде, когда жидкость и пар находятся в динамическом равновесии. Это значит, что одновременно конденсируется и испаряется одинаковое количество вещества.
Влажность воздуха говорит нам о том, сколько в воздухе содержится водяного пара. Но бесконечное количество пара в воздух не запихнешь. Поэтому, во-первых, его там очень мало, а во-вторых, при избыточном количестве водяного пара происходит конденсация — это когда образуется роса.
Но если мы тот же воздух поместим в помещение с температурой +20 градусов, то в него может испариться уже до 17 миллиграмм пара. Значит его влажность будет равна 1/17 = 6%. Человеку комфортнее всего находиться при значении влажности 40-50%.
Испарение в жизни
И действительно: чего в этой жизни только не испаряется — мы встречаемся с этим каждый день. Давайте узнаем, зачем этот процесс вообще нужен, и как люди научились извлекать из него пользу.
Испарение в организме человека и животных
Выше мы разбирали вопрос, почему если облиться теплой водой, нам все равно станет холодно. По этому же принципу работает ощущение холода после того, как мы вспотели — в какой-то момент нам становится холодно.
Само потоотделение — важный процесс терморегуляции организма. Если мы достигаем высокой температуры (из-за внешних воздействий или же из-за болезни), то организм стремится себя охладить, чтобы не умереть из-за превращения белков в нашем организме в яичницу.
Пот выделяется через поры кожи, а затем испаряется — все это позволяет нашему организму быстро избавиться от лишней энергии, охладить тело и нормализовать температуру.
При высокой влажности холод и тепло воспринимаются более чувствительно. Это связано с потливостью человека при высокой температуре. Такой механизм помогает нам бороться с жарой и «скинуть» избыточное тепло, но при высокой влажности пот не может испариться.
При низкой влажности происходит нечто похожее. Как ни странно, в мороз мы тоже потеем (намного меньше, но все-таки это происходит). Если влажность на улице низкая, то пот испарится из-под куртки и нам будет комфортно. А при высокой влажности — он там задержится и будет проводить тепло наружу, забирая у нас драгоценные Джоули тепла. Поэтому зимой в Петербурге холоднее, чем в Москве.
У животных этот механизм работает схожим образом. Но, например, собакам испарения с кожи недостаточно, поэтому они часто открывают пасть, высовывают язык и дышат порой ну очень смешно 🐶
Именно гортань и язык собаки идеально подходят для испарения влаги и охлаждения тела животного.
Испарение у растений
Удивительно, но у растений механизм испарения тоже работает схожим образом. Растения очень любят воду, поэтому домашние растения мы поливаем, а в пустынях их просто нет.
Ту воду, которую цветы поглотили, они могут испарять, чтобы не перегреться под жарким солнцем. Да, вода нужна, чтобы растения питались, но в жаркие дни еще и для температурной саморегуляции. Поэтому не забывайте поливать цветы, а в очень жаркие дни делайте это еще интенсивнее.
Испарение в природе и окружающей среде
Процесс испарения напрямую связан с круговоротом воды в природе. Именно круговоротом воды в природе обеспечивается жизнь на Земле — так как влага разносится по всему миру, растения в дикой природе способны жить без наших попыток полить большую пальму из леечки.
Испарение воды с поверхности рек, озер, морей и океанов создает дождевые тучи, которые затем, проливаясь дождем, поливают растения и деревья. Многие дождь не любят, мол, он мокрый, мерзкий и затекает в ботинки, но он очень нужен засушливым регионам — Северной Африке или Центральной Индии, которые часто страдают от засухи.
Испарение в промышленности и быту
С бытом совсем все просто: мы сушим вещи, готовим еду, покупаем увлажнители воздуха или размазываем разлитую лужу по полу.
В случае с промышленностью для нас все не так очевидно. Промышленная техника, работающая на основе испарения, разрабатывается по схожей схеме: в ней всегда максимально увеличена площадь поверхности жидкости, чтобы испарение шло интенсивно.
Например, испаритель, изображенный на схеме, состоит из совокупности соединенных между собой испарителей. В основе его действия — пар, полученный в одной ступени, который используют в качестве источника тепла для следующей ступени. По мере того, как температура уменьшается от одной ступени к другой, вакуум увеличивается, так что температура кипения становится ниже и испарение поддерживается. Он предназначен для того, чтобы очистить воду от отходов.