в чем растворить родий
Методы извлечения и очистки родия
Извлечение родия и очистка его от неблагородных и благородных примесей связана с исключительно сложными, длительными и трудоемкими операциями. Это неизбежно: родий относится к числу наиболее редких элементов. К тому же он рассеян, собственных минералов не имеет. Находят его вместе с самородной платиной и осмистым иридием. Данная курсовая работа посвящена способам извлечения родия из отработанных катализаторов.
Глава 1. ИЗВЛЕЧЕНИЕ РОДИЯ И ЕГО ОЧИСТКА
Извлечение родия и очистка его от неблагородных и благородных примесей связана с исключительно сложными, длительными и трудоемкими операциями. Это неизбежно: родий относится к числу наиболее редких элементов. К тому же он рассеян, собственных минералов не имеет. Находят его вместе с самородной платиной и осмистым иридием.
Однако содержание в них родия невелико: обычно оно составляет доли процента в самородной платине и несколько процентов в осмистом иридии. Известна, правда, редчайшая разновидность осмистого иридия – родистый невьянскит. В нем до 11,3% родия. Это самый богатый родием минерал.
Технология выделения родия зависит прежде всего от вида и состава перерабатываемого сырья. Расскажем для примера, как извлекают родий из самородной платины.
С приисков сырая платина поступает на аффинажный завод, где отделяют благородные металлы от неблагородных примесей и разделяют сами драгоценные металлы. Делается это так.
Сырую, платину загружают в фарфоровые котлы и обрабатывают царской водкой. Процесс идет при нагревании в течение суток. Родий, а вместе с ним почти вся платина, палладий, неблагородные металлы (железо, медь и другие), частично рутений и иридий переходят в раствор, а в осадке остаются осмистый иридий, кварц, хромистый железняк и другие минеральные примеси.
Сначала на него действуют хлористым аммонием, чтобы осадить и отделить платину. Оставшийся раствор упаривают: образуется осадок, который состоит из нескольких солей. В нем до 6% родия; присутствуют также палладий, рутений, иридий, платина (всю ее с помощью NH4Cl отделить не удается) и неблагородные металлы. Этот осадок растворяют в воде и еще раз тем же способом отделяют платину. А раствор, в котором остались родий, рутений и палладий, по мере накопления направляют на очистку и разделение.
Родий извлекают разными способами. Например, по способу, предложенному советским ученым В.В. Лебединским в 1932 г., вначале нитритом натрия NaNO2 осаждают и отделяют от раствора осадок гидроокисей неблагородных металлов; родий при этом остается в растворе в форме Na3[Rh(NO2)6]. После этого с помощью NH4Cl из раствора на холоду выделяют родий; он уходит в виде малорастворимого комплекса (NH4)2Na[Rh(NO2)6]. Однако при этом вместе с родием в осадок переходит и иридий; другие же платиновые металлы – рутений, палладий и остатки платины – остаются в растворе. Итак, родий в осадке, и нас теперь интересует уже только этот осадок. Что с ним происходит дальше?
Осадок растворяют в разбавленном едком натре и из этого раствора действием аммиака и NH4Cl снова осаждают родий – теперь уже в форме другого комплексного соединения [Rh(NH3)3(NO2)3]. Осадок отделяют и тщательно промывают раствором хлористого аммония.
На этом очистка родия еще не закончена. Осадок снова загружают в котел с соляной кислотой и нагревают несколько часов. Происходит реакция:
с образованием нового комплексного соединения родия ярко-желтого цвета. Это триаминтрихлорид родия. Его тщательно промывают водой и только после этого приступают к выделению металлического родия.
Соль загружают в печь и прокаливают несколько часов при 800. 900°C. Комплексное соединение разлагается и образуется порошкообразный продукт смеси родия с его окислами. После охлаждения порошок еще раз тщательно промывают разбавленной царской водкой для удаления оставшегося незначительного количества неблагородных примесей, а затем снова загружают в печь и восстанавливают до металла, прокаливая в атмосфере водорода.
Следует иметь в виду, что в нашем рассказе путь этот еще упрощен и укорочен: опущены второстепенные, не несущие самостоятельной «химической нагрузки» стадии. Но в действительности на всех стадиях родиевого производства нет «мелочей». Температурные режимы, концентрация реагентов, продолжительность операций, материалы аппаратуры – все важно. Управление всеми процессами требует больших знаний и громадного опыта.
Сейчас родий вместе с другими платиновыми металлами добывают также из сульфидных медноникелевых руд. Содержание элемента №45 в этих рудах исчисляется миллиграммами на тонну руды. Поэтому собственно аффинажу родия предшествуют сложные технологические операции отделения основных количеств цветных металлов и получения концентрата благородных металлов.
Глава 2. ПРИМЕНЕНИЕ РОДИЯ
Исключительно высокая стойкость платины по отношению к кислотам обеспечивает ей радушный прием в химических лабораториях, где она служит материалом для тиглей, чашей, сеток, трубок, электродов и других лабораторных атрибутов. Большое количество платины требуется также для производства кислото- и жароупорной аппаратуры химических заводов. В технике довольно широко применяют платиновые термометры.
В платиновых тиглях разлагают горные породы – чаще всего, сплавляя их с содой или обрабатывая плавиковой кислотой.
Платиновой посудой пользуются при особо точных и ответственных аналитических операциях.
Платина – лучший катализатор реакции окисления аммиака до окиси азота NO в одном из главных процессов производства азотной кислоты. Катализатор здесь предстает в виде сетки из платиновой проволоки диаметром 0,05. 0,09 мм. В материал сеток введена добавка родия (5. 10%). Используют и тройной сплав – 93% Pt, 3% Rh и 4% Pd. Добавка родия к платине повышает механическую прочность и увеличивает срок службы сетки, а палладий немного удешевляет катализатор и немного (на 1. 2%) повышает его активность. Срок службы платиновых сеток – год-полтора. После этого старые сетки отправляют на аффинажный завод на регенерацию и устанавливают новые. Производство азотной кислоты потребляет значительные количества платины.
Платиновые катализаторы ускоряют многие другие практически важные реакции: гидрирование жиров, циклических и ароматических углеводородов, олефинов, альдегидов, ацетилена, кетонов, окисление SO2 в SO3 в сернокислотном производстве. Их используют также при синтезе витаминов и некоторых фармацевтических препаратов.
Не менее важны платиновые катализаторы в нефтеперерабатывающей промышленности. С их помощью на установках каталитического риформинга получают высокооктановый бензин, ароматические углеводороды и технический водород из бензиновых и лигроиновых фракций нефти. Здесь платину обычно используют в виде мелкодисперсного порошка, нанесенного па окись алюминия, керамику, глину, уголь. В этой отрасли работают и другие катализаторы (алюминий, молибден), но у платиновых – неоспоримые преимущества: большая активность и долговечность, высокая эффективность.
Из сплава платины с 5. 10% родия делают фильеры для производства стеклянного волокна. В платиновых тиглях плавят оптическое стекло, когда особенно важно ничуть не нарушить рецептуру. В химическом машиностроении платина и ее сплавы служат превосходным коррозионностойким материалом. Аппаратура для получения многих особо чистых веществ и различных фторсодержащих соединений изнутри покрыта платиной, а иногда и целиком сделана из нее.
Из сплавов золота с платиной делают детали оборудования для получения синтетического волокна, которые по условиям производства должны обладать исключительной стойкостью к воздействию химических веществ.
Сплав палладия с другими металлами (главным образом, серебром) используют в зубоврачебной технике – из него делают отличные протезы.
Палладием покрывают особо ответственные контакты электронной техники, телефонных аппаратов и других электротехнических приборов. В оптике сплавы золота с палладием применяются чаще, чем золотоплатиновые сплавы, это связано с тем, что палладий сравнительно дешев – его цена в пять раз меньше, чем платины.
Глава 3. РОДИЙ И ЕГО СВОЙСТВА
Ро́дий (лат. Rhodium; обозначается символом Rh) — элемент побочной подгруппы восьмой группы пятого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 45. Простое вещество родий (CAS-номер: 7440-16-6) — твёрдый переходный металл серебристо-белого цвета. Благородный металл платиновой группы.
Родий содержится в платиновых рудах, в некоторых золотых песках Южной Америки. До 43 % родия содержится в мексиканском золоте. Также содержится в изоморфной примеси минералов группы осмистого иридия (до 3,3 %), в медноникелевых рудах. Редкая разновидность осмистого иридия — родиевый невьянскит — самый богатый родием минерал.
Физические свойства
Родиевая фольга и проволока
Родий — твёрдый металл, серебристо-серого цвета. Имеет высокий коэффициент отражения электромагнитных лучей видимой части спектра, поэтому широко используется для изготовления «поверхностных» зеркал.
Изотопы родия
Природный родий состоит из изотопа 103 Rh. Наиболее долгоживущие изотопы
РОДИЙ
свойства, получение и применение
Родий (лат. Rhodium; обозначается символом Rh) — элемент побочной подгруппы восьмой группы пятого периода периодической системы химических элементов Д. И. Менделеева, атомный номер — 45. По внешнему виду компактный родий – красивый серебристый металл с голубоватым оттенком.
Родий относится к благородным металлам платиновой группы. По сравнению с другими металлами этой группы он более яркий и твёрдый – пластичным становится только при нагревании.
Название элемента в переводе с древнегреческого означает «роза». Это имя он получил благодаря цвету своих типичных соединений — они красные, как и розы.
Родий очень редкий и рассеянный элемент. Среднее содержание его в земной коре 1•10-7 % по массе. Собственных минералов не имеет. Содержится в никелевых и платиновых рудах в виде простого соединения. Также содержится в изоморфной примеси минералов группы осмистого иридия (до 3,3 %), в медноникелевых рудах. Известна и редчайшая разновидность осмистого иридия – родистый невьянскит. В нем до 11,3% родия. Это самый богатый родием минерал.
Вплоть до 20-ых годов прошлого столетия Россия закупала родий за рубежом. В стране не было специалистов-аффинеров, свойства родия и его «собратьев» были плохо изучены, а заграничные фирмы держали в секрете способы извлечения и очистки металлов платиновой группы.
В 1918 году в нашей стране открылся Институт по изучению платины и других благородных металлов. В первые же годы в нем были выполнены важные исследования по химии, аффинажу и анализу родия. А в 1925 году из уральской платины был получен первый отечественный родий.
Заслуга в этом принадлежит, прежде всего, выдающемуся ученому-химику Л. А. Чугаеву и его ученикам, впоследствии известным ученым И. И. Черняеву, В. В. Лебединскому и Н. К. Пшеницыну.
ФИЗИЧЕСКИЕ СВОЙСТВА РОДИЯ
По внешнему виду компактный родий – красивый серебристый металл с голубоватым оттенком. Он обладает гранецентрированной кубической решеткой, параметр элементарной ячейки а = 0,3803 нм. Плотность при 20°C 12,41 г/см3. Температура плавления 1963 °C, кипения 3727 °C. В отличие от золота и платины родий плохо поддается механической обработке. Поэтому прокатать или протянуть его в проволоку можно лишь при 800. 900°C. Проявляет свойства парамагнетика. Отражательная способность поверхности родия 80% для видимой части спектра.
Компактный родий исключительно устойчив к любым химическим воздействиям. Однако если взять сплав родия с цинком или кадмием и растворить его в соляной кислоте, а затем отфильтровать, то получится осадок мелкодисперсного родия, способный взрываться на воздухе.
ХИМИЧЕСКИЕ СВОЙСТВА РОДИЯ
Родий — благородный металл, по химической стойкости в большинстве коррозионных сред превосходит платину. На компактный родий не действуют ни кислоты, ни щелочи. Лишь мелко раздробленный родий медленно растворяется в горячей царской водке или концентрированной серной кислоте. Родий весьма устойчив и к действию галогенов: с хлором, бромом и даже фтором он реагирует лишь после продолжительного нагревания. При этом в зависимости от температуры проведения реакций получаются галогениды различного состава. В частности, с хлором образуются хлориды одно-, двух- и трехвалентного родия RhCl, RhCl2, RhCl3. При высоких температурах родий медленно реагирует с серой, превращаясь в сульфиды RhS, RhS2, Rh2S5.
При нагревании родий медленно взаимодействует с концентрированной серной кислотой:
2Rh + 6KHSO4 = 2K3Rh(SO4)3 + 3H2.
Гидроксид и оксид родия проявляют основные свойства и взаимодействуют с кислотами с образованием комплексов Rh:
Rh2O3 + 12HCl = 2H3RhCl6 + 3H2O;
Rh(OH)3 + 6HCl = H3RhCl6 + 3H2O.
В присутствии хлоридов щелочных металлов, когда есть возможность образовывать комплексы [RhX3]3–, родий взаимодействует с хлором, например:
2Rh + 6NaCl + Cl2 = 2Na3[RhCl6].
При спекании реагирует с расплавами Na2O2 и BaO2:
2Rh + 3BaO2 = Rh2O3 + 3BaO.
Высшую степень окисления +6 родий проявляет в гексафториде RhF6, который образуется при прямом сжигании родия во фторе. Соединение неустойчиво. В отсутствие паров воды гексафторид окисляет свободный хлор или NO:
2RhF6 + 3Cl2 = 2RhF3 + 6ClF.
Родий легко сплавляется с платиной, палладием, медью и другими металлами.
Соединения родия довольно редко встречаются в повседневной жизни и их воздействие на человеческий организм до конца не изучено. Несмотря на это, они являются высоко токсичными и канцерогенными веществами. Соли родия способны сильно окрашивать человеческую кожу.
Месторождения и добыча родия
Раньше, основные залежи находились в России. На Урале были найдены внушительные запасы самородной платины. Но, теперь, их уже разработали. Сегодня по запасам родия лидирует Мексика. За ней следуют Южная Африка и Колумбия. Есть содержание драгоценного металла в золотых песках США.
Получение родия
Технология выделения родия зависит прежде всего от вида и состава перерабатываемого сырья. Рассмотрим получение родия из самородной платины.
С приисков сырая платина поступает на аффинажный завод, где ее загружают в фарфоровые котлы и обрабатывают царской водкой. Процесс идет при нагревании в течение суток. В результате родий переходит в раствор.
Затем на раствор действуют хлористым аммонием, чтобы осадить и отделить платину. Оставшийся раствор упаривают: образуется осадок, который состоит из нескольких солей. В нем до 6% родия. Этот осадок растворяют в воде и еще раз тем же способом отделяют платину. А раствор, в котором остались родий, рутений и палладий, по мере накопления направляют на очистку и разделение.
Далее нитритом натрия NaNO2 осаждают и отделяют от раствора осадок гидроокисей неблагородных металлов; родий при этом остается в растворе в форме Na3[Rh(NO2)6]. После этого с помощью NH4Cl из раствора на холоду выделяют родий; он уходит в виде малорастворимого комплекса (NH4)2Na[Rh(NO2)6]. Однако при этом вместе с родием в осадок переходит и иридий; другие же платиновые металлы – рутений, палладий и остатки платины – остаются в растворе.
Осадок растворяют в разбавленном едком натре и из этого раствора действием аммиака и NH4Cl снова осаждают родий – теперь уже в форме другого комплексного соединения [Rh(NH3)3(NO2)3]. Осадок отделяют и тщательно промывают раствором хлористого аммония.
Полученный садок снова загружают в котел с соляной кислотой и нагревают несколько часов. Происходит реакция:
2[Rh(NH3)3(NO2)3] + 6HCl > 2[Rh(NH3)3Cl3] +3NO2 + 3NO + 3H2O
с образованием нового комплексного соединения родия ярко-желтого цвета. Это триаминтрихлорид родия. Его тщательно промывают водой и только после этого приступают к выделению металлического родия.
Соль загружают в печь и прокаливают несколько часов при 800. 900°C. Комплексное соединение разлагается и образуется порошкообразный продукт смеси родия с его окислами. После охлаждения порошок еще раз тщательно промывают разбавленной царской водкой для удаления оставшегося незначительного количества неблагородных примесей, а затем снова загружают в печь и восстанавливают до металла, прокаливая в атмосфере водорода.
ПРИМЕНЕНИЕ РОДИЯ
Цена родия высока не только потому, что элемент драгоценный, но и потому что отраслей, где он нужен, больше чем самого металла. Однако, применяют его только там, где ему нет более дешевой и распространенной альтернативы.
Львиная доля добываемого родия потребляется автомобильной промышленностью. Отличные каталические свойства металла позволяют производить из его сплавов нейтрализаторы выхлопных газов.
Сплав родия с платиной является очень эффективным катализатором при производстве азотной кислоты путём окисления аммиака воздухом. Именно в этой сфере родию как металлу-катализатору нет аналогов.
Родий в сплавах с иридием и (или) платиной используют при производстве термопар, которые применяются для эффективного измерения высоких температур до 2200 градусов по Цельсию.
Крупный потребитель родия – стекольная промышленность. Из сплава родия с платиной (обычно 7% Rh) делают сосуды для плавления стекломассы и получения тончайших стеклянных и кварцевых нитей. Здесь родий также практически незаменим.
Поверхность родия обладает высокой отражательной способностью (80%) для видимой части спектра. Отражательная способность родия меньше, чем у серебра (95%), но зато его стойкость к действию корродирующих газов и высоких температур намного больше. Родированные поверхности не тускнеют даже в атмосфере вольтовой дуги. Поэтому родием покрывают рефлекторы прожекторов и технические зеркала прецизионных измерительных инструментов самого различного назначения.
Металлический родий используется для производства зеркал подвергающихся сильному нагреву (калению) для мощных лазерных систем (например фтороводородных лазеров), а так же для производства дифракционных решеток к приборам для анализа вещества (спектрометры).
Из драгоценного металла и фильтры жидкокристаллических мониторов. Потребность в них растет с каждым годом. Требуется все больше и больше родия на эту отрасль промышленности.
Родиевые детекторы применяются в реакторах для измерения нейтронного потока.
Существуют драгоценные минералы, кристаллы которых в искусственных условиях растут только на фильтрах из сплава платины и родия.
Родирование
Родий имеет красивый серебристо-белый оттенок, за который он очень ценится в ювелирной отрасли. Его отражательная способность очень велика, металл сверкает и переливается, его блеск великолепен. Поэтому родирование становится все более популярной процедурой в ювелирных мастерских.
Родирование – это нанесение тонкого слоя родия (0,1 – 0, 25 мкм) на поверхность ювелирных изделий. Покрытие улучшает не только внешний вид металлов, придавая поверхности платиновый блеск, но и их химические и механические свойства. Кроме того, родий не тускнеет со временем.
Достоинства родирования:
— блестящий платиновый цвет;
— стойкость изделия к механическим повреждениям, царапинам и т.п.
ЦЕНА РОДИЯ НА МИРОВОМ РЫНКЕ
Известно всем, что драгоценные металлы не могут стоить дешево. А так как к этой категории относится и родий, цена за грамм металла, который к тому же является достаточно редким, тоже довольно высока.
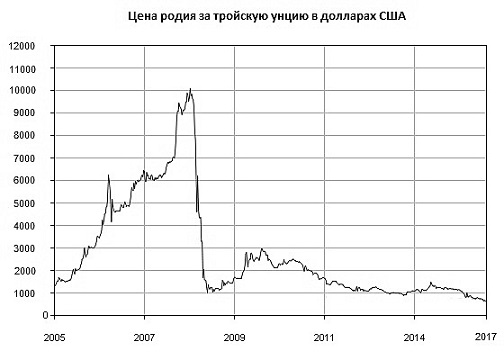
Вплоть до ноября 2008 года стоимость родия неумолимо росла, достигнув своей шокирующей критической отметки в 10 100 долларов за тройскую унцию (около 31,5 грамма), после чего рухнула до 900 долларов.
На графике представлена цена родия за тройскую унцию в долларах США за последние 10 лет. Как видим, своего максимума родий достиг в 2008 году. Это и был звездный час родия: цена на него в 10 раз превысила цену на золото. С 2012 года цена драгоценного металла платиновой группы несколько стабилизировалась.
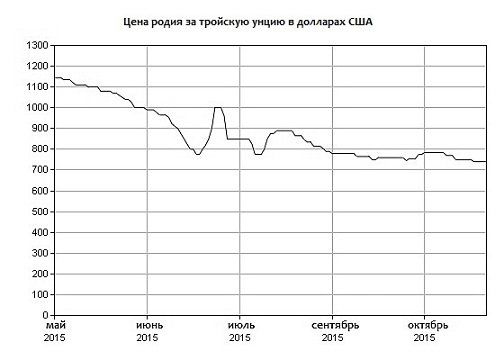
На графике представлена цена родия за тройскую унцию в долларах США с мая 2015 год.
Методы извлечения и очистки родия
Извлечение родия и очистка его от неблагородных и благородных примесей связана с исключительно сложными, длительными и трудоемкими операциями. Это неизбежно: родий относится к числу наиболее редких элементов. К тому же он рассеян, собственных минералов не имеет. Находят его вместе с самородной платиной и осмистым иридием. Данная посвящена способам извлечения родия из отработанных катализаторов.
Глава 1. ИЗВЛЕЧЕНИЕ РОДИЯ И ЕГО ОЧИСТКА
Извлечение родия и очистка его от неблагородных и благородных примесей связана с исключительно сложными, длительными и трудоемкими операциями. Это неизбежно: родий относится к числу наиболее редких элементов. К тому же он рассеян, собственных минералов не имеет. Находят его вместе с самородной платиной и осмистым иридием.
Однако содержание в них родия невелико: обычно оно составляет доли процента в самородной платине и несколько процентов в осмистом иридии. Известна, правда, редчайшая разновидность осмистого иридия – родистый невьянскит. В нем до 11,3% родия. Это самый богатый родием минерал.
Технология выделения родия зависит прежде всего от вида и состава перерабатываемого сырья. Расскажем для примера, как извлекают родий из самородной платины.
С приисков сырая платина поступает на аффинажный завод, где отделяют благородные металлы от неблагородных примесей и разделяют сами драгоценные металлы. Делается это так.
Сырую, платину загружают в фарфоровые котлы и обрабатывают царской водкой. Процесс идет при нагревании в течение суток. Родий, а вместе с ним почти вся платина, палладий, неблагородные металлы (железо, медь и другие), частично рутений и иридий переходят в раствор, а в осадке остаются осмистый иридий, кварц, хромистый железняк и другие минеральные примеси.
Сначала на него действуют хлористым аммонием, чтобы осадить и отделить платину. Оставшийся раствор упаривают: образуется осадок, который состоит из нескольких солей. В нем до 6% родия; присутствуют также палладий, рутений, иридий, платина (всю ее с помощью NH4 Cl отделить не удается) и неблагородные металлы. Этот осадок растворяют в воде и еще раз тем же способом отделяют платину. А раствор, в котором остались родий, рутений и палладий, по мере накопления направляют на очистку и разделение.
Родий извлекают разными способами. Например, по способу, предложенному советским ученым В.В. Лебединским в 1932 г., вначале нитритом натрия NaNO2 осаждают и отделяют от раствора осадок гидроокисей неблагородных металлов; родий при этом остается в растворе в форме Na3 [Rh(NO2 )6 ]. После этого с помощью NH4 Cl из раствора на холоду выделяют родий; он уходит в виде малорастворимого комплекса (NH4 )2 Na[Rh(NO2 )6 ]. Однако при этом вместе с родием в осадок переходит и иридий; другие же платиновые металлы – рутений, палладий и остатки платины – остаются в растворе. Итак, родий в осадке, и нас теперь интересует уже только этот осадок. Что с ним происходит дальше?
Осадок растворяют в разбавленном едком натре и из этого раствора действием аммиака и NH4 Cl снова осаждают родий – теперь уже в форме другого комплексного соединения [Rh(NH3 )3 (NO2 )3 ]. Осадок отделяют и тщательно промывают раствором хлористого аммония.
На этом очистка родия еще не закончена. Осадок снова загружают в котел с соляной кислотой и нагревают несколько часов. Происходитреакция:
с образованием нового комплексного соединения родия ярко-желтого цвета. Это триаминтрихлорид родия. Его тщательно промывают водой и только после этого приступают к выделению металлического родия.
Соль загружают в печь и прокаливают несколько часов при 800. 900°C. Комплексное соединение разлагается и образуется порошкообразный продукт смеси родия с его окислами. После охлаждения порошок еще раз тщательно промывают разбавленной царской водкой для удаления оставшегося незначительного количества неблагородных примесей, а затем снова загружают в печь и восстанавливают до металла, прокаливая в атмосфере водорода.
Следует иметь в виду, что в нашем рассказе путь этот еще упрощен и укорочен: опущены второстепенные, не несущие самостоятельной «химической нагрузки» стадии. Но в действительности на всех стадиях родиевого производства нет «мелочей». Температурные режимы, концентрация реагентов, продолжительность операций, материалы аппаратуры – все важно. Управление всеми процессами требует больших знаний и громадного опыта.
Сейчас родий вместе с другими платиновыми металлами добывают также из сульфидных медноникелевых руд. Содержание элемента №45 в этих рудах исчисляется миллиграммами на тонну руды. Поэтому собственно аффинажу родия предшествуют сложные технологические операции отделения основных количеств цветных металлов и получения концентрата благородных металлов.
Глава 2. ПРИМЕНЕНИЕ РОДИЯ
Исключительно высокая стойкость платины по отношению к кислотам обеспечивает ей радушный прием в химических лабораториях, где она служит материалом для тиглей, чашей, сеток, трубок, электродов и других лабораторных атрибутов. Большое количество платины требуется также для производства кислото- и жароупорной аппаратуры химических заводов. В технике довольно широко применяют платиновые термометры.
В платиновых тиглях разлагают горные породы – чаще всего, сплавляя их с содой или обрабатывая плавиковой кислотой.
Платиновой посудой пользуются при особо точных и ответственных аналитических операциях.
Платина – лучший катализатор реакции окисления аммиака до окиси азота NO в одном из главных процессов производства азотной кислоты. Катализатор здесь предстает в виде сетки из платиновой проволоки диаметром 0,05. 0,09 мм. В материал сеток введена добавка родия (5. 10%). Используют и тройной сплав – 93% Pt, 3% Rh и 4% Pd. Добавка родия к платине повышает механическую прочность и увеличивает срок службы сетки, а палладий немного удешевляет катализатор и немного (на 1. 2%) повышает его активность. Срок службы платиновых сеток – год-полтора. После этого старые сетки отправляют на аффинажный завод на регенерацию и устанавливают новые. Производство азотной кислоты потребляет значительные количества платины.
Платиновые катализаторы ускоряют многие другие практически важные реакции: гидрирование жиров, циклических и ароматических углеводородов, олефинов, альдегидов, ацетилена, кетонов, окисление SO2 в SO3 в сернокислотном производстве. Их используют также при синтезе витаминов и некоторых фармацевтических препаратов.
Не менее важны платиновые катализаторы в нефтеперерабатывающей промышленности. С их помощью на установках каталитического риформинга получают высокооктановый бензин, ароматические углеводороды и технический водород из бензиновых и лигроиновых фракций нефти. Здесь платину обычно используют в виде мелкодисперсного порошка, нанесенного па окись алюминия, керамику, глину, уголь. В этой отрасли работают и другие катализаторы (алюминий, молибден), но у платиновых – неоспоримые преимущества: большая активность и долговечность, высокая эффективность.
Из сплава платины с 5. 10% родия делают фильеры для производства стеклянного волокна. В платиновых тиглях плавят оптическое стекло, когда особенно важно ничуть не нарушить рецептуру. В химическом машиностроении платина и ее сплавы служат превосходным коррозионностойким материалом. Аппаратура для получения многих особо чистых веществ и различных фторсодержащих соединений изнутри покрыта платиной, а иногда и целиком сделана из нее.
Из сплавов золота с платиной делают детали оборудования для получения синтетического волокна, которые по условиям производства должны обладать исключительной стойкостью к воздействию химических веществ.
Сплав палладия с другими металлами (главным образом, серебром) используют в зубоврачебной технике – из него делают отличные протезы.
Палладием покрывают особо ответственные контакты электронной техники, телефонных аппаратов и других электротехнических приборов. В оптике сплавы золота с палладием применяются чаще, чем золотоплатиновые сплавы, это связано с тем, что палладий сравнительно дешев – его цена в пять раз меньше, чем платины.
Глава 3. РОДИЙ И ЕГО СВОЙСТВА
Ро́дий (лат. Rhodium; обозначается символом Rh ) — элемент побочной подгруппы восьмой группы пятого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 45. Простое вещество родий (CAS-номер: 7440-16-6) — твёрдый переходный металл серебристо-белого цвета. Благородный металл платиновой группы.
Родий содержится в платиновых рудах, в некоторых золотых песках Южной Америки. До 43 % родия содержится в мексиканском золоте. Также содержится в изоморфной примеси минералов группы осмистого иридия (до 3,3 %), в медноникелевых рудах. Редкая разновидность осмистого иридия — родиевый невьянскит — самый богатый родием минерал.
Физические свойства
Родиевая фольга и проволока
Родий — твёрдый металл, серебристо-серого цвета. Имеет высокий коэффициент отражения электромагнитных лучей видимой части спектра, поэтому широко используется для изготовления «поверхностных» зеркал.
Изотопы родия
Природный родий состоит из изотопа 103 Rh. Наиболее долгоживущие изотопы
| Изотоп | Период полураспада |
| 101 Rh | 3,3 года |
| 102 Rh | 207 дней |
| 102m Rh | 2,9 года |
| 99 Rh | 16,1 дней |
Химические свойства
Родий — благородный металл, по химической стойкости в большинстве коррозионных сред превосходит платину.
Металлический родий растворяется в царской водке при кипячении, а также электрохимически, анодно — в смеси перекиси водорода и серной кислоты.
Родий характеризуется высокой химической устойчивостью. С неметаллами он взаимодействует только при температуре красного каления. Мелко измельчённый родий медленно окисляется только при температуре выше 600 °C:
При действии на водные растворы солей и комплексов родия (III) щелочами образуется осадок гидроксида родия Rh(OH)3 :
Гидроксид и оксид родия (III) проявляют основные свойства и взаимодействуют с кислотами с образованием комплексов Rh (III):
В низших степенях окисления +1 и +2 родий образует комплексные соединения.
Применение
Катализаторы
· Родий применяется в катализаторах, в том числе в каталитических фильтрах-нейтрализаторах выхлопных газов автомобилей
· Сплав родия с платиной очень эффективный катализатор для производства азотной кислоты окислением аммиака воздухом и до сих пор его применению нет альтернативной замены.
Конструкционный материал
· при производстве стекла (сплав платина-родий — фильеры для стеклонитей, для жидкокристаллических экранов). В связи с ростом производства жидкокристаллических устройств потребление родия быстро растёт (в 2005 в производстве стекла было использовано 1,55 тонны родия, в 2003 — 0,81 тонны).
· Металлический родий используется для производства зеркал подвергающихся сильному нагреву (калению) для мощных лазерных систем (например фтороводородных лазеров), а также для производства дифракционных решеток к приборам для анализа вещества (спектрометры).
· Тигли из платино-родиевых сплавов используются в лабораторных исследованиях и для выращивания некоторых драгоценных камней и электрооптических кристаллов.
Термопары
· Термопары платина-родий и др., в качестве очень эффективного и долговечного измерения высоких (до 2200 °C) температур нашли широкое применение сплавы родия с иридием (например ИР 40\60).
Материал контактных пар
Благодаря высокой стойкости к электроэрозии родий и его сплавы применяются в качестве материала для контактов (герконы, разъёмы, скользящие контакты).
Ювелирное дело
Используются гальванические электролиты родирования (преимущественно сульфатные, сульфаматные и фосфатные) для получения износостойких и коррозионноустойчивых покрытий.
Холодный белый блеск родия хорошо сочетается с бриллиантами, фианитами и др. вставками. Так же родий добавляют в качестве легирующей, укрепляющей добавки в платину и палладий. Нанесение на ювелирное изделие родиевого покрытия уменьшает износ и увеличивает твердость изделия, защищая от царапин, и придает яркий блеск.
Биологическая роль и физиологическое воздействие
Родий не играет биологической роли.
Соединения родия довольно редко встречаются в повседневной жизни и их воздействие на человеческий организм до конца не изучено. Несмотря на это, они являются высоко токсичными и канцерогенными веществами. LD50 хлорида родия для крыс — 12,6 мг/кг. Соли родия способны сильно окрашивать человеческую кожу.
Глава 4. ИЗВЛЕЧЕНИЕ РОДИЯ ИЗ ОТРАБОТАННЫХ КАТАЛИЗАТОРОВ
Значительные количества родия используются в катализаторах процессов гидроформилирования (оксосинтеза). Этот процесс заключается во взаимодействии олефинов с окисью углерода и водородом при повышенных температурах и давлениях в присутствии некоторых карбонилов металлов, продуктом реакции являются альдегиды:
В этом уравнении Rозначает органический радикал.
Для проведения этой реакции часто используются кобальтсодержащие катализаторы; при этом процесс проводят при относительно высоких температурах, что приводит к увеличению образования изоальдегидов, как правило являющихся нежелательными продуктами. Применение родийсодержащего катализатора позволяет проводить процесс при значительно более мягких условиях с получением более высоких выходов н-альдегидов. Однако в промышленности эти катализаторы находят лишь ограниченное применение, поскольку извлечение и регенерация дорогостоящего металла связаны со значительными трудностями.
Как в периодическом, так и в непрерывном процессе более легко летучие компоненты реакционной смеси, в том числе и продукты реакции, отделяют путем дистилляции; при этом катализатор накапливается в высококипящем остатке от дистилляции. Этот остаток в принципе может быть возвращен в процесс гидроформилирования. Однако не удается рециркулировать весь остаток, поскольку его количество в ходе процесса постепенно возрастает, а активность катализатора постепенно снижается. Таким образом извлечение и регенерация дорогостоящих родиевых катализаторов являются весьма важными для повышения экономичности процессов; однако применявшиеся до настоящего времени методы извлечения не могут считаться удовлетворительными.
Метод включает обработку остатков дистилляции процесса гидроформилирования кислородсодержащими минеральными кислотами и перекисями, в результате чего получается водный раствор родиевой соли. Этот водный раствор обрабатывают катионитом, последний отделяют от раствора и абсорбированные ионы родия десорбируют соляной кислотой. Растворы гексахлорродината, содержащие соляную кислоту, подвергают в присутствии водорастворимого органического растворителя и третичного фосфина PR3 взаимодействию с оксидом углерода или с соединениями, отщепляющими оксид углерода, при температурах 0—150 °С и давлениях 0,1— 0,5 МПа. В результате получают комплексы I или, если процесс проводят в условиях гидрирования, комплексы II, которые выделяют из смеси.
Процесс предназначен для выделения родия из раствора, содержащего карбонильный комплекс родия, образующийся при карбонилировании спиртов, олефиновых или ацетиленовых соединений окисью углерода и водой. Процесс включает перевод выделенного родия в растворимый карбонильный комплекс родия и обработку полученного раствора водородом в присутствии носителя при температуре 25—300 °С и давлении 0,1—70,0 МПа.
После удаления родия раствор отделяют, а родий, осажденный на носителе, переводят в растворимый родиевый карбонильный комплекс действием оксида углерода в присутствии растворителя и соединения, которое может заменять оксид углерода в качестве лиганда; реакцию проводят при температуре 20—300 С и давлении 0,1—70,0 МПа.
Выделение родия происходит из присутствующего в кубовых остатках процесса гидроформилирования ненасыщенных углеводородов, в котором используется родий и триарилфосфит в качестве лиганда. Процесс выделения включает следующие стадии:
Предварительную обработку кубовых остатков совместно органическим растворителем или смесью растворителей, водой в количестве не менее 5 мл на 100 г кубового остатка, газообразным кислородом или соединением, выделяющим кислород и основанием в количестве достаточном для получения величины рН.
1.реакционной смеси после осаждения родия на стадиях 2—7.
2.Нагревание до температуры 0—80 °С с целью окисления триарилфосфитного лиганда в соответствующее фосфатное соединение.
3.Нагревание смеси, полученной на стадии 2, в течение 15—120 мин при 115— 175°С для осаждения металлического родия; в случае необходимости очистка полученного осадка родия на следующих стадиях.
4.Отделение осадка родия.
5.Промывка осадка родия кислотным растворителем при рН = 3-5-4.
6.Обработка осадка родия щелочным раствором восстановителя для восстановления примесей трехвалентного родия в металл.
7.Обработка родия ледяной уксусной кислотой.
9. Промывка родия, кислым раствором при рН = 3-10. Сушка родия в инертной атмосфере при 250—400 «С.
Родий извлекают из высококипящих смолистых остатков дистилляции, получаемых при переработке реакционных смесей, образующихся при превращении органических соединений в присутствии гомогенных комплексных родиевых катализаторов. В качестве примера таких реакций могут быть упомянуты гидроформилирование, гидрокарбоксилирование, изомеризация, димеризация или олигомеризация. Выделение катализатора проводят путем пропускания тока не окисляющего, предпочтительно восстанавливающего газа, например водорода или fводородсодержащего газа, через остатки от дистилляции при повышенной температуре. В результате достигается селективное удаление органических компонентов и получается гетерогенный остаток, содержащий родий. Этот остаток растворяют в неорганической кислоте, получая водорастворимое соединение родия, которое может быть использовано для приготовления комплексного родиевого катализатора. Предпочтительно в качестве неорганической кислоты применять олеум и после его смешивания с гетерогенным остатком проводить частичное упаривание. На рис. 3 представлен лабораторный аппарат, который может быть использован для проведения этого процесса.
Гомогенный раствор, в состав которого входит родиевый комплекс, и высококипящие остатки от дистилляции, нагревают в реакторе, через который непрерывно проходит поток газа. На схеме применены следующие обозначения: 1 — верхняя часть стеклянного реактора; 2 —- нижняя часть стеклянного реактора; 3 — нагреватель; 4 — термопара; 5а — металлический капилляр со стеклянной входной трубкой; 56 — стеклянный капилляр; 6 — трубка для выхода продуктов. Все компоненты кубового остатка и продукты, образующиеся в результате пиролиза, выносятся из реактора током газа, а получающийся металл остается в реакционной камере.
Ниже приводится конкретный пример осуществления данного процесса. Нагревают 500 г н-валерьянового альдегида при 300 °С в течение 72 ч в автоклаве с поршневой мешалкой. Затем отгоняют низкокипящие продукты поликонденсации в высоком вакууме. Растворяют 300 мг HRh(CO)(PR3 )3 и 1200 мг РРп3 в 15 мл остатка, образовавшегося при дистилляции, при =;100°С с пропусканием водорода. Водород подают с постоянной скоростью 0,4 л/мин.
После выхода из реакционной камеры газовый поток пропускают через две последовательно соединенные промывные склянки — с вышеупомянутыми продуктами поликонденсации и с толуолом. Реактор нагревают при температуре 300 °С в течение 90 мин и затем охлаждают. В реакторе образуется 169 мг твердого остатка.
Ни в одной из промывных склянок родий не обнаруживается; таким образом, весь имеющийся родий входит в состав твердого остатка.