газ хлор чем пахнет
Имеет ли запах хлор
Содержание статьи
Свойства хлора
Хлор, будучи простым веществом, при нормальных условиях в два с половиной раза тяжелее воздуха. По этой причине опасны утечки такого газа: он способен заполнять подвалы, нижние этажи зданий, овраги.
Этот газ желто-зеленого цвета обладает резким запахом. Иногда хлористый запах может показаться сладковатым. Примерно так же пахнет и хлорная известь.
Хлор обладает очень высокой активностью. Он может соединяться почти с каждым химическим элементом из периодической системы. По этой причине в естественных условиях этот газ встречается только в виде соединений или включается в состав минералов.
Впервые хлор был получен в лабораторных условиях Карлом Шееле. Шведский химик описал свойства газа и то, как он выделяется при взаимодействии между соляной кислотой и пиролюзитом. Шееле отметил, что запах хлора в чем-то схож с запахом «царской водки» и указал на отбеливающие свойства газа.
В 1811 году для нового химического элемента было предложено название: «хлорин». Через год химики сократили это наименование, назвав газ хлором. Одновременно был введен термин «галоген». В буквальном переводе это означает «солерод». Приписав это название тому же хлору, ученые впоследствии распространили новый термин на целую группу химических элементов, в которую включен и хлор.
Отравление хлором
Газообразный хлор и его химические соединения, которые содержат этот газ в активной его форме, токсичны, опасны для здоровья человека и животных. При вдыхании хлора вполне возможно острое (или же хроническое) отравление. Для всех форм отравления хлором характерна резкая реакция на действие газа. Газ раздражает рецепторы слизистой оболочки дыхательных путей. Это вызывает защитные симптомы. У человека появляется кашель, текут слезы, першит в горле.
Хлор способен взаимодействовать с влагой, которая содержится в слизистой оболочке. При этом образуется соляная кислота – она и оказывает токсическое действие на организм.
Если концентрация хлора в окружающей среде достаточно высока, человек может уже через несколько минут погибнуть. Сужение голосовой щели ведет к остановке дыхания, наступает потеря сознания. Вены на лице и шее вздуваются.
При средней тяжести отравления у пострадавших сохраняется сознание, но возможна рефлекторная остановка дыхания на некоторое время. Другие симптомы: боль за грудиной, резь в глазах.
При легкой форме отравления лишь раздражаются верхние дыхательные пути. Симптомы проходят через несколько дней.
Первая помощь при отравлении хлором

Что представляет собой хлор и где применяется
Хлор, как химический элемент, относится к группе галогенов, присутствует во всех живых организмах в виде различных соединений. Ионы этого вещества активно участвуют в обменных процессах организма в качестве водно-солевых растворов, способствуют снижению повышенной активности нейронов, а также улучшению выработки желудочного сока и соляной кислоты. Для взрослого человека суточной нормой потребления хлора является примерно 0,8 граммов вещества, которые восполняются за счет употребления поваренной соли.
Сам же по себе хлор довольно токсичен, представляет собой желтовато-зеленый газ с металлическим привкусом и резким запахом. Этот химический элемент хорошо растворяется в воде, а также в других органических жидкостях. Его массово используют в бытовой и промышленной сферах.
Хлор применяется для обеззараживания питьевой и сточной воды, для изготовления ядохимикатов, с помощью которых уничтожают грызунов и насекомых, для отбеливания тканей в промышленных и домашних условиях. Его используют как один из компонентов боевых отравляющих веществ. Немаловажен хлор в металлургическом производстве и в изготовлении пластмасс. Медицинская отрасль активно использует хлор для создания лекарственных препаратов, пищевых добавок.
Однако его высокая токсичность привела к тому, что данное вещество запрещено использовать в ряде европейских стран. При сжигании хлор образует очень опасное вещество – диоксин, обладающее иммунодепрессивным, тератогенным, канцерогенным и эмбриотоксическим эффектами.

Как можно отравиться хлором
Чаще всего отравление хлором и хлорсодержащими веществами возможно в таких ситуациях:
Особенно опасно отравление, контакт с токсическими веществами, в частности и с хлорсодержащими соединениями, для маленьких детей. Гораздо меньшая доза токсина может стать причиной интоксикации у ребенка в сравнении со взрослым и привести к непоправимым последствиям.
Симптомы отравления хлором
Проявления интоксикации зависят от пути поступления яда в организм: через органы дыхания (ингаляционно); через пищеварительный тракт (при приеме внутрь); через кожные покровы; а также от количества и времени воздействия на человека.
Различают три степени тяжести отравления хлором и хлорсодержащими веществами: легкая, средняя и тяжелая. При очень высоких концентрациях яда отравление наступает мгновенно.
Проявления отравления хлором легкой степени характеризуются:
Симптомы при поступлении яда через верхние дыхательные пути:
Симптомы при поступлении яда через желудочно-кишечный тракт:
При попадании яда на кожные покровы и слизистые:

Отравление хлором может изначально напоминать состояние опьянения, затем сонливости, переходящее в нарушение сознания, вплоть до комы, в зависимости от количества яда, поступившего в организм. Это состояние может длится приблизительно трое-четверо суток, и заканчивается в лучшем случае выходом из комы с возможными серьезными осложнениями, поражением печени, почек, легких.
При молниеносном течении все симптомы проявляются в крайне-тяжелой форме за кратчайший промежуток времени: внезапно развивающееся удушье с отеком легких, возможен судорожный синдром, нарушение ритма сердца, приводящее к остановке дыхания, сердечной деятельности.
Первая помощь при отравлении хлором

Чем можно помочь человеку при отравлении хлором:
После оказания первой помощи больного обязательно нужно доставить в медицинское учреждение для дальнейшего наблюдения и лечения. Первые сутки пациент должен находиться под наблюдением квалифицированного персонала, это поможет избежать многих неприятных серьезных последствий и предотвратить возникновение возможных тяжелых осложнений.
При лечении в стационаре терапия направлена на восстановление и поддержание жизненно-важных функций организма пострадавшего:
Возможные последствия и профилактика отравления хлором
При легких формах интоксикации хлором осложнения, как правило, отсутствуют. Выздоровление наступает спустя несколько суток после поступления токсина в организм.

Чтобы обезопасить себя от таких последствий и от возможности отравления хлором, необходимо соблюдать правила техники безопасности при работе с опасными веществами на производстве, а также в домашних условиях:
В заключение
Больше свежей и актуальной информации о здоровье на нашем канале в Telegram. Подписывайтесь: https://t.me/foodandhealthru
Газ хлор чем пахнет
Хлор
Хлор – ядовитое вещество, газ. Цвет желто-зеленый, тяжелее воздуха. При распространении хлора всегда ощущается резкий запах с «металлическим» «сладковатым» привкусом. Формула хлора простая двухатомная Cl2.. Производство этого вещества в больших количествах обусловлено не только необходимостью обеззараживать воду. но и целым рядом многочисленных производственных процессов при создании необходимых для человечества вещей.
Применение хлора
Свойства хлора
Воздействие хлора на человека
Хлор очень опасное химическое вещество для человека. При контакте с хром или нахождение человека в зоне выброса хлора со слизистой оболочками тела проходит реакция. Образуется соляная кислота, вызывающая отек легких, поражение кожных покровов, слизистой глаз и носа. При вдыхании высококонцентрированной смеси газа происходит ожог легких и приводит к удушью.
Поэтому в случае утечки хлора при транспортировке или при аварии на производстве, где используют вещество в больших количествах, локализация аварий происходит в специальной одежде с использованием СИЗОД.
Для работ с хлором идеально подходят изолирующие костюмы серии Стрелец. Чаще всего используется костюм скафандр Стрелец АЖ ТАСК – полная защита человека и дыхательной системы от контакта с хлором. Подробнее о защитных свойствах, комплектации, сроке службы костюмов смотрите здесь – Изолирующие костюмы Стрелец.
Влияние хлора на организм человека. Отравление парами хлора
Хлор, можно сказать, уже постоянный спутник нашей повседневной жизни. Редко в каком доме не будет бытовых средств, основанных на обеззараживающем действии данного элемента.
Но вместе с тем он очень опасен для человека! Хлор может проникнуть в организм через слизистую оболочку дыхательной системы, пищеварительных путей, кожные покровы. Отравиться им можно и дома, и на отдыхе — во многих бассейнах, аквапарках он является основным средством водоочистки.
Влияние хлора на организм человека резко негативное, он может стать причиной серьезных дисфункций и даже смерти. Поэтому каждому нужно быть в курсе симптоматики отравления, методов оказания первой помощи.
Хлор — что это за вещество
Хлор — газообразный элемент желтоватого цвета. Обладает резким специфичным запахом — хлорки (хлорной извести). В газообразном виде, а также в химических формах, что подразумевают его активное состояние, опасен, токсичен для человека.
Хлор в 2,5 раз тяжелее воздуха, поэтому при утечке будет стелиться по оврагам, пространствам первых этажей, по полу помещения. При вдыхании его у пострадавшего может развиться одна из форм отравления. Об этом поговорим далее.
Симптомы отравления
Как длительное вдыхание паров, так и иное воздействие вещества очень опасно. Так как оно активно, то влияние хлора на организм человека проявляется быстро. Токсичный элемент в большей степени поражает глаза, слизистые и кожные покровы.
Отравление может быть как острым, так и хроническим. Однако в любом случае при несвоевременном оказании помощи грозит летальный исход!
Симптоматика при отравлении парами хлора может быть разной — в зависимости от специфики случая, длительности воздействия и прочих факторов. Для удобства мы разграничили признаки в таблице.
Таково влияние хлора на организм человека. Поговорим о том, где можно отравиться его ядовитыми парами и как оказать первую помощь в этом случае.
Отравление дома
Отравление может грозить вам и дома, в случае, если вы нарушили инструкцию по применению «Дез-хлора». Также часто встречается хроническая форма отравления. Она развивается, если домохозяйка часто использует для наведения чистоты следующие средства:
Последствия воздействия хлора на организм
Постоянное воздействие даже малых доз хлора (агрегатное состояние может быть любым) на человеческий организм грозит для людей следующим:
Если вы заметили у себя один из недугов, перечисленных выше, при условии, что постоянно или однократно (случаи посещения бассейна сюда тоже относится) подвергались влиянию паров хлора, то это повод для скорейшего обращения к специалисту! Доктор назначит комплексную диагностику для изучения природы заболевания. Изучив ее результаты, затем он назначит лечение.
Первая помощь при отравлении
Хлор – газ, вдыхать который очень опасно, особенно в больших объемах! При средней, тяжелой форме отравления пострадавшему нужно немедленно оказать первую помощь:
Медикаментозная помощь при отравлении
До приезда бригады скорой медпомощи можно самостоятельно помочь потерпевшему, используя ряд бытовых и медикаментозных препаратов:
Профилактика
Зная, насколько опасен хлор, какое вещество оказывает действие на организм человека, лучше всего заранее позаботиться о снижении или исключении его негативного влияния на свой организм. Добиться этого можно следующими способами:
Работа с хлором всегда требует осторожности как в промышленных масштабах, так и в бытовых. Вы знаете, как диагностировать у себя признаки отравления веществом. Помощь же пострадавшему нужно оказывать незамедлительно!
Для оповещения населения, проживающего в зоне возможного химического заражения, связанной с выбросом АХОВ, используется единый сигнал — «Внимание всем!», подаваемый на объекте, где произошел выброс, путём коротких звонков, сирен, других характерных звуков тревоги, через громкоговорители.
Действия:
— закрыть входные двери, окна (в первую очередь – с наветренной стороны);
— заклеить (закрыть задвижки) вентиляционные отверстия плотным материалом или бумагой;
— двери уплотнить влажными материалами (мокрой простыней, одеялом и т.п.);
— щели оконных проёмов заклеить изнутри липкой лентой (пластырем, бумагой) или уплотнить подручными материалами (поролоном, мягким шнуром и т.п.);
— закрыть нос и рот ватно-марлевой повязкой (свернутой в несколько слоев тканью), смоченной слабым кислым (если АХОВ — аммиак) или щелочным (если АХОВ — хлор) раствором;
— одеть противопыльные (защитные, для бассейна) очки различного устройства:
СПб ГКУ «ПСО Адмиралтейского района»
Газ хлор чем пахнет
ХЛОР, химический элемент VII группы периодической системы, относится к галогенам. Атомный номер 17, относительная атомная масса 35,453. Природный хлор состоит из смеси двух изотопов – хлора-35 (75,77%) и хлора-37 (24,23%).
История получения.
Хлор, вероятно, получали еще алхимики, но его открытие и первое исследование неразрывно связано с именем знаменитого шведского химика Карла Вильгельма Шееле. Шееле открыл пять химических элементов – барий и марганец (совместно с Юханом Ганом), молибден, вольфрам, хлор, а независимо от других химиков (хотя и позже) – еще три: кислород, водород и азот. Это достижение впоследствии не смог повторить ни один химик. При этом Шееле, уже избранный членом Шведской королевской академии наук, был простым аптекарем в Чёпинге, хотя мог занять более почетную и престижную должность. Сам Фридрих II Великий, прусский король, предлагал ему занять пост профессора химии Берлинского университета. Отказываясь от подобных заманчивых предложений, Шееле говорил: «Я не могу есть больше, чем мне нужно, а того, что я зарабатываю здесь в Чёпинге, мне хватает на пропитание».
Многочисленные соединения хлора были известны, конечно, задолго до Шееле. Этот элемент входит в состав многих солей, в том числе и самой известной – поваренной соли. В 1774 Шееле выделил хлор в свободном виде, нагревая черный минерал пиролюзит с концентрированной соляной кислотой: MnO2 + 4HCl ® Cl2 + MnCl2 + 2H2O.
Вначале химики рассматривали хлор не как элемент, а как химическое соединение неизвестного элемента мурия (от латинского muria – рассол) с кислородом. Считалось, что и соляная кислота (ее называли муриевой) содержит химически связанный кислород. Об этом «свидетельствовал», в частности, такой факт: при стоянии раствора хлора на свету из него выделялся кислород, а в растворе оставалась соляная кислота. Однако многочисленные попытки «оторвать» кислород от хлора ни к чему не привели. Так, никому не удалось получить углекислый газ, нагревая хлор с углем (который при высоких температурах «отнимает» кислород от многих содержащих его соединений). В результате подобных опытов, проведенных Гемфри Дэви, Жозеф Луи Гей-Люссаком и Луи Жаком Тенаром, стало ясно, что хлор не содержит кислорода и является простым веществом. К тому же выводу привели и опыты Гей-Люссака, который проанализировал количественное соотношение газов в реакции хлора с водородом.
В 1811 Дэви предложил для нового элемента название «хлорин» – от греч. «хлорос» – желто-зеленый. Именно такой цвет имеет хлор. Этот же корень – в слове «хлорофилл» (от греч. «хлорос» и «филлон» – лист). Спустя год Гей-Люссак «сократил» название до «хлора». Но до сих пор англичане (и американцы) называют этот элемент «хлорином» (chlorine), тогда как французы – хлором (chlore). Приняли сокращенное название и немцы – «законодатели» химии на протяжении почти всего 19 в. (по-немецки хлор – Chlor). В 1811 немецкий физик Иоганн Швейгер предложил для хлора название «галоген» (от греческих «халс» – соль, и «геннао» – рождаю). Впоследствии этот термин закрепился не только за хлором, но и за всеми его аналогами по седьмой группе – фтором, бромом, иодом, астатом.
В 1826 шведский химик Йёнс Якоб Берцелиус, уточнив полученные им же ранее данные, определил для хлора атомную массу 35,41, которая отличается от современной лишь на 0,1%! Это поразительный результат, если учесть качество оборудования, с которым работал знаменитый химик. Основной инструмент для определения атомных масс – весы. Когда-то каждый экземпляр точных аналитических весов изготовлялся мастером вручную, и стоили хорошие весы очень дорого. Поэтому лишь немногие очень богатые химики могли похвастаться такими весами. Сам Берцелиус имел в молодые годы плохо оборудованную лабораторию с довольно грубыми весами, поэтому для получения надежных результатов он был вынужден повторять один и тот же анализ по 20–30 раз! В течение 10 лет Берцелиус опубликовал результаты анализа 2000 соединений, образованных 43 элементами, и труд, затраченный им на эту колоссальную работу, превосходит всякое воображение. Спустя почти столетие другой знаменитый химик, один из первых лауреатов Нобелевской премии по химии Вильгельм Оствальд, увидев в музее оборудование, с которым работал Берцелиус, сказал: «Мне стало совершенно ясно, как мало зависит от прибора и как много от человека, который перед ним сидит».
Хлор в природе.
Хлора в земное коре не очень много – всего 0,017%, причем в свободном состоянии он встречается лишь в небольших количествах в вулканических газах. В списке самых распространенных элементов хлор находится в конце второго десятка. Хлора меньше, чем даже ванадия и циркония (но больше, чем хрома, никеля, цинка, меди и азота). При этом хлор очень сильно распылен: небольшие количества этого элемента входят в состав множества различных минералов и горных пород. Очень высокая химическая активность хлора приводит к тому, что в природе он встречается, как правило, в виде соединений, в сочетании с натрием, калием, магнием, кальцием.
Хлор образует около ста минералов; главным образом это хлориды легких металлов – щелочных и щелочноземельных. Самый распространенный среди них – галит NaCl. Реже встречаются хлориды калия, кальция, магния. Из них наиболее распространены бишофит MgCl2·6H2O, карналлит KCl·MgCl2·6H2O, сильвин KCl, сильвинит NaCl·KCl, каинит KCl·MgSO4·3H2O, тахигидрит CaCl2·2MgCl2·12H2O. В виде таких соединений хлор содержится в соляных пластах, образовавшихся при высыхании древних морей. Особенно мощные залежи образует галит и калийные соли; их запасы оцениваются гигантским числом – более 10 триллионов тонн!
Очень много хлора содержится в морской воде – в среднем 1,9%. Происходит это потому, что хлор вымываемый из пород, нигде не может задержаться (почти все хлориды металлов растворимы) и выносится реками в моря и океаны. Но не следует думать, что попавший в морскую воду хлор уже не может вернуться на материки. В обратной миграции хлора большую роль играет ветер, уносящий соленую пыль с поверхности океанов, морей и соленых озер. Так хлор участвует в круговороте веществ. Но в засушливых и пустынных районах в результате интенсивного испарения воды концентрация хлора в грунтовых водах сильно повышается. Так образуются солончаки, особенно в низинах. Из различных источников ежегодно в мире добывают сотни миллионов тонн хлора.
Растворы хлоридов – обязательная составная часть живых организмов. Содержание хлора в теле человека 0,25%, в плазме крови – 0,35%. В теле взрослого человека содержится более 200 г хлорида натрия, из которых 45 г растворено в крови. В продуктах питания и природной воде часто недостаточно хлора для нормального развития человека, поэтому с древних времен люди подсаливают пищу. Вводят хлор и в подкормку животных. Растения же, в отличие от животных, никогда не испытывают дефицита хлора.
Получение хлора.
Метод Шееле в настоящее время используют редко – разве только во время лекционных демонстраций. В лабораториях для получения хлора используют более сильный окислитель – перманганат калия, который окисляет соляную кислоту уже при комнатной температуре: 2KMnO4 + 16HCl ® 2KCl + 2MnCl2 + 8H2O + 5Cl2. Этот способ был предложен немецким химиком Карлом Гребе. Аналогично идет реакция и с дихроматом калия:
K2Cr2O7 + 14HCl ® 2KCl + 2CrCl3 + 3Cl2 + 7H2O. Хлор выделяется также при действии соляной кислоты на хлорную известь: Ca(OCl)Cl + 2HCl ® CaCl2 + Cl2 + H2O. Можно окислить соляную кислоту до свободного хлора и концентрированным раствором пероксида водорода – пергидролем (реакция лучше идет на ярком свету). В 1867 английский технолог Генри Дикон разработал непрерывный способ получения хлора путем каталитического окисления хлороводорода кислородом воздуха над медным катализатором (диконовский процесс): 4HCl + O2 ® 2Cl2 + 2H2O. Сейчас этот метод имеет лишь историческое значение.
После того, как Алессандро Вольта создал в 1799 первый химический источник постоянного тока (вольтов столб), многие ученые начали изучать действие этого источника на различные вещества. Оказалось, что при пропускании тока через раствор поваренной соли можно получить хлор и гидроксид натрия. Однако промышленное значение этот метод приобрел только после 1872, когда для производства дешевой электроэнергии начали использовать изобретенные бельгийским мастером З.Т.Граммом динамо-машины. В настоящее время практически весь хлор получают электролизом водных растворов хлорида натрия: 2NaCl + 2H2O ® Cl2 + 2NaOH + H2. При этом хлор выделяется на аноде, тогда как на катоде также образуются ценные вещества – водород и гидроксид натрия. Путем повышения давления хлор сжижают и заливают в стальные баллоны, где он хранится под давлением около 6 атм. Чтобы выделяющийся при электролизе хлор не разрушал аноды, их делают из титановых сплавов и покрывают оксидами титана и рутения. Производство это энергоемкое – на тонну хлора расходуется в среднем 3000 кВт-ч электроэнергии. В развитых странах на производство хлора затрачивается около 2% всей вырабатываемой электроэнергии! Но одновременно получают и другие ценные продукты – едкий натр и водород. Получают свободный хлор в огромных количествах. Так, к началу 21 в. только в США его ежегодно производили в количестве более 11 млн. тонн!
Свойства хлора.
Хлор – тяжелый (в 2,5 раза тяжелее воздуха) желто-зеленый газ. Молекулы Cl2 легко диссоциируют на атомы при поглощении кванта света, а также при высокой температуре. При 730° С степень диссоциации составляет около 0,02%, а при 1730° С – уже почти 35%. При невысоких давлениях хлор близок к идеальным газам: 1 моль хлора при нормальных условиях занимает объем 22,06 л. При охлаждении до –34° С хлор сжижается, а при –101° С он затвердевает. Температуру сжижения газообразного хлора легко повысить, если увеличить давление; так при давлении 5 атм хлор кипит уже при +10,3° С.
Хлор неплохо растворяется в воде: при 10° С в 1 л воды растворяется 3,15 л хлора, при 20° С – 2,3 л. Образующийся раствор обычно называют хлорной водой. Если насытить хлором при атмосферном давлении холодную (ниже 9,6° С) воду, из раствора выделяются желтоватые кристаллы состава Cl2·6H2O. Такие же кристаллы гидрата хлора образуются при охлаждении влажного газообразного хлора. Нагревая гидрат хлора в одном колене запаянной изогнутой трубки и охлаждая второе колено льдом, Фарадей в 1823 получил жидкий хлор. Хлор хорошо растворяется во многих органических растворителях; так, в 100 г холодного бензола растворяется около 35 г хлора.
Химически хлор очень активен. Он реагирует почти со всеми веществами, даже с платиной (при температурах выше 560° С). А в хлорной воде растворяется и золото. В 1869 профессор химии в Эдинбурге Джемс Альфред Уанклин заметил, что хорошо высушенный хлор не действует на железо и некоторые другие металлы. В результате появилось возможность хранить безводный жидкий хлор в стальных баллонах. Промышленное производство жидкого хлора было налажено в 1888 немецкой фирмой БАСФ.
Высокую химическую активность хлора используют для демонстрации эффектных лекционных опытов. Так, при высыпании в колбу с хлором тонкого порошка металлической сурьмы он вспыхивает на лету красивыми белыми искорками, одновременно образуется белый дым SbCl3. Если в сосуд с хлором внести тонкую оловянную фольгу, она также самовоспламеняется, а на дно падает «огненный дождь»; в этой реакции образуются капли тяжелой дымящейся жидкости – SnCl4. Нагретые железные стружки горят в хлоре красноватым пламенем с образованием рыжего дыма FeCl3. Красный фосфор, внесенный в хлор, горит слабым зеленоватым пламенем. Очень энергично реагирует с хлор с рядом органических соединений. Так, если в цилиндр с хлором бросить комок ваты, смоченной скипидаром, он сразу же загорается, а из цилиндра вырывается пламя и облако сажи. Эффектно горит желтым пламенем в хлоре натрий, образуя на стенках сосуда белый налет соли. Этот опыт в молодости провел будущий академик, лауреат Нобелевской премии по химии Н.Н.Семенов. Собрав со стенок сосуда белый налет, он посыпал им кусок черного хлеба и смело съел; химия не подвела: из ядовитого газа и щелочного металла действительно получилась поваренная соль!
Хлор активно и с выделением значительного количества тепла реагирует с водородом:
Cl2 + H2 ® 2HCl + 184 кДж. Реакция идет по цепному механизму, и если скорость ее инициирования велика (сильное освещение ультрафиолетовым или сине-фиолетовым светом, нагрев до высокой температуры), смесь газов (если хлора в ней содержится более 11,5 и менее 95%) взрывается (см. также ЦЕПНЫЕ РЕАКЦИИ).
Интересна демонстрация горения водорода в атмосфере хлора: иногда во время опыта возникает необычный побочный эффект: раздается гудение. Чаще всего пламя гудит, когда тонкую трубку, по которой подается водород, опускают в заполненный хлором сосуд конической формы; то же справедливо для сферических колб, а вот в цилиндрах пламя обычно не гудит. Это явление назвали «поющим пламенем».
В водном растворе хлор частично и довольно медленно реагирует с водой; при 25° С равновесие: Cl2 + H2O 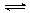
Хлор в своих соединениях может проявлять все степени окисления – от –1 до +7. С кислородом хлор образует ряд оксидов, все они в чистом виде нестабильны и взрывоопасны: Cl2O – желто-оранжевый газ, ClO2 – желтый газ (ниже 9,7 о С – яркокрасная жидкость), перхлорат хлора Cl2O4 (ClO–ClO3, светло-желтая жидкость), Cl2O6 (O2Cl–O–ClO3, ярко-красная жидкость), Cl2O7 – бесцветная очень взрывчатая жидкость. При низких температурах получены нестабильные оксиды Cl2O3 и ClO3. Оксид ClO2 производится в промышленном масштабе и используется вместо хлора для отбеливания целлюлозы и обеззараживания питьевой воды и сточных вод. С другими галогенами хлор образует ряд так называемых межгалогенных соединений, например, ClF, ClF3, ClF5, BrCl, ICl, ICl3.
Хлор и его соединения с положительной степенью окисления – сильные окислители. В 1822 немецкий химик Леопольд Гмелин путем окисления хлором получил из желтой кровяной соли красную: 2K4[Fe(CN)6] + Cl2 ® K3[Fe(CN)6] + 2KCl. Хлор легко окисляет бромиды и хлориды с выделением в свободном виде брома и иода.
Хлор в разных степенях окисления образует ряд кислот: HCl – хлороводородная (соляная, соли – хлориды), HClO – хлорноватистая (соли – гипохлориты), HClO2 – хлористая (соли – хлориты), HClO3 – хлорноватая (соли – хлораты), HClO4 – хлорная (соли – перхлораты). В чистом виде из кислородных кислот устойчива только хлорная. Из солей кислородных кислот практическое применение имеют гипохлориты, хлорит натрия NaClO2 – для отбеливания тканей, для изготовления компактных пиротехнических источников кислорода («кислородные свечи»), хлораты калия (бертолетова соль), кальция и магния (для борьбы с вредителями сельского хозяйства, как компоненты пиротехнических составов и взрывчатых веществ, в производстве спичек), перхлораты – компоненты взрывчатых веществ и пиротехнических составов; перхлорат аммония – компонент твердых ракетных топлив.
Хлор реагирует со многими органическими соединениями. Он быстро присоединяется к непредельным соединениям с двойными и тройными углерод-углеродными связями (реакция с ацетиленом идет со взрывом), а на свету – и к бензолу. При определенных условиях хлор может замещать атомы водорода в органических соединениях: R–H + Cl2 ® RCl + HCl. Эта реакция сыграла значительную роль в истории органической химии. В 1840-х французский химик Жан Батист Дюма обнаружил, что при действии хлора на уксусную кислоту с удивительной легкостью идет реакция
СН3СООН + Cl2 ® CH2ClCOOH + HCl. При избытке хлора образуется трихлоруксусная кислота ССl3СООН. Однако многие химики отнеслись к работе Дюма недоверчиво. Ведь согласно общепринятой тогда теории Берцелиуса положительно заряженные атомы водорода не могли заместиться отрицательно заряженными атомами хлора. Этого мнения придерживались в то время многие выдающиеся химики, среди которых были Фридрих Вёлер, Юстус Либих и, конечно, сам Берцелиус.
Чтобы высмеять Дюма, Вёлер передал своему другу Либиху статью от имени некоего Ш.Виндлера (Schwindler – по-немецки мошенник) о новом удачном приложении якобы открытой Дюма реакции. В статье Вёлер с явной издёвкой написал о том, как в уксуснокислом марганце Mn(CH3COO)2 удалось все элементы, в соответствии с их валентностью, заместить на хлор, в результате чего получилось желтое кристаллическое вещество, состоящее из одного только хлора. Далее говорилось, что в Англии, последовательно замещая в органических соединениях все атомы на атомы хлора, обычные ткани превращают в хлорные, и что при этом вещи сохраняют свой внешний вид. В сноске было указано, что лондонские лавки бойко торгуют материалом, состоящим из одного хлора, так как этот материал очень хорош для ночных колпаков и теплых подштанников.
Либиху шутка понравилась, и он опубликовал ее (на французском языке) от имени Ш.Виндлера всего через несколько страниц после статьи Дюма. Намек получился очень прозрачным. Тем не менее прав оказался все же Дюма.
Реакция хлора с органическими соединениями приводит к образованию множества хлорорганических продуктов, среди которых – широко применяющиеся растворители метиленхлорид CH2Cl2, хлороформ CHCl3, четыреххлористый углерод CCl4, трихлорэтилен CHCl=CCl2, тетрахлорэтилен C2Cl4. В присутствии влаги хлор обесцвечивает зеленые листья растений, многие красители. Этим пользовались еще в XVIII в. для отбеливания тканей.
Хлор как отравляющий газ.
Получивший хлор Шееле отметил его очень неприятный резкий запах, затруднение дыхания и кашель. Как потом выяснили, человек чувствует запах хлора даже в том случае, если в одном литре воздуха содержится лишь 0,005 мг этого газа, и при этом он уже оказывает раздражающее действие на дыхательные пути, разрушая клетки слизистой оболочки дыхательных путей и легких. Концентрация 0,012 мг/л переносится с трудом; если же концентрация хлора превышает 0,1 мг/л, он становится опасным для жизни: дыхание учащается, становится судорожным, а затем – все более редким, и уже через 5–25 минут происходит остановка дыхания. Предельно допустимой в воздухе промышленных предприятий считается концентрация 0,001 мг/л, а в воздухе жилых районов – 0,00003 мг/л.
Петербургский академик Товий Егорович Ловиц, повторяя в 1790 опыт Шееле, случайно выпустил значительное количество хлора в воздух. Вдохнув его, он потерял сознание и упал, потом в течение восьми дней страдал от мучительной боли в груди. К счастью, он выздоровел. Чуть не умер, отравившись хлором, и знаменитый английский химик Дэви. Опыты даже с небольшим количеством хлора опасны, так как могут вызвать сильное поражение легких. Рассказывают, что немецкий химик Эгон Виберг одну из своих лекций о хлоре начал словами: «Хлор – ядовитый газ. Если я отравлюсь во время очередной демонстрации, вынесите меня, пожалуйста, на свежий воздух. Но лекцию при этом придется, к сожалению, прервать». Если же выпустить в воздух много хлора, он становится настоящим бедствием. Это испытали на себе во время Первой мировой войны англо-французские войска. Утром 22 апреля 1915 германское командование решило провести первую в истории войн газовую атаку: когда ветер подул в сторону противника, на небольшом шестикилометровом участке фронта в районе бельгийского городка Ипр были одновременно открыты вентили 5730 баллонов, каждый из которых содержал 30 кг жидкого хлора. В течение 5 минут образовалось огромное желто-зеленое облако, которое медленно уходило от немецких окопов в сторону союзников. Английские и французские солдаты оказались полностью беззащитными. Газ проникал через щели во все укрытия, от него не было спасения: ведь противогаз еще не был изобретен. В результате было отравлено 15 тысяч человек, из них 5 тысяч – насмерть. Через месяц, 31 мая немцы повторили газовую атаку на восточном фронте – против русских войск. Это произошло в Польше у города Болимова. На фронте 12 км из 12 тысяч баллонов было выпущено 264 тонны смеси хлора со значительно более ядовитым фосгеном (хлорангидридом угольной кислоты COCl2). Царское командование знало о том, что произошло при Ипре, и тем не менее русские солдаты не имели никаких средств защиты! В результате газовой атаки потери составили 9146 человек, из них только 108 – в результате ружейного и артиллерийского обстрела, остальные были отравлены. При этом почти сразу же погибло 1183 человека.
Вскоре химики указали, как спасаться от хлора: надо дышать через марлевую повязку, пропитанную раствором тиосульфата натрия (это вещество применяется в фотографии, его часто называют гипосульфитом). Хлор очень быстро реагирует с раствором тиосульфата, окисляя его:
Na2S2O3 + 4Cl2 + 5H2O ® 2H2SO4 + 2NaCl + 6HCl. Конечно, серная кислота тоже не безвредное вещество, но ее разбавленный водный раствор намного менее опасен, чем ядовитый хлор. Поэтому у тиосульфата в те годы появилось еще одно название – «антихлор», но первые тиосульфатные противогазы были мало эффективны.
Применение хлора.
Ежегодно во всем мире получают огромные количества хлора – десятки миллионов тонн. Только в США к концу 20 в. ежегодно путем электролиза получали около 12 млн. тонн хлора (10-е место среди химических производств). Основная его масса (до 50%) расходуется на хлорирование органических соединений – для получения растворителей, синтетического каучука, поливинилхлорида и других пластмасс, хлоропренового каучука, пестицидов, лекарственных средств, многих других нужных и полезных продуктов. Остальное потребляется для синтеза неорганических хлоридов, в целлюлозно-бумажной промышленности для отбеливания древесной пульпы, для очистки воды. В сравнительно небольших количествах хлор используют в металлургической промышленности. С его помощью получают очень чистые металлы – титан, олово, тантал, ниобий. Сжиганием водорода в хлоре получают хлороводород, а из него – соляную кислоту. Хлор применяют также для производства отбеливающих веществ (гипохлоритов, хлорной извести) и обеззараживания воды хлорированием.
Якименко Л.М. Производство хлора, каустической соды и неорганических хлоропродуктов. М., Химия, 1974
Барков С.А. Галогены и подгруппа марганца: Элементы VII группы периодической системы Д.И.Менделеева. М., Просвещение, 1976
Фурман А.А. Неорганические хлориды. М., Химия, 1980