гальванический элемент что это
Гальванический элемент
Гальвани́ческий элеме́нт — химический источник электрического тока, основанный на взаимодействии двух металлов и (или) их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока. Назван в честь Луиджи Гальвани.
Содержание
История изучения гальванических процессов
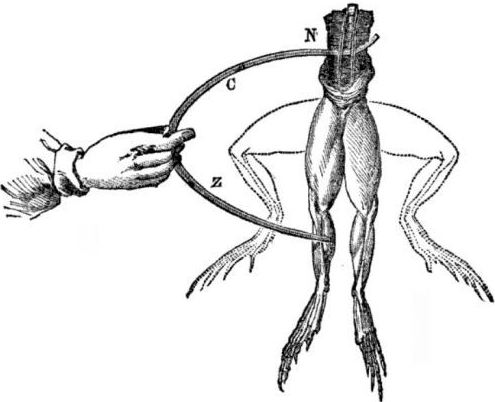
Явление возникновения электрического тока при контакте разных металлов было открыто итальянским физиологом, профессором медицины Болонского университета Луиджи Гальвани в 1786 году. Гальвани описал сокращения мышц задних лапок свежепрепарированной лягушки, закрепленных на медных крючках, при прикосновении стального скальпеля. Наблюдения были истолкованы первооткрывателем как проявление «животного электричества».
Итальянский физик и химик Алеcсандро Вольта, заинтересовавшись опытами Гальвани, увидел совершенно новое явление — создание потока электрических зарядов. Проверяя точку зрения Гальвани, А. Вольта проделал серию опытов и пришел к выводу, что причиной сокращения мышц служит не «животное электричество», а наличие цепи из разных проводников в жидкости. В подтверждение А. Вольта заменил лапку лягушки электрометром и повторил все действия. В 1800 году А. Вольта впервые публично заявляет о своих открытиях на заседании Лондонского королевского общества, что проводник второго класса (жидкий) находится в середине и соприкасается с двумя проводниками первого класса из двух различных металлов. Вследствие этого возникает электрический ток того или иного направления. Русский ученый Петров в 1802 году использовал гальванический элемент для построения электрической дуги.
Виды электродов
В состав гальванического элемента входят электроды. Электроды бывают:
Обратимые электроды
Ионоселективные мембранные электроды
Характеристики гальванических элементов
Гальванические элементы характеризуются: э.д.с., емкостью, энергией, которую он может отдать во внешнюю цепь, сохраняемостью.
Классификация гальванических элементов
Широкое распространение получили марганцево-цинковые элементы, не содержащие раствора электролита (сухие элементы, батарейки). Так, в солевых элементах Лекланше цинковый электрод служит анодом, электрод из смеси диоксида марганца с графитом служит катодом, графит служит токоотводом. Электролитом является паста из раствора хлорида аммония с добавкой муки или крахмала в качестве загустителя.
Щелочные марганцево-цинковые элементы, в которых в качестве электролита используется паста на основе гидроксида калия, обладают целом рядом преимуществ, в частности существенно большей ёмкостью, лучшей работой при низких температурах и при больших токах нагрузки.
Солевые и щелочные элементы широко применяются для питания радиоаппаратуры и различных электронных устройств.
Также существуют щелочные аккумуляторы. Наибольшее применение получили никель-кадмиевые и никель-металлгидридные аккумуляторы, в которых электролитом служит KOH.
В различных электронных устройствах (мобильные телефоны, планшеты, ноутбуки), в основном, применяются литий-ионные и литий-полимерные аккумуляторы, характеризующиеся высокой ёмкостью и отсутствием эффекта памяти.
Применение
См. также
Литература
Ссылки
 Химические источники тока Химические источники тока | |
|---|---|
| Гальванический элемент | Гальванический элемент Даниеля | Щелочной элемент | Ртутно-цинковый элемент | Сухой элемент | Концентрационный элемент | Воздушно-цинковый элемент | Нормальный элемент Вестона |
| Электрические аккумуляторы | Свинцово-кислотный | Серебряно-цинковый | Никель-кадмиевый | Никель-металл-гидридный | Никель-цинковый аккумулятор | Литий-ионный | Литий-полимерный | Литий-железо-сульфидный | Литий-железо-фосфатный | Литий-титанатный | Ванадиевый | Железо-никелевый |
| Топливные элементы | Прямой метанольный | Твердооксидный | Щелочной |
| Модели | Батарея | Электрический аккумулятор | Топливный элемент |
| Устройство | Анод | Катод | Электролит |
Полезное
Смотреть что такое «Гальванический элемент» в других словарях:
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ — химический источник тока, в котором электрическая энергия вырабатывается в результате прямого преобразования химической энергии окислительно восстановительной реакцией. В состав гальванического элемента входят два разнородных электрода (один… … Большой Энциклопедический словарь
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ — источник тока, в котором электрическая энергия возникает за счёт химической реакции. Гальванический элемент состоит из 2 электродов, помещённых в электропроводную жидкость (электролит). Применяются почти исключительно «сухие» элементы, в которых… … Краткая энциклопедия домашнего хозяйства
Гальванический элемент — ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ, химический источник тока; вырабатывает электроэнергию в результате прямого преобразования химической энергии окислительно восстановительной реакций. Различают гальванический элемент одноразового (первичные элементы),… … Иллюстрированный энциклопедический словарь
гальванический элемент — элемент Химический источник тока, состоящий из электродов и электролита, заключенных в один сосуд, предназначенный для разового или многократного разряда. [ГОСТ 15596 82] EN cell basic functional unit, consisting of an assembly of electrodes,… … Справочник технического переводчика
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ — первичный источник постоянного электр. тока, в к ром хим. энергия, освобождающаяся при хим. процессах, превращается в электрическую. Технический железнодорожный словарь. М.: Государственное транспортное железнодорожное издательство. Н. Н.… … Технический железнодорожный словарь
гальванический элемент — – система, в которой химическая энергия окислительно восстановительного процесса превращается в электрическую. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ — устройство, в котором электрическая энергия получается за счёт самопроизвольной хим. реакции. Простой хим. источник тока состоит из двух электродов отрицательного (напр. цинк) и положительного (напр. медь, оксиды металлов, уголь), погружённых в… … Большая политехническая энциклопедия
гальванический элемент — химический источник тока, в котором электрическая энергия вырабатывается в результате прямого преобразования химической энергии окислительно восстановительной реакции. В состав гальванического элемента входят два разнородных электрода (один … … Энциклопедический словарь
гальванический элемент — elektrocheminis elementas statusas T sritis chemija apibrėžtis Cheminis elektros energijos šaltinis, kuriame elektrocheminių reakcijų energija verčiama elektros energija. atitikmenys: angl. electrochemical cell; element; galvanic cell; voltaic… … Chemijos terminų aiškinamasis žodynas
Гальванический элемент — 2. Гальванический элемент Элемент Galvanisches Element Химический источник тока, состоящий из электродов и электролита, заключенных в один сосуд, предназначенный для разового или многократного разряда Источник: ГОСТ 15596 82: Источники тока… … Словарь-справочник терминов нормативно-технической документации
Предпосылки к появлению гальванических элементов. Немного истории. В 1786 году итальянский профессор медицины, физиолог Луиджи Алоизио Гальвани обнаружил интересное явление: мышцы задних лапок свежевскрытого трупика лягушки, подвешенного на медных крючках, сокращались, когда ученый прикасался к ним стальным скальпелем. Гальвани тут же сделал вывод, что это — проявление «животного электричества».
После смерти Гальвани, его современник Алессандро Вольта, будучи химиком и физиком, опишет и публично продемонстрирует более реальный механизм возникновения электрического тока при контакте разных металлов.
Вольта, после серии экспериментов, придет к однозначному выводу о том, что ток появляется в цепи из-за наличия в ней двух проводников из разных металлов, помещенных в жидкость, и это вовсе не «животное электричество», как думал Гальвани. Подергивание лапок лягушки было следствием действия тока, возникающего при контакте разных металлов (медные крючки и стальной скальпель).
Вольта покажет те же явления, которые демонстрировал Гальвани на мертвой лягушке, но на совершенно неживом самодельном электрометре, и даст в 1800 году точное объяснение возникновению тока: «проводник второго класса (жидкий) находится в середине и соприкасается с двумя проводниками первого класса из двух различных металлов… Вследствие этого возникает электрический ток того или иного направления».
В одном из первых экспериментов Вольта опустил в банку с кислотой две пластинки — цинковую и медную — и соединил их проволокой. После этого цинковая пластина начала растворяться, а на медной стали выделяться пузырьки газа. Вольта предположил и доказал, что по проволоке протекает электрический ток.
Так был изобретён «элемент Вольта» — первый гальванический элемент. Для удобства Вольта придал ему форму вертикального цилиндра (столба), состоящего из соединённых между собой колец цинка, меди и сукна, пропитанных кислотой. Вольтов столб высотою в полметра создавал напряжение, чувствительное для человека.
Поскольку начало исследованиям положил Луиджи Гальвани, то и название химического источника тока сохранило память о нем в своем названии.
Гальванический элемент — это химический источник электрического тока, основанный на взаимодействии двух металлов и/или их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока. Таким образом, в гальванических элементах химическая энергия переходит в электрическую.
Гальванические элементы сегодня
Напряжение батарейки зависит как от используемых металлов, так и от количества элементов в «батарейке». Батарейки, в отличие от аккумуляторов, не способны к восстановлению своих свойств, поскольку в них происходит прямое преобразование энергии химической, то есть энергии составляющих батарейку реагентов (восстановителя и окислителя), в энергию электрическую.
Входящие в батарейку реагенты, в процессе ее работы расходуются, ток при этом постепенно уменьшается, поэтому действие источника заканчивается после того как реагенты прореагируют полностью.
Щелочные и солевые элементы (батарейки) широко применяются для питания разнообразных электронных устройств, радиоаппаратуры, игрушек, а литиевые чаще всего можно встретить в портативных медицинских приборах типа глюкометров или в цифровой технике вроде фотоаппаратов.
Солевые батарейки
Марганцево-цинковые элементы, которые называют солевыми батарейками — это «сухие» гальванические элементы, внутри которых нет жидкого раствора электролита.
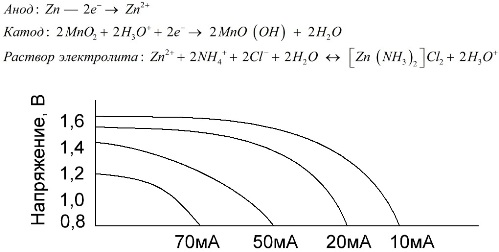
Цинковый электрод (+) — это катод в форме стакана, а анодом служит порошкообразная смесь из диоксида марганца с графитом. Ток течет через графитовый стержень. В качестве электролита используется паста из раствора хлорида аммония с добавлением крахмала или муки для загущения, чтобы ничего не текло.
Обычно производители батареек не указывают точный состав солевых элементов, тем не менее, солевые батарейки являются самыми дешевыми, их обычно используют в тех устройствах, где энергопотребление крайне низко: в часах, в пультах дистанционного управления, в электронных термометрах и т. п.
Понятие «номинальная емкость» редко употребляется для характеристики марганцево-цинковых батареек, так как их емкость сильно зависит от режимов и условий эксплуатации. Основными недостатками этих элементов являются значительная скорость снижения напряжения на всем протяжении разряда и значительное уменьшение отдаваемой емкости при увеличении тока разряда. Конечное разрядное напряжение устанавливают в зависимости от нагрузки в интервале 0,7-1,0 В.
Важна не только величина тока разряда, но и временной график нагрузки. При прерывистом разряде большими и средними токами работоспособность батареек заметно увеличивается по сравнению с непрерывным режимом работы. Однако при малых разрядных токах и многомесячных перерывах в работе емкость их может снижаться в следствии саморазряда.
Выше на графике изображены разрядные кривые для средней солевой батарейки за 4, 10, 20 и 40 часов для сравнения с щелочной, о которой речь пойдет далее.
Щелочные (алкалиновые) батарейки
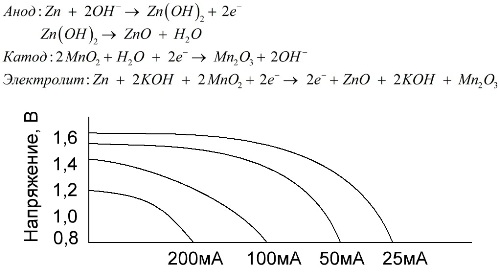
Щелочной элемент питания — марганцево-цинковый гальванический элемент питания, в котором в качестве катода используется диоксид марганца, в качестве анода — порошкообразный цинк, а в качестве электролита — раствор щёлочи, обычно в виде пасты гидроксида калия.
Эти батарейки обладают целым рядом преимуществ (в частности, существенно большей ёмкостью, лучшей работой при низких температурах и при больших токах нагрузки).
Щелочные батарейки, в сравнении с солевыми, могут обеспечивать больший ток в течение длительного времени. Больший ток становится возможным, поскольку цинк здесь используется не в виде стакана, а в виде порошка, обладающего большей площадью соприкосновения с электролитом. В качестве электролита применяется гидрооксид калия в виде пасты.
Именно благодаря способности данного вида гальванических элементов в течение длительного времени отдавать значительный ток (до 1 A), щелочные батарейки наиболее распространены в настоящее время.
В электрических игрушках, в портативной медицинской технике, в электронных приборах, в фотоаппаратах — всюду применяются щелочные батарейки. Они служат в 1,5 раза дольше солевых, если разряд идет малым током. На графике изображены разрядные кривые при различных токах для сравнения с солевой батарейкой (график был приведен выше) за 4, 10, 20 и 40 часов.
Литиевые батарейки
Катод и электролит литиевого элемента могут быть очень разными, поэтому термин «литиевый элемент» объединяет группу элементов с одинаковым материалом анода. В качестве катода могут использоваться например: диоксид марганца, монофторид углерода, пирит, тионилхлорид и др.
Литиевые батарейки отличается от других элементов питания высокой продолжительностью работы и высокой стоимостью. В зависимости от выбранного типоразмера и используемых химических материалов, литиевый элемент питания может производить напряжение от 1,5 В (совместим с щелочными батареями) до 3,7 В.
Эти элементы питания обладают наивысшей емкостью на единицу массы и длительным временем хранения. Литиевые элементы широко применяются в современной портативной электронной технике: для питания часов на материнских платах компьютеров, для питания портативных медицинских приборов, наручных часов, калькуляторов, в фототехнике и т. д.
На графике выше приведены разрядные кривые для двух литиевых батареек от двух популярных производителей. Начальный ток составлял 120 мА (на резистор порядка 24 Ома).
Все о гальваническом элементе
Впервые в мире гальванический элемент был разработан Луиджи Гальвани. Об его истории читайте в этой статье. По сути это временный источник электрического тока, который формируется за счет протекания химической реакции. Поток электронов формируется за счет взаимодействия между двумя разноименными металлами. В результате этого химическая энергия преобразуется в электрическую, которую уже можно использовать в повседневной жизни.
Концентрационный гальванический элемент – это источник тока в состав которого входит 2 однотипных металлических электродов помещенных в смесь солей этого металла в различных концентрациях.
Кроме Гальвани созданием эффективной батареи занимался Даниэль Якоби. Он немного видоизменил свой источник энергии. В его состав входит пластина, выполненная из меди, помещенная в CuSO4 и пластина из цинка погруженная в ZnSO4. Чтобы не дать им воздействовать прямо друг на друга между ними установлена пористая стенка. Ниже представлена схема гальванического элемента Даниэля Якоби.
Цинк и медь обладают разной активностью и поэтому их заряд по величине будет различным. В итоге уровень электродов также не однозначен. Это позволяет им перемещаться и производить электрический или гальванический ток. Он начинает протекать, когда любой человек или изобретатель тока хранящего аппарата присоединяет нагрузку. В качестве нее может быть лампочка, приемник, компьютерная мышка и другие электрические устройства.
Схема гальванического элемента
Под схемой подразумевают его состав и устройство. Он может быть выполнен из нескольких химических элементов с применением вспомогательных приспособлений. Ниже об строение гальванического элемента будет рассказано кратко. Подробнее о нем читайте в этой статье!
Устройство гальванического элемента
Самый простой энергетический накопитель состоит из:
Как видно из этой схемы в составе строения гальванического элемента имеется отрицательный и положительный электрод. Они могут быть выполнены из меди, цинка и других металлов. Имеют название по типу медно цинковые. Иногда их называют сухие батарейки.
Обозначение гальванического элемента на схеме выполнено в виде двух вертикальных прямых приближенных друг к другу на небольшом расстоянии. Одна из которых будет меньше. По краям возле каждой такой линии имеются знаки, обозначающие полярность. У длинной линии ставят плюс, а у короткой минус. Рядом может располагаться вольтаж. Это означает что схема в которой используется батарейка работает только от этого напряжения.
Принцип работы гальванического элемента
Работа гальванического элемента осуществляется за счет движения электронов от одного металлического контакта к другому. Идет некое химическое превращение. Подробнее про термодинамику гальванического элемента и образование гальванического электричества читайте здесь.
Ответы на часто задаваемые вопросы
Гальваника – это протекание химических процессов с использование электрического тока. В ходе реакция сокращается количество растворенных катионов металла до такой степени что в конечном итоге они создают единое покрытие на металлическом электроде. В итоге предмет получается более прочным, исчезают небольшие вмятины и его вид становится более привлекательным.
Типы гальванических элементов
Выделяют ряд батареек определенных типов.
Таблица гальванических элементов
| Тип | Напряжение | Основные плюсы |
| Литиевые | 3 V | Большая емкость, высокая сила тока. |
| Солевые батарейки или угольно – цинковые | 1.5 в | Самые дешевые. |
| Никельоксигидроксильные NiOOH | 1.6 вольт | Повышенный ток. Большая емкость. |
| Щелочные или алкалиновые | 1.6 V | Большая сила тока. Хороший объем. |
Более детальнее эта тема раскрыта в статье виды батареек!
Назначение гальванического элемента
Он предназначен для запуска электрической технике. Это могут быть:
И им подобные окружающие нас вещи.
Гальванический элемент в домашних условиях
Простой источник тока можно сделать и своими руками. Для этого нам потребуется следующий инвентарь:
Процесс изготовления
Берем пластиковый стаканчик и наливаем в него электролит. Не следует наполнять стакан до самых краев. Лучше на 1-2 сантиметра не долить. К металлическим пластинам прикрепите проводники. Далее установите на края нашей емкости пластины из меди и алюминия. Они должны располагаться параллельно друг к другу. Когда все готова можно замерить с помощью вольтметра напряжение.
Подключите прибор и прикоснитесь щупами к контактам нашего источника тока. Держите и не отрывайте их пока на дисплее не высветится напряжение. Обычно оно составляет 0.5-0.7 вольт. Такие цифры показываются в зависимости от электролита. Точнее используемого вещества в его качестве.
Более детально создание батареи своими руками описано в этой статье.
Таким образом изготавливается самодельный гальванический элемент.
Особенности гальванических элементов
Люди довольно часто сталкиваются с электрохимическими элементами в повседневной жизни: от одноразовых батареек АА в пультах дистанционного управления ТВ до литий-ионных батарей в смартфонах. Существует два типа таких ячеек: гальванические и электролитические. Первые получают свою энергию от самопроизвольных окислительно-восстановительных реакций (ОВР), в то время как вторые требуют внешний источник электронов, например, блока питания переменного тока. Оба элемента состоят из анода (А) и катода (К), изготавливаемых из разнородных металлов и электролитов.
Что это такое
В любом электрохимическом процессе электроны переходят из одного вещества в другое, что обусловлено ОВР. Восстановитель представляет собой вещество, которое теряет электроны и в процессе окисляется. Связанная энергия определяется разностью потенциалов между валентными электронами в атомах различных элементов.
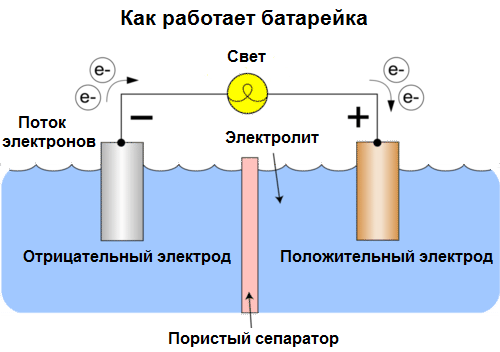
Гальванический элемент — это устройство, которое преобразует химическую энергию в электрическую, используя электрохимию, а в быту называется батареей.
В такой ячейке есть контейнер, в котором содержится раствор концентрированного сульфата меди (CuSO4), а внутри раствора вставлен медный стержень — катод. Внутри контейнера находится пористый сосуд, заполненный концентрированной серной кислота (H2SO4), в нее вставлен цинковый стержень — анод. Таким образом, когда провод соединяет медный и цинковый стержни, по нему начинает протекать электрический ток.
Дополнительная информация. Реакции окисления и восстановления разделяются на части, называемые полуреакциями. Внешняя цепь используется для проведения потока электронов между электродами гальванического элемента. Электроды изготавливают из любых проводящих материалов, таких как металлы, полупроводники, графит и даже полимеры.
Источник токов
Существует два типа электрохимических элементов: гальванические и электролитические. Гальваническая клетка использует энергию, выделяемую во время спонтанной окислительно-восстановительной реакции для выработки электроэнергии.
Электролитическая ячейка потребляет энергию от внешнего источника, используя ее, чтобы вызвать непредвиденную окислительно-восстановительную реакцию.
Гальванический элемент, история создания которого официально началась в 18 веке, дал старт развития науки электротехники. Во время проведения экспериментов с электричеством в 1749 году Бенджамин Франклин впервые ввел термин «батарея» для описания связанных конденсаторов. Однако его устройство не стала первой ячейкой. Находки археологов «батареи Багдада» в 1936 году имеют возраст более 2000 лет, хотя точное назначение их до сих пор спорно.
Луиджи Гальвани в честь которого названа гальваническая ячейка, впервые описал «электричество животных» в 1780 году, когда пропускал ток через лягушку. В то время он не знал об этом, но его устройство работало по принципу батареи. Его современник Алессандро Вольта в честь которого названа «вольтовая ячейка» был убежден, что «животное электричество» исходило не от лягушки, а от чего-то другого, он много работал над этим и в 1800 году изобрел первую настоящую батарею — «вольтовую кучу».
В 1836 году Джон Фредерик Даниэль, исследуя способы преодоления проблем вольтовой кучи создал свою ячейку. За этим открытием последовало создание ячейки Уильяма Роберта Гроува в 1844 году. Первая аккумуляторная батарея была изготовлена из свинцово-кислотного элемента в 1859 году компанией Gaston Plante, далее появились гравитационная ячейка Калло в 1860 и ячейка Лекланш Жоржа Лекланша в 1866 году.
До этого момента все батареи были мокрого типа. В 1887 году Карл Гасснер создал первую сухую батарею, изготовленную из углеродно-цинковой батареи. Никель-кадмиевая батарея была представлена в 1899 году Вальдмаром Юнгнером вместе с никель-железной батареей. Однако Юнгнер не смог запатентовать ее и в 1903 году изобретатель Томас Эдисон запатентовал свой слегка измененный дизайн.
Русский ученый-физик Василий Петров в 1802 году соорудил крупнейшую гальваническую батарею в мире, дающую напряжение 1500В. Для сооружения потребовалось около 4200 цилиндров из меди и цинка с диаметром 35.0 мм м толщиной 2.5 мм. Батарея была размещена в ящике из красного дерева, обработанного несколькими слоями различных смол. Опыты Петрова положили начало современной электрометаллургии в дуговых печах.
Обратите внимание! Крупный прорыв в гальваническом направлении источников тока произошел в 1955 году, когда Льюис Урри, сотрудник компании «Energizer», представил общую щелочную батарею. 1970-е годы привели к никель-водородной батарее, а 1980-е годы к никель-металлогидридной батарее.
Литиевые батареи были впервые созданы еще в 1912 году, однако наиболее успешный тип, литий-ионный полимерный аккумулятор, используемый сегодня в большинстве портативных электронных устройств, был выпущен только в 1996 году.
Гальванические элементы классифицируются, как щелочные и нещелочные. Стандартная щелочная сухая батарея имеет цинковый А и К из диоксида марганца. Электролит выполнен в виде некислотной пасты. Обычно электролитом, используемым в щелочных батарейках — есть гидроксид калия. Она выполнена в форме стальной банки, заполненной диоксидом марганца в самой внутренней области К, и заполнена цинком и электролитом в центральной области А. Электролит, окружающий А, запускает химреакцию между ними.

Типичная нещелочная батарея с сухими элементами имеет цинковый А и К из углеродного стержня/ диоксида марганца. Электролит обычно представляет собой кислое пастообразное вещество из смеси хлорида аммония и хлорида цинка. Физически она имеет обратную щелочной батареи конструкцию. Цинковый контейнер служит внешним анодом, тогда как углеродный стержень/ диоксид марганца занимает внутреннюю область в качестве К. Электролит смешивается с К и обеспечивает химическую реакцию между К и А.
Общее мнение специалистов говорит о том, что химически щелочная батарея имеет преимущества по отношению к нещелочной. Хотя последние более надежные и дешевые, тем не менее, щелочные, нужны, когда требуется быстрое, сильнотоковое потребление, например, вспышка на камере с быстрой перезарядкой.
Щелочные батареи
Эта конструкция ячейки получила свое название благодаря использованию щелочных водных растворов в качестве электролитов. Химия щелочных устройств была впервые введена в начале 60-х годов. И сразу стала крупнейшим конкурентом цинк-углеродной ячейки. Эти элементы обладают многими признанными преимуществами по сравнению с цинк-углеродом, включая более высокую плотность энергии, длительный срок хранения, превосходное сопротивление утечке, лучшие характеристики, как в непрерывном, так и в прерывистых рабочих циклах, и более низкое внутреннее сопротивление, что позволяет им работать при высоких скоростях разряда.
Цинк в порошкообразной форме увеличивает площадь поверхности анода, что обеспечивает большее взаимодействие частиц. Это снижает внутреннее сопротивление и увеличивает плотность мощности. Катод, MnO2, произведен синтетически из-за его превосходства над природным MnO2, что дает рост плотности энергии. Как и в цинковой в углеродной ячейке, графит добавляется к катоду для увеличения проводимости.
Электролит КОН, обеспечивает высокую ионную проводимость. Оксид цинка часто включают для замедления коррозии цинкового анода. Производное от целлюлозы и гелеобразующего агента делают щелочной элемент более дорогим, чем цинк-углерод, но более экономичным, особенно в ситуациях с высоким расходом, когда плотность энергии щелочного элемента намного выше.
Существуют и другие конструкции ячеек, которые относятся к категории щелочных, в том числе оксиды ртути, серебра и цинка. Ртуть и серебро дают еще более высокую плотность энергии, но стоят намного дороже и постепенно исключаются требованиями международных организаций из-за их высокой токсичности.
Солевые ячейки
Аккумуляторы с сухими элементами — это устройства, в которых используется электролит с очень низким содержанием влаги. Они контрастируют с батареями с мокрыми элементами, такими как свинцово-кислотные, в которых используется жидкий электролит. Электролит, используемый в большинстве устройств с сухими элементами, является пастой, которая, хотя и содержит влагу, тем не менее остается относительно сухой. Наиболее часто используемые формы сухих элементов — это батареи типа «С», «А», 9 вольт батарейки и для электронных часов.
Важно! Сухих элементы вырабатывают электроэнергию путем преобразования химической энергии в электричество. Выходные данные зависят от типа батареи с сухими элементами. Более популярными являются конструкции с использованием цинка и углерода или цинка и диоксида марганца.
Эти материалы помещаются в пасту электролита внутри батареи. Они реагируют друг с другом посредством химического процесса, в котором электролит, диоксид углерода или марганца реагирует с цинком, создавая электричество.
Литиевые аккумуляторы
Литий-ионная технология включает в себя несколько химических процессов: ионы лития хранятся в аноде или отрицательном электроде, и транспортируются во время разряда к катоду или положительному электроду в органическом электролите.
Наиболее популярными материалами являются графит для анода и оксид металла для катода на основе никеля, марганца и кобальта. Все эти материалы обладают хорошими свойствами интеркалирования лития, что позволяет хранить большое количество энергии.

Выбор аккумуляторной технологии зависит от требований эксплуатации по производительности, сроку службы, безопасности и стоимости, причем каждый тип аккумулятора обеспечивает определенные функциональные возможности.
Преимущества литий-ионных аккумуляторов:
У таких батарей есть один существенный недостаток — им требуется встроенная схема защиты. Кроме того они страдают от старения и могут выдержать 500–1000 циклов зарядки-разрядки.
Устройство гальванического элемента
Гальваническая ячейка представляет собой простое устройство, с помощью которого химическая энергия преобразуется в электрическую энергию.
Строение гальванического элемента для литиевых батарей:
Обратите внимание! Строение электролита ионный проводник, при этом электронный изолятор, разделяет два электрода и обеспечивает среду для переноса заряда внутри ячейки между анодом и катодом. Электролитом обычно является неводный неорганический растворитель, содержащий растворенную соль лития, например LiPF6 в пропиленкарбонате.
Принцип работы
Литиевая батарея известна как «электронный насос» из-за носителей заряда, перемещающихся между двумя электродами во время зарядки и разрядки. Электрическое (насосное) давление или разность потенциалов между положительной и отрицательной клеммами называется напряжением или электродвижущей силой (ЭДС). Свободная энергия, связанная с переносом электронов вокруг внешней цепи и ионов лития между двумя интеркалирующими электродами, связана с разницей в химическом потенциале лития в двух электродах.
Элементы батареи накапливают энергию химически в своих электроактивных материалах. Эта химическая энергия преобразуется в электрическую энергию по требованию, посредством электрохимической реакции окисления-восстановления.

Клетки построены в разряженном состоянии. При зарядке положительный электрод, катод, материал окисляется, ионы Li + де-интеркалируются из слоистого интеркалирующего литиевого источника, например LiCoO2, проходят через электролит.
Когда элемент разряжается, на отрицательном электроде происходит реакция окисления, ионы Li + де-интеркалируются из анода и мигрируют через электролит, чтобы быть повторно интеркалированными в материал катода. Одновременная реакция электрохимического восстановления протекает на положительном электроде и принимает электроны из внешнего контура, ионы Li + из электролита, чтобы преобразовать исходный материал. Переход от электронного тока к ионному току происходит на границе раздела электрод/электролит.
Область использования
Электрохимия имеет множество важных применений, особенно в промышленности. Ее процессы используются для изготовления электрических батарей. Они имеют множество применений, включая:
Использование химических реакций для производства электричества в настоящее время является приоритетом для многих исследователей. Возможность адекватно использовать химические реакции в качестве источника энергии в значительной степени поможет решить проблемы загрязнения окружающей среды.