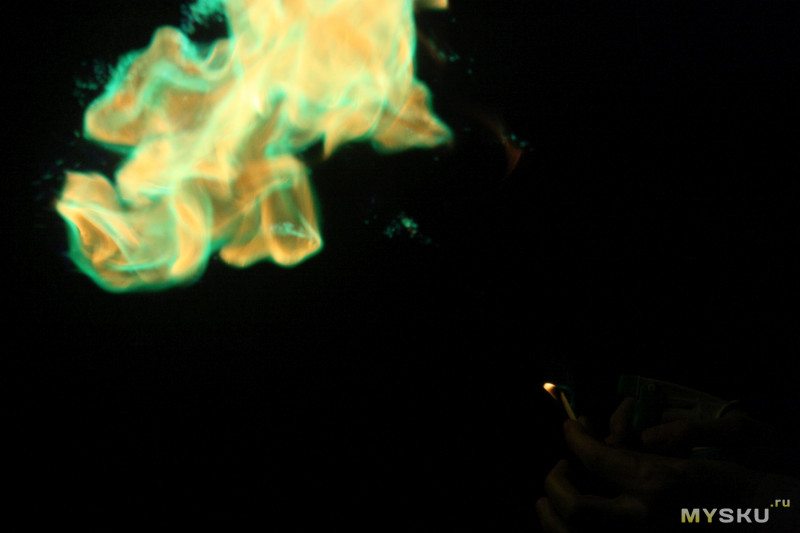что нужно добавить в огонь чтобы он стал синим
«Волшебный» порошок для создания разноцветного огня
Лирическо-познавательное вступление.
Нетерпеливые могут листать до первой фотографии товара.
Как часто бывает, то, что мы сейчас используем для развлечения, когда то было результатом великого научного открытия. Я не нашел информации, как давно люди использую разные вещества для окрашивания огня. Но научно этот эффект исследовал и систематизировал результаты в 1858 году немецкий химик Роберт Бунзен. Результатом его опытов стало открытие спектрографии, благодаря которой были обнаружены неизвестные до этого химические элементы, а сегодня ученые имеют возможность определять химический состав космических объектов на расстоянии многих тысяч световых лет от нас. Как все начиналось, отлично описал еще в 30-е годы прошлого века талантливый физик и популяризатор науки Матвей Бронштейн в своем сборнике научно-популярных рассказов «Солнечное вещество».
Я же узнал о способности разных веществ окрашивать огонь лет в 10, перебирая у бабушки на чердаке отцовские номера Юного техника 60-70-х годов. В номере 6 за 1966 год была такая заметка:
Как на ребенка постчернобыльской эпохи предложение поискать соединения стронция в школьной лаборатории произвело на меня впечатление, как 1,21 джигаватта на Дока Брауна — уран в каждой аптеке и все вот это вот.
Кстати, то, что природный стронций неопасен, мне объяснили только недавно здесь на муське. Но это уже совсем лирика.
Так что же нам предлагают китайские друзья?
Пакетики разного веса с порошком внутри. Пакеты рекомендуется целиком бросать в костер. Состав указан на обороте: медный купорос, хлорид меди, поливинилхлорид. Также есть предупреждение, что нельзя готовить еду над цветным огнем.
Я заказал сначала один большой пакет на 25 грамм, потом подумал и купил еще два по 10. В итоге меньшие пакеты сжег в костре, а больший вскрыл и оставил для эксперИментов.
Порошок представляет из себя смесь трех видов кристаллов. Больше всего синих — медного купороса. Крупным планом выглядит, как мет:)
Во время следующей поездки в село захватил пакетики с собой и вечером разложил небольшой костер. Разгорался порошок довольно долго, минуты три. Я сначала бросил в костер один пакет, за время, пока он разгорался, успел испугаться отсутствия эффекта и бросил второй. Когда порошок выходит в «штатный режим» горения, выглядит это очень красиво. Больше всего в огне зеленого цвета, синего и красного меньше (что логично, поскольку в порошке больше всего медного купороса). Цвета могут смешиваться, в огне появляются лиловые, салатовые отблески. Короче, зачем пытаться подыскать слова, если можно показать.



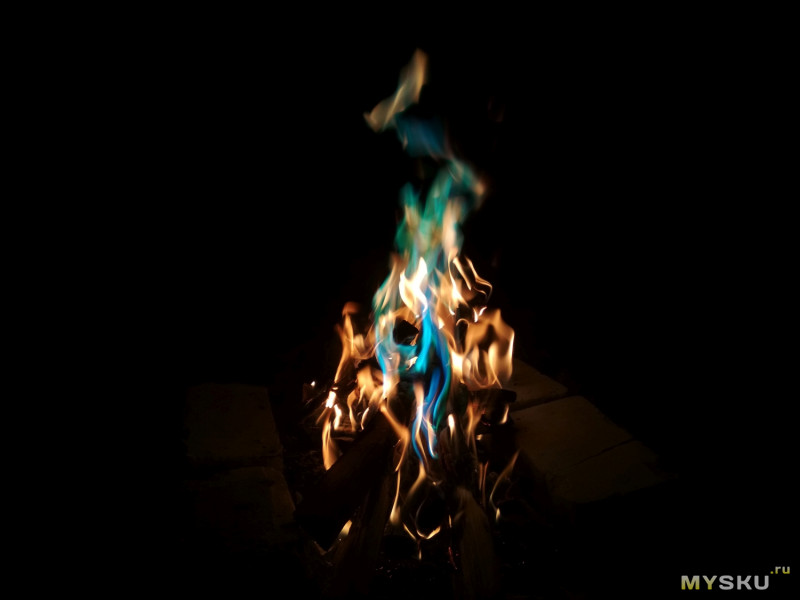


Вот, как все это выглядит в динамике. В телефоне камера не очень, в живую, конечно, смотрится значительно лучше. Первое видео неинтересное — оно скорее для демонстрации, сколько времени порошок разгорается. На втором горение уже идет в полную силу.
В общей сложности активная фаза горения длилась около 15 минут.
Однозначно, супер, вау-эффект и куча восторга. Нашел лот с десятком пакетов, буду летом радовать дочку и племянников.
С порошком из распотрошенного пакета решил повторить рецепт из «Юного техника» — растворил порошок в воде, вымочил в нем несколько листиков бумаги и дал высохнуть. Результат не впечатлил — бумага горит ровным синим пламенем без других оттенков. Выглядит симпатично, но не больше.


Также попробовал растворить порошок в спирте. Получилась веселого цвета жидкость с осадком из не растворившихся компонентов.
Сначала попробовал поджечь раствор просто в металлической крышке — получил сине-зеленое пламя, напоминающее северное сияние.



А потом попробовал повторить фокус из первого эпизода «Во все тяжкие».
Этот эксперимент понравился, пламя выглядит очень круто.




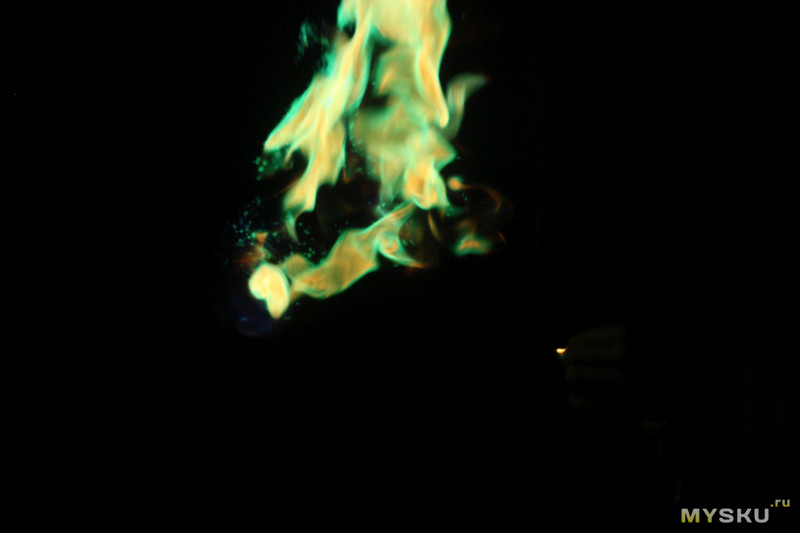
Что сказать в заключение — штука классная, при использовании по назначению выглядит очень красиво, также позволяет проявить фантазию и немного подурачиться.
Что нужно добавить в огонь чтобы он стал синим
При совместном применении цветных составов неплохо учитывать следующие закономерности, о которых пишет Чувурин [2]:
Поэтому в пиротехнике, а тем более при устройстве фейерверков придерживаются определённых правил цветовой гаммы. Считается наиболее гармоничным расположение цветного огня в следующей последовательности: красный, зелёный, синий, фиолетовый, жёлтый и белый. Красный цвет неплохо гармонирует практически со всеми цветами радуги, особенно с зелёным, но теряет яркость в присутствии белого и проигрывает в окраске в присутствии жёлтого.
Итак нам понадобятся:
— цветообразующие реактивы. Это нитрат стронция Sr(NO3)2 — для красного; нитрат бария Ba(NO3)2 — для зеленого; нитрат натрия NaNO3 — для желтого. Обычно огни на их основе получаются без особых проблем. Надо только учесть, что красный стронция и особенно зеленый бария получаются только в присуствии ионов хлора в достаточном количестве, потому помимо дополнительных окислителей — хлоратов или перхлоратов — обычно добавляют хлорсодержащие горючие (см. далее). Если надыбаете хлората бария (вместо нитрата), то цвет будет, говорят, еще лучше.
Что же касается огня синих оттенков, то с ним приходится повозиться любому начинающему пиротехнику. В среде пиротехников-любителей синий цвет считается самым сложным. Его главным компонентом служат соединения меди, в качестве которых обычно применяют основной карбонат меди Cu2(CO3)(OH)2, оксид меди (I или II), хлорид меди (I или II), хлорокись 3Cu(OH)2•CuCl2 (которую, впрочем, в чистом виде приобрести проблематично — фунгицид под таким названием содержит хлорокиси всего около 50%), банальный медный купорос, либо, наконец, просто порошок меди. У Чувурина вместо основного карбоната меди (дигидроксокарбоната, он же минерал малахит) в большинстве случаев указана более экзотическая горная синь Cu3(СО3)2(ОН)2 (дигидроксодикарбонат, он же минерал азурит или медная лазурь). Обратите на это внимание: в «Химической энциклопедии» именно дигидроксодикарбонат указан в качестве компонента пиротехнических составов. В [8] тоже указывается, что «[горная синь], как более богатая медью, окрашивает пламя несколько гуще, потому и чаще применяется». Однако, в продаже вы встретите скорее обычный основной карбонат (порошок зеленого цвета, в отличие от синего азурита). Его несложно получить и самостоятельно из других соединений меди.
Хлорид (I), (CuCl, хлористая медь) можно брать загрязненный, с хранения. Он тогда зеленоватого оттенка благодаря отчасти присутствию хлорной меди (II) (при сушке она желтеет) отчасти основного хлорида CuCl2·Cu(OH)2. Но, конечно, лучше, если хлористую медь почистить, пользуясь тем, что она почти нерастворима в воде, в отличие от хлорной меди. CuCl самопроизвольно окисляется до основного хлорида во влажном воздухе, при этом одновалентная медь переходит в двухвалентную, и потому свежий или заново очищенный хлорид(I) необходимо хранить в герметичной таре.
Загрязненную CuCl очистить несложно, при условии, что у вас есть оборудование для фильтрации под вакуумом: грязную хлористую медь размешивают в воде, при этом голубая хлорная медь переходит в раствор, а нерастворимая хлористая медь образует взвесь белого цвета. Суспензию пропускают через грубый фильтр (ткань или нетканый материал), на котором остаются крупные включения, а затем отделяют белый осадок хлористой меди от голубого раствора с помощью фильтрации под вакуумом (воронка Бюхнера+водоструйный насос). Осадок можно дополнительно промыть водой и затем как можно быстрее высушить (иначе он опять позеленеет). И не мечтайте обойтись без вакуума: суспензия CuCl настолько мелкая, что через крупные фильтры проходит, не задерживаясь, а фильтровальную бумагу намертво забивает в первые секунды. Без вакуума можно только слегка почистить CuCl, если дать суспензии отстояться пару суток (а еще лучше пару недель), а затем аккуратно слить с осадка то, что можно слить, и отсосать большую часть оставшегося с помощью впитывающей ткани. Но таким образом можно очистить только от посторонних примесей — осадок слишком влажный и в процессе неизбежно длительной сушки успеет с поверхности на довольно большую глубину позеленеть заново.
В рецептах можно использовать чистый медный порошок, причем говорят, что с чистой медью цвет получается даже лучше, чем с ее соединениями [3]. Но оттенки пламени при замене могут меняться радикально; мало того, они зависят от степени дисперсности компонентов. Скажем, простая замена угля, который добавляют в синие составы в мизерных дозах (не более 1-3 %), с порошка ручного помола на пыль шарового помола может менять оттенок пламени. Меняет его неаккуратное смешение компонентов, крошки нерастертого перхлората или серы, применяемое связующее (которым иногда вообще заменяют горючее) и т.д.
Кроме всего прочего, синий цвет легко забивается любым другим и требует идеальной чистоты реактивов. Надо учесть, что для успешного получения синего цвета температура пламени не должна превышать 800-900 градусов (оцените — температура пламени свечи или спички в верхней его части гораздо выше, и составляет около 1200°), причем среда должна быть окислительной (избыток кислорода и хлора). В восстановительной среде (избыток нейтрального горючего) пламя получается зеленым [1]. Могут быть и все промежуточные случаи в виде голубого цвета — голубой получить, кстати, легче всего, к нему тяготеют все остальные.
— хлорсодержащие агенты. Присутствие ионов хлора в продуктах горения цветных составов с вышеуказанными цветообразующими компонентами — обязательное условие. Без хлора может обойтись только желтый огонь на основе натрия, так как он и без того дает насыщенное окрашивание, в остальных случаях в отсутствие хлора цвета пламени получаются блеклыми и невыразительными. Наиболее популярный хлорсодержащий агент в настоящее время — поливинилхлорид, ПВХ в виде порошка. Заодно он служит горючим. В случае отсутствия в продаже порошка ПВХ его можно напилить и самостоятельно, так как ПВХ — один из самых популярных пластиков. С этой же целью в цветные составы вводят, как уже указывалось, хлораты и перхлораты.
— металлические порошки. Как правило, это магний, алюминиево-магниевый порошок (ПАМ) или, на худой конец, алюминиевая пудра (ПАП). В цветных огнях металлические порошки служат горючими и употребляются для повышения яркости пламени. Синий огонь тут представляет исключение, так как металлические порошки заодно повышают температуру горения и в голубых/синих/фиолетовых составах не используются.
Указанные металлы без принципиальных проблем заменяются друг на друга в рецептах. Единственное, что нужно учитывать — из чистого магния достаточно мелкий порошок получить нельзя, именно для этой цели его смешивают с алюминием, получая ПАМ. Потому заменять ПАМ на магний следует с оглядкой: крупный порошок магния мешает уплотнить смесь как следует, и она получается более склонной взрываться, а не гореть. Кроме того, порошок магния из-за относительной крупности частиц повышает температуру воспламенения состава, что особенно важно для звездок, которые находятся в контакте с пламенем ограниченное время. Зато цвет у составов с магнием оказывается на высоте — заметно чище, чем у составов с ПАМ и тем более алюминием. Особенно хороши красный и зеленый с нитратами и магнием, потому в некоторых случаях его применение может быть целесообразно.
Немногие знают, что можно употреблять и другие металлы: например, титан, хотя его порошок дорог и экзотичен (мы его будем применять в подмазке, где много состава не требуется). Отдельной строкой в составы вводят порошок железа — обычно достаточно крупнозернистое железо употребляется для получения искр. Причем предпочтительно использовать железо в виде чугуна — его крупинки, быстро нагреваясь, трескаются и разлетаются в воздухе на несколько мелких искр. Нужный порошок чугуна можно получить сверлением старой плиты, батареи отопления или заслонки от печки — под сверлом чугун не дает стружек, а сразу крошится в крупинки. Чтобы не испортить сверло сразу, сверлить следует, смачивая место сверления жидким маслом, которое затем отмывается полосканием опилок в бензине.
Все составы с металлами (особенно при наличии селитры) рекомендуют готовить незадолго до употребления. Правда, по моему опыту, если хранить составы в герметично закрытой посуде, употреблять их можно (кроме искристых составов с чугуном), как минимум, в течение сезона. Составы с чугуном теряют свойства в течение двух-четырех месяцев (в зависимости от влажности в начальном состоянии и герметичности емкости). Хуже других цветных огней хранятся зеленые (и, наверное, осветительные) составы с нитратом бария — они полностью теряют цвет к началу следующего сезона. Относительно хорошо хранятся красные с нитратом стронция. Конечно, желтые на основе натриевой селитры без металлов, подобно обычному черному пороху и мякоти, могут храниться сколько угодно. Долговечна в хранении титановая подмазка с бертолетовой солью (см. следующий раздел); и вообще составы с бертолеткой, при условии их аккуратного приготовления и хранения без доступа влаги, долговечнее, чем с нитратами.
— горючие компоненты, а также компоненты, облегчающие воспламенение состава. К ним в первую очередь относятся хорошо нам уже знакомые сера и уголь; кроме того, во многих составах употребляют порошок уротропина (сухого спирта). Уголь для цветных огней можно и нужно употреблять ручного растирания (из активированного угля можно в ступке, в противном случае измельчать «методом молотка» или шлифмашинки). Хотя это и неофициальная рекомендация — в пособиях вы такого не встретите, возможно потому, что в пиротехнических цехах смеси употребляют килограммами, и вручную уголь для них не растирают. «Ручной» уголь добавляет искристый шлейф к любому цвету, и без него мне эффект кажется каким-то вялым и скучным. Горючим является и упоминавшийся порошок ПВХ, также к ним относятся и связующие.
— связующие употребляют для получения более прочного и плотного состава при прессовании звездок и в других подобных случаях, а иногда и как самостоятельные или дополнительные горючие компоненты. В старые времена употребляли экзотические ныне камеди (застывшие соки некоторых деревьев, в т. ч. гуммиарабик; химически представляют собой полисахариды — полимеры глюкозы и родственных ей моносахаридов), но сейчас они почти недоступны. Из традиционных связующих ныне доступны шеллак (компонент натурального спиртового лака по дереву) и идитол (спирторастворимая смола, родственник бакелита, придуманная изначально, как синтетический заменитель дорогого шеллака), которые можно приобрести в интернет-магазинах. С точки зрения удобства пользования идитол и является наилучшим связующим для наших целей, при условии, что вы сможете приобрести чистый спирт-ректификат для его растворения. Идитол растворяется и в ацетоне, но ацетон слишком быстро испаряется, и работать с таким составом очень неудобно. То же относится и к фабричному нитролаку, который часто упоминается в качестве связующего на пиротехнических интернет-форумах. Автор несколько раз пытался освоить фабричный нитролак в качестве связующего (о нем так много говорят!), но ни разу ничего не получилось: например, смесь для звездок сохнет быстрее, чем успеваешь ее напихать в шприц для прессования. Кроме того, нитролак абсолютно не липкий и потому смеси на нем не получаются пластичными.
Если вы встречаете эти вещества в рецептах, а приобрести не получается, то не гоняйтесь по всему Интернету: их можно заменить на более доступное связующее (исключение представляют смеси, где связующее служит и основным горючим [8] — там замена не всегда возможна). Авторитетный Платов [6] для простых изделий предпочитает дешевый крахмал, который действительно удобнее, когда нужно приготовить сразу много всего (при небольших объемах производства он неудобен, потому что его долго готовить и нельзя долго хранить разведенным). Для звездок можно применять спиртовой раствор канифоли, хотя они получаются не столь прочными.
Автор очень долго работал с декстрином, который легко растворяется просто в воде, и большая часть сказанного далее проверена именно на смесях с декстрином. И лишь потом перешел на идитол, когда удалось его приобрести. Идитол в продаже бывает в крупных прозрачных желтоватых чешуйках. Перед добавлением в состав его надо растереть в мелкий порошок, что может представлять отдельную проблему. Идитол легко крошится, но при растирании липнет к стенкам ступки, и оттереть ее можно потом только после замачивания в ацетоне (или спирте). Потому целессообразно сразу заготовить грамм сто размолотого идитола для дальнейшего использования. Посуда после размешивания смесей на идитоле и спирте легко оттирается тряпочкой, смоченной в ацетоне. И ни в коем случае не добавляйте идитол в смесь для размола в шаровой мельнице — потом не отмоете!
Связующего добавляется обычно порядка 5% от объема или (если связующее сухое) массы состава (сверх 100%, то есть 5 г на 100 г смеси). В некоторые составы с идитолом (осветительные, например), его добавляется 1/10 по весу. Крахмал, по Платову, нужно растворять примерно в двадцатикратном объеме воды (230 г на 4 л), предварительно заварив его в кипятке, образованном из десятой части этой воды.
— флегматизаторы горения нужны для предотвращения взрывного разложения состава в условиях применения. В рецептах прессованных звездок флегматизатор обычно служит и связующим.
Все компоненты, склонные к слеживанию и комкованию перед смешиванием необходимо просушивать. Особенно это необходимо, если вы их пользуете на даче летом, где влажность почти всегда повышенная. То есть сушить окислители, кроме негигроскопичных марганцовокислого калия и бертолетовой соли — обязательно! В первую очередь это относится к нитратам и перхлорату, но и бертолетову соль, марганцовку также необходимо просушить, если атмосфера очень влажная, как бывает после длительных дождей. То же относится к сере — просушенная сера в любом случае будет меньше комковаться и липнуть к ступке. Необязательно сушить металлические порошки, ПВХ, малахит и уголь, если только они не откровенно влажные. В некоторых случаях (составы без бертолетовой соли, серы и без металлических порошков) просушивать можно и уже готовый состав.
Просушивания, в общем, не требуют компоненты, которые потом будут подвергаться увлажнению и прессованию: для изготовления звездок и т.п., однако лучше их тоже просушить — смешивать будет несравненно легче, компоненты перестанут липнуть к ступке и комковаться. То есть, если вы готовите звездки на декстрине и воде, то просушивать компоненты не обязательно, просушивают уже готовые звездки. Удобство применения идитола на спирту для звездок еще и в том, что в этом случае также можно избежать сушки: при испарении спирта он захватывает с собой лишнюю воду.
Для просушки на металлический лист стелят бумагу, на которой ровным рыхлым слоем не более 1 см толщиной рассыпают порошок компонента. Просушивают в электродуховке при температуре 100° 15-20 минут и дают остыть вместе с духовкой, или на нагревательном приборе 40-50° в течение часа. Серу лучше в духовке при 100° не сушить — она плавится уже при 113° и может по краям подплавляться.
О теоретическом расчете пиротехнических смесей
В принципе горение пиротехнических смесей, как и любая химическая реакция, поддается теоретическому расчету. Эта тема не очень освоена даже многими людьми с химическим образованием: в школе ее проходят по необходимости поверхностно, а для современных химиков она не очень нужна сама по себе — за исключением немногих профессиональных неоргаников. В реальности теория этого дела изуметельно проста: она исходит из того, что вещества реагируют в том сотношении атомов, которое указано в реакции, и при этом в одном моле любого вещества (грамм-молекуле или грамм-атоме по старой терминологии) содержится одинаковое число молекул. Потому достатно положить перед собой таблицу Менделеева, где указаны атомные веса элементов, чтобы рассчитать в принципе любую реакцию.
Классический пример: 2H2+O2=2H20. Зная вышеприведенные правила, из этого уравнения, согласно которому две молекулы водорода реагируют с одной молекулой кислорода, образуя две молекулы воды, можно извлечь массу полезной информации:
— молекулярный вес (строго говоря, масса, но я привык к молекулярному весу) водорода H2 = 2, кислорода O2 = 32, отсюда 4 грамма водорода, реагируя с 32 граммами кислорода, дадут 36 грамм воды. Имея исходный вес компонентов в смеси, по этим данным можно рассчитать конечный результат реакции: например, определить какой из компонентов в избытке и сколько его останется непрореагировашим, то есть сколько его надо добавить для полного протекания реакции (т.е. определить стехиометрическое соотношение компонентов). Можно, например, подсчитать, сколько воздуха нужно взять и сколько добавить к нему водорода, чтобы весь кислород прореагировал без остатка;
— более того: если реакция, как здесь, полностью протекает в газообразной фазе, то стоит вспомнить еще одно правило: один моль любого газа занимает при нормальных условиях объем 22,4 литра. С соотношением объемов иметь дело даже проще, чем с граммами: например, для нашей реации отсюда вытекает точное соотношение объемов газов в исходной смеси для нашей реакции: два объема водорода и один объем кислорода. В результате, между прочим, получится два объема водяных паров, то есть объем результата на треть меньше исходного, и давление должно упасть! А, учитывая то, что вода при нормальных условиях большей частью сконденсируется в жидкость, то вообще образуется вакуум. Но произойдет, конечно, это только после остывания: температура водородно-кислородного пламени сильно больше 2000°, оттого продукты резко расширяются и реакция протекает в форме мощного взрыва.
И так далее.
Довольно подробно этот вопрос применительно к пиротехническим смесям рассмотрен в пособии [13]. При составлении смесей играет роль так называемый кислородный баланс: соотношение количеств атомов (точнее, грамм-атомов) кислорода в исходной смеси и их количества, необходимого для образования продуктов реакции. Сразу отметим, что у большинства правильно составленных смесей этот баланс отрицательный, то есть кислорода меньше, чем надо: иначе реакция протекала бы слишком бурно. Эти расчеты могут быть полезны при доработке смесей — если вы хотите ускорить или замедлить горение, или заменить один компонент на другой. Однако, надо помнить, что без знания реально протекающих реакций эти расчеты могут быть лишь очень приблизительными (ниже я приведу пример, как без знания механизма реакции запросто можно попасть пальцем в небо).
Методика расчета проста по сути, но довольно муторная и просто так автоматизации не поддается (и это еще счастье, что у нас с вами есть калькулятор: химики времен выпуска указанного пособия все считали на бумажке вручную или, в лучшем случае, на логарифмической линейке). Покажем, как это делается, на примере расчета смеси оранжевого огня, содержащей целых три окислителя: азотнокислый натрий, азотнокислый стронций, а также перхлорат калия. Третий окислитель — перхлорат, — здесь нужен, как хлорагент (для «проявления» красного цвета стронция), и мы заодно посмотрим, как он влияет на кислородный баланс.
Sr(NO3)2 46
NaNO3 11 (вариант: уменьшить до 5-7)
Перхлорат калия KCl04 19
S (сера) 21
C (угольная пудра) 3
Al (пудра) 3
(цифры здесь обозначают условную массовую долю компонента; сумма этих долей необязательно равна 1 или 100%, так удобнее считать и составлять смеси; далее мы широко будем применять этот прием в рецептах).
Молекулярные веса компонентов (Мкомп): Sr(NO3)2 — 212; NaNO3 — 147; KCl04 — 138,5; S — 32; C — 12; Al — 27. Если вам встретится полимер (например, ПВХ в некоторых рецептах), то нужно считать по минимальному повторяющемуся фрагменту («составному звену»), в большинстве случаев соотвествующему молекуле мономера (для ПВХ это хлорвинил C2H3Cl).
Принимаем мольную долю азотнокислого стронция (АС) за 1 и составляем пропорции для остальных компонентов по уравнению:
212 : Mкомп×мол. доля комп = масс. доля АС по рецепту: масс. доля комп по рецепту;
Смысл этой пропорции в том, чтобы найти неизвестную нам мольную долю компонента: умноженная на его молекулярный вес, она даст массу компонента, которая относится к известной нам массе азотнокислого стронция (212×1) согласно соотношению массовых долей по рецепту. Распишем пропорции для всех компонентов (буквы после молекулярного веса означают искомую мольную долю по первой букве названия компонента):
NaNO3: 212:147·N = 46:11 (для второго, более красного, варианта огня 46:5);
KCl04: 212:138,5·K = 46:19;
S: 212:32·S = 46:21;
C: 212:12·C = 46:3;
Al: 212:27·A = 46:3.
Не уверен, что сейчас пропорции так же обстоятельно проходят в школе, как в мое время — по сути пропорция есть более наглядный вид обычного равенства произведений, в логику математики она не укладывается, зато прекрасно укладывается в здравый смысл. Мы даже не писали знака деления, ставя вместо него тире и произнося словами примерно такое: «212 частей в-ва АС — это 147х частей в-ва N, а 46 частей в-ва АС — это 11 частей N». Неизвестная величина, где бы она не стояла, при этом находится из основного правила пропорции: «произведение крайних членов равно произведению средних членов». Отсюда:
Мольная д. NaNO3 I вар. N = 212·11/147·46 = 0,345;
II вар. N = 212·5/147·46 = 0,157;
Мольная д. KCl04 K = 212·19/138,5·46 = 0,63;
Мольная д. S = 212·21/32·46 = 3,0;
Мольная д. C = 212·3/12·46 = 1,15;
Мольная д. Al A = 212·3/27·46 = 0,5;
Отсюда расписываем мольный состав кислородсодержащих соединений в смеси и подсчитываем количество грамм-атомов кислорода в ней:
I вариант: Sr(NO3)2 + 0,345·NaNO3 + 0,63·KCl04;
содержание кислорода в смеси I = 6+0,345·3+0,63·4 = 6+1,03+2,52 = 9,55 г-а (или 4,8 моля молекулярного O2 в официальных единицах, хотя так считать неудобно).
II вариант: Sr(NO3)2 + 0,157·NaNO3 + 0,63·KCl04;
содержание кислорода в смеси II = 6+0,157·3+0,63·4 = 6+0,47+2,52 = 9,0 г-а.
Теперь посчитаем, сколько его надо для полного сгорания. Полагаем, что все участвующие элементы-восстановители окисляются полностью, а именно:
Sr → SrO
Na → Na2O
K → K2O
S → SO2
C → CO2
Al → Al2O3
Иными словами, на 1 грамм-атом стронция Sr пойдет 1 грамм-атом кислорода O, на 1 грамм-атом Na и K пойдет 1/2 грамм-атома кислорода; серы S и угля С — по 2 грамм-атома; алюминия Al — 3/2 грамм-атома. Зная количество мольных долей каждого из этих элементов (в том числе в составе соответствующих соединений), получаем необходимое количество грамм-атомов кислорода:
Sr: 1 г-а O;
Na: I вар. 0,345/2 = 0,17 г-а O; II вар. 0,157/2 = 0,08 г-а.
K: 0,63/2 = 0,315 г-а O;
S: 3,0*2 = 6 г-а O;
C: 1,15*2 = 2,3 г-а O;
Al: 0,5*3/2 = 0,75 г-а O;
10-20% дефицита кислорода может считаться нормой, при большей недостаче смесь может просто гаснуть в процессе горения, если вообще ее удастся воспламенить. Справедливости ради отметим, что недостача связанного кислорода не единственная причина плохого зажигания и вялого горения смесей, о чем несколько слов в конце этого раздела.
Как видим, расчеты действительно довольно муторные, но иногда их проводить целесообразно. Например, такой же анализ смесей красного и зеленого огня (см. след. раздел), показывает, что замена азотнокислого стронция на азотнокислый барий в равном весовом количестве практически ничего не меняет в кислородном балансе, и одинаковый состав для удобства составления смесей тут вполне приемлем.
В реальности реакция тут совсем другая: 2KNO3+S+3C=K2S+N2+3CO2! И по ней классический состав черного пороха кислороднодефицитен в минимальной степени: просто небольшая (не более 1/10) часть C сгорает до CO, а не CO2).
В пособии И. В. Быстрова для артиллеристов [13], откуда заимствована эта методика, приводятся примеры и других теоретических расчетов пиротехнических составов. Из них самый большой интерес представляет тепловой расчет, который в принципе прозволяет оценить температуру и интенсивность горения смеси. На практике, однако, такие расчеты из-за большого числа влияющих факторов довольно бесполезны — измените крупность частиц, рыхлость смеси и соотношение поверхность/объем (т.е насыпную плотность — насколько смесь утрамбована), замените картонный корпус на металлический, учтите влажность компонентов — все это влияет на интенсивность и температуру горения. Причем влияет неоднозначно: уменьшение площади поверхности по отношению к объему сначала увеличивает скорость горения (из-за снижения теплопотерь в окружающую среду), но затем, по мере уплотнения самой смеси скорость горения быстро снижается — смесь становится слишком плотная, чтобы гореть сразу во всем объеме, и сгорает послойно. Кроме того, для каждого соотношения площадь/объем есть оптимальная крупность частиц, при котором скорость горения максимальна (сравните гранулы ружейного и артиллерийского пороха). И, как любые другие тепловые расчеты, ваш окажется к большинству практических случаев неприменимым. Так что такие расчеты могут в лучшем случае служить некоторым подспорьем для опытного экспериментатора, а сами по себе они не окупают затраченного времени.