что брызгают астматики чтоб дышать
«Ловушки», в которые можно угодить при лечении бронхиальной астмы
Рисунок 1. Зачастую у больных астмой снижены виды на будущее, хотя некоторые склонны недооценивать тяжесть симптомов своего заболевания Какова дифференциальная диагностика между бронхиальной астмой и ХОЗЛ? С чем связаны возможны
 |
| Рисунок 1. Зачастую у больных астмой снижены виды на будущее, хотя некоторые склонны недооценивать тяжесть симптомов своего заболевания |
Какова дифференциальная диагностика между бронхиальной астмой и ХОЗЛ?
С чем связаны возможные ошибки в диагностике?
Какова основная роль b-агонистов в терапии бронхиальной астмы?
Как назначаются кортикостероиды?
Несмотря на возросшую компетентность врачей и доступность эффективных методов лечения, смертность от бронхиальной астмы остается высокой. Предотвратить многие смертельные исходы и даже избежать большинства случаев госпитализации можно было бы при проведении правильного лечения.
Необходимо помнить, что ведение больных астмой — процесс сложный и длительный.
Недооценка степени несостоятельности дыхания. Тяжесть состояния пациента и степень несостоятельности его дыхательной системы можно не распознать, если пренебречь тщательным выяснением всех проявлений болезни и построением диаграммы измерений максимальной скорости потока (МСП) выдыхаемого воздуха.
Зачастую у больных астмой снижены виды на будущее, хотя некоторые и склонны недооценивать серьезность симптомов своего заболевания. Чтобы выявить такую недооценку, нужно подробно расспросить пациента, бывает ли у него кашель или хриплое дыхание ночью или при физической нагрузке.
Если пациентам не удается достичь наилучшей возможной функции легких, то для коррекции этого состояния необходимо для начала вычислить нормальную МСП выдыхаемого воздуха для данного пациента, пользуясь диаграммой, прилагаемой к пикфлуометру.
Если измеренная МСП более чем на 20% меньше вычисленной, стоит провести исследование обратимости этого состояния, что делается путем сопоставления МСП или жизненной емкости легких (ЖЕЛ) до и после лечения.
Необходимая терапия может состоять всего лишь в однократном приеме бронходилятатора, но если это не увеличивает МСП на 20%, то есть до вычисленного уровня, могут понадобиться более серьезные меры, например трехнедельный курс системных кортикостероидов (30 мг преднизолона в день для взрослых). Таким образом выясняется наилучший достижимый уровень МСП, на который ориентируются в последующем лечении.
Иногда пациенты сообщают об уменьшении одышки, но при этом значения МСП не изменяются. В таких случаях необходимо провести измерение ЖЕЛ с помощью спирометра, которое может подтвердить улучшение, не определяемое по МСП (рис. 2). Спирометрами в настоящее время укомплектованы все врачебные приемные.
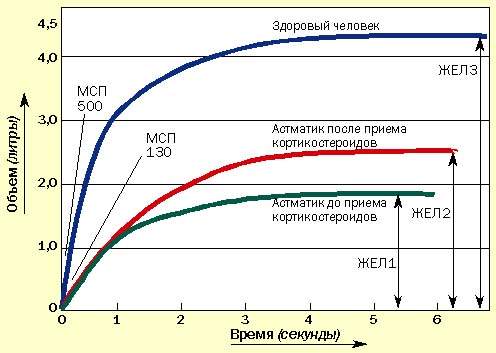 |
| Рисунок 2. Изменение ЖЕЛ под влиянием курса кортикостероидов. МСП может не измениться, но увеличение ЖЕЛ свидетельствует об улучшении состояния |
Бронхиальная астма, замаскированная под хроническое обструктивное заболевание легких (ХОЗЛ). Страдающие одышкой пациенты, которым поставлен диагноз ХОЗЛ или эмфизема, могут иметь скрытый бронхоспастический элемент, обусловленный бронхиальной астмой.
Таким пациентам необходимо провести исследование обратимости процесса, как описано выше. Любое улучшение функции легких можно поддержать, проводя адекватное лечение бронхиальной астмы. При отсутствии улучшения легочной функции назначение кортикостероидов ничем не оправдано, а только приводит к нежелательным побочным эффектам, таким как остеопороз.
Что должен помнить врач, наблюдающий больных с бронхиальной астмой
Постоянный прием b-агонистов короткого действия. Показано, что лечение астмы постоянным приемом b-агонистов увеличивает гиперреактивность легких и утяжеляет бронхиальную астму [1]. Если пациент использует b-агонисты скорее регулярно, чем случайно, их применение должно сопровождаться назначением ингаляционных кортикостероидов или, если кортикостероиды уже применяются, увеличением их дозы до достаточной, чтобы контролировать астму. Таким образом, b-агонисты оставляют на случаи одышки и хрипов.
Последние методические указания по лечению бронхиальной астмы в Британии рекомендуют начинать с высокой дозы ингаляционных или системных кортикостероидов для достижения быстрого контроля, затем постепенно снижать дозу до минимальной, обеспечивающей нормальное самочувствие пациента и оптимальные значения МСП или ЖЕЛ на фоне минимального применения бронходилятатора (рис. 3). Быстрое облегчение состояния, достигаемое при применении кортикостероидов, улучшает настроение пациента и увеличивает его доверие к лечению.
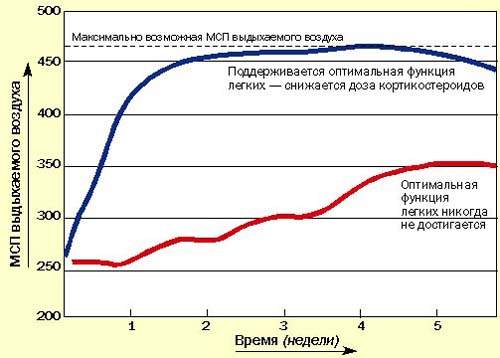 |
| Рисунок 3. Рекомендуется начинать с высоких доз кортикостероидов, а затем постепенно снижать дозу до минимальной (оптимальные значения МСП или ЖЕЛ) |
Последние данные свидетельствуют о том, что назначать кортикостероиды нужно как можно раньше всем астматикам, и не только для контролирования симптомов, но и для предотвращения прогрессирующих структурных повреждений легких, обусловленных хроническим воспалением [2,3]. Это означает, что кортикостероиды следует предпочесть b-агонистам, как только диагноз подтверждается МСП-диаграммой. b-агонисты остаются препаратами резерва на крайний случай.
Возможность альтернативного лечения. Хотя ингалируемые кортикостероиды должны быть краеугольным камнем в лечении астмы, в случаях, трудно поддающихся лечению, можно использовать и некоторые другие препараты. Доказано, что противовоспалительным эффектом обладают теофиллины в достаточно небольших дозах, но надо учитывать в каждом индивидуальном случае их возможное взаимодействие с другими препаратами.
Пожилым пациентам целесообразно назначать ипратропиум. Иногда оказываются эффективными недокромил и кромогликат.
Бронходилятаторы длительного действия, такие как сальметерол, могут облегчать состояние, особенно ночью, блокируя бронхоконстрикторные механизмы. Однако необходимо, чтобы все вышеперечисленные препараты сопровождались применением адекватных доз кортикостероидов.
Техника ингаляции. Нужно добиться, чтобы у пациентов выработались правильные навыки обращения с ингалятором. Врач должен помочь подобрать тот тип ингалятора, который наиболее удобен пациенту, и проверить его работоспособность. Для этого в кабинете врача должен быть полный набор ингаляторов.
Спейсеры. Применяемые вместе с аэрозольными ингаляторами, спейсеры облегчают проникновение препарата в легкие и снижают как накопление его в глотке, так и системное всасывание за счет проглатывания.
Спейсеры помогают координировать выброс препарата со вдохом. Это особенно важно при ингалировании кортикостероидов. Так как кортикостероиды применяются только дважды в день, громоздкий спейсер можно хранить дома.
Спейсеры обеспечивают лучшее накопление препарата в легких, чем распылители. Необходимо правильно их применять: встряхнуть ингалятор, чтобы лекарство смешалось с носителем, и однократно впрыснуть смесь с последующим скорейшим вдохом [4].
Триггерные факторы. Нераспознанные триггерные факторы могут быть и дома, и на работе, и на отдыхе, то есть практически в любом месте. Выявить источник поможет анамнез. Например, при профессиональной бронхиальной астме состояние улучшается во время отпуска и в выходные дни. Отсутствие раздражителя уменьшает или устраняет проявления болезни и снижает необходимость в лекарствах.
Проблемой, которую часто не принимают во внимание, может быть пассивное курение. Такие препараты, как b-блокаторы и нестероидные противовоспалительные средства (НПВС), также могут вызывать астму.
Использование распылителей (небулайзеров) без фоновой кортикостероидной терапии. При лечении острого астматического приступа без назначения пероральных кортикостероидов все еще используют распылители, которые обеспечивают проникновение более высокой дозы b-агонистов. Это действительно снимает бронхоспазм, но поскольку высокая доза b-агонистов не воздействует на сопутствующий воспалительный процесс, необходимо сразу же дать больному кортикостероиды внутрь, чтобы предотвратить нарастание приступа; эффект бронходилятаторов снижается по мере увеличения отека слизистой.
Если тяжесть приступа такова, что требуется небулайзер, необходимо назначить системные кортикостероиды. Даже при умеренном приступе бронходилятаторы сами по себе приносят лишь временное облегчение и есть опасность повторения приступа — возможно, глубокой ночью!
Несвоевременное назначение оральных кортикостероидов. Если не проводить противовоспалительной терапии, у больных нарастает отек слизистой, что приводит к повторению приступов. Такие пациенты часто нуждаются в госпитализации и назначении высоких доз кортикостероидов в течение нескольких дней, прежде чем у них наступит стабилизация состояния.
Пациенты, подверженные быстроразвивающимся приступам, нуждаются в как можно более раннем назначении кортикостероидов и бронходилятаторов. Они должны уметь распознавать ухудшение состояния, всегда иметь под рукой кортикостероиды и знать, как их использовать. Не следует заставлять этих пациентов дожидаться прихода к ним врача (рис. 4).
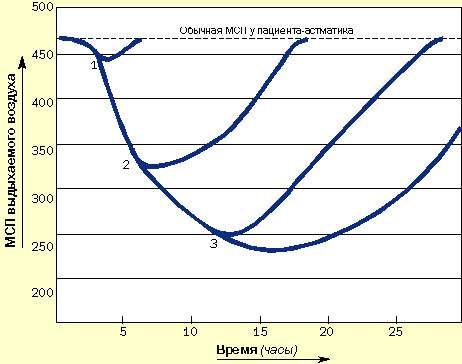 |
| Рисунок 4. Зависимость развития острых приступов от времени назначения кортикостероидов и как результат применения длительных курсов системной кортикостероидной терапии. (1) Кортикостероиды назначены сразу после возникновения приступа: выздоровление наступает быстро. (2) Кортикостероиды назначены через 6 часов: выздоровление замедлено. (3) Кортикостероиды назначены позже чем через 12 часов: приступ тяжелый и длительный, выздоровление наступает медленно |
Пациенты с постепенным развитием приступов могут подождать и посмотреть, помогает ли увеличенная доза ингаляционных кортикостероидов в сочетании с бронходилятаторами.
Неадекватный курс системных кортикостероидов. Иногда назначенные кортикостероиды отменяют до полного купирования приступа, что ведет к сохранению гиперреактивности бронхов и очередному приступу.
Подобная цепь событий может привести пациента к ложному заключению, что у него бронхиальная астма, трудно поддающаяся лечению.
Ситуацию можно исправить длительным курсом кортикостероидов, продолжающимся в течение нескольких дней после стабилизации состояния, и снижением их дозы постепенно до достижения минимальной поддерживающей.
Прекращение наблюдения за пациентом после острого приступа или госпитализации. Трудности возникают при отмене системного кортикостероида и назначении ингаляционного. В этот переходный период необходимо тщательное наблюдение; по достижении стабилизации состояния дозу ингалируемого кортикостероида постепенно снижают до минимально необходимой, чтобы заболевание никак себя не проявляло и функция легких была оптимальной.
Целью последующего лечения становится поддержание наивысшей МСП, достигнутой в больнице после курса системных кортикостероидов.
Консультация, проведенная через некоторое время после выписки, дает хорошую возможность проверить план ведения пациента, выяснить, что не так, и внести соответствующие поправки.
Кашель и хрипы с гнойной мокротой иногда принимают за легочную инфекцию. Однако мокрота больных астмой содержит гораздо больше эозинофилов, чем полиморфных клеток и бактерий. В пожилом возрасте левожелудочковая недостаточность и сердечная астма должны наводить на мысль о предшествующей бронхиальной астме. Будьте осторожны с b-блокаторами!
Внезапная одышка может быть обусловлена пневмотораксом или легочной эмболией. Хрипы встречаются при туберкулезе легких, бронхиальной карциноме или инородном теле и могут быть четко локализованы. Следовательно, у любого пациента с астмой, развившейся во взрослом возрасте, необходимо провести рентгенологическое исследование органов грудной клетки.
После установления диагноза основная цель врача — освободить пациента от проявлений болезни и оптимизировать функцию легких, а также установить контроль за болезнью. Для этого специально обученный медперсонал должен обучать больных и проверять правильность выполнения ими всех назначений.
Конечно, в некоторых случаях это может оказаться затруднительным, однако план предписанных действий способно усвоить абсолютное большинство больных.
Все пациенты должны:
Литература
1. Sears M. R., Taylor D. R. et al. Regular inhaled b-agonist treatment in bronchial asthma. Lancet 1990;336:1491–1396.
2. Tari Haahtela et al. Comparinson of terbutaline with budesonide in newly detected asthma. N Engl J Med 1991;325:388–392.
3. Redingon A. K., Howarth P. H. Airway remodelling in asthma. Thorax 1997;52:310–312.
4. O’Callaghan C., Barry P. Spacer devices in the treatment of asthma. BMJ 1997;314:1061–1062.
Спирометрия при хронической бронхиальной астме
Бочкообразная грудная клетка при хронической бронхиальной астме возникает из-за задержки воздуха в периферических отделах легких, что приводит к постоянному поддержанию грудной клетки в состоянии вдоха. Задержанный воздух не выдыхается и бесполезно занимает большую часть легких (остаточный объем). Это снижает объем воздуха (жизненную емкость легких), входящего в легкое.
Воздух задерживается из-за хронического воспаления, вызывающего отек слизистой периферических бронхиол. При лечении кортикостероидами отек спадает и воздух высвобождается. Это доказывается увеличением ЖЕЛ, определенной спирометрически. МСП может не изменяться (см. рис. 2.)
Обратите внимание!
Приступ астмы
Хроническая астма/ХОЗЛ
Приступ удушья при астме
Бронхиальная астма является одним из самых распространенных заболеваний в нашей стране. По данным статистики, этим недугом в России страдают более 25 % населения, большая часть из которых дети. Количество больных за последние два года увеличилось почти в 2 раза. Чаще всего заболевание возникают в возрасте до 10-ти лет. Самое опасное в этом заболевании — приступ удушья. Астма может быть как приобретенной, так и наследственной. Приступ начинается в любой момент, даже во время сна. Поэтому важно знать, как помочь человеку справиться с этим припадком.
Приступы удушья при астме: причины
Заболевание заставляет человека постоянно жить в страхе перед следующим приступом. Удушье при бронхиальной астме ведет к кислородному голоданию. При этом происходят:
Иногда больной заранее чувствует приближение очередного приступа удушья при астме. Выдыхать воздух человеку становится все тяжелее. При выпускании воздуха он начинает издавать «свистящий» и хрипящий звук. Кожа человека бледнеет, а губы синеют. Это связано с тем, что кровь не получает необходимого количества кислорода. Завершается припадок сильным кашлем. При этом у больного выделяется вязкая мокрота.
Основными причинами приступа удушья при бронхиальной астме являются:
При бронхиальной астме удушье также может быть спровоцировано большими физическими нагрузками. Возникают приступы при резком снижении температуры воздуха или из-за микроорганизмов, которые попали в бронхи.
Методы диагностики
Когда у человека возникает первый приступ удушья, он не всегда понимает, в чем его причина. Специалист для определения причины удушья назначает пациенту:
| Методика диагностики | Время |
|---|---|
| Бронхоскопия | 20 минут |
| Рентген легких | 10 минут |
| Общий анализ крови | 10 минут |
| Анализ крови на IgE | 10 минут |
Какой врач лечит приступы удушья при бронхиальной астме?
Назначить эффективное лечение и купировать приступ удушья при бронхиальной астме сможет:
Приступы удушья при бронхиальной астме: первая помощь
В начале заболевания люди могут даже не догадываться о предстоящем приступе. Дети же, переживая его, испытывают огромный стресс. Поэтому так важно знать, как правильно оказать первую помощь при приступе удушья. Бронхиальная астма приводит к панике, которая только усугубляет ситуацию.
Если на ваших глазах у человека начался приступ, то вам необходимо удостовериться, нет ли у него с собой лекарственных препаратов, которые помогают купировать астму. Медицинские средства подбираются каждому пациенту индивидуально лечащим врачом в зависимости от чувствительности пациента, частоты возникновения удушья, формы заболевания. Препараты могут быть как в форме таблеток, так и в виде ингаляторов карманного типа. Чаще всего используются последние средства, которые впрыскиваются непосредственно в бронхи. Они снимают спазм в течение нескольких минут.
При приступе больному необходимо сидеть, а руки его должны упираться в стол или спинку стула. Ослабьте его галстук или расстегните плотно прилегающий ворот рубашки. По возможности откройте окна, чтобы обеспечить доступ кислорода. Ноги человека рекомендуется погрузить в емкость с горячей водой до голеней.
При повторном приступе, который длится более пятнадцати минут, необходимо вызвать «Скорую помощь» или привезти больного в стационар самостоятельно.
Как снять приступ удушья при астме?
При возникновении удушья врачи рекомендуют не откладывать применение лекарственных препаратов. Однако, как снять приступ удушья при астме, когда у больного нет с собой никаких медицинских средств? До того, как прибудет «Скорая помощь», можно облегчить состояние человека. Постарайтесь успокоить его и нормализовать дыхание. Для этого можно принять любое антигистаминное средство. Эти противоаллергенные препараты особенно действенны в самом начале приступа. Горчичники, поставленные на грудь, также облегчат дыхание при сильном спазме.
Профилактика приступов удушья при бронхиальной астме
Отказ от курения и алкоголя, регулярные физические упражнения укрепят иммунитет, уменьшат количество приступов. Профилактика удушья при бронхиальной астме включает:
Еще одним действенным методом профилактики приступов является баночный массаж. Его проводить можно даже в домашних условиях. Процедура в среднем длится не более 10 минут. Для проведения массажа вам понадобятся:
Спину больного необходимо обильно смазать вазелином. Тампон нужно смочить спиртом и поджечь. Опустить его на несколько секунд в банку. Вынуть тампон. Быстро приложить банку к спине и водить вверх-вниз.
Современная терапия бронхиальной астмы
Бронхиальная астма — заболевание, с которым все чаще сталкиваются врачи в последнее время. Это неудивительно, ибо, по данным международных исследований, в развитых странах мира около 5% взрослого населения и почти 10% детей страдают этим недугом.
Бронхиальная астма — заболевание, с которым все чаще сталкиваются врачи в последнее время. Это неудивительно, ибо, по данным международных исследований, в развитых странах мира около 5% взрослого населения и почти 10% детей страдают этим недугом. Кроме того, в последние десятилетия прослеживается четкая тенденция роста заболеваемости аллергическими болезнями, в том числе бронхиальной астмой.
Именно этим обстоятельством обусловлено появление в последние годы ряда программных документов, руководств, посвященных диагностике и лечению бронхиальной астмы. Такими основополагающими документами являются Совместный доклад ВОЗ и Национального института сердца, легких, крови (США) «Бронхиальная астма. Глобальная стратегия (GINA)», 1996 [1] и «Бронхиальная астма (Формулярная система). Руководство для врачей России», 1999 [2]. Эти руководства предназначены для практических врачей и служат одной цели — формированию единой концепции бронхиальной астмы, ее диагностики и лечения.
В свою очередь, современная терапия бронхиальной астмы базируется на вышеупомянутой концепции, на основании которой определяются форма и степень тяжести заболевания.
Согласно современным представлениям, бронхиальная астма независимо от тяжести ее течения является хроническим воспалительным заболеванием дыхательных путей, в формировании которого участвуют многие клетки: тучные клетки, эозинофилы и Т-лимфоциты. При наличии предрасположенности это воспаление приводит к повторяющимся эпизодам хрипов, одышки, тяжести в грудной клетке и кашлю, особенно ночью и/или ранним утром. Эти симптомы обычно сопровождаются распространенной, но вариабельной обструкцией бронхов, которая по крайней мере частично обратима спонтанно или под влиянием лечения. Воспаление приводит к формированию повышенной чувствительности дыхательных путей к самым различным стимулам, которые у здоровых лиц никакой реакции не вызывают. Это состояние — бронхиальная гиперреактивность, которая может быть специфической и неспецифической. Специфическая гиперреактивность представляет собой повышенную чувствительность бронхов к определенным, специфическим аллергенам, вызвавшим развитие астмы. Под неспецифической гиперреактивностью понимают повышенную чувствительность к разнообразным неспецифическим стимулам неаллергенной природы: холодному воздуху, физической нагрузке, резким запахам, стрессам и пр. Одним из важных признаков гиперреактивности, используемых для оценки степени тяжести бронхиальной астмы, является суточная вариабельность пиковой скорости выдоха (ПСВ), составляющая 20% и более.
Аллергические механизмы становятся причиной развития астмы у 80% детей и приблизительно у 40-50% взрослых, поэтому Европейская Академия Аллергологии и Клинической Иммунологии (EAACI) предлагает использовать термин «аллергическая астма» как основное определение астмы, обусловленной иммунологическим механизмом, причем в тех случаях, когда доказано участие в этом механизме антител класса иммуноглобулинов Е, отсюда и термин «IgE-обусловленная астма» [4]. В нашей стране для обозначения этого варианта применяется термин «атопическая астма». Определение полностью отражает суть процесса, в котором принимают участие IgE-антитела. Другие неиммунологические типы астмы ЕААСI предлагается называть неаллергической астмой [4]. По-видимому, к этой форме может быть отнесена астма, развивающаяся из-за нарушения метаболизма арахидоновой кислоты, эндокринных и нервно-психических расстройств, нарушения рецепторного и электролитного балансов дыхательных путей, воздействия неаллергенных аэрополлютантов и профессиональных факторов.
Установление формы бронхиальной астмы имеет принципиальное значение для ее терапии, ибо лечение любого аллергического заболевания начинается с мероприятий по элиминации аллергена (или аллергенов), виновного в развитии болезни. Можно полностью удалить аллерген, если речь идет о домашнем животном, пищевом продукте или лекарственном препарате, и уже только благодаря этому добиться ремиссии бронхиальной астмы. Но чаще развитие астмы провоцирует клещ домашней пыли, которого не удается удалить полностью. Однако количество пылевых клещей можно существенно сократить, используя специальные безаллергенные постельные принадлежности и акарицидные средства, проводя регулярную влажную уборку с помощью пылесоса с глубокой степенью очистки. Все эти мероприятия, равно как и меры по сокращению содержания пыльцы в воздухе жилых помещений в сезон цветения и меры, позволяющие минимизировать контакт со спорами внедомашних и внутридомашних непатогенных плесневых грибов, приводят к значительному ослаблению симптомов бронхиальной астмы у чувствительных к этим аллергенам пациентов.
Фармакотерапия — неотъемлемая и важнейшая составляющая комплексной лечебной программы бронхиальной астмы. Существует несколько ключевых положений в терапии бронхиальной астмы:
Итак, все препараты, которые используются для лечения бронхиальной астмы, принято делить на две группы: базисные или лечебные, то есть обладающие противовоспалительным эффектом, и симптоматические, обладающие преимущественно быстрой бронхолитической активностью. Однако за последние годы на фармакологическом рынке появилась новая группа противоастматических препаратов, которые представляют собой комбинацию противовоспалительных и бронхолитических средств.
К базисным противовоспалительным препаратам относятся глюкокортикостероиды, стабилизаторы тучных клеток — кромоны и ингибиторы лейкотриенов.
Ингаляционные глюкокортикостероиды (беклометазон дипропионат, флютиказон пропионат, будесонид, флунизолид) в настоящее время являются препаратами выбора для лечения среднетяжелой и тяжелой астмы. Более того, согласно международным рекомендциям, ингаляционные глюкокортикостероиды (ИГКС) показаны всем больным с персистирующей астмой, в том числе и с легким течением, ибо даже при этой форме астмы в слизистой дыхательных путей присутствуют все элементы хронического аллергического воспаления. В отличие от системных стероидов, которые, в свою очередь, являются средством выбора при острой тяжелой астме, ИГКС не имеют тяжелых системных побочных эффектов, представляющих угрозу для больного. Лишь в высоких суточных дозах (выше 1000 мкг) они могут угнетать функцию коры надпочечников. Многофакторное противовоспалительное действие ингаляционных глюкокортикостероидов проявляется в их способности снижать или даже вовсе устранять бронхиальную гиперреактивность, восстанавливать и повышать чувствительность β2-адренорецепторов к катехоламинам, в том числе к препаратам β2-агонистам. Доказано, что противовоспалительная эффективность ИГКС зависит от дозы, поэтому целесообразно начинать лечение со средних и высоких доз (в зависимости от тяжести астмы). При достижении стабильного состояния больных (но не ранее чем через 1-3 месяца от начала терапии ИГКС) и улучшении показателей ФВД дозу ИГКС можно снизить, но не отменять! В случае ухудшения течения астмы и снижения функциональных легочных показателей доза ИГКС должна быть повышена. Возникновения таких неопасных, но нежелательных побочных эффектов ИГКС, как кандидоз ротовой полости, дисфония, раздражающий кашель, можно избежать благодаря применению спейсеров, а также полосканию ротовой полости и горла слабым раствором соды или просто теплой водой после каждой ингаляции препарата.
Кромогликат натрия и недокромил натрия (кромоны) подавляют выделение медиаторов из тучной клетки путем стабилизации ее мембраны. Эти препараты, назначенные до начала воздействия аллергена, способны угнетать раннюю и позднюю аллергические реакции. Их противовоспалительный эффект значительно уступает таковому у ИГКС. Снижение бронхиальной гиперреактивности происходит лишь после длительного (не менее 12 недель) лечения кромонами. Однако преимущество кромонов — в их безопасности. Эти препараты практически не дают побочных эффектов и поэтому с успехом применяются для лечения детской астмы и астмы у подростков. Атопическая астма легкого течения у взрослых иногда также хорошо контролируется кромогликатом или недокромилом натрия.
Антилейкотриеновые препараты, включающие в себя антагонисты цистеиниловых (лейкотриеновых) рецепторов и ингибиторы синтеза лейкотриенов, представляют собой относительно новую группу противовоспалительных препаратов, используемых для лечения астмы. В России в настоящее время зарегистрированы и разрешены к использованию препараты зафирлукаст (аколат) и монтелукаст (сингуляр) — блокаторы лейкотриеновых рецепторов, представленные в форме для орального применения. Противовоспалительный эффект этих препаратов заключается в блокаде действия лейкотриенов — жирных кислот, продуктов распада арахидоновой кислоты, участвующих в формировании бронхиальной обструкции. В последние годы появилось много работ, посвященных изучению клинической эффективности антилейкотриеновых препаратов при различных формах и различной степени тяжести бронхиальной астмы. Эти препараты эффективны в лечении больных с аспириновой формой бронхиальной астмы, при которой лейкотриены являются основными медиаторами воспаления и формирования бронхиальной обструкции. Они эффективно контролируют астму физических нагрузок и ночную астму, а также интермиттирующую астму, вызванную воздействием аллергена. Особое внимание уделяется изучению антилейкотриеновых препаратов, применяемых в терапии детской астмы, так как они удобны в использовании и вызывают относительно низкий по сравнению с ИГКС риск возникновения серьезных побочных эффектов. В последних американских руководствах по диагностике и терапии астмы препараты — антагонисты лейкотриеновых рецепторов рассматриваются как альтернатива ИГКС для контроля легкой, персистирующей астмы у детей 6 лет и старше, а также у взрослых. Однако в настоящее время проводится достаточно много исследований, демонстрирующих эффективность этих препаратов у лиц, страдающих среднетяжелой и тяжелой астмой, которым антагонисты лейкотриеновых рецепторов назначаются как дополнение к ИГКС. Такое сочетание препаратов, потенциирующих действие друг друга, усиливает противоастматическую терапию и позволяет избежать повышения дозы ИГКС у некоторых пациентов, а иногда даже снизить ее.
Таким образом, новые противоастматические препараты — антагонисты лейкотриеновых рецепторов могут использоваться для противовоспалительной (базисной) терапии астмы в следующих ситуациях [5]:
Препараты бронхолитического действия применяются как для купирования острого приступа астмы при хроническом ее течении, так и для профилактики астмы физических нагрузок, острой астмы, индуцированной аллергеном, а также для снятия тяжелого бронхоспазма при обострении бронхиальной астмы.
Ключевые положения в бронхолитической терапии бронхиальной астмы:
Селективные β2-агонисты первой генерации [3]: албутерол (сальбутамол, вентолин), тербуталин (бриканил), фенотерол (беротек) и другие — представляют собой наиболее эффективные бронхолитики. Они способны быстро (в течение 3-5 мин) и на довольно долгий срок (до 4-5 ч) оказывать бронхолитическое действие после ингаляции в виде дозированного аэрозоля при легких и среднетяжелых приступах астмы, а при использовании растворов этих препаратов через небулайзер — и при тяжелых приступах в случае обострения астмы. Однако β2-агонисты короткого действия следует применять только для купирования приступа удушья. Они не рекомендуются для постоянной, базисной терапии, так как не способны уменьшать воспаление дыхательных путей и бронхиальную гиперреактивность. Более того, при постоянном и длительном их приеме степень бронхиальной гиперреактивности может возрастать, а показатели функции внешнего дыхания — ухудшаться [3]. Этих недостатков лишены β2-агонисты второй генерации, или β2-агонисты длительного действия: сальметерол и формотерол. В силу липофильности своих молекул эти препараты очень близки β2-адренорецепторам, чем прежде всего и определяется длительность их бронхолитического действия — до 12 ч после ингаляции 50 мкг или 100 мкг сальметерола и 6 мкг, 12 мкг или 24 мкг формотерола. При этом формотерол кроме длительного действия одновременно оказывает и быстрое бронхорасширяющее действие, сопоставимое со временем начала действия сальбутамола. Все препараты β2-адреномиметики обладают способностью ингибировать высвобождение медиаторов аллергического воспаления, таких, как гистамин, простагландины и лейкотриены, из тучных клеток, эозинофилов, причем максимально это свойство проявляется у β2-агонистов длительного действия. Кроме того, последние обладают способностью уменьшать проницаемость капилляров слизистой бронхиального дерева. Все это позволяет говорить о противовоспалительном эффекте β2-агонистов длительного действия. Они способны подавлять как раннюю, так и позднюю астматические реакции, возникающие после ингаляции аллергена, и снижать бронхиальную реактивность. Эти препараты являются средством выбора при легкой и среднетяжелой астме, а также у пациентов с ночными симптомами астмы; их можно использовать также для профилактики астмы физических нагрузок [1]. У пациентов со среднетяжелой и тяжелой астмой их целесообразно сочетать с ИГКС.
Теофиллины — основной вид метилксантинов, используемых в лечении астмы. Теофиллины обладают бронхолитическим и противовоспалительным действием. Блокируя фермент фосфодиэстеразу, теофиллин стабилизирует цАМФ и снижает концентрацию внутриклеточного кальция в клетках гладкой мускулатуры бронхов (и других внутренних органов), тучных клетках, Т-лимфоцитах, эозинофилах, нейтрофилах, макрофагах, эндотелиальных клетках. В результате происходят расслабление гладкой мускулатуры бронхов, подавление высвобождения медиаторов из клеток воспаления и снижение повышенной сосудистой проницаемости. Теофиллин в значительной степени подавляет как раннюю, так и позднюю фазы астматической реакции. Пролонгированные теофиллины успешно применяются для контроля ночных астматических проявлений. Однако эффективность теофиллина при острых приступах астмы уступает (как по скорости наступления эффекта, так и по его выраженности) β2-агонистам, применяемым ингаляционно, особенно через небулайзер. Поэтому внутривенное введение эуфиллина должно рассматриваться как резервное мероприятие для тех пациентов с острой тяжелой астмой, для которых прием β2-агонистов через небулайзер оказывается недостаточно эффективным [1]. Это ограничение обусловлено еще и высоким риском возникновения побочных реакций на теофиллин (сердечно-сосудистые и желудочно-кишечные расстройства, возбуждение ЦНС), развивающихся, как правило, при превышении концентрации 15 мкг/мл в периферической крови. Поэтому длительное применение теофиллина требует мониторинга его концентрации в крови.
Антихолинергические препараты (ипратропиум бромид и окситропиум бромид) обладают бронхолитическим действием за счет блокады М-холинорецепторов и снижения тонуса блуждающего нерва. В России давно зарегистрирован и успешно применяется один из этих препаратов — ипратропиум бромид (атровент). По силе и скорости наступления эффекта антихолинергические препараты уступают β2-агонистам, их бронхолитическое действие развивается через 30-40 мин после ингаляции. Однако совместное их использование с β2-агонистами, взаимно усиливающее действие этих препаратов, оказывает выраженный бронхолитический эффект, особенно при среднетяжелой и тяжелой астме, а также у пациентов с астмой и сопутствующим хроническим обструктивным бронхитом. Такими комбинированными препаратами, содержащими ипратропиум бромид и β2-агонист короткого действия, являются беродуал (содержит фенотерол) и комбивент (содержит сальбутамол).
Принципиально новым шагом в современной фармакотерапии бронхиальной астмы является создание комбинированных препаратов, обладающих выраженным противовоспалительным и длительным бронхолитическим действием. Речь идет о комбинации ингаляционных кортикостероидов и длительно действующих β2-агонистов. Сегодня на фармакологическом рынке Европы, и России в том числе, существуют два таких препарата: серетид, содержащий флютиказон пропионат и сальметерол, и симбикорт, имеющий в своем составе будесонид и формотерол. Оказалось, что в подобных соединениях кортикостероид и пролонгированный β2-агонист обладают комплементарным действием и их клинический эффект существенно превышает таковой в случае монотерапии ИГКС или β2-агонистом длительного действия. Назначение такой комбинации может служить альтернативой повышению дозы ИГКС у пациентов со среднетяжелой и тяжелой астмой. Пролонгированные β2-агонисты и кортикостероиды взаимодействуют на молекулярном уровне. Кортикостероиды увеличивают синтез β2-адренорецепторов в слизистой бронхов, снижают их десенситизацию и, напротив, повышают чувствительность этих рецепторов к действию β2-агонистов. С другой стороны, пролонгированные β2-агонисты стимулируют неактивный глюкокортикоидный рецептор, который в результате становится более чувствительным к действию ингаляционных глюкокортикостероидов [6]. Одновременное применение ИГКС и пролонгированного β2-агониста не только облегчает течение астмы, но и существенно улучшает функциональные показатели, снижает потребность в короткодействующих β2-агонистах, значительно эффективнее предупреждает обострения астмы по сравнению с терапией только ИГКС.
Безусловным преимуществом этих препаратов, особенно привлекающим пациентов-астматиков, является сочетание двух активно действующих субстанций в одном устройстве для ингаляций: дозированном аэрозольном ингаляторе (серетид ДАИ) или порошковом ингаляторе (серетид мультидиск) и турбухалере, содержащем препараты в виде пудры (симбикорт-турбухалер). Препараты имеют удобный двукратный режим дозирования, для симбикорта возможен также однократный прием. Серетид выпускается в формах, содержащих различные дозы ИГКС: 100, 250 или 500 мкг флютиказона пропионата при неизменной дозе сальметерола — 50 мкг. Симбикорт выпускается в дозировке 160 мкг будесонида и 4,5 мкг формотерола. Симбикорт можно назначать от 1 до 4 раз в сутки, что позволяет контролировать вариабельное течение астмы с помощью одного и того же ингалятора, уменьшая дозу препарата при достижении адекватного контроля астмы и увеличивая при ухудшении симптомов. Это обстоятельство позволяет подобрать адекватную терапию с учетом тяжести астмы для каждого конкретного больного. Кроме того, симбикорт за счет быстродействующего формотерола быстро облегчает симптомы астмы. Из этого вытекает повышение приверженности к терапии: видя, что лечение помогает быстро и эффективно, больной более охотно соблюдает предписание врача. Следует помнить, что комбинированные препараты (ИГКС + длительно действующие β2-агонисты) не должны использоваться для купирования острого приступа астмы. Для этой цели пациентам рекомендуются β2-агонисты короткого действия.
Таким образом, применение комбинированных препаратов ИГКС и пролонгированных β2-агонистов целесообразно во всех случаях персистирующей астмы, когда не удается достичь хорошего контроля над заболеванием только назначением ИГКС. Критериями хорошо контролируемой астмы являются отсутствие ночных симптомов, хорошая переносимость физической нагрузки, отсутствие потребности в неотложной помощи, суточная потребность в бронхолитиках менее 2 доз, пиковая скорость выдоха больше 80% и ее суточные колебания менее 20%, отсутствие побочных эффектов от проводимой терапии [7].
Безусловно, целесообразно начинать лечение ИГКС с комбинации их с сальметеролом или формотеролом, что позволит достичь быстрого клинического эффекта и заставит пациентов поверить в успех лечения.
По вопросам литературы обращайтесь в редакцию

