брилинта или клопидогрель что лучше после стентирования
Клопидогрель против тикагрелора при плановом стентировании
Несмотря на высокую безопасность планового чрескожного вмешательства на коронарных артериях, одним из осложнений процедуры может быть развитие инфаркта миокарда.
Внутривенное использование кангрелора сопровождалось меньшим числом ишемических, но большим числом геморрагических событий у пациентов с плановым стентированием. При этом тикагрелор в данной клинической ситуации не изучался. В связи с чем целью исследования ALPHEUS сравнение эффективности тикагрелора относительно снижения риска перипроцедурного инфаркта при сравнении с клопидогрелем у пациентов, которым выполняется плановое стентирование.
Открытое рандомизированное исследование проводилось в 49 клиниках Франции и Чехии. Его участниками были пациенты со стабильной ишемической болезнью сердца, имеющие показания к чрескожному коронарному вмешательству и хотя бы 1 критерий высокого риска.
Пациенты рандомизировались в соотношении 1:1 к приему тикагрелора (нагрузочная доза 180 мг и далее 90 мг два раза в день) или клопидогреля (нагрузочная доза 300-600 мг и далее 75 мг в день).
Первичная конечная точка включила инфаркт миокарда 4 типа (а или b) или повреждение миокарда. Первичной точкой безопасности были большие кровотечения. Все исходы оценивались через 48 часов от момента выполнения чрескожного вмешательства на коронарных артериях или во время выписки из стационара, если она происходила раньше этого времени.
В исследование было включено 1910 пациентов; 956 из них рандомизированы в группу тикагрелора и 954 – в группу клопидогреля.
Через 48 часов наступление первичной точки эффективности регистрировалось у 334 (35%) пациентов из группы тикагрелора и у 341 (36%) пациента из группы клопидогреля (отношение рисков 0.97; 95% доверительный интервал 0.8-1.17; p=0.75).
Различий в первичной точке безопасности также обнаружено не было, однако число малых кровотечений за период 30 дней с момента выполнения процедуры оказывалось статистически значимо меньше в группе клопидогреля (отношение рисков 1.54; 95% доверительный интервал 1.12-2.11; p=0.007).
Таким образом, у пациентов с плановым чрескожным вмешательством на коронарных артериях использование тикагрелора по сравнению с клопидогрелем не сопровождалось снижением риска перипроцедурного некроза миокарда, однако приводило к значимому увеличению риска малых кровотечений в течение 30 дней с момента выполнения.
Silvain J, et al. Lancet. 2020. doi: 10.1016/S0140-6736(20)32236-4.
Правила жизни пациентов после коронарного стентирования
Дорогие друзья. Этот текст мы написали специально для наших пациентов после ангиопластики и стентирования коронарных артерий. Надеемся, что Вы найдете здесь ответы на основные вопросы.
4 совета пациентам после стентирования
Стентами мы восстанавливаем кровоток по артериям. Но не вылечиваем ишемическую болезнь сердца. Все теперь зависит от правильного медикаментозного лечения и Вашего образа жизни. Что самое важное?
Не ограничен. Важный период- первые 12 месяцев, пока стент «врастает» в стенку артерии. Риск рестеноза в первый год в «покрытых» стентах, которые мы используем, не выше 1-2%. Дальше все зависит от правильного лечения, прежде всего от приема статинов. Сужения в стенте, которые возникают через 2 года и позже, почти всегда связаны с новыми холестериновыми бляшками.
Практически любую. Если мы не планируем дальнейшего стентирования, то считаем кровоснабжение миокарда достаточным. А значит и ограничений в физической нагрузке у Вас нет. Вы можете жить полноценной жизнью: бег, бассейн, силовые тренировки не противопоказаны начиная со следующего дня после выписки из стационара. Часто для того, чтобы убедиться в качестве выполненной операции, мы проводим нагрузочный тест- стресс-эхокардиографию. Почти всегда ее можно выполнять в первые дни после операции. Тест покажет не только есть ли признаки ишемии (нехватки крови сердцу), но и адекватность медикаментозной терапии.
Да. Через год мы, скорее всего, отменим часть антитромботиков, но основные препараты (статины, аспирин, гипотензивные препараты) нужно будет принимать всегда.
Да, без всяких ограничений. Коронарные стенты очень тонкие и не создадут никаких проблем в этих ситуациях.
Очень важно обратиться к врачу если Вы наблюдаете: 1. возобновление стенокардии, т.е. кратковременная тяжесть или дискомфорт в груди/шее/нижней челюсти, возникающий при физической нагрузке. 2. Любые непонятные боли в груди или внезапная одышка. 3. Кровотечение.
Позвонить в Клинику в любое время (телефон реанимации работает круглосуточно). Лечащий врач или заведующий отделением рентгенхирургии свяжутся с Вами.
Современная антиагрегантная терапия: место тикагрелора в клинических рекомендациях
Рассмотрена доказательная база применения новых антиагрегантов, в частности тикагрелора, при ведении пациентов с острым коронарным синдромом, после процедуры аортокоронарного шунтирования и чрескожного коронарного вмешательства. Представлен алгоритм выбор
The evidence base of application of new antiplatelet agents, such as ticagrelor in the management of patients with acute coronary syndrome after coronary artery bypass procedures and percutaneous coronary intervention is considered. The algorithm of selection antiplatelet therapy.
Лидирующей причиной смертности населения во всем мире по-прежнему является сердечно-сосудистая патология, несмотря на высокий уровень развития кардиологии за последние десятилетия [1, 2]. В основе различных клинических проявлений сосудистой патологии лежит общий анатомический субстрат в виде дисфункции эндотелия артерий, хронического воспаления и повреждения покрышки атеросклеротической бляшки, замедления кровотока, формирования внутрисосудистого тромба [3]. В этой связи снижение риска развития тромботических осложнений является главной задачей, которую должен ставить перед собой врач, желающий увеличить продолжительность и улучшить качество жизни пациентов с сердечно-сосудистыми заболеваниями.
Патогенез тромбообразования включает три основные точки для лекарственного воздействия: тромбоцитарное звено — действие антиагрегантов, свертывающая система — зона действия антикоагулянтов, фибрин — действие фибринолитиков. Тромбоциты первыми реагируют на разрыв атеросклеротической бляшки, запуская коагуляционный каскад, являются источником активного синтеза гуморальных факторов, стимулирующих одновременно процессы образования тромба и воспаления. По данным метаанализа 287 рандомизированных исследований по вторичной профилактике и 6 исследований по первичной профилактике назначение антиагрегантной терапии позволяет снизить риск развития нефатального инфаркта миокарда и нефатального инфаркта мозга на 23% [4]. Данный метаанализ подтверждает, что ведущая роль в профилактике осложнений атеросклероза должна отводиться антиагрегантам.
Антиагреганты — лекарственные препараты, препятствующие тромбообразованию за счет уменьшения функциональной активности тромбоцитов. На сегодняшний день известно более 20 различных лекарственных препаратов, которые способны угнетать функции тромбоцитов путем различных механизмов действия. Однако в ходе многолетней практики и клинических исследований эффективность была подтверждена только для ингибиторов циклооксигеназы (ацетилсалициловая кислота), блокаторов рецепторов аденозиндифосфата (АДФ) — Р2Y12 (клопидогрел, прасугрел*, тикагрелор), ингибиторов фосфодиэстеразы (дипиридамола) и антагонистов гликопротеинов IIb–IIIa для внутривенного применения (абциксимаб, тирофибан*, эптифибатид). Активация тромбоцитов и их последующая агрегация происходят под действием различных медиаторов, наиболее важными из которых являются тромбоксан А2 и АДФ, поэтому наиболее широкое применение получили ацетилсалициловая кислота (АСК) и ингибиторы АДФ (клопидогрел, прасугрел, тикагрелор).
История создания класса началась с обнаружения антитромбоцитарных свойств АСК. В 1987 г. было опубликовано первое рандомизированное Канадское исследование с участием 585 больных с инсультом, получавших АСК в течение 26 месяцев. В исследовании была доказана эффективность АСК в отношении повторного инсульта [5]. Это послужило поводом к тому, что в 1980 г. Управление по надзору за качеством пищевых продуктов и лекарственных средств США (Food and Drug Administration, FDA) одобрили АСК для лечения больных после инсульта. В последующем была доказана эффективность АСК в снижении риска смерти и повторного инфаркта миокарда у больных с нестабильной стенокардией и инфаркта миокарда без подъема сегмента ST [4]. Так началась эпоха антиагрегантной терапии и первого ее достойного представителя — ацетилсалициловой кислоты.
Ацетилсалициловая кислота блокирует активацию тромбоцитов за счет ингибирования циклооксигеназы (ЦОГ), предотвращая образование тромбоксана А2. Тромбоциты — безъядерные клетки, поэтому они лишены способности синтезировать белки. Необратимое ингибирование ЦОГ-1, невозможность ее ресинтеза из-за отсутствия ядра, а также ежедневное обновление пула тромбоцитов лишь на 10% приводят к тому, что блокада синтеза тромбоксана во время терапии АСК сохраняется на протяжении периода жизни тромбоцитов, до 10 дней. Полное подавление продукции тромбоксана достигается при постоянном длительном приеме АСК в дозах ≥ 75 мг/сут. У большинства больных со стабильной ишемической болезнью сердца (ИБС) предпочтительнее назначение АСК в низких дозах за счет благоприятного соотношения пользы и риска. АСК для данной категории пациентов остается основой медикаментозной профилактики артериального тромбоза [6]. Повреждающее действие АСК на желудочно-кишечный тракт (ЖКТ) возрастает по мере увеличения дозы. Препарат рекомендуется всем больным с установленным диагнозом ИБС без каких-либо ограничений длительности применения. Оптимальное соотношение пользы и риска достигается при применении АСК в диапазоне доз от 75 до 150 мг/сут, при использовании в составе двойной антитромбоцитарной терапии доза составляет 75–100 мг.
Однако в последние годы активно обсуждается проблема резистентности к терапии АСК, под которой понимают неспособность препарата у некоторых больных в должной мере подавлять функцию тромбоцитов, снижать синтез тромбоксана А2 и/или удлинять время кровотечения. Распространенность резистентности к терапии АСК, по данным различных исследований, составляет от 10% до 45% [7]. Среди возможных причин этого феномена выделяют следующие:
В ряде независимых исследований было установлено, что у больных с острым коронарным синдромом (ОКС) без подъема сегмента ST (ESSENCE, PRISM PLUS) ближайший прогноз зависит от предшествующего приема АСК до развития обострения ИБС. Так, в исследовании PRISM PLUS при применении АСК при ОКС частота развития инфаркта миокарда, рефрактерной стенокардии и внезапной смерти к 7-му дню наблюдения составила 12,1% среди больных, не принимавших ранее АСК, и 23,5% — среди лиц, принимавших АСК до развития обострения. Этот факт получил название «аспириновый парадокс», что послужило поводом D. L. Bhatt и E. J. Topol (2004 г.) отнести АСК к «субоптимальным антитромбоцитарным средствам» [8, 9]. Все это способствовало разработке и изучению новых антитромбоцитарных препаратов-ингибиторов АДФ P2Y12-рецепторов и определению подходов к двойной антитромбоцитарной терапии.
Группу блокаторов рецепторов АДФ — Р2Y12 представляют препараты тиклопидин, клопидогрел, прасугрел, тикаглерол. Данные препараты ингибируют агрегацию тромбоцитов, индуцированную аденозиндифосфатом, вызывая изменения в рецепторе АДФ тромбоцитов, который получил название Р2Y12 [9]. Существуют значительные отличия между перечисленными выше препаратами, так, к необратимым ингибиторам P2Y12-рецепторов относятся тиенопиридины (тиклопидин, клопидогрел и прасугрел), а к обратимым — триазолопиридины (тикагрелор). Сравнительная характеристика препаратов представлена в табл. 1.
Клопидогрел — наиболее известный и активно применяемый в отечественной медицине на сегодняшний день антиагрегант после АСК [10]. Результаты крупных клинических исследований доказали эффективность по снижению частоты осложнений у широкого круга пациентов с ИБС при добавлении клопидогрела к АСК [11, 12], что послужило основанием для разработки показаний к двойной антитромбоцитарной терапии у пациентов с ОКС без подъема ST, а также после аортокоронарного шунтирования (АКШ) и чрескожного коронарного вмешательства (ЧКВ) для профилактики тромбоза [13].
Клопидогрел, как видно из таблицы, относится к пролекарствам, препарат имеет сложный метаболизм. Абсорбция клопидогрела в кишечнике контролируется особым белком (Р-гликопротеином), кодируемым геном АВСВ1, в этой связи только около 15% из абсорбируемого клопидогрела в печени превращается в активный метаболит. Процесс является двухступенчатым (окисление и гидролиз), зависящим от нескольких изоферментов системы цитохрома P450, наиболее важными из которых являются СУР2С19 и СУР3А4 [14]. Несмотря на широкую доказательную базу эффективности данного препарата, клопидогрел обладает рядом недостатков, к которым можно отнести отсроченное антиагрегантное действие, так как это пролекарство и требуется время для активации, максимальное подавление рецепторов АДФ наступает только на 4–5 день регулярного приема. Кроме того, отмечается вариабельность антитромботического эффекта клопидогрела у различных пациентов, что может быть обусловлено рядом фармакокинетических факторов, в т. ч. недостаточной ударной и поддерживающей дозой препарата, нарушением его всасывания и образования активного метаболита, лекарственным взаимодействием, в частности с ингибиторами протоновой помпы, которые часто назначаются для профилактики кровотечений из верхних отделов ЖКТ [15, 16].
В связи с имеющимися недостатками клопидогрела и невозможностью решить данную проблему, мировому сообществу стала очевидной необходимость создания нового препарата группы блокаторов рецепторов АДФ — Р2Y12.
Новым антиагрегантным препаратам является тикагрелор — обратимый антагонист P2Y12-рецепторов прямого действия. Препарат представляет собой активное вещество, которое метаболизируется посредством изофермента СYР3А4 с образованием активного метаболита. Степень ингибирования P2Y12-рецепторов определяется, прежде всего, содержанием тикагрелора в плазме и, в меньшей степени, его активного метаболита. Период полувыведения составляет около 12 ч, в связи с чем препарат назначается дважды в сутки. Тикагрелор характеризуется более быстрым началом терапевтического действия и обеспечивает более выраженное и стойкое ингибирование активации тромбоцитов по сравнению с клопидогрелом. В то же время восстановление функции тромбоцитов после отмены тикагрелора происходит быстрее по сравнению с клопидогрелом. Наличие более привлекательных фармакологических свойств, а также существующие проблемы, связанные с приемом клопидогрела, послужили основными причинами организации крупномасштабного исследования PLATO (Platelet inhibition and patient outcomes), в котором сравнивались эффективность и безопасность применения тикагрелора по сравнению с клопидогрелом у больных с ОКС [17]. По данным исследования, обнародованного 30 августа 2009 на Конгрессе Европейского общества кардиологов (European Society of Cardiology, ESC), новый антитромботический препарат тикагрелор эффективнее клопидогрела при лечении пациентов с острым коронарным синдромом и при этом не повышает риск кровотечений.
ГБОУ ВПО ОмГМА МЗ РФ, Омск
Брилинта после стентирования
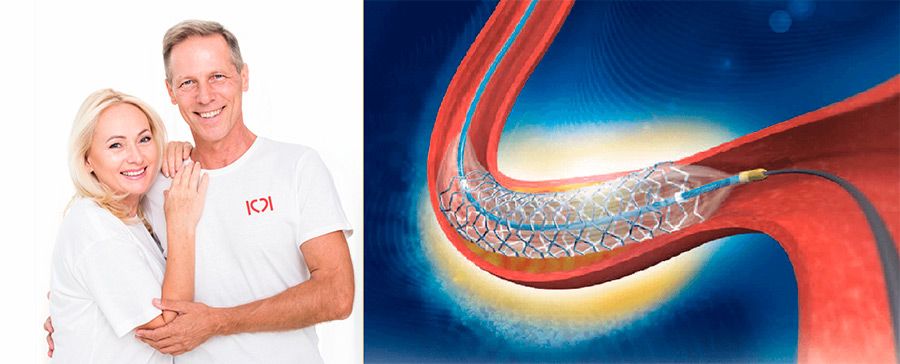
Атеросклеротический стеноз или окклюзия коронарных артерий устраняется различными способами, одним из которых является стентирование сердечных сосудов. Эта методика позволяет расширить просвет артериального русла путем фиксации в нем стента в виде цилиндрической сетчатой конструкции. Она производится на основе биосовместимых материалов (металл, сплавы или полимеры). Поддерживая сосудистую стенку, стент способствует восстановлению внутреннего диаметра сосуда и его гемодинамики. Это крайне важно для восстановления коронарного кровотока и обеспечения полноценной трофики миокарда.
Во избежание тромбообразования и повторного стеноза, помимо применения конструкций, покрытых противотромботическими веществами (гепарин, наноуглерод, фосфорилхолин и др.) важно применять ряд препаратов, среди которых и Брилинта. Медикаментозная терапия на послеоперационном этапе позволяет обеспечить стабильное разжижение крови и образование кровяных сгустков в артериальных руслах. О том, сколько пить Брилинту после стентирования, а также об особенностях послеоперационного периода пойдет речь далее.
Что такое Брилинта
Брилинта – современный препарат с действующим веществом тикагрелор, которое способно вступать в связь с блокаторами аденозиндифосфата. Показан взрослым для предупреждения атеротромботических осложнений. В том числе пациентам с инфарктом в анамнезе сроком от года и более назад. Медикамент снижает частоту тромбозов в кровеносных сосудах, риск повторных инфарктов, ишемических инсультов и смертности от сердечно-сосудистых заболеваний на 15-20%. Обычно назначается с небольшими дозировками аспирина. Клиническая эффективность подтверждена несколькими исследованиями.
Лекарственное средство производится в виде таблеток с различной дозировкой. Они удобны для проглатывания, запивая чистой воды. Если у больного есть проблемы с глотанием, допускается возможность размельчения пилюли до порошкообразного состояния.
Как действует Брилинта
Благодаря действию активного вещества, снижается вероятность образования тромбов. В результате значительно снижается риск развития тяжелых сердечно-сосудистых патологий. Другим эффектом, который показывает тикагрелор в составе Брилинты, становится выработка аденозина. Он обеспечивает снижение напряжения в сосудах, замедление клеточной гибели (апоптоза) внутри сердечных тканей. Если регулярно принимать этот препарат, повысится уровень аденозина, что приведет к более продолжительному лечебному эффекту.
Лекарство во многих случаях переносится хорошо, но исключить полностью риск побочных реакций невозможно. Часто больным приходится сталкиваться с:
В более редких случаях возможно развитие:
Брилинта для профилактики инфаркта
Используют Brilinta не только при стентировании, но также на фоне проблем с кровоснабжением сердца и угрозе инфаркта миокарда. Или в качестве дополнения к медикаментозной терапии после проведения баллонной ангиопластики.
Препарат рационален в применении, поскольку внезапное препятствие нормальному току крови в ветвях коронарной артерии – прямая причина инфаркта. Тромбы тому виной в 95–97 % случаев.
Нагрузочную дозу приема Брилинты пациентам в случае профилактики инфаркта не назначают. Обычно суточная доза составляет 120мг/сутки, разделенные на 2 приема. Если ранее пациент принимал другие препараты, необходим суточный перерыв. Точную схему лечения и дозировку определяет лечащий врач.
Особенности реабилитационного периода и восстановления после стентирования
На длительность кардиологического восстановления после установки кардио-стента влияет множество факторов. В категорию основных входит точное следование врачебным рекомендациям:
Сколько нужно пить Брилинту после стентирования
Вести регулярный мониторинг состояния пациента, а в случае необходимости предпринимать своевременные меры по устранению кровотечений, способен только опытный специалист. Особенно это важно для больных с ишемической болезнью сердца, часто подвергающихся кровотечениям во время лечения этим лекарством.
Только врач, с учетом особенностей клинической картины определяет, сколько пить Брилинту. Согласно инструкции производителя, принимать этот медикамент необходимо не меньше года. По истечению данного периода рассматривается возможность исключения антитромботика из медикаментозной терапии с учетом лабораторных исследований.
В заключении
По мнению эндоваскулярных хирургов и самих пациентов, стентирование коронарных сосудов – эффективный способ улучшения качества жизни больного. Дать прямого ответа на вопрос, сколько после подобной операции сможет прожить пациент, невозможно. Главное помнить, что успешное выздоровление (пусть и не полное, поскольку после операции необходимо всю жизнь пить некоторые лекарства) во многом зависит от соблюдения рекомендаций лечащего врача, среди которых диета, умеренно активный образ жизни, отказ от курения. Также понадобится принимать антитромботические и другие лекарства (врачом определяется как долго).
[feedback text1=»Остались вопросы про брилинту после стентирования?» text2=»Бесплатная консультация специалистов AngioClinic»]
Автор
Врач генетик. Окончила Челябинскую Государственную медицинскую академию. Прошла интернатуру в Северо-Западном Государственном медицинском университете имени И.И. Мечникова.
Добавить комментарий Отменить ответ
Блог МЦ Аист
Мединиский центр «Аист» представляет вам статьи, в которых вы можете найти необходимую вам информацию о историях болезней или информацию о способах лечения, а так же свежие новости в медицинской среде
Клопидогрел в профилактике тромботических осложнений у больных с коронарным атеросклерозом после чрескожных коронарных вмешательств (обзор)
Опубликовано в журнале:
CONSILIUM MEDICUM | ТОМ 13 | № 5
В.П.Лупанов, А.Н.Самко
Институт клинической кардиологии им. А.Л.Мясникова РКНПК Минздравсоцразвития РФ, Москва
Одним из ведущих направлений в фармакотерапии ишемической болезни сердца (ИБС), профилактике развития новых случаев инфаркта миокарда (ИМ) и улучшении прогноза больных является рациональное назначение оральных дезагрегантов, и прежде всего клопидогрела. Механизм его действия заключается в ингибировании АТФ-зависимой агрегации тромбоцитов путем необратимого связывания с белковым рецептором мембраны P2Y12. Клопидогрел представляет собой пролекарство, поэтому для подавления АДФ-индуцированной агрегации тромбоцитов необходимо его превращение в активный метаболит под действием печеночных цитохромов. Подобное превращение требует времени, а скорость этого процесса и проявление антитромбоцитарного эффекта препарата определяются множеством факторов, среди которых немаловажное значение имеет доза клопидогрела [1]. Положительные эффекты клопидогрела, возможно, выходят за рамки его влияния на агрегационную способность тромбоцитов. Так, у больных с хроническими формами ИБС при лечении клопидогрелом увеличивается биодоступность эндотелиального оксида азота и снижается содержание биомаркеров оксидативного стресса, что приводит к снижению эндотелиальной дисфункции, причем этот эффект имеет дозозависимый характер [2, 3].
Обычно клопидогрел применяют в сочетании с малыми или средними дозами ацетилсалициловой кислоты (АСК), поскольку отмечается синергизм действия этой комбинации в подавлении агрегации тромбоцитов посредством подавления цикла арахидоновой кислоты и АДФ-индуцированной активации тромбоцитов, а также в уменьшении коллаген- и тромбининдуцированной агрегации [4].
В 1997 г. клопидогрел был разрешен к применению по результатам исследования СARPIE (Clopidоgrel versus Aspirin in Patients at Risk of Ischemic Events) [5] с участием 19 185 пациентов с атеросклеротическими проявлениями в различных артериальных бассейнах. Исследование длилось от 1 до 3 лет (в среднем 1,9 года) и показало способность клопидогрела (75 мг/сут) более эффективно, чем АСК (325 мг/сут), снижать суммарный риск ишемического инсульта, ИМ и сердечно-сосудистой смерти (статистически значимое снижение риска составило 8,7%). Лучшие результаты лечения клопидогрелом были получены у пациентов с перемежающейся хромотой, после коронарного шунтирования, с сахарным диабетом (СД), с атеросклеротическим поражением нескольких сосудистых бассейнов и рецидивирующими ишемическими событиями.
В течение последних нескольких лет в научной литературе активно обсуждаeтся проблема позднего тромбоза покрытых лекарствами стентов. Поводом для ее возникновения стали результаты некоторых аутопсийных исследований, в которых наблюдались замедленная реэндотелизация, отложения фибрина и инфильтрация воспалительными клетками в области опорных участков стента, что может свидетельствовать о высоком потенциальном риске тромбоза [6]. На аутопсии выявлено также аневризматическое расширение стентированных сегментов с выраженной локальной реакцией гиперчувствительности, скоплением эозинофилов и Т-лимфоцитов. Поскольку сиролимус присутствует в стенке только в течение 60 дней после имплантации, указанные изменения скорее всего связаны с реакцией на полимер. Тромбоз может развиться как во время процедуры или непосредственно после имплантации стента, так и в последующем отдаленном периоде.
Возврат симптомов заболевания (стенокардии) более чем через 6 мес после успешного чрескожного коронарного вмешательства (ЧКВ) обычно связан с прогрессированием атеросклеротического процесса в другом сосуде и значительно реже является результатом внутристентового рестеноза.
Антитромбоцитарная терапия при ЧКВ
На результат ЧКВ влияет адекватность проводимой медикаментозной терапии, направленной на уменьшение риска тромботической окклюзии артерии в ближайшем и отдаленном послеоперационном периодах.
Существует большое количество современных антитромботических препаратов различных классов, рациональное применение которых позволяет существенно улучшить и ближайший, и отдаленный результаты ЧКВ, значительно уменьшив риски тромботических и геморрагических осложнений [7]. К основным препаратам, применяемым для профилактики тромботических осложнений при выполнении ЧКВ, относятся антитромбоцитарные препараты – АСК, производные тиенопиридинов (тиклопидин, клопидогрел, прасугрел) [8, 9]. АСК блокирует циклооксигеназу-1 тромбоцитов, нарушая синтез в них тромбоксана А2. Таким образом, АСК необратимо подавляет агрегацию тромбоцитов, индуцированную коллагеном, АДФ и тромбином.
Механизм антиагрегантного действия тиенопиридинов (тиклопидин, клопидогрел) связан с подавлением АДФ-индуцированной агрегации тромбоцитов путем необратимого связывания с белковым рецептором мембраны Р2Y12.
Тиклопидин – эффективное антитромботическое средство, но обладающее нежелательными побочными эффектами, среди которых возможность развития гиперхолестеринемии и нейтропении (3,2%, в том числе в 0,8% тяжелая); описаны также случаи тромбоцитопении, анемии и тромботической тромбоцитопенической пурпуры (0,02%), смертность при развитии которой может достигать 20%. Поэтому в связи с высоким риском развития гематологических осложнений назначение тиклопидина требует регулярного контроля за общим анализом крови, особенно в первые 3 месяца лечения с частотой 2 раза в месяц. Но наиболее частым побочным эффектом, приводящим к преждевременной отмене медикаментозного лечения, являются тошнота, диарея (20% случаев) и сыпь (4,8–15%).
После того как клопидогрел (Плавикс ® ) в сравнительных исследованиях [10] показал в 2 раза лучший профиль безопасности по сравнению с тиклопидином, он практически полностью заменил последний в большинстве клинических ситуаций и клинических рекомендаций. Применение клопидогрела – неотъемлемый компонент медикаментозной поддержки в интервенционной кардиологии, официально рекомендованный всеми международными согласительными документами. При использовании нагрузочной дозы препарата в 300 мг ингибирование агрегации тромбоцитов начинается через 2 ч и достигает пика через 48 ч.
Вследствие синергизма действия клопидогрел чаще применяют в сочетании с АСК. Двойная антитромбоцитарная терапия (АСК + клопидогрел) позволила в 1990-х годах во многом справиться с острыми и подострыми осложнениями ангиопластики и коронарного стентирования, снизив частоту развития тромбоза стента до уровня менее 1% [11–13], хотя и не смогла повлиять на рестеноз.
Схемы и оптимальная продолжительность назначения клопидогрела
В настоящее время согласно международным рекомендациям [14] при проведении ЧКВ всем больным заранее следует назначать двухкомпонентную антитромбоцитарную терапию. При этом клопидогрел можно назначать: 1) в нагрузочной дозе 300– 600 мг (совместно с АСК, доза которой будет зависеть от конкретной клинической ситуации) не менее чем за 6 ч до вмешательства; 2) в дозе 75 мг/сут (совместно с АСК в дозе 100 мг/день) за 5–7 дней до планового ЧКВ, что позволит достичь оптимального уровня подавления агрегации тромбоцитов.
Адекватная антиагрегантная терапия перед проведением ЧКВ включает: АСК 75–125 мг (более 5 дней либо 325 мг однократно) и клопидогрел 300–600 мг (за 5 дней по 75 мг, либо за 24 ч однократно). После ЧКВ назначают АСК в дозе 75–125 мг/сут постоянно и клопидогрел 75 мг при имплантации непокрытых металлических стентов (НМС) как минимум в течение 4 нед, в идеале –12 мес; при имплантации стентов, выделяющих лекарства (СВЛ), –на срок не менее 1 года (табл. 1).
| Клопидогрел рекомендован | ACC/AHA/SCAI [11] | |
| Перед процедурой | Нагрузочная доза, как правило, 600 мг должна быть назначена до или во время процедуры пациентам, получившим 12–24 ч назад тромболитическую терапию. Нагрузочная доза 300 мг может быть обоснована | Прием клопидогрела более 1 года может быть обоснован при СВЛ |
| После имплантации НМС | Желательная длительность приема комбинации АСК и клопидогрела составляет 12 мес при отсутствии риска * кровотечений. При риске * кровотечений – минимум 2 нед | |
| После имплантации стентов, покрытых sirolimus | По крайней мере 12 мес; при отсутствии риска* кровотечений | |
| После имплантации стентов, покрытых paclitaxel | По крайней мере 12 мес; при отсутствии риска * кровотечений | |
| Пациентам с абсолютным противопоказанием к АСК | 300 или 600 мг по крайней мере за 6 ч перед ЧКВ и/или применением блокаторов IIb/IIIa гликопротеиновых рецепторов тромбоцитов во время процедуры | |
| Примечание. * Высокий риск. | ||
Тромбоз СВЛ и риск преждевременной отмены клопидогрела
В большинстве ранних исследований с установкой стентов, покрытых сиролимусом, двойная антитромбоцитарная терапия продолжалась в среднем 2–6 мес за исключением одного исследования, в котором все больные получали терапию в течение 12 мес. В этих сериях наблюдений частота острого и подострого тромбоза стента находилась в интервале 0,2–1,1% [15].
Научная группа из Роттердама [16] опубликовала результаты серии наблюдений 2602 пациентов (998 со стентами «Cypher» и 1202 cо стентами «TAXUS»), в которых поздний тромбоз развивался у 15 человек (0,23%).
Таким образом, первичные наблюдения показывают, что частота позднего тромбоза стента является относительно низкой, однако это осложнение характеризуется крайне неблагоприятным исходом (9-месячный уровень смертности встречался в 49% случаев).
Следует подчеркнуть, что острый тромбоз (в течение 1-х суток после вмешательства) и подострый тромбоз стента (любой тромбоз стента, возникающий более чем через 30 сут до 1 года после имплантации стента) относительно просто диагностировать в стационаре, поскольку изменение клинической ситуации потребует проведения дополнительной коронарной ангиографии, способной подтвердить наличие тромба. Постановка диагноза значительно затрудняется при развитии отдаленных клинических осложнений, при которых роль тромбоза стента определить достаточно сложно.
При увеличении времени от проведения ЧКВ диагностика тромбоза затруднена, например если пациент внезапно умирает через 15–16 мес после процедуры. При отсутствии аутопсийного исследования не представляется возможным определить, связано ли это драматическое событие с тромбозом стента или оно обусловлено главным образом прогрессированием ИБС и коронарного атеросклероза. Таким образом, все еще остается некоторая неопределенность в отношении позднего тромбоза стента, несмотря на то, что его частота не особенно высока (0,23–0,35%), однако тромбоз стента – одна из основных причин ИМ, экстренной операции коронарного шунтирования, повторного ЧКВ и летального исхода.
Проблеме позднего тромбоза стента было посвящено исследование BASKET LATE [17]. Цель его заключалась в сравнительной оценке частоты поздних тромбозов у больных с имплантацией СВЛ или НМС после прекращения терапии клопидогрелом. В исследовании участвовали 743 пациента (у 433 был установлен СВЛ, у 244 – НМС). Через год от вмешательства потребность в реваскуляризации пораженного сосуда была достоверно ниже в группе с имплантацией СВЛ (4,5% против 6,7%). Тем не менее частота дополнительных событий, связанных с тромбозом стента, имела тенденцию к повышению у больных с имплантацией СВЛ, чем у больных с имплантацией НМС (2,6% против 1,3%). Эта зависимость не была статистически достоверной, возможно, в связи с малым числом наблюдений и недостаточной «мощностью» исследования. Другими словами, на каждые 100 больных с имплантацией СВЛ приходится 3 случая смерти или ИМ; в то же время данное вмешательство позволяет предотвратить 5 случаев повторной реваскуляризации пораженного сосуда. Данный компромисс имеет большое клиническое значение, если у большинства больных проводится имплантация СВЛ.
Проведено несколько исследований, показавших возникновение поздних тромбозов стентов у пациентов после имплантации СВЛ после преждевременного прекращения приема клопидогрела [18, 19]. J.Spertus и соавт. [20] опубликовали анализ из регистра PREMIER 500 больных с острым ИМ, леченных с применением СВЛ. Смертность пациентов, которые в течение последующих 11 мес прекратили терапию тиенопиридинами, составляла 7,5% в сравнении с 0,7% у тех, кто не прекращал терапию (отношение рисков – ОР 9,0, р
Оптимальная нагрузочная доза клопидогрела
Впервые целесообразность нагрузочной дозы клопидогрела (Плавикса) 300 мг была доказана в 2002 г. в исследовании CREDO [25]. В этом же исследовании также было установлено оптимальные время введения (за 6 ч до планового ЧКВ) и продолжительность комбинированной терапии Плавиксом и АСК после ЧКВ (12 мес). В дальнейшем целесообразность нагрузочной дозы 300 мг была подтверждена на популяции пациентов с острым коронарным синдромом (ОКС), а также в подгруппе пациентов, получивших инвазивное лечение (PCI-CURE при ОКС без подъема ST и PCI-CLARITY– при остром ИМ) [26, 27]. В двух группах больных ИБС в течение 30 дней после ЧКВ назначали клопидогрел в дозе 75 и 150 мг в день. Большая доза препарата ассоциировалась со снижением реактивности тромбоцитов и большим увеличением ингибирования тромбоцитов по сравнению с общепринятой дозой 75 мг в день [28]. Увеличение нагрузочной дозы клопидогрела до 600– 900 мг и более существенно снижает агрегацию тромбоцитов по сравнению со стандартной дозой, что сокращает интервал времени между приемом препарата и возможностью безопасного выполнения ЧКВ до 2 ч. Однако эффект дозировки 900 мг не всегда существенно отличался по отдаленным результатам внутрикоронарной ангиопластики.
Исследование RELOAD [29] показало, что такой эффект высоких нагрузочных доз отмечается и у больных стабильной стенокардией, которые ранее длительно принимали клопидогрел. В исследованиях G.Patti и соавт. [30], M.Lotrionte и соавт. [31] было продемонстрировано достоверное уменьшение частоты сердечно-сосудистой смертности и несмертельного ИМ после применения высоких доз клопидогрела в ближайшем и отдаленном (до 6 мес) периодах.
В августе 2009 г. были представлены предварительные результаты клинического исследования CURRENTOASIS 7 на конгрессе Европейского общества кардиологов в Барселоне. В этом крупнейшем клиническом исследовании [32] с участием 25 087 пациентов по оценке различных режимов дозирования препарата Плавикс ® (клопидогрел) + АСК у различных групп пациентов с ОКС: нестабильной стенокардией, ИМ без подъема сегмента ST, ИМ с подъемом сегмента ST. Исследование проводилось с целью оценки оптимальной эффективности и безопасности применения двойной нагрузочной дозы клопидогрела (1-й день – нагрузочная доза 600 мг, на 2–7-й дни – поддерживающая доза 150 мг/сут, 8–30-й дни – 75 мг/сут) по сравнению со стандартной дозировкой клопидогрела (Плавикс ® ) (в 1-й день – нагрузочная доза 300 мг, 2–30-й дни – 75 мг/сут) у пациентов, для которых планировалась ранняя инвазивная стратегия лечения при помощи ЧКВ. Группы были рандомизированы и по дополнительному приему АСК – в низкой (75–100 мг) и в высокой (300–325 мг) дозах. Комбинированная первичная конечная точка (смерть от сердечно-сосудистого заболевания, ИМ или инсульт через 30 дней) для всей исследуемой популяции при оценке различий между высокодозированным и стандартным режимами приема Плавикса не достигла статистически достоверных отличий (4,2% против 4,4%; ОР 0,95, р=0,37). Для клинически значимых подгрупп, в отношении которых был проведен заранее запланированный предварительный анализ, таких как ЧКВ (70% исследуемой популяции, 17 232 пациента), наблюдались значимые различия в отношении конечных исходов. В данной подгруппе анализ показал улучшение исходов у пациентов, получавших препарат в более высокой дозировке (1-й день – нагрузочная доза 600 мг, 2–7-й дни – 150 мг, 8–30-й дни – 75 мг) по сравнению со стандартной дозировкой (300 мг – нагрузочная доза в 1-й день, 75 мг – 2–30-й дни), что подтверждается снижением комбинированной конечной точки – количества случаев летального исхода в связи с сердечно-сосудистыми заболеваниями, ИМ и инсультом – на 15,4% (4,5% по сравнению с 3,9%, р=0,037). Кроме того, анализ показал значительное (на 42%) снижение ОР доказанного тромбоза стента (1,2% против 0,7%, р=0,001) при применении клопидогрела в высокой дозировке по сравнению со стандартным режимом дозирования.
Параметры достижения основной конечной точки безопасности оценивали по строгим критериям кровотечений, разработанным группой OASIS, при этом наблюдалось достоверное увеличение частоты кровотечений при применении высоких доз Плавикса по сравнению со стандартным режимом терапии во всей исследуемой популяции (2,5% по сравнению с 2,0%; ОР 1,25, р=0,01) и в популяции ЧКВ (1,6% против 1,1%; ОР 1,44, р=0,006). При этом не наблюдалось статистически значимых отличий по частоте внутричерепных кровотечений как в общей популяции, так и в популяции ЧКВ.
Данные исследования СURRENT-OASIS 7 могут стать основанием для широкого использования на практике удвоенных нагрузочной и поддерживающей доз клопидогрела. Речь идет о краткосрочном применении поддерживающей дозы (1 нед), которое не может существенно сказаться на общей стоимости лечения. Кроме обоснования целесообразности практического применения удвоенных доз клопидогрела в связи с ЧКВ, данные CURRENT-OASIS 7 важны с точки зрения значимости результатов сравнительных испытаний этого препарата с новыми антитромбоцитарными агентами при ОКС – прасугрелом (prasugrel) (исследование TRITONTIMI 38 [33]), кангрелором (сangrelor) [34], тикагрелором (ticagrelor). Так, в двойном слепом рандомизированном исследовании PLATO [35] пероральный антагонист P2Y12-рецепторов тикагрелор тоже уменьшал частоту развития тромбоза стентов при ОКС по сравнению с клопидогрелом, но при этом увеличивал частоту кровотечений. Проявятся ли преимущества новых лекарственных средств при сравнении с удвоенной дозой клопидогрела у пациентов, подвергнутых ЧКВ, покажут дальнейшие их сравнительные многоцентровые исследования.
Долгосрочный прогноз больных ИБС в течение 2 лет после ЧКВ
При использовании НМС риск тромбоза стента практически ограничивался госпитальным периодом (7– 10 дней) и был минимальным спустя 1 мес после имплантации. Широкое внедрение в клиническую практику СВЛ отмечено тенденцией к сохранению тромбогенности этих эндопротезов в более поздние сроки. В нескольких исследованиях было показано, что риск позднего тромбоза СВЛ сохраняется на стабильном уровне в течение 2-го года после вмешательства [36–38], что требует дополнительных исследований и поиска решений данной проблемы.
E.Eisenstein и соавт. [39] провели обсервационное исследование 4666 больных ИБС с длительностью наблюдения 6, 12, и 24 мес после стентирования. У больных, леченных с применением НМС (3165 пациентов), продолженное использование клопидогрела не повлияло на частоту случаев смерти и ИМ между 6 и 12-м месяцами. В противоположность этому у больных с СВЛ (1501 пациент) продолженное использование клопидогрела через 6, 12, и 24 мес ассоциировалось с уменьшением частоты случаев смерти или комбинированной суммарной точки (смерть + ИМ) во всех временных интервалах (табл. 2).
| n=4666 | CЛП + К | СЛП – К | НМС + К | НМС – К |
| При отсутствии серьезных событий спустя 6 мес после ЧКВ | ||||
| Смерть | 2% | 5,3% | 3,7% | 4,5% |
| Смерть + ИМ | 3,1% | 7,2% | 5,5% | 6,0% |
| p | — | — | >0,1 | |
| При отсутствии серьезных событий спустя 12 мес после ЧКВ | ||||
| Смерть | 0% | 3,5% | 3,3% | 2,7% |
| Смерть + ИМ | 0% | 4,5% | 4,7% | 3,6% |
| p | — | — | >0,1 | |
| Примечание. СЛП – стент с лекарственным покрытием, НМС – непокрытый металлический стент, + К – прием клопидогрела, – К– без клопидогрела. | ||||
В случае прекращения приема клопидогрела при имплантации СЛП частота неблагоприятных исходов сопоставима с таковой, если установлены НМС. Таким образом, исследователи сделали вывод, что длительный прием клопидогрела у пациентов с СЛП приводил к снижению риска смерти и ИМ за счет снижения частоты позднего тромбоза стента. В некоторых исследованиях был продемонстрирован важный вклад в развитие тромбоза стента резистентности к клопидогрелу, для преодоления которой необходим дальнейший поиск в этом направлении. Проблема вариабельности антиагрегантного действия клопидогрела и даже резистентности к его действию у некоторых пациентов пока не решена. Предполагают, что это связано с ограничениями во всасывании клопидогрела в желудочно-кишечном тракте или его трансформации в печени в активный метаболит. Продолжаются исследования и по оценке функциональной активности тромбоцитов при лечении клопидогрелом [40].
В недавно проведенное исследование S.Park и соавт. [41] включали пациентов, которые уже ранее в течение 12-месячного периода после имплантации СЛП принимали двойную антитромбоцитарную терапию АСК и клопидогрелом по стандартной схеме. Оценивался прогноз в двух рандомизированных группах: первая – Сorrelation of Clopidogrel Therapy Discontinuation in Real-World Patients Treated with Drug-Eluting Stent implantation and Late Coronary Arterial Thrombotic Events (REAL-LATE) в течение 2-го года наблюдения продолжала принимать двойную антитромбоцитарную терапию (клопидогрел 75 мг и АСК 100–200 мг в день), 2-я группа – за тот же период наблюдения принимала только АСК (Evaluation of the Long-Term Study after Zotarolimus-Eluting Stent, Sirolimus-Eluting Stent, оr Paclitaxel-Eluting Stent Implantation for Coronary Lesions-Late Coronary Arterial Thrombotic Events – ZEST-LATE).
Авторами сделано заключение, что двойная антитромбоцитарная терапия в сроки более чем 12 мес от проведения ЧКВ не более эффективна, чем монотерапия одной АСК в снижении риска ИМ или смерти от сердечных причин у больных, перенесших ЧКВ с имплантацией покрытых стентов. Такая терапия не сопровождается увеличением ишемических осложнений и увеличением частоты больших кровотечений, однако требуются дополнительные исследования для подтверждения безопасности непрерывного приема клопидогрела после 12 мес терапии.
Современным методом оценки рестеноза после ЧКВ является внутрисосудистое ультразвуковое исследование (ВСУЗИ) или коронарная ангиоскопия [42]. Измерение размеров артерии посредством ВСУЗИ (минимальные и максимальные диаметры, площадь поперечного сечения), площадь и структура атеросклеротических бляшек (в том числе атером, не видимых на коронарографии), оценка вероятности атеротромбоза, осложнений ЧКВ (диссекций) – дополняют и уточняют данные ангиографического исследования. Выполненные ВСУЗИ через 6 и 9 мес после имплантации СВЛ выявили низкую степень (менее 50%) эпителизации эндопротезов вследствие высокой антипролиферативной активности лекарственного вещества. Металлическая поверхность стента остается морфологическим субстратом тромбоза и способствует повышенному риску его возникновения. Некоторые исследования выявили также глубокое деструктивное воздействие рапамицин-покрытых стентов на сосудистую стенку с образованием локальных сосудистых аневризм в отдаленном периоде, что также является существенным фактором риска развития острых сосудистых осложнений. При имплантации СЛП описан феномен позднего неполного прилегания стента к стенке сосуда. ВСУЗИ помогает диагностировать этот феномен и определить степень эндотелизации после имплантации стентов [43, 44]. Еще одним фактором, способствующим развитию тромбоза стента, является само действующее вещество. Имеются указания на усиленную экспрессию тканевого фактора, а также рецептора фактора VII под воздействием паклитаксела и сиролимуса.
В табл. 3 представлены предикторы тромбоза СВЛ, принимая во внимание применение пациентами длительной двойной антитромбоцитарной терапии.
| Клинические | Ангиографические |
| Пожилой возраст | Длинные стенты |
| ОКС | Множественные поражения |
| СД | Частично покрывающие поражения стенты |
| Низкая фракция выброса левого желудочка | Устьевое или бифуркационное поражение |
| Предварительная брахитерапия | Мелкие сосуды |
| Почечная недостаточность | Субоптимальные результаты стентирования, недораскрытие стента |
Представляется логичным увеличить длительность комбинированной антитромбоцитарной терапии у больных с имплантацией СВЛ в связи с дистальным стенозом левой основной коронарной артерии. Это обосновано двумя причинами: поражение в области бифуркации является одним из факторов, определяющих риск тромбоза стента, и тромбоз в этой области практически всегда приводит к немедленной смерти. Больные СД также могут рассматриваться в качестве кандидатов на более продолжительное профилактическое антитромбоцитарное лечение. СД является высокотромбогенным состоянием, и хотя пока еще нет более точной информации, представляется логичным продлить комбинированную антитромбоцитарную терапию на несколько больший период (более 1 года) у этой категории больных. Результаты немногочисленных наблюдательных исследований показали, что при отсутствии тяжелых кровотечений и других противопоказаний двойная антитромбоцитарная терапия может быть продолжена более 1 года, однако максимальная ее длительность пока не определена [46].
Удлинение сроков лечения клопидогрелем более 12 мес, кажущееся логичным с точки зрения клинициста, требует дополнительного подтверждения в рандомизированных клинических исследованиях, которые должны продемонстрировать не только пользу такой терапии, но и риски кровотечения, а также оценить ее экономическую эффективность. Основными причинами прекращения двойной антитромботической терапии после ЧКВ с имплантацией СЛП являлись: кровотечение, прием сопутствующей антикоагулянтной терапии, хирургические вмешательства, гастрит и гастроэзофагеальный рефлюкс, аллергия [47].
Долгосрочная тройная антитромботическая терапия после ЧКВ
У пациентов, перенесших ЧКВ, применение антагонистов витамина К не рекомендуется, если к ним нет специальных показаний [48]. Однако иногда пациенты с установленным стентом имеют абсолютные показания к приему витамина К. В таком случае, несмотря на потенциально более высокий риск кровотечений, необходимо использовать тройную антитромботическую терапию: варфарин (целевое МНО 2,0–2,5) + АСК 75 мг/день + клопидогрел 75 мг/день.
В проспективном многоцентровом исследовании SNENTICO [48] у 349 пациентов было показано, что использование тройной антитромбоцитарной терапии (от 2 до 12 мес) увеличивает риск осложнений, в первую очередь тяжелых и средних кровотечений. Больные были разделены на 2 группы: 1-я – группа из 234 пациентов, которые прекратили прием антикоагулянтов (22±31 день), 2-я (125 пациентов), у которой терапия не прекращалась. Основные характеристики групп были сопоставимы. Частота инсультов в 2 группах достоверно не отличалась. Тяжелые и средней тяжести кровотечения встречались в 2,1 и 6,4% (р=0,04) [49]. При необходимости приема тройной антитромботической терапии и высоком риске кровотечений эксперты рекомендуют в случае установки НМС снизить длительность применения клопидогрела до 2–4 нед. При установке СВЛ и доказанной необходимости приема клопидогрела не менее 12 мес – исключить из тройной схемы АСК [48].
Из-за важности двойной антитромботической терапии АСК и клопидогрелом после имплантации стента, особенно если рассматривается СВЛ, лечащим врачам следует убедиться в том, что пациент может следовать предписаниям двойной антитромботической терапии продолжительностью 1 год. Пациентов также следует проинструктировать о необходимости проконсультироваться со своим лечащим врачом перед прекращением любой антитромботической терапии, поскольку резкое прекращение ее может сопровождаться риском тромбоза стента – сoбытия, которое может привести к ИМ или даже смерти. Врачам других специальностей следует отложить плановые хирургические процедуры до истечения 12 мес после имплантации СВЛ. Если хирургическое вмешательство должно быть выполнено быстрее, чем до истечения 12 мес, пациенту следует оставить поддерживающую терапию АСК и минимизировать перерыв в приеме тиенопиридинов [50].
Специалистами по чрескатетерной кардиоваскулярной терапии предложены рекомендации, когда не следует имплантировать СВЛ во избежание возможных осложнений [51, 52]:
В исследовании, проведенном в ФГУ РКНПК Минздравсоцразвития РФ [53], изучали судьбу больных ИБС, которым с марта 2002 г. по сентябрь 2004 г. проводили ЧКВ с имплантацией НМС – 275 больных или СВЛ – 338 больных. К каждому больному осуществлялся индивидуальный подход: решение о необходимости вмешательства и его виде принимал лечащий врач на основании рекомендаций специалистов по инвазивной кардиологии и сердечно-сосудистой хирургии. В течение 3,5 года наблюдения частота развития основных неблагоприятных событий (общая смертность, сердечно-сосудистая смертность, нефатальный ИМ, нефатальный инсульт или транзиторная ишемическая атака) в 2 группах достоверно не различалась (10,7 и 12,4% соответственно). Частота развития поздних тромбозов стента в течение 3,5 года наблюдения составила: после имплантации СВЛ – доказанных 0,89% и НМС – 0,36%, вероятных – 3,3 и 2,9% соответственно (р>0,05). Потребность в проведении повторной реваскуляризации миокарда (ЧКВ/КШ) при использовании СВЛ составила 10,9% и НМС – 21,5% с достоверным снижением относительного риска развития на 49% вследствие снижения частоты развития внутристентового рестеноза. По данным многофакторного анализа прямое стентирование и прекращение приема тиенопиридинов в течение 2 мес после процедуры являлись основными факторами риска развития позднего тромбоза при использовании СВЛ.
Однако ЧКВ не устраняет причину ИБС – атеросклероз, а лишь нивелирует патофизиологическое влияние гемодинамически значимой атеросклеротической бляшки. Атеросклеротический процесс может прогрессировать как в стентированном или баллонированном, так и в других сегментах коронарного русла. Кроме того, имплантация стента может вызвать его тромбоз в отдаленном периоде. Поэтому лечение больного ИБС, помимо антитромботических препаратов, следует проводить с соблюдением всех мер вторичной профилактики ИБС с целью снижения развития ИМ, инсульта, сердечно-сосудистой и общей смертности у больных после ЧКВ [54, 55]. Поэтому после проведения стентирования к моменту окончания наблюдения (3,5 года) пациенты продолжали принимать АСК (90%), β-блокаторы (80%), статины (69%), ИАПФ или антагонисты рецепторов ангиотензина (65%). Средний срок приема тиенопиридинов составил в группе СВЛ 8,7 мес, в группе НМС – 7,1 мес, что не соответствует современным рекомендациям, согласно которым антитромбоцитарную терапию рекомендовано продлить как минимум до 12 мес. Приверженность больных приему лекарственных препаратов оказывала влияние на отдаленный прогноз после проведения вмешательства.
Клопидогрел и дженерики
Таким образом, ЧКВ на коронарных артериях является эффективным методом лечения ИБС и ее обострений. Остается проблема рестеноза после вмешательства, хотя его частоту удалось снизить путем использования СВЛ. Благодаря появлению коронарных СВЛ эндоваскулярные методы заняли лидирующие позиции в лечении ИБС. Достигнуто радикальное снижение частоты развития рестеноза стента благодаря антипролиферативным свойствам препаратов, нанесенных на металлическую основу эндопротеза (пакситаксела, сиролимуса, его производного эверолимуса и др.). Наибольшее преимущество от использования СВЛ получают пациенты, страдающие СД, имеющие протяженные поражения коронарных артерий и поражения в артериях малого диаметра, а также с рестенозом после баллонной ангиопластики или стентирования, поскольку для этих пациентов характерна значительно более высокая частота осложнений и повторных реваскуляризаций.
Основной причиной, которая может ухудшать прогноз пациентов с ИБС после имплантации СВЛ, является поздний тромбоз. Наиболее вероятными механизмами, приводящими к увеличению его частоты, принято считать замедление процесса эндотелизации, реакцию гиперчувствительности, развитие неполного прилегания стента к стенке сосуда [57, 58]. Двойную антитромботическую терапию следует применять у всех больных, перенесших ЧКВ (баллонную ангиопластику и/или стентирование) [59, 60]. Рекомендуется неограниченно долго (пожизненно) принимать АСК в суточной дозе 75–100 мг. Больные с имплантацией СВЛ должны получать в течение 1 года комбинацию антитромбоцитарных препаратов – АСК 100 мг/сут и клопидогрела 75 мг/сут. Пациентам, перенесшим стентирование, рекомендуется принимать клопидогрел, а не тиклопидин. Через 1 год после имплантации СВЛ все больные должны продолжать принимать АСК (или клопидогрел 75 мг/сут, если АСК плохо переносится) на протяжении всей последующей жизни.
Если перед вмешательством врач предполагает прогрессирование заболевания, развитие возможных осложнений или недостаточную приверженность последующему антитромботическому лечению, следует рассмотреть возможность имплантации НМС (двойная антитромбоцитарная терапия проводится только в течение 1–3 мес), а не СВЛ.
Основная причина подострого или позднего тромбоза стента заключается в прекращении антитромбоцитарной терапии (даже через 1 год после вмешательства, когда больной принимает только АСК) [61–63]. У пациентов с непереносимостью АСК, перенесших ЧКВ, единственной альтернативой является клопидогрел. Пациентам, перенесшим ЧКВ, при отсутствии иных абсолютных показаний применение непрямых антикоагулянтов (антагонистов витамина К) не рекомендуется. Необходимо, чтобы врачи общей практики, хирурги и анастезиологи не отменяли антитромбоцитарную терапию (в том числе прием АСК) при отсутствии на это противопоказаний. Вопросы прекращения приема антитромбоцитарных препаратов у больных с имплантированными стентами требуют тщательного обсуждения с участием кардиологов, анастезиологов, хирургов и врачей общей практики.
Заключение
Двойная антитромбоцитарная терапия (клопидогрел в комбинации с АСК) стала основой стратегии предупреждения тромбоза стентов после ЧКВ. Оптимальная продолжительность двойной антитромбоцитарной терапии составляет 12 мес независимо от типа стента (обновленные рекомендации по реваскуляризации миокарда Европейского кардиологического общества/Европейской ассоциации сердечно-сосудистой хирургии, 2010) [64]. При острых состояниях (ОКС) в догоспитальной фазе и перед проведением ЧКВ доказана эффективность назначения клопидогрела (Плавикса) в дозах 300–600 мг [65–68].
Преждевременное прекращение двойной антитромбоцитарной терапии заметно увеличивает риск тромбоза стента – катастрофического события, которое часто приводит к ИМ и/или смерти. Если не ожидается, что больной по экономическим или другим причинам будет соблюдать 12-месячную двойную антитромбоцитарную терапию, это должно рассматриваться как серьезный аргумент в пользу отказа от применения СВЛ. Необходимо после ЧКВ перед выпиской больных предупредить их о риске преждевременного прекращения приема АСК и клопидогрела. Если необходимы плановые операции (процедуры), при которых существует значительный риск пери- или послеоперационного кровотечения, то они должны быть отложены до того момента, когда больной закончит 12-месячный курс приема клопидогрела. Все крупные клинические исследования проведены с использованием оригинального клопидогрела (Плавикса).
В ноябре 2010 г. компания Санофи-Авентис зарегистрировала в России новую дозировку Плавикса – 300 мг в 1 таблетке, использование которой, бесспорно, более удобно, эффективно и имеет большое преимущество перед дженериками. В то время как известная проблема избытка примесей и точного содержания лекарственного вещества в таблетке препарата в случае использования нагрузочных доз из 8 и более таблеток без должной проверки эффективности и безопасности именно нагрузочных доз дженериков может иметь драматические последствия для больного, поскольку у них отсутствуют данные по биоэквивалентности нагрузочных доз. Для фармацевтичеcкого рынка РФ, где около 80% всех лекарств – воспроизведенные лекарственные средства, проблема качества весьма существенна [69]. При этом крайне важно, чтобы дженерическое лекарственное средство было воспроизведено по стандартам GMP (Good Manufacturing Practice). Немаловажным является факт, зарегистрирован ли данный препарат в США и странах Евросоюза, где контролирующие организации и регуляторы рынка следят за этим.
.gif)