высокий креатинин и низкий гемоглобин что делать
Жизнь при хронической почечной недостаточности
Как живут люди с хронической почечной недостаточностью? Если болезнь не на терминальной стадии, то пациенты проходят консервативное лечение. Стадию определяют по скорости клубочковой фильтрации (СКФ). При терминальной 5-й стадии она ниже 15 мл/мин/1,73м² — здесь уже требуется диализ или трансплантация почки. Хронической считают почечную недостаточность с 3-ей по 5-ю стадии — СКФ ниже 60 мл/мин/1,73м². На любой из них пациент должен вести особый образ жизни: соблюдать диету и ряд рекомендаций, назначаемых врачом.
В чем особенности жизни при ХПН и что делать
При хронической недостаточности почки перестают нормально выполнять свою функцию — выведение продуктов обмена с мочой. В результате они копятся в организме человека. В первую очередь это мочевина и креатинин. Именно по уровню последнего оценивают функцию почек. Высокий креатинин — это нарушение функции почек. Поэтому при ХПН важно регулярно сдавать анализы для проверки уровня этого продукта распада. Чтобы он не повышался, необходимо следовать ряду правил.
Избегать тяжелой физической нагрузки
Она повышает уровень креатинина. Это обусловлено тем, что данное вещество — конечный продукт креатин-фосфатной реакции в мышцах при их энергетическом обмене, работе и возникновении травм. Отсюда высокая физическая нагрузка — это высокий уровень креатинина, с которым и без того не работающие почки не могут справиться.
Ограничить белковые продукты
При хронической почечной недостаточности в диете ограничивают белок: при СФК ниже 50 мл/мин — до 30-40 г/сут., ниже 20 мл/мин — до 20-24 г/сут. Это необходимо, чтобы уменьшить нагрузку на почки. В то же время с началом диализа количество белка увеличивают до 1,1-1,5 г/кг/сут. Все потому, что в процессе диализа вымывается много важных компонентов, и белок на состояние почек влияет уже не так сильно.
Употреблять достаточно углеводов и жиров
Вместо белка в рационе должно быть достаточное количество углеводов и жиров. Основу рациона составляют сложные углеводы, которые не повышают глюкозу и медленно всасываются, и ненасыщенные жиры, полезные для сердца и сосудов.
Соблюдать калорийность рациона
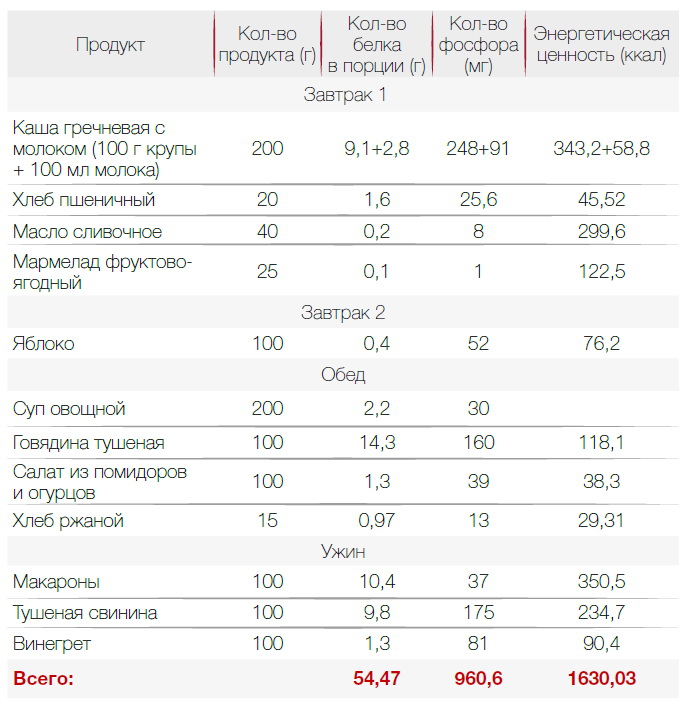
В диете при хронической почечной недостаточности важна калорийность. Она должна быть высокой — около 3000 ккал для восполнения всех витаминов и минералов. Диета назначается индивидуально, поэтому 3000 ккал — ориентировочное число. Пример меню с учетом требований приведен ниже.
Контролировать поступление микроэлементов и воды
Поскольку почки плохо работают, они не выводят калий, а от его избытка нарушается работа сердца. Поэтому количество калия, поступающего с пищей, нужно контролировать. Он содержится в картофеле и других овощах. Чтобы снизить количество калия, эти овощи перед приготовлением нужно порезать и замочить на 6-10 часов, причем как можно чаще воду менять.
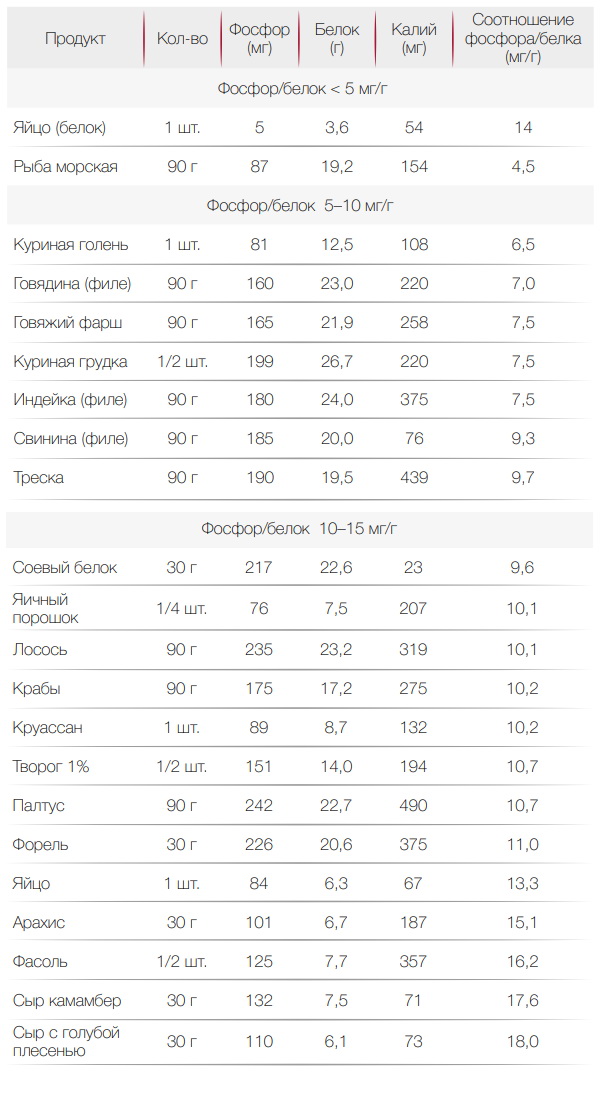
Еще необходимо ограничить поступление фосфора. При ХПН он может привести к поражению костей и сердца. Фосфор содержится в белковой пище. В растительной тоже есть, но из нее фосфор усваивается хуже. Также его количество снижается при термической обработке пищи. Выбирая продукты, стоит обращать внимание на те, что имеют низкий фосфорно-белковый индекс — ниже 20 мг/г. Примеры продуктов питания при почечной недостаточности с таким индексом приведены в таблице.
Другое важное правило питания при ХПН — следить за питьевым режимом. При выраженных отеках приходится уменьшить количество выпиваемой воды. В таком случае нужно ежедневно в одно время, после опорожнения мочевого пузыря и кишечника взвешиваться. Если вес резко увеличился — значит произошла задержка жидкости. При ограничениях количества воды можно рассасывать кусочек льда, а с сухостью во рту поможет справиться полоскание, жевательная резинка, леденцы или долька лимона.
Контролировать артериальное давление
Кровяное давление нужно контролировать, оно должны быть на уровне не выше 130/80, максимальные показатели — 140/90. Для этого на диете при ХПН количество соли в день ограничивается 2-3 г в сутки. При развитии выраженной гипертензии необходимо перейти на бессолевую диету.
Чтобы уменьшить количество соли в сутки, можно следовать таким советам:
Полезные советы для пациентов с ХПН
Образ жизни пациента с хронической почечной недостаточностью действительно полон ограничений, но это помогает долгое время поддерживать организм в нормальном состоянии. Специалисты рекомендуют вести дневник питания, внося в него все употребляемые продукты. Этот дневник в дальнейшем может быть полезен и для врача, который сможет скорректировать рацион, если состояние вдруг ухудшилось.
На кухне под рукой всегда стоит держать таблицы с содержанием в продуктах всех микро- и макроэлементов и их энергетической ценности. Для более точных расчетов рациона нужно иметь кухонные весы. Все это поможет предотвратить повышение креатинина и ухудшение работы почек.
Всегда нужно учитывать, что приведенные советы носят общий характер. Для получения точных рекомендаций необходимо обратиться к врачу. В Государственном центре урологии вы можете получить помощь по полису ОМС. Диагностика и лечение будут для вас бесплатными. Просто запишитесь на прием в онлайн-форме или по контактному номеру клиники.
Анемия при диабетической нефропатии
Сахарный диабет (СД) — распространенное заболевание, которым страдает около 5% населения Европы. Распространенность этого заболевания растет с каждым годом. Ожидается, что в ближайшие несколько лет число таких пациентов в Европе превысит 32 млн человек.
Сахарный диабет (СД) — распространенное заболевание, которым страдает около 5% населения Европы. Распространенность этого заболевания растет с каждым годом. Ожидается, что в ближайшие несколько лет число таких пациентов в Европе превысит 32 млн человек [1]. Характерным осложнением СД как 1, так и 2 типа является нефропатия. В индустриально развитых странах диабетическая нефропатия сегодня стала ведущей причиной терминальной стадии хронической болезни почек (ХБП) [2, 3]. По мере роста числа больных СД можно ожидать и пропорционального возрастания роли диабетической нефропатии в структуре больных терминальной почечной недостаточностью.
Примерно половина больных с ХБП страдает анемией [4, 5]. Соответственно, СД является одной из главных причин почечной анемии. При диабетической нефропатии анемия развивается раньше и чаще и протекает тяжелее, чем у больных с заболеваниями почек другой природы. Например, по данным эпидемиологического исследования NHANES III (National Health and Nutrition Examination Survey), проводившегося в США, частота анемии у больных ХБП III–IV стадий и СД была в 2 раза выше, чем у больных с сопоставимым нарушением функции почек, не страдающих СД [6].
Анемия оказывает нежелательное влияние на качество жизни больных, вызывает снижение работоспособности и толерантности к физической нагрузке, ухудшение сексуальной и когнитивной функций и сопровождается различными симптомами (одышка, головокружение, плохой аппетит и т. д.). Более того, анемия у больных СД позволяет предсказать повышенный риск неблагоприятных исходов (независимо от тяжести нефропатии) и, по-видимому, сама по себе способствует прогрессированию микро- и макроангиопатии. Тем не менее, врачи обычно не придают особого значения анемии у таких пациентов [7].
Ведущую роль в патогенезе почечной анемии играет дефицит эритропоэтина, вырабатывающегося почками. В этой связи высказано предположение о том, что его более раннее применение у больных диабетической нефропатией может привести к улучшению прогноза при этом состоянии.
Частота анемии у больных сахарным диабетом
В соответствии с рекомендациями ВОЗ, критерием диагноза анемии является снижение уровня гемоглобина 2 [12]. По мере ухудшения функции почек частота анемии экспоненциально увеличивается как у мужчин, так и у женщин. Уровень гемоглобина наиболее тесно ассоциируется со скоростью клубочковой фильтрации, в том числе у пациентов с нормальным сывороточным содержанием креатинина.
При диабетической нефропатии анемия развивается раньше, чем у пациентов с другими заболеваниями почек. D. Bosman и соавт. [13] сравнили распространенность анемии у больных СД 1 типа, осложнившимся нефропатией, и больных хроническим гломерулонефритом. Анемия была выявлена почти у половины больных с диабетической нефропатией и отсутствовала у всех больных группы сравнения. Более того, повышенную частоту анемии регистрируют у больных СД, не страдающих нарушением функции почек (скорость клубочковой фильтрации > 90 мл/мин/1,73 м 2 ), хотя это не всегда указывает на реальное отсутствие нефропатии. Анемия ассоциируется с микроальбуминурией, которая является ранним маркером воспаления и повреждения микрососудов и предшествует ухудшению почечной функции.
СД способствует развитию более тяжелой анемии. E. Ishimura и соавт. [14] сопоставили уровни гемоглобина у больных СД 2 типа и пациентов с недиабетическими заболеваниями почек. Концентрация гемоглобина у пациентов с диабетом была значительно ниже, чем у больных контрольной группы (p
Ю. С. Милованов, доктор медицинских наук
С. Ю. Милованова, кандидат медицинских наук
ММА им. И. М. Сеченова, Москва
Железодефицитные состояния при гинекологических заболеваниях и способы их коррекции
Рассмотрены роль железа в организме человека, механизмы его усвоения из пищи, клинические признаки железодефицитных состояний и железодефицитной анемии (ЖДА) у женщин, а также подходы к терапии и профилактике ЖДА с применением современных пероральных ферр
Железодефицитная анемия (ЖДА) — гематологический синдром, характеризующийся нарушением синтеза гемоглобина вследствие дефицита железа. В основе анемии лежит тканевая гипоксия, развивающаяся в результате снижения количества гемоглобина вследствие кровопотери, нарушения образования эритроцитов, их деструкции или сочетания этих причин [1, 2].
Дефицит железа встречается почти у 1/3 жителей Земли, а железодефицитная анемия составляет 80–90% среди всех анемий. Распространенность анемий различается от пола, возраста, климато-географических и эколого-производственных причин [1, 3, 4].
Соответствующий дефицит развивается, когда потери железа превышают его поступление 2 мг/сут, и наблюдается при различных физиологических состояниях и заболеваниях [5, 6].
Железодефицитная (гипохромная, микроцитарная) анемия обычно возникает вследствие снижения ресурсов железа в организме при хронической кровопотере или недостаточном внешнем поступлении железа.
Наиболее уязвимы по развитию железодефицитных состояний женщины репродуктивного возраста вследствие ежемесячной физиологической кровопотери во время менструации, беременные по причине высокой потребности в микроэлементах, дети и подростки — из-за высоких потребностей растущего организма, пожилые люди, страдающие хроническими заболеваниями и имеющие плохое питание.
Железо является незаменимым микроэлементом, играющим важную роль в функционировании клеток многих систем организма, основная из которых — участие железа в процессах тканевого дыхания. Общее количество железа в организме женщины достигает 2–3 г, а его концентрация — 40–50 мг на кг массы тела.
Различают два вида железа: гемовое и негемовое. Гемовое железо входит в состав гемоглобина, содержится лишь в мясных продуктах, легко всасывается, и на его всасывание практически не влияет состав пищи.
Негемовое железо находится в свободной ионной форме — двухвалентного или трехвалентного железа. Абсорбция негемового железа (содержится преимущественно в овощах), на которое приходится до 90% железа всего рациона, находится в зависимости от целого ряда факторов. Основная часть железа входит в состав гемоглобина и миоглобина — 70%; депо железа — 18% (внутриклеточное накопление в форме ферритина и гемосидерина); функционирующее железо — 12% (миоглобин и содержащие железо энзимы); транспортируемое железо — 0,1% (железо, связанное с трансферрином) [7–9].
К наиболее важным железосодержащим соединениям относятся: гемопротеины, структурным компонентом которых является гем (гемоглобин, миоглобин, цитохромы, каталаза, пероксидаза), негемовые ферменты (сукцинатдегидрогеназа, ацетил-КоА-дегидрогеназа, ксантиноксидаза), ферритин, гемосидерин, трансферрин.
В слизистой оболочке тонкого кишечника из продуктов питания усваивается только двухвалентное негемовое железо. Чтобы железо могло связаться с белками и поступить в клетку, трехвалентное железо восстанавливается в двухвалентное в присутствии кислой среды, основную роль в этом процессе в большинстве случаев играет аскорбиновая кислота [10–13]. Затем для поступления в плазму крови и связывания с трансферрином железо вновь окисляется до трехвалентного. В связанном с трансферрином состоянии железо доставляется тканям посредством эндоцитоза, где оно либо утилизируется клеткой, либо откладывается в составе ферритина. В составе ферритина железо хранится в легкодоступной и нетоксичной форме. Уровень ферритина является «золотым» стандартным показателем количества депонированного железа в организме. Каждый микрограмм ферритина соответствует 8 мг депонированного железа и для женщин в норме составляет 15–150 мг/мл [2, 14–16]. Концентрация же сывороточного железа подвержена значительным суточным колебаниям и составляет в среднем у женщин 6,6–26 мкмоль/л. Поэтому ее определение не имеет первостепенного значения [2].
Гемоглобин является транспортным белком для кислорода, содержащим гемовое железо. Гемы объединены в протопорфириновый каркас, в центре которого находится один двухвалентный атом железа. Одна молекула гемоглобина может перенести максимум 4 молекулы кислорода. Таким образом, количество эритроцитов и гемоглобина играет важную роль в транспортировке кислорода [2].
В течении железодефицита выделяют последовательные стадии: латентный дефицит железа, при котором потери железа превышают его поступление без изменений концентрации гемоглобина, и собственно железодефицитную анемию, которую в зависимости от степени выраженности подразделяют на компенсированную, субкомпенсированную и декомпенсированную формы [3].
Концентрация гемоглобина выражается в граммах на литр. Нормальным уровнем гемоглобина у женщин считается 115–145 г/л (MCHC, Mean Corpuscular Hemoglobin Concentration — средняя концентрация гемоглобина в клетке 320–360 г/л), об анемии говорят при снижении гемоглобина ниже 110 г/л. О тяжести течения анемии судят по уровню гемоглобина. По степени выраженности анемии выделяют легкую степень — 90–109 г/л, среднюю степень — 70–89 г/л и тяжелую степень — менее 70 г/л [3, 14, 15].
Кроме того, для железодефицитной анемии характерны снижение гематокрита, гипохромия (MCH, Mean Corpuscular Hemoglobin — среднее абсолютное содержание гемоглобина в одном эритроците), микроцитоз (MCV, Mean Corpuscular Volume — средний обьем эритроцита), гипосидероз (снижение количества сывороточного железа, увеличение общей железосвязывающей способности сыворотки крови, снижение уровня ферритина в сыворотке крови и в гемолизате) [3, 5]. Количество эритроцитов, гематокрита и гемоглобина составляют измеряемые величины, а MCV, MCH, MCHC являются производными этих величин [2].
Клиническая картина анемии обусловлена кислородным голоданием тканей, прогрессирующей гемической гипоксией с последующим развитием вторичных метаболических расстройств. Клинические симптомы появляются по мере возрастания тяжести заболевания: общая слабость, головокружение, головная боль, сердцебиение, одышка, обмороки, снижение работоспособности, бессонница. Симптомы, характерные ЖДА, заключаются в изменении кожи, ногтей, волос, мышечной слабости, извращении вкусовых ощущений. Кожа становится сухой, на ней появляются трещины. Вследствие нарушения обмена каротина при дефиците железа возникает желтизна кожи. Изменяется форма ногтей, они уплощаются, становятся вогнутыми и ломкими. Волосы истончаются, ломаются и обильно выпадают, появляется седина. При ЖДА также возможны симптомы поражения сердечно-сосудистой системы: сердцебиение, одышка, боли в груди и иногда отеки на ногах [6, 14].
Основными компенсаторными механизмами являются циркуляторная и вентиляционная адаптация, включающие увеличение сердечного выброса, вазодилатацию, снижение сосудистого сопротивления, увеличение перфузии тканей, перераспределение крови, увеличение минутного объема дыхания, усиление активности эритропоэтина. Острая, тяжелая и некомпенсированная анемия может привести к циркуляторному коллапсу и шоку [2].
Основной причиной развития железодефицитных анемий у женщин являются кровопотери различной этиологии. Дефицит железа у женщин встречается в 6 раз чаще, чем у мужчин. Значительное количество крови теряется во время менструации, беременности, в родах. При обильных менструациях возможна потеря железа в количестве 50–250 мг железа [2]. Чаще всего гиперполименорея связана с наличием миомы матки, аденомиозом, гиперпластическими процессами эндометрия, дисфункциональными маточными кровотечениями. Метроррагии при миоме матки чаще всего связаны с субмукозной локализацией узлов, при которой увеличивается менструирующая поверхность, повышается проницаемость кровоснабжающих миому сосудов, снижается сократительная способность матки. При миоме замедляется регенерация кровоточащей поверхности матки после десквамации эндометрия. При аденомиозе поражается миометрий матки, что приводит к длительным обильным менструациям и к вторичной железодефицитной анемии.
Нарушения менструального цикла возникают у женщин в различные возрастные периоды. К развитию гиперменструального синдрома могут привести разнообразные причины — сильные эмоциональные потрясения, нарушение питания, авитаминозы, ожирение, профессиональные вредности, инфекционные и септические заболевания, незрелость гипоталамических структур в пубертатном возрасте и инволютивная перестройка в пременопаузе. В значительной части случаев менометроррагии у женщин сопровождаются анемией различной степени тяжести, что способствует развитию трофических нарушений в различных органах и тканях. Профилактика и лечение анемий у женщин с нарушением менструального цикла и органическими гинекологическими заболеваниями являются важнейшими факторами восстановления их здоровья [1, 4, 17].
Независимо от причины менометроррагий (миома, эндометриоз, дисфункция яичников) и необходимости воздействия на соответствующий фактор, требуется длительная терапия препаратами железа для приема внутрь. Доза, режим дозирования и конкретный препарат подбираются индивидуально с учетом содержания железа в препарате, его переносимости и т. д.
При выборе конкретного препарата и оптимального режима дозирования необходимо иметь в виду, что адекватный прирост показателей гемоглобина при наличии ЖДА может быть обеспечен поступлением в организм от 30 до 100 мг двухвалентного железа [18]. Одними диетическими мероприятиями нельзя возместить дефицит железа и достичь лечебного эффекта.
Антианемическая терапия должна проводиться препаратами для приема внутрь и не должна прекращаться после нормализации гемоглобина. Показания для парентерального введения достаточно ограничены: патология кишечника с нарушением всасывания, непереносимость препаратов для приема внутрь, социальные причины (использование у пациентов с изменениями личности, душевнобольных). По данным многих исследований парентеральные формы не имеют преимущества перед пероральными, при этом отмечается большое количество серьезных побочных эффектов [4, 10, 19]. Гемотрансфузии при ЖДА должны проводиться только по жизненным показаниям.
Современные пероральные ферропрепараты представляют собой соли двухвалентного железа (в пищеварительном тракте ионы трехвалентного железа не всасываются) или соединения, состоящие из гидроксид-полимальтозного комплекса трехвалентного железа (механизм всасывания отличается от такового ионных препаратов) [20].
Наивысшей биодоступностью обладает сернокислая соль железа, поэтому в основном в ферропрепаратах содержится сульфат железа [19, 21]. Сульфат железа это наиболее изученная, проверенная форма, хорошо зарекомендовавшая себя при длительном применении, поэтому чаще других входит в состав препаратов для приема внутрь. Обладает наибольшей степенью всасывания из всех препаратов железа.
В процессе всасывания двухвалентного железа в кишечнике большое значение имеет аскорбиновая кислота, которая способствует поддержанию железа в двухвалентной форме, поэтому очень важно ее наличие в препарате [22]. В гемопоэзе существенная роль принадлежит фолиевой кислоте, усиливающей нуклеиновый обмен. Для нормального обмена фолиевой кислоты необходим цианокобаламин, который способствует образованию из нее активной формы. Дефицит этих веществ, часто возникающий при анемиях, связанных с кровопотерями, приводит к нарушению синтеза ДНК в кроветворных клетках, тогда как включение этих компонентов в препарат увеличивает активную абсорбцию железа в кишечнике и его дальнейшую утилизацию. Наличие в лекарственном препарате аскорбиновой и фолиевой кислот, а также цианокобаламина значительно увеличивает скорость синтеза гемоглобина и повышает эффективность терапии железодефицитных состояний и железодефицитной анемии [14, 23, 24].
Перечисленные компоненты, повышающие биодоступность железа, входят в состав комплексного антианемического препарата Ферро-Фольгамма® [24], который был разработан и производится в соответствии с рекомендациями Всемирной организации здравоохранения (1998).
В 1 капсуле содержится 112,6 мг сульфата железа (элементарного железа 37 мг), что является оптимальной дозой для терапии и сокращает частоту побочных эффектов.
Абсорбция железа из препаратов солей (Fe2+) происходит в виде пассивной диффузии согласно градиенту концентрации, не зависит от рН и двигательной активности желудочно-кишечного тракта (ЖКТ), что обеспечивает быстрое насыщение.
Аскорбиновая кислота улучшает всасывание железа в кишечнике, предотвращает его переход из двухвалентной формы в трехвалентную, ускоряет транспортировку железа и его включения в гем, а также участвует в процессе высвобождения железа из депо.
Аскорбиновая кислота необходима для образования и сохранения восстановленной формы фолиевой кислоты — тетрагидрофолиевой кислоты.
В свою очередь фолиевая кислота является важнейшим фактором для синтеза ДНК и РНК, метаболизма белков и образования красных кровяных клеток, а также выступает дополнительным стимулятором эритропоэза и гемопоэза [21, 23, 25].
Цианокоболамин необходим для образования гемоглобина, эритроцитов, метаболизма белков, жиров, углеводов, производства энергии.
Ферро-Фольгамма® обладает высокой эффективностью, обеспечивая прирост гемоглобина в среднем 2,5 г/л/сут (наибольшая скорость прироста гемоглобина среди препаратов сульфата железа). При использовании препарата Ферро-Фольгамма® ослабление клинической симптоматики постгеморрагической анемии отмечается в течение первых 10 дней приема [6].
Ферро-Фольгамма® назначается по 1 капсуле 3 раза в день после еды в течение 3–4 недель при легкой форме анемии, при средней форме — по 1 капсуле 3 раза в день 8–12 недель, а при тяжелых формах анемии — по 2 капсулы 3 раза в день в течение 16 недель и более. Во время беременности назначается для профилактики недостаточности фолиевой кислоты и железа по 1 капсуле 3 раза в день во II и III триместрах, в послеродовом периоде во время кормления грудью.
После прекращения лечения препаратом Ферро-Фольгамма® положительный эффект и стабилизация показателей сыворотки крови (уровень гемоглобина, эритроцитов, сывороточного железа, общая железосвязывающая способность сыворотки крови) гарантированно сохраняются минимум на протяжении одного месяца [4].
Активные компоненты препарата Ферро-Фольгамма® находятся в специальной нейтральной оболочке, которая обеспечивает их всасывание в верхнем отделе тонкой кишки, что исключает раздражающее действие на желудок. Компоненты растворены в рапсовом масле, которое позволяет улучшить всасывание железа и одновременно снизить раздражающее влияние железа на слизистую оболочку желудка, способствуя хорошей переносимости препарата со стороны пищеварительного тракта [1, 13]. Благодаря отсутствию агрессивного действия на слизистую оболочку ЖКТ Ферро-Фольгамма® может с успехом применяться для коррекции анемического синдрома, при дефиците витамина В12 и фолиевой кислоты на фоне нарушения всасывания в ЖКТ (атрофия слизистой желудка и двенадцатиперстной кишки).
Кроме того, Ферро-Фольгамма® эффективно применяется при сочетанных железо-фолиево-В12-дефицитных анемиях, вызванных хроническими кровопотерями, хроническим алкоголизмом, инфекциями, приемом противосудорожных и пероральных контрацептивных препаратов, анемии во время беременности и кормления грудью.
Эффективность препарата Ферро-Фольгамма® для лечения и профилактики железодефицитной анемии при хорошей переносимости и благоприятных фармакоэкономических характеристиках (стоимость/доза железа/эффективность) была доказана в нескольких российских исследованиях, которые включали широкий круг пациентов, в т. ч. беременных и женщин с гинекологическими заболеваниями [4, 18, 19]. Показаниями к назначению препарата Ферро-Фольгамма® являются анемии, вызванные сочетанным дефицитом железа, фолиевой кислоты и витамина B12, возникающие на фоне хронических кровопотерь (мено- и метроррагий и др.), а также при хроническом алкоголизме, инфекционных заболеваниях, приеме противосудорожных средств и пероральных контрацептивов. Препарат разрешен для профилактики и лечения дефицита железа и фолиевой кислоты во II и III триместрах беременности, в послеродовом периоде и во время лактации.
Таким образом, антианемическая терапия с применением препарата Ферро-Фольгамма® с оптимальным содержанием железа является высокоэффективной с быстрой скоростью прироста гемоглобина (полная клиническая и гематологическая ремиссия у 93% пациенток после 3 недель терапии). Отмечается хорошая переносимость — отсутствие побочных эффектов у 95% пациентов, аллергических реакций и отрицательного влияния на организм женщин, а также стабильность достигнутых результатов и сохранение положительного эффекта в течение месяца после лечения, что позволяет рекомендовать препарат Ферро-Фольгамма® широкому кругу пациентов.
Литература
ГБОУ ВПО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва
Abstract. The role of Ferrum in human organism has been analyzed, mechanisms of its digestion from food, clinical presentations of hypoferric conditions and women’s hypoferric anemia, as well as approaches to therapy and prophylaxis of hypoferric anemia with modern peroral preparations.