все что можно определить по таблице менделеева
Периодический закон Д. И. Менделеева и периодическая система химических элементов
Периодический Закон Д.И. Менделеева
Периодический закон Д.И. Менделеева и периодическая система химических элементов имеет большое значение в развитии химии. Окунемся в 1871 год, когда профессор химии Д.И. Менделеев, методом многочисленных проб и ошибок, пришел к выводу, что
«… свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
Периодичность изменения свойств элементов возникает вследствие периодического повторения электронной конфигурации внешнего электронного слоя с увеличением заряда ядра.
Современная формулировка периодического закона
звучит следующим образом
«свойства химических элементов (т.е. свойства и форма образуемых ими соединений) находятся в периодической зависимости от заряда ядра атомов химических элементов».
Преподавая химию, Менделеев понимал, что запоминание индивидуальных свойств каждого элемента, вызывает у студентов трудности. Он стал искать пути создания системного метода, чтобы облегчить запоминание свойств элементов. В результате появилась естественная таблица, позже она стала называться периодической.
Наша современная таблица очень похожа на менделеевскую. Рассмотрим ее подробнее.
Таблица Менделеева
Периодическая таблица Менделеева состоит из 8 групп и 7 периодов. Рассмотрим подробнее что такое период и что такое группа в периодической таблице Менделеева.
Группы в таблице Менделеева
Вертикальные столбцы таблицы называют группами.
Элементы, внутри каждой группы, обладают сходными химическими и физическими свойствами. Это объясняется тем, что элементы одной группы имеют сходные электронные конфигурации внешнего слоя, число электронов на котором равно номеру группы. При этом группа разделяется на главные и побочные подгруппы.
В Главные подгруппы входят элементы, у которых валентные электроны располагаются на внешних ns- и np- подуровнях.
В Побочные подгруппы входят элементы, у которых валентные электроны располагаются на внешнем ns- подуровне и внутреннем (n — 1) d- подуровне (или (n — 2) f- подуровне).
Все элементы в периодической таблице, в зависимости от того, на каком подуровне (s-, p-, d- или f-) находятся валентные электроны классифицируются на:
Высшая и низшая степени окисления элементов
Высшая валентность элемента и высшая степень окисления (за исключением O, F, элементов подгруппы меди и восьмой группы) равна номеру группы, в которой он находится.
Низшая степень окисления элемента равна
Номер группы — 8
Для элементов главных и побочных подгрупп одинаковыми являются формулы высших оксидов (и их гидратов).
В главных подгруппах состав водородных соединений являются одинаковыми, для элементов, находящихся в этой группе.
Твердые гидриды образуют элементы главных подгрупп I — III групп, а IV — VII групп образуют а газообразные водородные соединения. Водородные соединения типа ЭН4 – нейтральнее соединения, ЭН3 – основания, Н2Э и НЭ — кислоты.
Периоды в таблице Менделеева
Горизонтальные ряды таблицы называют периодами. Элементы в периодах отличаются между собой. Общим является то, что последние электроны находятся на одном энергетическом уровне (главное квантовое число n — одинаково).
Как определить металл или неметалл?
Если посмотреть на периодическую таблицу Менделеева и провести воображаемую черту, начинающуюся у бора и заканчивающуюся между полонием и астатом, то все металлы будут находиться слева от черты, а неметаллы главных подгрупп – справа.
Элементы, непосредственно прилегающие к этой линии будут обладать свойствами как металлов, так и неметаллов. Их называют металлоидами или полуметаллами. Это бор, кремний, германий, мышьяк, сурьма, теллур и полоний.
Как изменяются свойства элементов в Периодической таблице?
Правило октета
Правило октета утверждает, что все элементы стремятся приобрести или потерять электрон, чтобы иметь восьмиэлектронную конфигурацию ближайшего благородного газа. Т.к. внешние s- и p-орбитали благородных газов полностью заполнены, то они являются самыми стабильными элементами.
Согласно правилу октета, при движении по периодической таблице слева направо для отрыва электрона требуется больше энергии. Поэтому элементы с левой стороны таблицы стремятся потерять электрон, а с правой стороны – его приобрести.
Изменение энергии ионизации
Энергия ионизации – это количество энергии, необходимое для отрыва электрона от атома.
Изменение сродства к электрону
Сродство к электрону – изменение энергии при приобретении дополнительного электрона атомом вещества в газообразном состоянии.
Изменение электроотрицательности
Электроотрицательность — мера того, насколько сильно атом стремится притягивать к себе электроны связанного с ним другого атома.
Электроотрицательность увеличивается при движении в периодической таблице слева направо и снизу вверх. При этом надо помнить, что благородные газы не имеют электроотрицательности. Таким образом, самый электроотрицательный элемент – фтор.
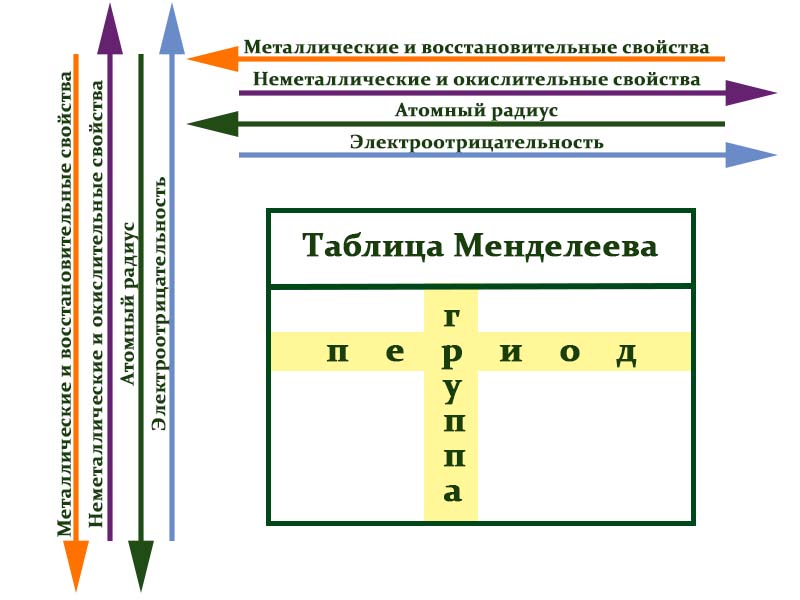
Итак, в периодической зависимости находятся такие свойства атома, которые связанны с его электронной конфигурацией: атомный радиус, энергия ионизации, электроотрицательность.
Изменение металлических и неметаллических свойств атомов
Неметалличность атома увеличивается при движении в периодической таблице слева направо и снизу вверх.
Изменение основных и кислотных свойств оксидов и гидроксидов
О сновные свойства оксидов уменьшаются, а кислотные свойства увеличиваются при движении слева направо и снизу вверх. При этом кислотные свойства оксидов тем сильнее, чем больше степень окисления образующего его элемента
По периоду слева направо основные свойства гидроксидов ослабевают.
По главным подгруппам сверху вниз сила оснований увеличивается. При этом, если металл может образовать несколько гидроксидов, то с увеличением степени окисления металла, основные свойства гидроксидов ослабевают.
По периоду слева направо увеличивается сила кислородосодержащих кислот. При движении сверху вниз в пределах одной группы сила кислородосодержащих кислот уменьшается. При этом сила кислоты увеличивается с увеличением степени окисления образующего кислоту элемента.
По периоду слева направо увеличивается сила бескислородных кислот. При движении сверху вниз в пределах одной группы сила бескислородных кислот увеличивается.
На рисунке ниже схематично показано изменение свойств атомов химических элементов в периодах и группах периодической таблицы Менделеева
Задания и примеры по строению таблицы Менделеева, положению атомов химического элемента в ней и закономерностям изменения свойств атомов элементов в периодах и группах периодической таблицы Менделеева представлены с разделе Задачи к разделу Периодический закон Д.И. Менделеева и периодическая система химических элементов
Почему американцы называют «Периодическую таблицу Менделеева» просто «Периодической таблицей»
Мы привыкли к тому, что Периодическая таблица химических элементов напрямую связана с именем великого русского ученого Дмитрия Ивановича Менделеева, который эту самую таблицу и изобрел. Однако, в США и других странах Запада, вовсю пользующихся таблицей Менделеева, о самом Менделееве практически никто не знает.
На Западе таблицу Менделеева называют просто «Периодическая таблица элементов». Так, конечно, удобнее. Не нужно ломать язык о фамилию какого-то русского.
А, кроме того, это идет в русле с весьма популярной на Западе максимой, не так давно озвученной актером Хью Лори: «Русские ничего не производят, кроме депрессии».
Фамилия великого русского ученого на его же периодической таблице, приклеенной в американской школе? Ну уж нет! Это будет постоянный источник дискомфорта для многих людей. Зачем? Мы будет просто пользоваться открытым Менделеевым периодическим законом, учиться по его учебникам, но говорить о нем не будем.
А ведь открытие Дмитрия Ивановича Менделеева произвело настоящую революцию в химии. Русский ученый в 1869 году систематизировал более 60-ти известных на тот момент элементов согласно своему фундаментальному Периодическому закону, который, по сути дела, и создал химию, как науку, упорядочил ее.
Менделеев, опираясь на свое открытие, предсказал обнаружение новых элементов, для которых он оставил в таблице пустые клетки. Позднее ученые из разных стран мира, действительно, нашли эти элементы.
Следует сказать, что сразу после публикации Периодической системы Менделеева ученые высказывали большие сомнения в том, что она верна. Лишь в 1913 году британский физик Генри Мозли со всей очевидностью доказал, что открытие русского ученого абсолютно верное.
И вот доказательство Мозли правильности закона Менделева на Западе и стали называть Законом Мозли! Это же чудо что такое, согласитесь! Этак можно подтвердить правильность Теоремы Пифагора и назвать ее своим именем.
Нет, достижение Мозли никто не оспаривает, тем более, сам физик строго подчеркивал, что Периодический закон открыл Дмитрий Менделеев, а он лишь подтвердил его правильность. Вот только западной общественности было удобнее, чтобы закон назывался именем Мозли, а не именем Менделеева.
Понравилась статья? Подпишитесь на канал, чтобы быть в курсе самых интересных материалов
Расшифровка таблицы Менделеева: как пользоваться

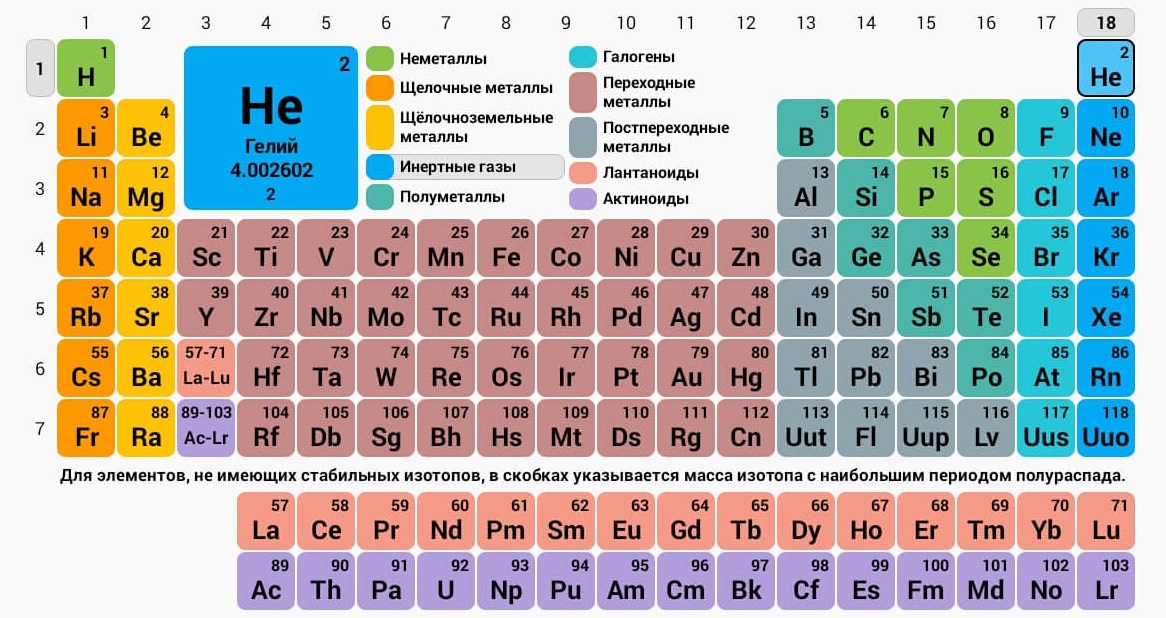
Расшифровка обозначений элементов
Каждому химическому элементу в таблице отведена одна клеточка, в которой указаны символ и название элемента, порядковый номер и относительная атомная масса.
Расшифровка обозначений элементов таблицы Менделеева:
Чтобы узнать количество нейтронов в ядре элемента, необходимо из относительной атомной массы (массового числа) вычесть порядковый номер.
Элементы периодической таблицы Менделеева
Металлы расположены в левом нижнем углу таблицы, неметаллы — в правом верхнем углу. Между ними находятся полуметаллы. Все периоды, кроме первого, начинается щелочным металлом. Каждый период заканчивается инертным газом.
Расшифровка групп и периодов таблицы Менделеева
В таблице химические вещества расположены в специальном порядке: слева направо по мере роста их атомных масс. Все они в периодической системе объединены в периоды и группы.
Периоды — это горизонтальные ряды в таблице. У всех элементов одного периода одинаковое количество заполненных электронами энергетических уровней.
Номер периода, в котором находится элемент, совпадает с номером его валентной оболочки. Эта валентная оболочка постепенно заполняется от начала к концу периода.
Группы — это столбцы. Элементы во всех группах имеют одинаковое электронное строение внешних электронных оболочек. В каждой группе на внешнем энергетическом атома одинаковое число электронов, то есть номер группы совпадает с числом валентных электронов, которые могут участвовать в образовании химических связей. Поэтому номер группы часто совпадает с валентностью элементов. Например, номер группы совпадает с валентностью s-элементов и с наибольшей возможной валентностью p-элементов.
Атомное число показывает, сколько протонов содержит ядро атома элемента и сколько электронов в атоме находятся вокруг него. Атом каждого последующего элемента содержит на один протон больше, чем предыдущий.
Валетность — это свойство элементов образовывать химические связи. То есть это количество химических связей, которые образует атом или число атомов, которое может присоединить или заместить атом данного элемента. Валентность бывает: постоянная и переменная (зависит от состава вещества, в которое входит элемент).
Определить валентность:
— Постоянная валентность идентична номеру группы главной подгруппы. Номера групп в таблице изображаются римскими цифрами.
— Переменная валентность (часто бывает у неметаллов) определяется по формуле: 8 вычесть № группы, в которой находится вещество.
Расшифровка периодов и групп периодической таблицы Менделеева
Каждый элемент имеет свой порядковый (атомный) номер, располагается в определённом периоде и определённой группе.
Периоды
В таблице 7 периодов. В каждом содержится определённое число элементов:
1-й период — 2 элемента (малый период),
2-й период — 8 элементов (малый период),
3-й период — 8 элементов (малый период),
4-й период — 18 элементов (большой период),
5-й период — 18 элементов (большой период),
6-й период — 32 элемента (18+14) (большой период),
7-й период — 32 элемента (18+14) (большой период).
Группы и подгруппы
В Периодической таблице может использоваться разное обозначение групп. Поэтому согласно такому обозначению бывает разная расшифровка групп таблицы менделеева:
Элементы с порядковыми номерами 58–71 (лантаноиды) и 90–103 (актиноиды) вынесены из таблицы и располагаются под ней. Это элементы IIIB группы. Лантаноиды относятся к шестому периоду, а актиноиды — к седьмому.
Элементы главной подгруппы
1 группа главная подгруппа элементов (IA) — щелочные металлы.
Это мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним электроном на внешней оболочке и прекрасно вступают в реакцию.
Литий Li (3), Натрий Na (11), Калий K (19), Рубидий Rb (37), Цезий Cs (55), Франций Fr (87).
3 группа главная подгруппа (IIIА).
Все элементы данной подгруппы, за исключением бора, металлы. Главную подгруппу составляют составляют бор, алюминий, галлий, индий и таллий. На внешнем электронном уровне элементов по три электрона. Они легко отдают эти электроны или образуют три неспаренных электрона.
5 группа главная подгруппа (VA).
Физические свойства элементов подгруппы азота различны. Азот является бесцветным газом. Фосфор, мягкое вещество, образует несколько вариантов аллотропных модификаций — белый, красный и чёрный фосфор. Мышьяк — твёрдый полуметалл, способный проводить электрический ток. Висмут — блестящий серебристо-белый металл с радужным отливом.
8 группа главная подгруппа (VIIIA) — инертные (благородные) газы.
(He, Ne, Ar, Kr, Xe, Rn, Og). У них полностью заполнен внешний электронный уровень. Они практически не способны участвовать в реакциях. Поэтому их иногда называют «благородными». У инертных газов есть способность: они светятся под действием электромагнитного излучения, поэтому используются для создания ламп. Так, неон используется для создания светящихся вывесок и реклам, а ксенон — в автомобильных фарах и фотовспышках.
Элементы побочной подгруппы
Элементы побочных подгрупп кроме лантаноидов и актиноидов — переходные металлы.
Твёрдые (исключение жидкая ртуть), плотные, обладают характерным блеском, хорошо проводят тепло и электричество.
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
3 группа побочная подгруппа (IIIB) шестого и седьмого периодов — лантаноиды и актиноиды.
Для удобства их помещают под основной таблицей.
Неметаллы
Кислородные и водородные соединения
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения.
Существует 8 форм кислородных соединений: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4,
где R — элемент группы.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют 4 формы водородных соединений: RH4, RH3, RH2, RH.
Характер соединений: RH — сильнокислый; RH2 — слабокислый; RH3 — слабоосновный; RH4 — нейтральный.
Таблица Менделеева — периодическая система элементов
Сложно ли было Менделееву создать собственную таблицу? Почему именно она прошла испытание временем и располагается на данный момент у людей? Сложно ли читать по ней что-либо об элементе?
Каждому школьнику, перешедшему порог восьмого класса понятие «Периодическая система химических элементов» («Таблица Менделеева») становится понятным даже при упоминании первого слова. Созданная величайшим Дмитрием Ивановичем Менделеевым, она очень хорошо помогает людям, работающим в химической сфере. Даже нет, не так. Это основное, чем они пользуются при проведении собственных опытов.
Периодическая система элементов
Каждому, наверное, известно, как она появилась. Однажды Дмитрий Иванович засыпал в собственной кровати, думая над тем, как же можно классифицировать все известные на тот момент химические элементы. По отдельным группам? Нет, тогда их будет слишком много. Может, по каким-то свойствам? А что тогда делать с теми, у кого их несколько и они входят сразу в несколько сфер? Может, тогда по каким-то признакам, которые они проявляют при соединении с чем-нибудь? Нет, тоже не то. Может же встретиться что-то такое, что обязательно не будет ни с чем контактировать. И что тогда? Выкидывать?

Но долго мучиться мужчине не пришлось. Во сне к нему пришла полная периодическая таблица химических элементов, которая на данный момент украшает стены очень многих кабинетов химии в школах. Конечно, всё было не так уж и просто, да и сам Менделеев высказался по этому поводу таким образом, что никакое глобальное изобретение не приходит по щелчку пальцев. Можно ли тогда считать его систему одним из самых великих изобретений? Но почему именно она, да и вообще, по какому принципу, в каком порядке там поставлены все элементы?
Менделеев Дмитрий Иванович — был 17 ребёнком в семье
Как пользоваться Таблицей Менделеева
Честно говоря, в первый раз смотря на таблицу, невозможно её прочитать. Почему где-то есть пропуски, а где-то целые десятки элементов входят в одну ячейку? По какому принципу летучие вещества были расположены в конце группы, в то время как те, у которых более выражены металлические свойства, располагаются ближе к началу? На большую часть этих вопросов отвечают уроки химии, на которых учитель тратит огромное время на обучение детей прочтению таблицы Менделеева. Но, если в памяти это не отложилось, или что-то осталось непонятным — не беда, всё не так уж и сложно.

Наверное, многие успели заметить то, что все элементы расположены по порядку, а у каждого есть свой собственный номер. Именно он характеризует количество протонов в ядре, а также количество электронов, движущихся вокруг него. Чем оно больше – тем больше уровней, так называемых, «орбиталей», по которым они в состоянии передвигаться.
Следующее, на что обращается внимание – иногда даже огромное число внизу. Это относительная атомная масса элемента, характеризующая, сколько будет весить один его моль. Как правило, она измеряется в граммах на моль, поэтому нетрудно предположить, насколько же легка. Как правило, кстати, это усреднённое значение, поэтому записывается с числами после запятой. Исключения составляют лишь элементы, стоящие в седьмом периоде, то есть, радиоактивные.
Иногда также сбоку подписываются несколько чисел, которые в сумме дают порядковый номер. Это не случайно. Это расположение электронов по тем самым орбиталям, о которых ранее шла речь. Это довольно-таки удобно для использования в будущем, но, к сожалению, не всегда присутствует.
Самое главное же, что осталось на конец, – это группы и периоды в данной таблице. Столбики и строчки, простыми словами. Это один из самых важных моментов, характеризующий элементы в таблице Менделеева. Чтобы проще запомнить, стоит понять, что в группе, как правило, расположены элементы со сходными химическими свойствами, в то время, как в периоде они изменяются.
Период, как правило, совпадает с валентной оболочкой элемента. Как правило, чем правее вещество расположено, тем более выражены его металлические (восстановительные) свойства, в то время как в левой части больший акцент делается на окислительных.
Группа же, в свою очередь, это валентность элемента. Это число электронов, которые могут вступать в сложные химические связи. Но не стоит сразу же бежать писать и уравнивать соединения, в которых «неправильно» поставлены индексы. На самом же деле, валентность не всегда совпадает с номером группы. Но не стоит сомневаться в первых трёх – там всё более, чем нормально.
2018 в Дании был введен запрет на изучение таблицы Менделеева. В министерстве иностранных дел посчитали, что «русские используют Периодическую систему в качестве пиара интеллектуальных достижений России». А также она опасна для детей.
Таким образом, несложно понять, что таблица Менделеева – очень полезная вещь в химии, без которой невозможно было бы выполнять огромного количества действий. А сама её история создания просто завораживает дух!