врожденный дискератоз что это
Врожденный дискератоз
Врожденный дискератоз – крайне редкое генетическое заболевание, классическая клиника которого включает локальную гиперпигментацию кожных покровов, дистрофию ногтевых пластинок и лейкоплакию. Также возникает депрессия костного мозга, что проявляется апластической анемией, иммунодефицитом и кровотечениями. Часто врожденный дискератоз осложняется злокачественными новообразованиями. Диагностика подразумевает сопоставление клинических симптомов и выявление дефектов кариотипа при помощи кариотипирования или флуоресцентной гибридизации. Лечение заключается в восстановлении нормальной функции костного мозга путем его трансплантации или фармакологической стимуляции. Параллельно проводится симптоматическая терапия.
Общие сведения
Врожденный дискератоз – генетически обусловленный синдром, проявляющийся недостаточностью костного мозга и совокупностью специфических симптомов. Впервые классическая триада заболевания была описана в 1906 году немецким дерматовенерологом Цинссером. В 1930-х годах Коул и Энгман дополнили описание, после чего патология получила второе название – синдром Цинссера-Коула-Энгмана. На данный момент клиническая характеристика заболевания, помимо классической триады, включает другие симптомы и синдромы. Патология встречается крайне редко, распространенность – 1:1000000. Представители мужского пола болеют в 4,7 раз чаще, чем женского. Манифестация заболевания происходит в возрасте от 5 до 15 лет, поэтому первым с ним сталкивается педиатр. Симптомы развиваются постепенно, наиболее выраженная клиническая картина приходится на возраст 25-30 лет и старше. Как правило, больные умирают от осложнений в виде вторичных инфекций, злокачественных новообразований и внутренних кровотечений.
Причины врожденного дискератоза
Симптомы врожденного дискератоза
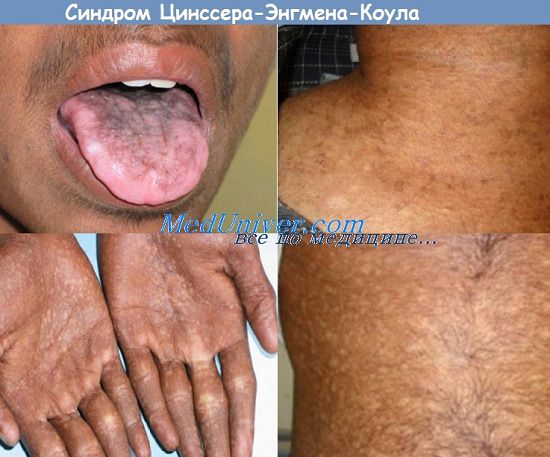
Классический вариант врожденного дискератоза включает в себя триаду симптомов: дистрофические изменения ногтей, гиперпигментацию кожных покровов и лейкоплакию слизистых оболочек. Более чем в 85% случаев его течение осложняется другими патологическими состояниями: апластической анемией, иммунодефицитом, аномалией развития мозжечка, умственной отсталостью, фиброзным перерождением легких или печени, злокачественным новообразованием. Заболевание развивается постепенно. До 5 лет врожденный дискератоз протекает латентно. Первые проявления могут развиваться в возрасте от 6 до 15 лет, иногда – после 20. С возрастом происходит усугубление всех симптомов и развитие осложнений.
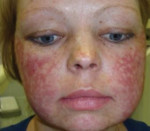
Первичным проявлением врожденного дискератоза, как правило, выступает дистрофия ногтевых пластинок. Ногти становятся тонкими и ломкими, возникает продольная исчерченность. Спустя 2-3 года к данным проявлениям присоединяется сетчатая гиперпигментация кожи с характерной локализацией – лицо, шея, верхняя часть поверхности грудной клетки. Средний размер пораженных участков – 2-8 мм в диаметре. Кожа атрофируется, приобретает коричневый оттенок, на ней могут наблюдаться телеангиэктазии. Часто возникает гипергидроз и гиперкератоз стоп и ладоней, акроцианоз, алопеция. Спустя некоторое время ногтевые пластики могут самопроизвольно отпадать, что чаще всего наблюдается на мизинцах стоп.
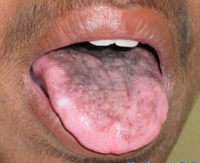
Более чем у половины больных в возрасте до 8-10 лет развивается гипопластическая анемия, которая в педиатрии часто расценивается как анемия Фанкони. Первые клинические проявления – частые носовые кровотечения. Вскоре происходит снижение иммунитета. Изредка анемия и иммунодефицит являются первичными признаками врожденного дискератоза. В возрасте 25-30 лет возникает поражение слизистых оболочек рта. На них могут развиваться везикулы или папулы, переходящие в эрозии; папилломы, атрофия сосочков языка, гингивит, лейкоплакия. Наблюдается выпадение зубов. Часто возникает поражение глаз – конъюнктивит, блефарит, эктропион, катаракта и глаукома. Постепенно лейкоплакия поражает и другие слизистые оболочки – мочеиспускательного канала, кишечника, половых органов. У трети больных наблюдаются умственная отсталость.
Диагностика врожденного дискератоза
Диагностика врожденного дискератоза затруднена. Заболевание встречается крайне редко и имеет большое количество клинических проявлений. Диагноз выставляется на основании всех имеющихся симптомов и синдромов, данных лабораторных анализов и гистологического исследования биоптата кожных покровов.
Общие клинические анализы позволяют установить наличие отдельных синдромов. В ОАК на ранних стадиях возможен лейкоцитоз, нейтропения, повышение СОЭ. Далее развивается панцитопения, апластическая анемия, возможны макроцитоз и повышение концентрации фетального гемоглобина. Стернальная пункция на поздних стадиях выявляет депрессию костного мозга. Гистологическое исследование пораженных участков кожи позволяет обнаружить атрофию эпидермиса, слабовыраженный гиперкератоз, увеличение пигментации базального слоя, в дерме – увеличение количества меланофагов в сосочковом и сетчатом слоях, расширение сосудов микроциркуляторного русла. Возможно нарушение структуры коллагена, гомогенизация и фрагментация его волокон. Специфическая диагностика направлена на выявление дефектов кариотипа. Проводится кариотипирование или флуоресцентная гибридизация, при которых удается установить мутацию гена в участке Xq28, редко – в 3q14.
Лечение врожденного дискератоза
Лечение врожденного дискератоза малоэффективно. Основная цель – борьба с угнетением функции костного мозга. Метод выбора – трансплантация костного мозга от родного брата или сестры, не страдающих данным заболеванием. Даже на фоне пересадки у большей части больных наблюдается реакция «трансплантат против хозяина». При невозможности провести трансплантацию показано использование анаболических гормональных средств (оксиметолон), колониестимулирующих факторов, эритропоэтинов. Лечение злокачественных новообразований у таких больных проводится при помощи протонной терапии. При лейкоплакии используются ретиноиды и Р-каротин.
Прогноз при врожденном дискератозе неблагоприятный. Почти всегда заболевание имеет летальный исход. К смерти приводят злокачественные новообразования, присоединение вторичной инфекции (в основном – пневмонии), желудочно-кишечные или другие внутренние кровотечения. Чаще всего пациенты умирают от плоскоклеточного рака ротовой полости, гортаноглотки, половых органов, мочеиспускательного канала и ЖКТ, реже – аденокарциномы поджелудочной железы, лимфомы Ходжкина.
Врожденный дискератоз что это
Дискератоз врожденный (ДВ) (MIM 305 000, 242 230, 127 550) — редкая форма эпидермальной дисплазии. Встречается почти исключительно у мужчин. Отмечено три типа наследования: аутосомно-рецессивный, связанный с полом рецессивный и аутосомно-доминантньш. Ген ДВ располагается на длинном плече X хромосомы, Xq28. У больных ДВ выявляются также различные иммунные нарушения.
Дети с врожденным дискератозом остаются здоровыми до 5-летнего возраста. В последующие 10 лет у них развиваются эритема, сетчатая гиперпигментация и телеангаэктазии, наиболее выраженные на лице, шее и бедрах, а также оральная или аногенитальная лейкоплакия. Наблюдаются также атрофия кожи с исчезновением ладонной дерматоглифики, дистрофия ногтей, паронихии. Удетей сетчатая серо-коричневая пигментация на шее, бедрах и груди с атрофией и телеангиэктазиями в этих местах придают коже картину пойкилодермии. У взрослых наблюдаются ладонно-подошвенный гиперкератоз, гипергидроз, геморрагические пузыри на слизистой оболочке рта и пойкилодермически измененной коже. Также нередки нарушения со стороны глаз (блефарит, эктропион, катаракта, глаукома, обструкция выходных отверстий слезных протоков), гингивиты, лейкокератоз щек, языка, нёба, раннее выпадение зубов, ранняя алопеция, преждевременная седина. Кроме того, у больных с этим синдромом могут наблюдаться низкорослость и костные нарушения, у 30% — умственная отсталость.
Возможны системные проявления врожденного дискератоза, такие как гематологические заболевания (спленомегалия, тромбоцитопения, апластическая анемия и панмиелофтиз).
На фоне лейкоплакии у больных врожденным дискератозом нередко развивается плоскоклеточный рак. Заболевание также ассоциируется со злокачественньми опухолями ротоглотки, аногенитальной области и желудочно-кишечного тракта, описано развитие аденокарциномы поджелудочной железы, лимфогранулематоза.
При гистологическом исследовании врожденного дискератоза выявляют атрофию эпидермиса, увеличение количества меланина в базальном слое; вдерме — расширение сосудов и появление меланофоров.
Дифференциальный диагноз врожденного дискератоза проводится с синдромом Ротмунда—Томсона, пигментной ксеродермой, ангидротической эктодермальной дисплазией.
Прогноз врожденного дискератоза неблагоприятный из-за развития гематологических заболеваний и рака на фоне лейкоплакии. Причиной летального исхода могут быть инфекции и желудочно-кишечные кровоизлияния.
Лечение опухолей кожи при врожденном дискератозе проводят хирургически или аппликациями мазей с цитостатиками (5% флуороурациловая, 50% проспидиновая и др.); лечение лейкоплакии проводят этретинатом, что снижает частоту ее трансформации в плоскоклеточный рак.
Анемия Фанкони
Анемия Фанкони (АФ) — редкое наследственное заболевание, передающееся по аутосомно-рецессивному типу (MIM 227650). Различают четыре группы АФ, причем ген группы С клонирован и картирован на 9-й хромосоме 9q22.3, а ген группы А экспериментально определен на длинном плече 20-й хромосомы — 20q. Хотя функция белка, закодированного в этом локусе, неизвестна, предполагается, что белок является цитоплазматическим и играет прямую роль в репарации ДНК. В результате наблюдается заметная хромосомная нестабильность, сопровождающаяся повышенной тенденцией к разрыву ДНК перекрестно-связывающими агентами, такими как диэпоксибутан, используемый в диагностическом гесте на АФ.
Анемия Фанкони встречается у детей в возрасте от 4 до 10 лет. Характеризуются аплазией костного мозга и панцитопенией (анемия, нейтроцитопения, тромбоцитопения) в сочетании с рядом соматических и метаболических нарушений: задержкой роста, дефектами формирования скелета (микроцефалия и др.), глаз, ушных раковин, сердца, нервов, мочеполового и желудочно-кишечного трактов, гипогонадизмом, гипоплазией почек или селезенки, аминоацидурией, глюкозурией.
Кожный процесс анемии Фанкони представлен оливковокоричневыми пятнами на нижней части туловища, сгибах конечностей, шее. В пределах этих очагов разбросаны мелкие, депигментированные и гиперпигментированные пятна, придающие коже сетчатый вид. Кроме того, имеются пятна типа «кофе с молоком».
У больных анемией Фанкони отмечается заметная предрасположенность к злокачественным новообразованиям, особенно к острому миелолейкозу, который в 52% случаях развивается в возрасте до 40 лет. Часты и эпителиальные новообразования, в том числе ротоглотки, желудочно-кишечного и мочеполового трактов, кожи, которые развиваются в раннем возрасте.
Лечение врожденного дискератоза в Израиле
Что такое врожденный дискератоз
Это редкая наследственная патология, при которой костный мозг не вырабатывает достаточно клеток крови. У больных на коже образуются пигментные пятна, начинается дистрофия ногтей и поражение слизистых оболочек. При этом кожные изменения могут начаться раньше, чем разовьется недостаточность костного мозга. Последняя диагностируется по низкому числу клеток крови, включая эритроциты, лейкоциты и тромбоциты.
Другие возможные признаки врожденного дискератоза – низкорослость, аномалии глаз и зубов, истончение и раннее поседение волос, заболевания легких, печени и кишечника, остеопороз, бесплодие, когнитивные нарушения, а также задержки развития. Среди страдающих врожденным дискератозом зафиксирована повышенная частота лейкемии и других онкологических заболеваний.
Типы врожденного дискератоза
Симптомы врожденного дискератоза
Симптоматика у пациентов зависит от нескольких факторов:
Симптомы могут различаться даже в пределах одной семьи. За исключением особо тяжелых форм – синдрома Хойерала-Хрейдарссона и синдрома Ревеца – заболевание проявляется не с рождения, а развивается в детстве, подростковом возрасте и, редко, у взрослых. Как правило, чем раньше проявляется врожденный кератоз, тем тяжелее и быстрее прогрессирует.
Диагностика
Диагноз «врожденный дискератоз» могут поставить на основании всесторонней клинической оценки, детального анамнеза и характерных симптомов, включая изменения кожи и слизистых оболочек. Верный диагноз поставить сложнее, если первыми проявлениями врожденного дискератоза была апластическая анемия или фиброз легких.
У пациентов с недостаточностью костного мозга признаком дискератоза служат короткие теломеры в клетках периферической крови.
Диагноз может быть подтвержден на основании молекулярно-генетического теста. На врожденный дискератоз указывают мутации в генах DKC1, TERC, TERT, TINF2, NHP2 или NOP10.
Однако тест может не выявить всех генетических нарушений. Так, например, тест «не видит» крупную делецию. Поиск генетических вариантов, ответственных за дискератоз, может быть затруднительным. Кроме того, не все мутации, описанные в литературе, на самом деле ответственны за болезни. У половины пациентов не обнаружено никаких мутаций, несмотря на очевидное проявление болезни.
Врожденный дискератоз и ТКМ
Если есть подходящий донор, трансплантация гемопоэтических стволовых клеток потенциально может устранить нарушения в составе крови, вызванные дискератозом. ТГСК может быть показана пациентам, у которых недостаточность костного мозга – основное нарушение. При этом трансплантация не улучшает состояние тканей, пораженных в результате заболевания.
Пациенты с врожденным дискератозом должны наблюдаться в течение всей жизни, чтобы вовремя отследить развития легочных и онкологических заболеваний. Генетическое консультирование может иметь преимущества для самого пациента и членов его семьи. В остальном лечение врожденного дискератоза является симптоматическим и поддерживающим.
Теломеры и болезни (2)
Теломеропатии
(Продолжение. Начало статьи – здесь.)
Нарушение механизмов восстановления теломер может вызываться мутациями, значительно снижающими способность теломеразы удлинять теломеры, что приводит к ускоренному разрушению хромосом [9]. Классической «теломерной болезнью» является врожденный дискератоз – редкое наследственное заболевание, характеризующееся неполноценной работой костного мозга. Наследственный дефект в гене DKC1 при Х-сцепленном врожденном дискератозе идентифицировал Индерджит Докал (Inderjeet Dokal) при анализе групп сцепления у большого количества людей с семейной историей заболевания [10]. Ген DKC1 кодирует дискератин – белок, связывающийся с РНК-компонентом теломеразы и стабилизирующий теломеразный комплекс. У представителей некоторых семей с аутосомно-доминантным врожденным дискератозом позже были выявлены гетерозиготные мутации TERC [11]. Тяжелый фенотип Х-сцепленного врожденного дискератоза, по всей видимости, обусловлен гемизиготной утратой DKC1 и значительно сниженной эффективностью функционирования теломеразы. При аутосомно-доминантном врожденном дискератозе, вызываемом дефектами TERC и других генов соматических хромосом, нарушение теломеразной функции обусловлено неполноценностью гена на одной из парных хромосом, что снижает уровень белкового продукта гена.
Врожденный дискератоз имеет патогномоничные (безусловно характерные для данного заболевания) признаки. Исторически заболевание впервые было описано дерматологами, к которым пациенты и по сей день часто обращаются по поводу аномального изменения ногтей и пигментированной сетчатой сыпи. Завершающим компонентом этой диагностической триады является лейкоплакия (ороговение) слизистой оболочки ротовой полости. У таких пациентов на первом десятилетии жизни, как правило, развивается апластическая анемия (угнетение кроветворной функции костного мозга). При врожденном дискератозе легкие и печень также функционируют неполноценно или утрачивают способность к нормальной работе после трансплантации стволовых клеток, проводимой с целью лечения болезни костного мозга.
Врожденный дискератоз и его типичные проявления в некоторых случаях могут возникать у взрослых людей, например, у пациентов с мутацией DKC1, численность лейкоцитов у которых не восстанавливается после химиотерапии. Однако большинство теломеропатий взрослого возраста – результат мутаций TERC и ферментативного компонента, кодируемого TERT, которые не приводят к неизбежному развитию болезни, а скорее являются факторами риска. Первые выявленные у человека мутации TERT были обнаружены у пациентов с приобретенной апластической анемией, не имевших физических отклонений и соответствующего семейного анамнеза. Для формирования фенотипических признаков мутаций TERT и TERC на уровне целостного организма характерна высокая вариабельность как внутри семей, так и между ними, что проявляется значительными различиями в тяжести течения, возрасте, в котором появляются первые симптомы, и вовлечении органов. Внутри одних и тех же семей родственники, имеющие мутацию, могут вообще не иметь или иметь минимальные клинические проявления, на более поздних этапах жизни у них могут развиваться апластическая анемия, фиброз легких или цирроз печени [9]. Мутации теломеразы выявлены у значительной части пациентов с семейной историей фиброза легких, а также в популяциях пациентов с тяжелым циррозом печени.
В гемопоэтических стволовых клетках активность теломеразы повышена для обеспечения постоянного поступления в кровь эритроцитов, лейкоцитов и тромбоцитов; нарушения кроветворной функции при теломеропатиях вызваны снижением численности стволовых клеток костного мозга и их способности к восстановлению. Однако проблемы, которые теломеропатии вызывают в печени и особенно в легких, объяснить гораздо сложнее, так как потребность в пролиферации их клеток считается невысокой, а задействованные в повреждениях типы клеток неизвестны. В то же время у пациентов преклонного возраста, кожа и слизистые оболочки повреждаются редко, а кишечник, как ни странно, вообще не страдает ни при врожденном дискератозе, ни при других теломерных болезнях: у пациентов не развивается воспалительные поражения слизистых оболочек и сохраняется способность к абсорбции, несмотря на то, что для тканей обоих типов характерны высокие уровни репликации клеток. Механизмы, лежащие в основе заболеваний, вызываемых теломеропатиями, практически неизвестны. Неясно, почему в легких и печени развивается фиброз, тогда как при апластической анемии костный мозг замещается жировой тканью. Неизвестен и вклад в развитие теломеропатий факторов окружающей среды (атаки иммунной системы на костный мозг при апластической анемии, курения при поражении легких, а также алкоголя и вирусных инфекций при поражении печени).
Взаимосвязь между мутациями теломеразы и заболеваниями трех различных систем органов (крови, легких и печени) имеет важное практическое значение для пациентов и врачей. При наличии семейного анамнеза даже небольшие отклонения количественных показателей клеток крови, фиброз легких и цирроз печени являются важными данными для диагностики теломеропатии (как при острой миелоидной лейкемии, см. ниже), но разнообразие симптомов может ввести в замешательство любого из занимающихся больным узких специалистов. Одним из недавних достижений является появление коммерческих наборов для оценки длины теломер в лейкоцитах, сильное укорочение которых является надежным диагностическим маркером [12]. Можно также секвенировать последовательность генов TERT и TERC. Выявление недостаточности теломеразы оказывает влияние на прогноз течения и подходы к лечению заболевания, а также на генетическое консультирование.
Несмотря на то, что диагноз теломеропатии бывает очевидным, его постановка может быть связана с определенными трудностями. У представителей одних семей с типичными симптомами отсутствуют известные мутации, тогда как у других длина теломер может быть нормальной при наличии этиологических (таких, без которых болезнь никогда не разовьётся) замен нуклеотидов. Редкие мутации генов, кодирующих белки-шелтерины, могут приводить к тяжелому врожденному дискератозу, не изменяя способности теломеразы к восстановлению теломер. В некоторых случаях причина может скрываться в регуляторных регионах генов, обычно не подвергаемых скринингу.
Апластическая анемия
Помимо внимательного клинического осмотра минимальный спектр необходимых диагностических исследований при подозрении на апластическую анемию включает:
В 1976 и 1979 гг. Брюсом Камиттой и соавт. была выделена группа простейших показателей периферической крови и костного мозга, определяющих тяжесть течения заболевания и прогноз больных апластической анемией.
Критерии тяжёлой формы апластической анемии
Наследственная апластическая анемия с избирательным поражением эритропоэза (анемия Блекфена-Даймонда)
В периферической крови нормохромная макроцитарная гипо- или арегенераторная анемия (ретикулоциты 0-0,1 %), как правило, тяжелой степени. Число лейкоцитов и тромбоцитов остается на нормальном уровне в течение первых лет жизни; иногда отмечается тенденция к тромбоцитозу. При длительном течении заболевания может развиваться умеренная тромбоцитопения. После первого десятилетия жизни может также появиться умеренная нейтропения, вероятно, из-за снижения клональной эффективности предшественников гранулоцитов.
Биохимически отмечается высокий уровень активности эритроцитарной аденозиндезаминазы; уровень фетального гемоглобина нормальный или умеренно повышен; повышено содержание i-антигена в эритроцитах; увеличено содержание эритропоэтина в сыворотке.
В стернальном пунктате костный мозг нормоклеточный, по мере прогрессирования заболевания отмечается гипоклеточность. Эритроидный росток резко сужен; диагностическим критерием является отсутствие или малое количество эритробластов (менее 5 % ядросодержащих клеток) в костном мозге. Миелоидный и мегакариоцитарный ростки не изменены. Число ретикулярных клеток и лимфоцитов увеличено, плазматических клеток не изменено.
Анемия Блекфена-Даймонда протекает хронически, у 80 % больных получают ремиссию при использовании кортикостероидов; у 20 % больных описана спонтанная ремиссия. «Постоянная гипоксия, нарушение утилизации железа, необходимость по жизненным показаниям трансфузии эритроцитарной массы неуклонно ведут к гемосидерозу, который в дальнейшем является «убийцей» больного ребенка». Возможна трансформация в миелодиспластический синдром, острый лейкоз (лимфобластный, миелобластный, промиелоцитарный, мегакариоцитарный), солидные опухоли (гепатобластому, рстеосаркому, злокачественную фиброзную гистиоцитому), лимфогранулематоз.
Дифференциальный диагноз
Дифференциальный диагноз при анемии Блекфена-Даймонда проводится с другими видами анемий, при которых в периферической крови уменьшается количество ретикулоцитов.
Анемия в период выздоровления после гемолитической болезни новорожденных.
Иногда может сочетаться со снижением интенсивности эритропоэза. Апластические кризы, характеризующиеся ретикулоцитопенией и уменьшением числа предшественников эритроцитов, могут осложнять разные типы гемолитической болезни. Подобные эпизоды являются транзиторными, кроме того, обычно выявляются признаки предшествующей гемолитической болезни. Развитие апластических кризов связывают с В19-парвовирусной инфекцией. Тактика ведения больных, как правило, выжидательная: при значительном снижении уровня гемоглобина проводятся гемотрансфузии.
Транзиторная эритробластопения детского возраста
Вторичные (приобретенные) аплазии эритроидного ростка
Эпизоды острой недостаточности эритропоэза могут сопровождать целый ряд вирусных инфекций. При этом значительно снижается количество циркулирующих ретикулоцитов (менее 0,1 %) и повышается уровень железа в сыворотке. В костном мозге уменьшено число предшественников эритроцитов. Эти эпизоды, как правило, купируются и не оставляют каких-либо последствий. Наиболее часто вторичная аплазия эритроидного ростка вызывается парвовирусом В19.
У всех больных грудного возраста при диагностике эритробластопении необходимы следующие исследования:
Эти исследования могут помочь в дифференциации эритробластопении при инфицировании парвовирусом В19 и эритробластопении другого генеза.
Приобретенные апластические анемии
Клиника приобретенных апластических анемий отличается в зависимости от тотального или избирательного поражения гемопоэза. У больных приобретенными апластическими анемиями в отличие от наследственных форм отсутствуют врожденные аномалии развития, физическое и психическое развитие детей не изменено, костный возраст соответствует паспортному.
Для тотальных форм апластических анемий характерно сочетание геморрагического, анемического и инфекционно-септического синдромов. Геморрагический синдром, обусловленный тромбоцитопенией, выражен резко: множественные экхимозы и петехии на коже и слизистых оболочках, конъюнктивах, рецидивирующие носовые, десневые, маточные, желудочно-кишечные и почечные кровотечения, кровоизлияния в местах инъекций. Непосредственной причиной смерти у таких больных являются чаще всего кровоизлияния в жизненно важные органы. Поражение эритроидного ростка приводит к развитию анемического синдрома, при котором у больного отмечается общая слабость, снижение аппетита, головокружение, повышенная утомляемость, бледность кожи и слизистых оболочек, ногтевых фаланг, изменения со стороны сердечно-сосудистой системы: расширение границ сердца, приглушенность тонов, тахикардия, систолический шум различной интенсивности, возможна экстрасистолия, одышка. Наличие лейкогранулоцитопении обусловливает возникновение инфекционно-септического синдрома: легкое присоединение инфекций любой локализации, язвенно-некротическое поражение кожи, слизистых оболочек. Характерно тяжелое течение инфекций, вызванных не только патогенной флорой, но и условно-патогенными и грибковыми возбудителями. Лимфатические узлы, печень, селезенка не увеличены. При избирательном поражении эритроидного ростка имеются проявления лишь анемического синдрома.
Все симптомы болезни могут проявляться и нарастать более или менее остро.
Дифференциальный диагноз при приобретенных апластических анемий проводится преимущественно с острым лейкозом, мегалобластными анемиями, синдромом гиперспленизма, метастазами опухолей в костный мозг.