впр костной системы что это
Врожденные пороки развития верхних и нижних конечностей
Аномалии развития – это отклонения, которые не вкладываются в понятие «нормального» строения тела. Врожденные аномалии закладываются внутриутробно в период с 3 по 10 неделю беременности. Некоторые отклонения развиваются уже после рождения при росте органов.
В центре современной косметической ортопедии и травматологии Ладистен корректируются пороки развития конечностей разной природы у пациентов разного возраста.
Основные аномалии развития конечностей
Пороки развития конечностей имеют сложную и широкую классификацию. Их можно разделить на две большие группы:
Пороки формирования верхних конечностей
К аномалиям относятся любые отклонения в скелете плечевого пояса и рук.
Пороки нижних конечностей
Аномалии развития нижних конечностей аналогичны верхним. Врожденная аномалия нижних конечностей в МКБ- 10 занимает коды Q74.1- Q74.9.
Причины врождённых пороков развития конечностей
Аномалии развития конечностей у детей закладываются еще в утробе. К основным причинам относятся:
Точную причину удается выяснить не всегда, но эффективное лечение существует.
Профилактика
Пороки развития конечностей в основном являются врожденными дефектами. В качестве профилактики необходимо вести здоровый образ жизни, планово делать УЗИ для своевременного выявления патологии. Некоторые ситуации можно исправить еще в утробе. Питаться при беременности нужно сбалансированно, чтобы плод получал достаточно витаминов и микроэлементов для развития. Также важна экология и гигиена. Инфекции могут быть причиной дефектов.
Восстановление конечностей
Аномалии нижних конечностей подлежат исправлению с помощью современной хирургии. То же касается и рук: Ладистен предлагает многопрофильные реконструкционные операции для разных патологий. В каждом отдельном случае лечение индивидуально. Клиника использует все современные методики и возможности реконструкции. В том числе, проводятся операции с использованием микроскопа. Во время реконструкции конечность восстанавливается до максимально естественного анатомического вида. Возобновляется кровоток, сухожилия и нервные пучки.
Для пороков развития хирургия направлена на восстановление, балансирование длины, исправление дефектов. Если аномалия врожденная, лучше исправлять ее еще в детстве. Ребенок легче адаптируется к «новому» органу, учится его использовать и привыкает к нормальной жизни вместе со здоровым строением тела.
Источники
Пренатальная (дородовая) диагностика врожденной патологии плода
Рождение здорового ребенка – естественное желание каждой беременной женщины. Но, к сожалению, надежды на счастливое материнство не всегда оправдываются. Около 5% новорожденных имеют различные врожденные заболевания. Скрининг в 1 и во 2 триместрах беременности позволяет определить, насколько велик риск врожденной патологии у будущего ребенка.
В настоящее время существуют достаточно эффективные методы пренатальной (дородовой) диагностики многих заболеваний плода, которые можно выявить с 11 недели беременности. Своевременное проведение скрининговых обследований дает возможность определить большой спектр патологии плода и увидеть ультразвуковые признаки хромосомных аномалий.
Что такое ранний пренатальный скрининг и когда он проводится
Скрининг (от англ. «просеивание») – это совокупность исследований, позволяющих определить группы беременных, у которых существует риск рождения ребенка с хромосомными аномалиями и врожденными пороками. Но ранний скрининг – это только начальный, предварительный этап обследования, после которого женщинам, с выявленным риском врожденных аномалий, рекомендуется более детальное диагностическое обследование, которое точно подтвердит или исключит наличие патологии.
Что включает в себя ранний пренатальный скрининг
В комплексное обследование входят:
Полученные данные: анамнез, УЗИ и биохимические маркеры помещают в специально разработанную программу Astraia, которая рассчитывает риск рождения ребенка с врожденными аномалиями. Комбинация данных исследований увеличивает эффективность выявления плодов с синдромом Дауна и другими хромосомными заболеваниями.
Что такое программа Astraia
Astraia – это профессиональная программа, вычисляющая вероятность хромосомных аномалий у плода. Программа была разработана Фондом Медицины Плода (Fetal Medicine Foundation – FMF) в Лондоне и успешно апробирована на огромном клиническом материале во многих странах мира. Она постоянно совершенствуется под руководством ведущего специалиста в области пренатальной диагностики профессора Кипроса Николаидеса, в соответствии с последними мировыми достижениями в области медицины плода.
Специалист, проводящий ранний пренатальный скрининг, должен иметь международный сертификат FMF, дающий право на выполнение данной диагностики и работу с программой Astraia. Сертификат подтверждается ежегодно после статистического аудита проделанной за год работы и сдачи сертификационного экзамена. Таким образом обеспечивается высокая диагностическая точность полученных рисков.
Проведение раннего пренатального скрининга с помощью данной программы регламентировано приказом Министерства Здравоохранения РФ от 1 ноября 2012 г. № 572н «Об утверждении порядка оказания медицинской помощи по профилю «акушерство-гинекология» (за исключением использования вспомогательных репродуктивных технологий)».
Ранний пренатальный скрининг позволяет вычислить следующие риски:
Что оценивается при УЗИ в 1 триместре
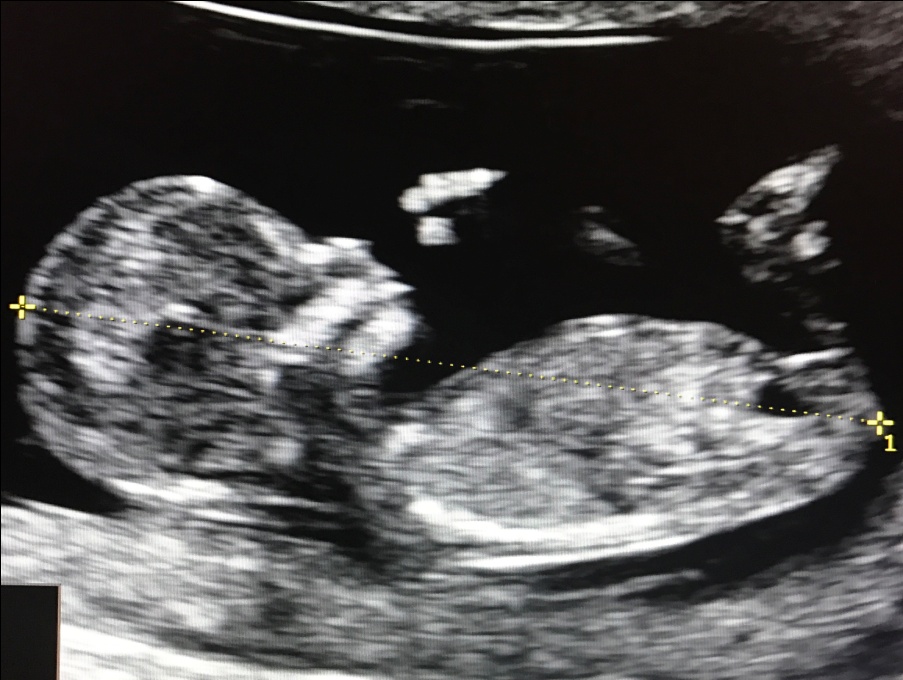
1. Копчико-теменной размер (КТР) плода
Правильное измерение КТР плода
2. Маркеры хромосомной патологии:
— толщина воротникового пространства (ТВП) – является основным признаком хромосомной патологии у плода. Патологической величиной считается увеличение ТВП больше 95-й процентили для каждого срока гестации. Каждое увеличение ТВП повышает риск существования хромосомной аномалии у плода.
ТВП в норме ТВР при патологии
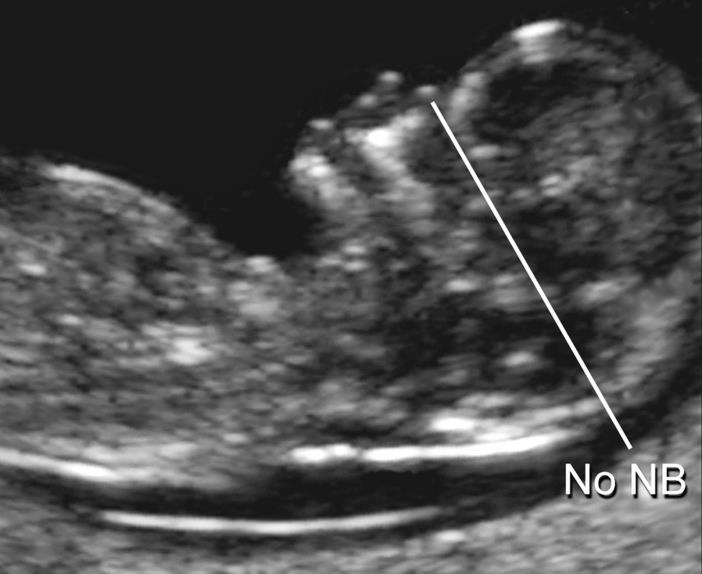
— носовая кость. У плодов с синдромом Дауна носовая кость может отсутствовать, либо быть уменьшенной (гипоплазированной). Очень редко такое может встречаться и у совершенно здоровых детей. Точный диагноз устанавливается только при помощи генетического анализа.
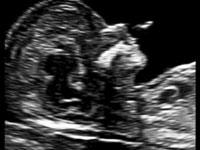
Нормальная носовая кость Отсутствие носовой кости
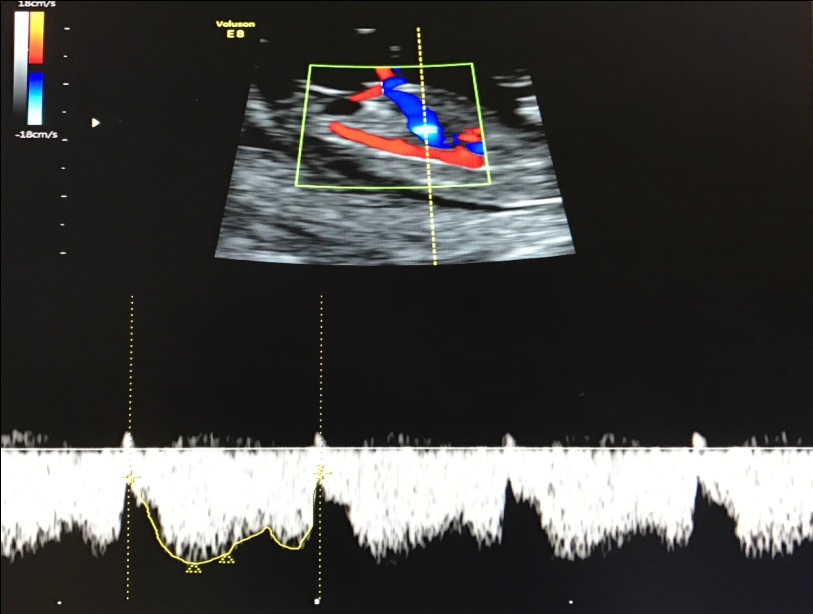
— кровоток в венозном протоке – это маленький сосуд в печени плода. При обратном (ретроградном) токе крови в данном сосуде можно предположить, что у плода хромосомный синдром, либо врожденный порок сердца.
Нормальный кровоток в венозном протоке
Но важно правильно получить этот кровоток и дать ему оценку. Для этого требуются определенные навыки и квалификация врача, которые подтверждаются ежегодной сертификацией FMF.
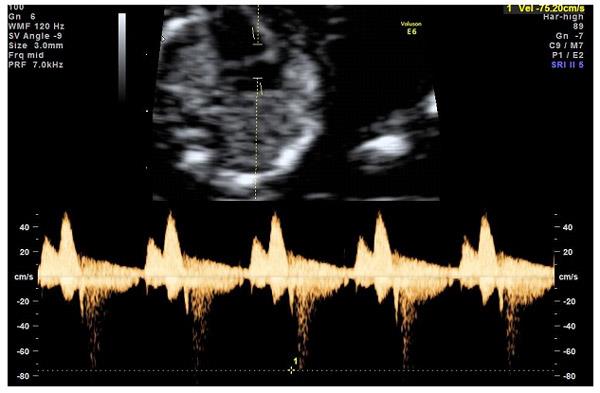
— кровоток через трикуспидальный клапан в сердце плода. Здесь ретроградный (обратный) кровоток тоже указывает на хромосомную патологию, либо может проявляться при врожденных пороках сердца.
3. Анатомические структуры плода и исключение крупных врожденных пороков
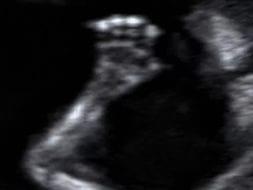
Ручка плода Мозг плода в виде “бабочки” в норме
4. Длина шейки матки
5. Стенки матки и придатков (яичников)
6. Кровоток в маточных артериях
УЗИ может проводиться как трансабдоминально, так и трансвагинально.
Что делать при высоком риске хромосомной патологии у плода
Если комплекс раннего пренатального обследования указывает на высокий риск врожденной патологии у плода, Вам будет рекомендована консультация генетика с последующей инвазивной диагностикой (биопсия ворсин хориона на сроке до 14 недель или амниоцентез, проводимый после 16 недель) и генетическим анализом. Именно генетический анализ точно определяет хромосомные заболевания и врожденные патологии у плода.
Что представляет собой скрининг во втором триместре беременности
Согласно приказу № 572н от 1.11.2012 г., второй скрининг состоит из ультразвукового исследования плода на сроке 18-21 неделя беременности. В этом возрасте кровь на биохимические маркеры уже не сдается. Плод имеет массу около 300-500 грамм и длину 20-25 см, и УЗИ позволяет детально проанализировать все анатомические структуры плода и выявить большинство пороков развития. Тогда же оценивается количество околоплодных вод, расположение и структура плаценты, длина шейки матки и др.
После проведения УЗИ на данных сроках беременности большинство вопросов пренатальной диагностики считаются закрытыми.
Надеемся, что эта информация поможет Вам лучше понять важность и необходимость скрининга в первом и втором триместрах беременности. В нашей клинике у Вас есть уникальная возможность пройти качественное обследование и получить максимально объективные данные о состоянии Вашего плода.
Скрининг на выявление врожденных заболеваний плода при беременности
Что собой представляет скрининг при беременности и зачем он проводится
Скрининг при беременности — это комплекс обследований, в который входят УЗИ и биохимический анализ венозной крови на гормоны. Как правило, скрининг проводят трижды — в первом, втором и третьем триместре.
Раннее обнаружение патологий имеет очень большое значение. Это дает возможность приступить к лечению генетических заболеваний как можно раньше и если не полностью вылечить их, то хотя бы максимально купировать симптомы. Если при обследовании врач замечает отклонения, беременность контролируется особенно тщательно, что дает возможность предупредить развитие осложнений или преждевременные роды. Если же обнаруженные патологии окажутся слишком тяжелыми и несовместимыми с жизнью, врач направит пациентку на прерывание беременности по медицинским показаниям.
Скрининг при беременности безвреден как для мамы, так и для малыша. Это довольно точное исследование, хотя следует четко понимать, что оно не дает стопроцентной гарантии. Точность скрининга зависит от многих факторов — профессионализма исследователей, соблюдения женщиной правил подготовки к обследованию и других факторов.
Первый скрининг при беременности
Первый скрининг при беременности проводят между и неделями. Нет смысла проходить это обследование ранее — до недели беременности многие показатели практически не поддаются определению.
Исследование включает в себя два медицинских теста — УЗИ и анализ крови.
При помощи УЗИ врач определяет точный срок беременности, оценивает телосложение ребенка, его размеры (окружность головы, длину конечностей, рост), работу сердечной мышцы, симметричность головного мозга, объем околоплодных вод, структуру и размер плаценты, а также состояние и тонус матки. Для каждого из этих параметров есть показатели нормы, с которыми врач и будет сравнивать полученные результаты. Для беременности эти нормы составляют:
Длина кости носа — 2–4,2 мм. Слишком маленькая кость носа может говорить о патологии или же просто о том, что нос у малыша будет курносым. ЧСС (частота сердечных сокращений) — 140–160 ударов в минуту. Небольшое (до 40 ударов в минуту) отклонение в ту или иную сторону считается вариантом нормы.
Размер хориона, амниона и желточного мешка. Хорион — это внешняя оболочка плода, которая со временем станет плацентой. Если он расположен на нижней стенке матки, говорят о предлежании хориона. Это потенциально опасная ситуация, чреватая выкидышем, и в этом случае беременной рекомендован постельный режим.
Амнион — внутренняя оболочка, которая удерживает околоплодные воды. Нормальный объем околоплодных вод на сроке 11–13 недель — 50–100 мл.
Желточный мешок — это зародышевый орган, который в первые недели жизни плода выполняет роль некоторых внутренних органов, которые будут сформированы позже. К сроку первого скрининга желточный мешок должен практически исчезнуть (тогда в бланке обследования будет указано «не визуализируется»). Если же размер его составляет около 6 мм, то, возможно, у плода присутствуют определенные патологии.
Шейка матки. В норме ее длина к моменту первого скрининга составляет 35–40 мм. Более короткая шейка матки означает риск преждевременных родов.
УЗИ проводят двумя способами — трансабдоминальным, при котором датчик располагается на животе, и трансвагинальным, при котором он вводится во влагалище. Трансвагинальное УЗИ дает более полную и точную информацию, но его обычно проводят только в первом триместре. Этот метод, как правило, используют при обследовании женщин с лишним весом, поскольку жировая прослойка в области живота не позволяет в деталях рассмотреть плод и матку.
К УЗИ необходимо соответствующим образом подготовиться. Перед трансабдоминальным УЗИ советуют выпить примерно литр воды, чтобы на момент обследования мочевой пузырь был заполнен — тогда матка немного сместится в сторону живота и картинка будет четче. При трансвагинальном УЗИ степень наполненности мочевого пузыря не имеет никакого значения, однако перед обследованием лучше зайти в туалет — так будет комфортнее. Перед исследованием нужно принять душ или освежиться при помощи влажных салфеток. Скопление газов способно исказить результаты УЗИ, каким бы методом оно ни проводилось. Поэтому будущим мамам, страдающим от метеоризма, советуют за день до обследования принимать средства от метеоризма и не есть ничего газообразующего.
Анализ крови
Чтобы анализ крови дал максимально точные сведения, его нужно сдавать на голодный желудок, как минимум через 8 часов после последнего приема пищи. За 2–3 дня до анализа следует воздерживаться от жареной, жирной, острой, копченой пищи, шоколада, орехов, морепродуктов. Рекомендуется также не вступать в половые контакты. Все это не столь значительно, однако может тем или иным образом повлиять на результат.
Второй скрининг при беременности
Второй скрининг при беременности проводят на сроке 16–20 недель. Как и первый, он состоит их тех же двух этапов — УЗИ и анализа крови.
На этот раз врач определяет не только размеры, но и положение плода и его костную структуру, состояние внутренних органов и место прикрепления пуповины, а также объем околоплодных вод. Вот приблизительные основные показатели нормы для срока 16–20 недель:
ИАЖ (индекс амниотической жидкости, то есть объем околоплодных вод) — 73–230 мм. Маловодие может негативно повлиять на состояние костной структуры ребенка и развитие его нервной системы.
Локализация плаценты. Некоторый риск есть лишь при расположении плаценты на передней стенке матки — при такой локализации возможно отслоение плаценты.
Пуповина. Один из важнейших параметров — место прикрепления пуповины. Краевое, расщепленное или оболочечное прикрепление чревато гипоксией плода и трудностями во время родов, нередко оно становится показанием для кесарева сечения. Пуповина подпитывается через 2 артерии и 1 вену, хотя иногда в наличии имеется только одна артерия. Это может вызвать гипоксию плода, порок сердца, нарушения в работе системы ребенка, стать причиной пониженной массы тела малыша. Впрочем, если все остальные анализы и обследования не показывают отклонений от нормы, волноваться не стоит.
Шейка матки. Длина шейки матки на этом сроке должна составлять 40–45 мм. Короткая шейка матки означает угрозу выкидыша.
Визуализация. Неудовлетворительная визуализация может быть вызвана как особенностями положения плода или лишним весом будущей мамы, так и отеками или гипертонусом матки.
Анализ крови
Третий скрининг при беременности
Третий скрининг при беременности проводят на 30- неделе. По результатам этого скрининга врач принимает решение о необходимости кесарева сечения или возможности естественных родов. Основа третьего скрининга — все те же УЗИ. Иногда назначают допплерографию — исследование работы сосудов. Вот приблизительные нормы для данного срока беременности:
Пренатальный скрининг очень важен, и пренебрегать им не стоит. Вовремя выявленные патологии и отклонения от нормы могут спасти жизнь и здоровье вашему ребенку. Об этом стоит помнить, особенно тем родителям, которые отказываются от обследования из страха узнать о том, что развитие малыша идет не по плану.
ГЕНЕТИЧЕСКИ ОБУСЛОВЛЕННЫЕ ВПР КОСТНО-МЫШЕЧНОЙ СИСТЕМЫ
Примерно 6% выявляемых врожденных аномалий обусловлены хромосомными нарушениями. Как правило, любой хромосомный дисбаланс, возникающий как в результате количественных (поли-, анеуплоидии), так и качественных изменений (структурные аберрации) хромосомного набора, приводит к множественным структурным дефектам и нарушениям развития.
Примерно 7% всех пороков составляют пороки генной природы. К настоящему времени известно, что врожденные пороки развития могут быть вызваны мутациями разных типов генов, например, генов, кодирующих факторы транскрипции, содержащие специфические нуклеотидные последовательности (мотивы), распознающие последовательности для ДНК-связывания.
Факторы транскрипции регулируют генную экспрессию и, таким образом, участвуют в контроле процессов развития. К формированию пороков могут приводить и мутации генов, кодирующих рецепторы, участвующие во взаимодействии клеток, а также мутации генов, кодирующих ферменты, транспортные молекулы, структурные белки.
Многочисленными исследованиями последних лет доказано, что большинство изолированных пороков развития возникает в результате взаимодействия генетических и средовых факторов. Пороки с такой сложной мультифакториальной этиологией составляют от 20 до 30% в общей группе пороков развития.
Системные ВПР костно-мышечной системы
Ахондроплазия
Этиология
Результат миссенс-мутации, сопровождаемой заменой глицина на аргинин в белке, ответственном за пролиферацию хрящей в суставах длинных костей. Мутации в гене FGFR3, кодирующем рецептор фактора роста фибробластов. Делеции участка хромосомы, на котором располагается FGFR3, при других заболеваниях не приводят к аномалиям скелета, характерным для ахондроплазии, что позволяет предположить усиление или приобретение функции при этом заболевании.
Ахондроплазия всегда встречается в гетерозиготной форме, поскольку гомозиготность по данному признаку летальна.
Патогенез
FGFR3 — трансмембранный рецептор тирозинкиназы, связывающийся с FGF. Связь FGF с внеклеточной областью FGFR3 активизирует внутриклеточный домен рецептора и запускает сигнальную последовательность. В эндохондральных костях активация FGFR3 тормозит пролиферацию хондроцитов в ростовой пластинке, таким образом помогая координировать рост и дифференцировку хондроцитов с ростом и дифференцировкой клеток-предшественниц кости. Связанные с ахондроплазией мутации FGFR3 — мутации усиления функции, вызывающие лиганднезависимую активацию белка FGFR3. Такая постоянная активизация белка FGFR3 неправильно тормозит пролиферацию хондроцитов в ростовой пластинке и приводит к укорочению длинных трубчатых костей, а также аномальному формированию других костей. Гуанин в позиции 1138 в гене FGFR3 — один из наиболее мутирующих нуклеотидов, идентифицированных во всех генах человека. Мутация этого нуклеотида встречается почти в 100% случаев ахондроплазии; при этом более 80% пациентов имеют новую мутацию. Новые мутации гуанина в 1138 положении гена FGFR3 происходят исключительно в отцовских половых клетках, и их частота увеличивается с возрастом отца (>35 лет).
Поражаются только кости, растущие по энхондральному типу: трубчатые кости, кости основания черепа и т. д. Кости свода черепа, растущие из соединительной ткани, достигают положенного размера, что приводит к несоответствию пропорций между головой и телом, а также становится причиной характерного изменения формы черепа.
Симптомы
У пациентов с ахондроплазией при рождении отмечают ризомиелическое укорочение рук и ног, сравнительно длинное и узкое туловище, кисти рук в форме трезубца и макроцефалию с гипоплазией средней трети лица и выступающим лбом. Рост при рождении обычно несколько меньше нормы, хотя и пределах нижней границы нормы; с возрастом рост таких детей прогрессивно отстаёт от нормальных величин.
В основном пациенты имеют нормальный интеллект, хотя большинство задержаны в моторном развитии. Эта задержка вызвана сочетанием мышечной гипотонии, гиперподвижными суставами (хотя локтевые суставы ограничены в разгибании и вращении), механическими затруднениями при удержании их большой головки и, реже, стенозом большого затылочного отверстия со сдавлением ствола мозга.
Лечение
Пожизненная медицинская помощь должна быть сфокусирована на предупреждении и лечении осложнений ахондроплазии. В младенчестве и раннем детстве пациентов следует проверять на хронический отит, гидроцефалию, сдавление ствола мозга и обструктивную асфиксию и при необходимости назначать лечение.
Лечение больных со сдавлением ствола мозга декомпрессией краниоцервикального соединения обычно приводит к значительному улучшению неврологических функций. В позднедетском и подростковом возрасте больных необходимо проверять на наличие симптомов сужения спинномозгового канала, варусной деформации ног, ожирения, стоматологических осложнений и хронического отита.
Лечение сужения спинномозгового канала обычно требует хирургической декомпрессии и стабилизации позвоночника.
Предупредить и лечить ожирение трудно, и это часто осложняет оказание помощи при обструктивной асфиксии и проблемах позвоночника и суставов.
Миопатия Дюшенна
Этиология
Вызванна мутацией в гене DMD, ответственном за синтез белка дистрофина (ген расположен в локусе Xq21). Наследование — Х-сцепленное рецессивное заболевание.
Патогенез
Ген DMD кодирует дистрофии, внутриклеточный белок, экспрессирующийся преимущественно в гладких, скелетных и сердечной мышце, а также в некоторых нейронах мозга. В скелетной мускулатуре дистрофии составляет часть большого комплекса связанных с сарколеммой белков, обеспечивающих устойчивость сарколеммы. Мутации в гене DMD включают крупные делеции (60-65%), крупные дупликации (5-10%) и небольшие делеции, инсерции или замены нуклеотидов (25-30%). Самые крупные делеции происходят в одной из двух горячих точек. Нуклеотидные замены встречаются по всему гену, преимущественно в динуклеотидах CpG. De novo мутации возникают со сравнимой частотой в ходе овогенеза и сперматогенеза; наиболее крупные делеции de novo возникают в овогенезе, тогда как большинство de novo нуклеотидных замен возникает в ходе сперматогенеза. Мутации, вызывающие фенотипическое отсутствие дистрофина, приводят к более тяжелому поражению мышц, чем мутантные аллели DMD, экспрессирующие частично функциональный дистрофии. Корреляции между генотипом и фенотипом для интеллектуального снижения не обнаружено.
Прогрессирующая миопатия начинается с мышц тазобедренного пояса и сгибателей шеи, мышечная слабость прогрессивно захватывает плечевой пояс и дистальные мышцы конечностей и туловища.
Симптомы, течение болезни
Обычно больных мальчиков диагностируют в возрасте от 3 до 5 лет при появлении аномалий походки. К 5 годам большинство пораженных детей используют приемы Говерса и имеют псевдогипертрофию мышц голеней, т.е. увеличение голеней вследствие замены мышц жировой и соединительной тканью. К возрасту 12 лет основная часть больных обездвижены в инвалидном кресле и имеют контрактуры и сколиоз.
Большинство пациентов умирают от нарушения легочной функции и пневмонии; средний возраст смерти — 18 лет.
Почти 95% больных миодистрофией Дюшенна имеют те или иные кардиологические отклонения (дилатационная кардиомиопатия или электрокардиографические аномалии), а 84% имеют видимые поражения мышцы сердца при вскрытии.
Хронические нарушения сердца бывают почти у 50% пациентов, изредка сердечная недостаточность вызывает у них жалобы. Хотя дистрофии также присутствует в гладких мышцах, гладкомышечные осложнения встречаются редко и включают расширение желудка, заворот кишок и гипотонию мочевого пузыря.
Больные миодистрофией Дюшенна имеют IQ примерно на 1 среднеквадратичное отклонение ниже обычного, и почти треть имеет ту или иную степень умственной отсталости. Причины этого не установлены.
Женщины с мышечной дистрофией Дюшенна
Возраст начала и тяжесть миодистрофии Дюшенна у женщин зависят от степени смещения инактивации Х-хромосомы. Если Х-хромосома, несущая мутантный аллель DMD, активна в большинстве клеток, у женщины развиваются признаки миодистрофии Дюшенна;
Если преимущественно активна Х-хромосома, несущая нормальный аллель DMD, женщины имеют только несколько или не имеют вообще симптомов данного заболевания. Независимо от того, есть ли у них клинические симптомы скелетной мышечной слабости, женщины-носительницы имеют отклонения в функции сердечной мышцы, например дилатационную кардиомиопатию, дилатацию левого желудочка и электрокардиографические изменения.
Лечение
В настоящее время излечение мышечной дистрофии Дюшенна невозможно, хотя улучшившееся симптоматическое лечение повысило средний срок жизни от конца детства до ранней зрелости. Цели терапии — замедлить развитие болезни, обеспечить мобильность, предотвратить или исправить контрактуры и сколиоз, контролировать массу тела и улучшить функции легких и сердца. Глюкокортикоидная терапия может замедлять развитие заболевания в течение нескольких лет. Исследуют несколько видов экспериментального лечения, включая генную передачу. Большинство больных нуждается также в расширенном консультировании, так как имеют дело с психологическими эффектами хронической фатальной болезни.
Болезнь Альберс-Шенберга
(Мраморная болезнь)
Этиология
Патогенез
Увеличение количества компактного вещества кости связано со способностью мезенхимы удерживать большее, чем в норме, количество солей. В зонах эндостального и энхондрального окостенения развивается избыточное количество склерозированной ткани.
Поражение челюстных костей сопровождается нарушением развития и прорезывания зубов. Влияние болезни на зубы выражается в замедлении развития, позднем прорезывании и изменении их строения. Зубы имеют недоразвитые корни, облитерированные полости зуба и каналы. Характерна высокая поражаемость зубов кариозным процессом.
Симптомы, течение болезни
Различают две формы мраморной болезни: проявляющуюся в раннем возрасте с резко выраженными симптомами и протекающую без видимых клинических проявлений и диагностируемую лишь при рентгенологическом исследовании.
Мраморная болезнь, как правило, проявляется в детском возрасте.
Симптомами, заставляющими больного обратиться к врачу, являются боли в конечностях, утомляемость при ходьбе. Возможно развитие деформаций и возникновения патологических переломов костей конечностей. При осмотре больного отклонений в физическом развитии не отмечают. При рентгенологическом исследовании обнаруживается, что все кости скелета (трубчатые, ребра, кости таза, основание черепа, тела позвонков) имеют резко уплотненную структуру.
Эпифизарные концы костей несколько утолщены и закруглены, метафизы булавовидно утолщены, внешняя форма и размеры костей не изменены.
Все кости плотны и совершенно не прозрачны для рентгеновского излучения, костномозговой канал отсутствует, кортикальный слой кости не выделяется. Особенно склерозированы кости основания черепа, таза, тела позвонков. В отдельных случаях в метафизарных отделах длинных трубчатых костей видны поперечные просветления, что придает им мраморный оттенок. Кости становятся менее упругими, ломкими.
Содержание фосфора и кальция в крови и моче не изменяется. Возможны изменения по типу гипохромной анемии. Следствием изменения строения костного скелета являются деформации лицевого и мозгового черепа, позвоночника, грудной клетки. При появлении гиперостоза скелета в первые годы жизни развивается гидроцефалия как следствие остеосклероза основания черепа; характерны низкий рост, позднее начало ходьбы, ослабление или потеря зрения вследствие сдавливания в костных каналах зрительных нервов, позднее появление островков окостенения эпифизов, задержка прорезывания зубов, которые нередко поражаются кариесом.
Лечение
Лучшие результаты лечения данного заболевания получены при попытках трансплантации костного мозга.
Лечение мраморной болезни проводится преимущественно в амбулаторных условиях. Оно направлено на укрепление нервно-мышечной системы. Назначают лечебную гимнастику, плавание, массаж. Рекомендуется полноценное питание, богатое витаминами (свежие овощи и фрукты, творог, натуральные фруктовые и овощные соки). Детей периодически направляют на санаторно-курортное лечение. Восстановить в клинических условиях нормальные процессы костеобразования не удается, т.к. патогенетическая терапия мраморной болезни пока не разработана. При развитии анемии проводят комплекс патогенетических мероприятий, направленных на ее устранение.
Изолированные ВПР костно-мышечной системы
2.2. Синдактилия
Генетические типы
Клиническая картина
При простой форме синдактилии различают базальную, субтотальную, тотальную и терминальную, а также кожную и костные формы. При базальной синдактилии пальцы соединены между собой складкой в виде перепонки, состоящей из двух листков кожи; движения в пальцах сохраняются в полном объеме, их развитие не нарушается. Кожная тотальная синдактилия представляет более тесное сращение пальцев без костных изменений, возможно только совместное движение пальцев. Терминальные формы подразумевают общий кожный покров и ногтевую пластинку в области дистальных фаланг пальцев. Функция страдает. Движения ограничены. Для костной синдактилии, кроме сращения мягких тканей, характерно сращение костей фаланг. Сложные формы синдактилии встречаются при сочетании с другими пороками развития конечности: поли- и олигодактилией, эктродактилией, афалангией с амниотическими перетяжками, брахидактилией и т.д.
Лечение
Все предложенные хирургические вмешательства можно разделить на следующие группы:
• кожная пластика местными тканями после рассечения сросшихся пальцев;
• свободная кожная пластика расщепленным или полнослойным кожным лоскутом;
• сочетание кожной пластики местными тканями со свободной пересадкой кожного аутотрансплантата.
2.2. Полидактилия
Полидактилия может наблюдаться при многих хромосомных и генных заболеваниях и скелетных дисплазиях.
По локализации полидактилию подразделяют на:
Радикальную – удвоение сегментов большого пальца.
Центральную – дупликация указательного, среднего и безымянного пальцев.
Ульнарную – удвоение мизинца.
По типу удвоения многопалость может представлять такие образования:
Рудимент – нефункциональный палец, состоящий из мягких тканей без костей и держащийся на кожной ножке.
Раздвоенный основной палец – образующийся вследствие удвоения кости (плюсневой или пястной), почти всегда имеющий меньшее число фаланг и являющийся недоразвитым.
Полноценный добавочный палец – имеющий нормальную форму и размеры.
Этиология
Изучена не до конца. Однако достоверно установлено, что самой распространенной причиной является наследственность. Семейный тип наследования полидактилии – аутосомно-доминантный с неполной пенетрантностью, т.е. носителями мутационного гена может быть один из родителей – мать или отец, но при этом оба они могут быть здоровыми. Тем не менее, вероятность унаследования аномалии составляет порядка 50%. По другой версии полидактилия является одним из симптомов генных синдромов (Эллиса-Ван Кревельда, Меккеля, Лоренса-Муна-Барде-Бидля и др.) и сложных хромосомных синдромов (например, синдрома Патау). Всего генетика насчитывает около 120 синдромов, которые могут сопровождаться полидактилией.
Лечение
Только хирургическое. Если добавочный палец висит на тонкой ножке, целесообразно его удалить в первые недели жизни ребенка. При нормально сформированном добавочном пальце, удвоении фаланг возникают трудности в решении вопроса об анатомической и функциональной неполноценности удаляемого пальца или сегмента. Хирургическое вмешательство рационально к концу первого года жизни ребенка, что создает возможность нормального роста и развития остальных пальцев кисти.
2.3. Синдром Клиппеля-Фейля
Этиология
Генетические аберрации гетерогенны. При KFS1 они затрагивают локус q22.1 8-й хромосомы, при KFS2 находятся в локусе q22.1 5-й хромосомы, при KFS3 — в локусе q13.31 12-й хромосомы. Наиболее изученным является ген GDF6, ответственный за возникновение KFS1. Мутации в этом гене приводят к нарушению синтеза белка, участвующего в формировании костно-суставного аппарата путем создания разграничения между отдельными костями. В зависимости от типа синдром Клиппеля-Фейля имеет различный механизм наследования: для KFS1 и KFS3 он аутосомно-доминантный, для KFS2 — аутосомно-рецессивный.
Патогенез
Аномалия развивается в результате нарушения васкуляризации, сегментации, аплазии, гипоплазии, задержки слияния парной закладки позвонков в эмбриональном и фетальном периодах. Сформировавшиеся синостозы шейных, а иногда и верхних грудных позвонков, уменьшение числа шейных позвонков до 4-5, несращение дуг и тел позвонков определяют клиническую картину и тяжесть деформации при данном синдроме.
Клинические формы
Первый тип — KFS1 — характеризуется уменьшенным количеством шейных позвонков. В норме у человека в шейном отделе 7 позвонков, при KFS1 обычно 4-5.
Второй тип — KFS2 — синостоз всех позвонков шейного отдела, их спаянность с затылочной костью и верхнегрудными позвонками.
Третий тип — KFS3 — представляет собой комбинацию первого или второго со сращением позвонков в нижнем грудном и поясничном отделах. Зачастую в шейном отделе наблюдаются добавочные ребра и spina bifida — незаращение позвонковых дужек.
Симптомы
Основной клинической триадой, характеризующей синдром Клиппеля-Фейля, выступает укорочение шеи, смещение границы роста волос вниз по задней поверхности шеи, нарушение подвижности позвоночника в шейном отделе. Выраженность укорочения шеи может варьировать, в наиболее тяжелом варианте мочки ушей достают плеч, а подбородок — грудины, затруднено глотание и дыхание. Характерно широкое разведение лопаток и зачастую их укорочение. Может наблюдаться типичное для болезни Шпренгеля высокое стояние одной из лопаток. В ряде случаев отмечаются аномалии мускулатуры плечевого пояса и складки на шее. В редких случаях возникает корешковый синдром — боли, связанные со сдавлением шейных спинномозговых корешков.
В 50-60% случаев синдром Клиппеля-Фейля сочетается со сколиозом, в 25% случаев — с костным вариантом кривошеи. Возможно сочетание синдрома короткой шеи с аномалиями верхних конечностей (полидактилией, синдактилией, врожденными ампутациями), деформацией стоп, пороками ребер, аномалиями зубов, асимметрией лица, дальнозоркостью. У 45% пациентов диагностируется дистопия, аплазия или гипоплазия почек, возможен гидронефроз, эктопия мочеточников. У 25% больных выявляется врожденная глухота, у 20% — волчья пасть, у 15% — врожденные пороки сердца (открытый артериальный проток, ДМЖП, ДМПП, декстрапозиция аорты). Может наблюдаться аплазия или гипоплазия легких.
Со стороны нервной системы бывает олигофрения (умственная отсталость), эпилепсия, гидроцефалия, спинно-мозговая грыжа, микроцефалия, глазодвигательные расстройства (косоглазие, птоз, синдром Горнера). С раннего возраста характерна мышечная слабость в конечностях и синкинезии — непроизвольные одновременные движения обеих рук, чаще только кистей. Со временем могут возникать спастические и вялые пара- и тетрапарезы.
Лечение
Осуществляются преимущественно консервативные лечебные мероприятия, направленные на предупреждение развития деформаций позвоночника и увеличение объема движений в шее. Проводят массаж шейного отдела и воротниковой зоны, плечевого пояса и верхних конечностей. Рекомендованы регулярные занятия лечебной физкультурой. Возможно применение физиотерапии. По показаниям проводят симптоматическое лечение нарушений в работе соматических органов. При корешковых болях назначают анальгетики, ношение воротника Шанца.
Стойкий болевой синдром, обусловленный компрессией корешков верхними ребрами, является показанием к проведению операции.
Хирургическое вмешательство проводится согласно технике Бонола и представляет собой т. н. цервикализацию путем резекции верхних 4-х ребер. Доступ осуществляют через паравертебральный разрез, идущий параллельно внутреннему краю лопатки. Операция выполняется в 2-этапа, отдельно на каждой стороне.
Сам по себе синдром Клиппеля-Фейля имеет благоприятный витальный прогноз. Наличие пороков развития соматических органов значительно осложняет ситуацию и может выступать причиной преждевременной смерти. В функциональном отношении прогноз неблагоприятный, несмотря на проводимые консервативные мероприятия, у пациентов сохраняется выраженное ограничение движений головой, степень которого зависит от типа и тяжести синдрома. Течение заболевания может усугубиться происходящими в позвоночнике дегенеративными изменениями.
Список использованной литературы: