вокруг раны покраснение что значит
Первые симптомы нагноения ран: почему это опасно
Любая колотая, рубленная, рванная и резанная рана может осложниться процессом нагноения. Даже если вы порезали ножом палец на кухне, не стоит думать, что это пустяк, потому что недостаточно обработанная рана может загноиться. Первые симптомы нагноения ран следует знать каждому по той причине, что эту проблему в большинстве случаев приходиться решать исключительно хирургическим путем.
Особенно эта проблема актуальна для тех, кто перенес какую-либо операцию, и после реабилитации выписался домой. Если дома не осуществляется уход за послеоперационными швами так, как предписал врач, то, при попадании инфекции, может начаться нагноение. Вопреки общепринятому мнению пациентов, нагноения после операций начинаются не из-за условий во время операции, а именно по вине пациентов, которые безответственно подходят к назначениям врача, оказавшись в домашних условиях.
Во время операции принципиально соблюдение абсолютной стерильности, и этот принцип никогда не нарушается. Врачи медицинского центра Ейска «Сенситив» рекомендуют всегда полностью выполнять назначения, которые они делают, чтобы избежать подобных серьезных осложнений.
Как развивается процесс нагноения раны
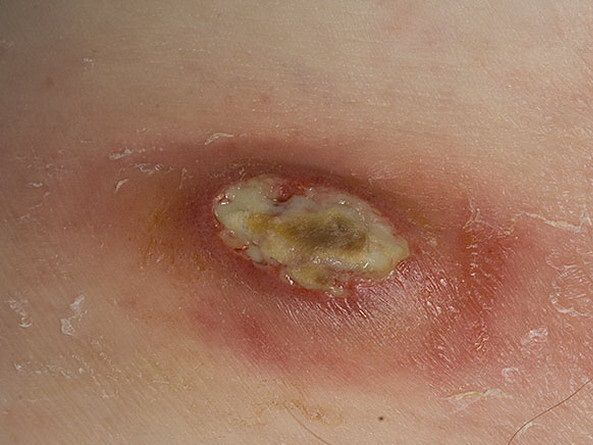
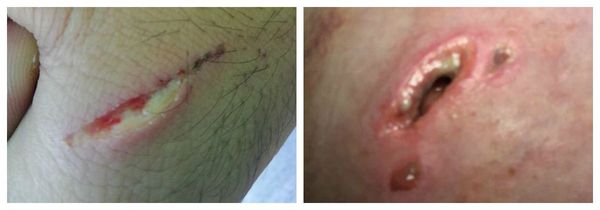
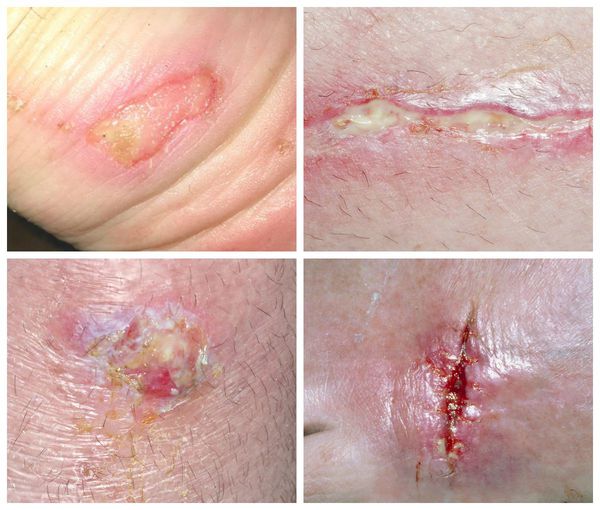
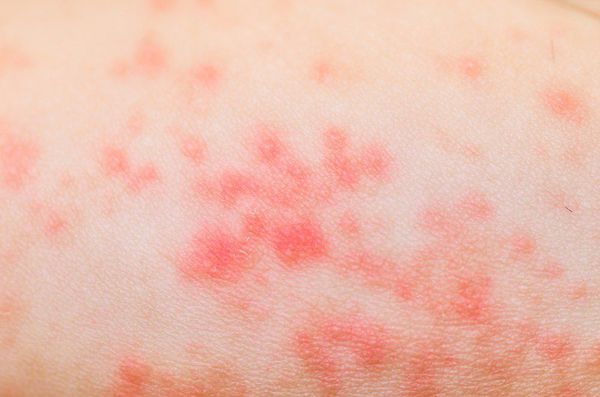
Обычно нагноение начинается при инфицировании чистой раны, развивается отек вокруг раны, некроз тканей и появляются гнойные выделения. Если вокруг раны началось покраснение, которое сопровождается дергающей болью, усиливающейся по ночам, то это значит, что вы имеете дело с первым симптомом нагноения раны, и требуется принять срочные меры.
При осмотре раны видны омертвевшие ткани, выделение гноя. Ситуация опасна тем, что продукты распада всасываются организмом, и это приводит к нарастающей интоксикации организма. В результате появляются следующие симптомы:
Причины нагноения ран
Любая рана, маленькая или большая, считается инфицированной, потому что в нее в любом случае попадают бактерии. Однако, это далеко не всегда приводит к нагноению. Для того, чтобы развился этот деструктивный процесс тканей, требуются дополнительные условия:
Поэтому первые симптомы нагноения раны могут появиться даже после обычной занозы при условии, что ее частичка останется в ткани тела, и при этом на самом инородном теле будут патогенные микроорганизмы. К последним относятся те, которые ответственны за развитие гнойного процесса: стафилококки, стрептококки, кишечная палочка и подобные им микроорганизмы.
Помимо этого велик риск нагноения в том случае, когда у пациента в анамнезе сахарный диабет, сосудистые и соматические заболевания, лишний вес и пожилой возраст.
Характер раны также имеет значение для развития этого процесса. Так, колотая рана может загноиться по причине слишком узкого раневого канала из-за чего нет нормального оттока. В том случае, когда рана сопровождается размозжением окружающих тканей, нагноение происходит по причине слишком большого количества мертвых тканей в ране и обильного загрязнения. При этом быстрее и лучше заживают раны на голове и шее, а хуже всего – на стопах ног.
Лечение нагноений ран
Первые симптомы нагноения раны должны насторожить и заставить обратиться к врачу незамедлительно по той причине, что существует опасность серьезных осложнений, которые несут угрозу жизни. Самое тяжелое осложнение – сепсис, при развитии которого человек может умереть. Также могут начаться деструктивные процессы в лимфоузлах, сосудах и других органах.
Проще всего победить эту патологию на ранних стадиях. Для этого хирург проводит очищение раны, принимает меры к ограничению процесса воспаления. Проводится детоксикация и медикаментозное лечение процессов, начавшихся в результате активности патогенных микроорганизмов.
Что такое гнойная рана? Причины возникновения, диагностику и методы лечения разберем в статье доктора Богданова Сергея Геннадьевича, детского хирурга со стажем в 9 лет.
Определение болезни. Причины заболевания
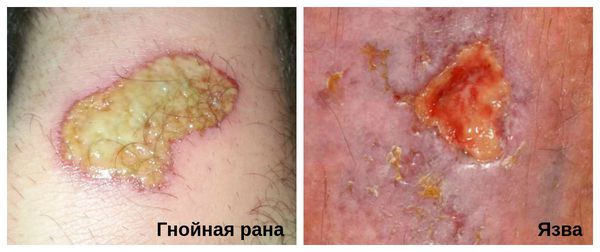
Гнойная рана — это рана, в которой развивается инфекционный процесс, так как защитные силы организма не справляются с микробами, попавшими в неё. Иначе такую рану называют инфицированной. Она сопровождается симптомами воспаления: болью, покраснением, скоплением крови и лимфы в окружающих тканей, а также наличием гнойного отделяемого с неприятным запахом.
Те или иные повреждения человек получает практически ежедневно, однако риск инфицирования зависит от условий получения раны и от состояния иммунной системы человека. Например, при операционных ранах риски инфицирования крайне малы, так как человек получает их практически в стерильных условиях. Наиболее высокий риск занесения инфекции отмечается при ранах, полученных во время работы с землёй, строительства или при чрезвычайных происшествиях (авариях, падениях с высоты).
Важную роль в развитии инфекции в ране играют такие факторы как пол, возраст и наличие сопутствующей патологии (например, сахарного диабета):
Заведомо инфицированными считаются укушенные и хронические раны (существующие более трёх недель). Чаще всего встречаются укусы насекомых, но на первом месте по обращаемости за медицинской помощью стоят укусы кошек и собак.
Операционные раны считаются чистыми, однако при вскрытии абсцессов и ли фурункулов рана автоматически становится контаминированной, т. е. обсеменённой патогенными микроорганизмами.
Также развитию раневой инфекции способствуют:
Симптомы гнойной раны
Клиническая картина гнойной раны складывается из двух групп симптомов: общих и местных. Выраженность проявлений зависит от многих причин, таких как обширность и характер поражения, состояние защитных сил организма и свойств возбудителя инфекции.
К общим симптомам можно отнести : головную боль, слабость, вялость, быструю утомляемость, учащение пульса, озноб, увеличение температуры тела, потерю аппетита, повышенную возбудимость. Степень выраженности данной группы симптомов зависит от тяжести интоксикации.
К местным симптомам гнойной раны относятся :
Боль — неотъемлемый симптом любого ранения. Её интенсивность зависит от степени раздражения болевых рецепторов. Сильная боль способна вызвать паралич центральной нервной системы с последующим развитием шокового состояния. Поэтому вторым по важности компонентом оказания помощи (после кровотечения) является обезболивание пациента.
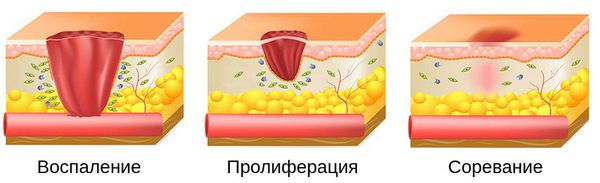
Патогенез гнойной раны
Процесс заживления раны делится на три этапа :
Развитие всех фаз заживления раны занимает в среднем от 8 до 12 месяцев.
Основой патогенеза гнойной раны является инфицирование повреждения. Его развитие зависит следующих факторов:
Классификация и стадии развития гнойной раны
Также раны делятся:
Непосредственно гнойные раны подразделяют на два типа:
Осложнения гнойной раны
Наиболее грозными осложнениями являются эндотоксикоз, инфекционно-токсический шок и сепсис.
Инфекционно-токсический шок — это острая недостаточность кровообращения, связанная с распространением инфекции в организме. Она является наиболее частой причиной летальности. Сопровождается резким уменьшением капиллярного кровотока, тяжёлыми метаболическими расстройствами, гипоксией и нарушением работы внутренних органов.
Основные симптомы инфекционно-токсического шока:
Сепсис — это генерализованная воспалительная реакция. Она возникает из-за неспособности организма поддерживать нормальную работу внутренних органов и систем. При этом начинают преобладать деструктивные эффекты медиаторов воспаления (интерлейкинов, цитокинов и туморнекротического фактора). Нарушаются процессы иммунного ответа: клетки иммунной системы начинают «атаковать» клетки собственного организма, в связи с чем формируются очаги системного воспаления, развивается моно- и полиорганная недостаточность.
В отличие от инфекционно-токсического шока, который развивается молниеносно, для сепсиса характерно более длительное течение. Клинически он характеризуется вариабельностью симптомов. Одними из его главных признаков является гипертермия: температура колеблется в пределах 39-40°C. К другим характерным симптомам относятся:
Нарушается работа желудочно-кишечного тракта, что проявляется отсутствием аппетита, рвотой и диареей. Постепенно развивается токсический гепатит, который проявляется нарушением обменных процессов в печени и задержкой выведения из организма продуктов распада. Со стороны органов мочевыделительной системы наблюдается снижение объёма мочи.
Диагностика гнойной раны
Диагноз инфицир ованной раны ставится на основании следующих клинических проявлений:
При появлении данных признаков необходимо незамедлительно обратиться к врачу.
Хроническую инфицированную рану необходимо отличить от язвы. В отличии от раны, язва является более глубоким дефектом кожных покровов, при котором происходит потеря ткани.
Лечение гнойной раны
Лечение инфицированной раны должно быть незамедлительным. Оно требует комплексного подхода, т. е. должно воздействовать как на рану, так и на организм в целом.
Для борьбы с возбудителем раневой инфекции применяют:
В первые сутки чаще всего назначают эмпирическую антибактериальную терапию (амоксициллин/клавулановая кислота, ципрофлоксацин). Затем терапия корректируется в зависимости от результатов бактериальных посевов, учитывая чувствительность выявленной инфекции к антибиотикам. Помимо антибактериальных препаратов пациентам назначают бактериофаги (вирусы, избирательно убивающие бактериальные клетки).
Также в случае гнойной раны может потребоваться комплексная детоксикация ор ганизма :
Симптоматическая терапия включает в себя купирование боли и коррекцию повреждённых органов и систем.
Существует несколько методов озонотерапии. К наиболее применяемым в лечении гнойных ран относят:
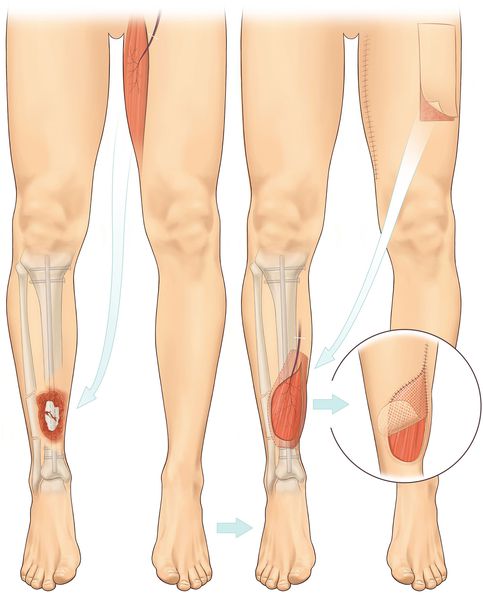
Кожно-пластические операции применяются:
Выбор метода кожной пластики осуществляется с учётом вида и локализации раны, индивидуальных особенностей пациента, состояния окружающей кожи и характера тканей.
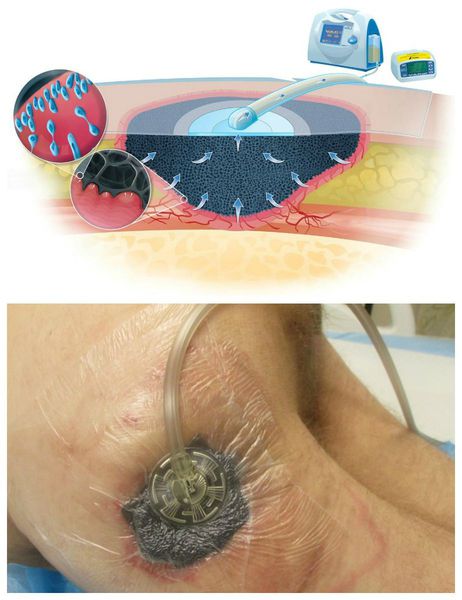
Вакуум-терапия проводится следующим образом:
Противопоказания к вакуум-терапии:
Прогноз. Профилактика
Для профилактики гнойных ран рекомендуется избегать травмоопасных ситуаций, близких контактов с животными, соблюдать технику безопасности во время строительных и садовых работ.
Первая помощь при термических ожогах
Термические ожоги кожи: как оценить степень поражения
По статистике, большая часть ожогов происходит в бытовых условиях и вызвана воздействием пламени, кипятка, горячего пара или раскаленных предметов. И – увы! – их нередко получают дети. Именно поэтому каждый взрослый человек должен ориентироваться в определении степени ожогов, так как от этого зависит выбор способа оказания первой помощи, метода дальнейшего лечения ожога и оценка необходимости во врачебной (в том числе, стационарной) помощи.
Итак, в связи с тем, что при термических ожогах (в отличие от химических ожогов и ожогов глаз) определить их степень достаточно легко, это должен уметь делать каждый человек. Для начала следует, по возможности, уточнить у пострадавшего или окружающих, что произошло, для того, чтобы убедиться в том, что у пострадавшего именно термический ожог, затем осмотреть пораженную поверхность и оценить площадь ожога и степень.
Выделяют 4 степени ожога:
1. Первая степень: покраснение и отек кожи в месте термического ожога. Возможно появление мелких пузырей с прозрачным содержимым.
2. Вторая степень: покраснение и отек кожи в месте термического ожога, а также напряженные или вскрывшиеся пузыри и тонкий струп, который начинает формироваться.
3. Третья степень. При третьей степени термического повреждения имеется глубокий ожог до мышц и костей с формированием струпа. Пузыри при третьей степени, как правило, уже лопнувшие. При этом вокруг зоны глубокого ожога могут быть мелкие пузыри с прозрачным содержимым (вторая степень ожога), покраснение (первая степень ожога).
4. Четвертая степень. При четвертой степени ожога происходит обугливание обожженной части тела. Возможно комбинирование четвертой степени с первой, второй и третьей.
То есть, у одного пострадавшего могут быть ожоги разной степени. При этом тяжесть состояния пострадавшего оценивают по наиболее глубоким ожогам в зависимости от площади пораженной поверхности.
Термические ожоги кожи: как оценить площадь поражения
Уметь определять площадь термического ожога крайне важно – это позволяет выбрать правильную тактику лечения и порой даже спасти жизнь пострадавшему. Один из самых простых способов оценки площади ожога – «правило ладони». Площадь ладони человека составляет в среднем 1% площади его тела. Так, с помощью ладони можно определить, сколько процентов тела поражено.
Существует также правило «девятки» для взрослых: рука, половина ноги, половина спины, грудь, живот, голова – по 9%, и промежность – 1%. Но у детей голова с шеей составляет около 21% площади тела.
Термические ожоги кожи: как выбрать правильную стратегию оказания первой помощи.
При поверхностных термических ожогах более 10% площади тела взрослых (у детей – более 5%) и при более глубоких ожогах от 5% тела взрослого человека (соответственно, более 2,5% тела ребенка) после оказания первой помощи требуется обязательная врачебная помощь с последующей госпитализацией. Такие ожога приводят к нарушению общего состояния, угрожают жизни пострадавшего и в последующем могут потребовать оперативного вмешательства.
Кроме этих случаев, обязательной госпитализации подлежат пострадавшие с глубокими ожогами кистей рук и стоп и поверхностными обширными ожогами кистей рук и стоп, с ожогами глаз, ушей, лица и промежности, а также с предполагаемыми ожогами дыхательных путей из-за вдыхания крайне горячего воздуха.
Термические ожоги кожи: как оказать первую помощь
Алгоритм оказания само- и взаимопомощи при любых термических ожогах кожи таков:
— Немедленно погасить пламя на одежде и коже пострадавшего, для чего накрыть его тканью (это приведет к прекращению поступления воздуха), или сбросить горящую одежду. Можно погасить пылающий участок одежды, забросав его землей, песком или снегом, облив водой или опустив в воду.
— Успокоить пострадавшего и окружающих.
— Осторожно снять с пострадавшего тлеющие остатки одежды, которые не зафиксировались в ране. Запрещено отдирать от раны прилипшие остатки одежды. Прикасаться к обожженной поверхности руками тоже нельзя.
— При солнечных ожогах следует просто перенести пострадавшего в тень.
— Если вы не знаете, что произошло, кратко и быстро уточнить обстоятельства («ребенок вылил на себя чашку горячего бульона», «загорелась одежда от пламени костра»).
— Держать в течение 10-20 минут пораженную поверхность тела под струей проточной холодной воды (можно в емкости с чистой прохладной водой). Это необходимо для того, чтобы предупредить дальнейшее углубление и расширение раны за счет нагрева обожженной зоны. Также это улучшит кровообращение в ране. Но ни в коем случае нельзя использовать для охлаждения зоны ожога лед, так как, помимо имеющегося ожога, у пострадавшего возникнет дополнительная травма – обморожение. В экстремальных случаях (при полном отсутствии проточной воды) возможно охлаждение раны с помощью мочи, но в реальной жизни поводов для применения этого способа практически никогда не бывает.
— На обожженную поверхность нанести Солкосерил® гель, затем наложить сверху сухую стерильную повязку. Ни в коем случае не использовать вату: можно применять только бинт, марлю – тканевые материалы. Если нет поблизости ни одного средства для экстренной помощи при ожогах и стерильных бинтов нет, нужно просто наложить чистую сухую повязку. Запрещается наносить на обожженную кожу мази, кремы, растительное масло, взбитое яйцо, сметану, кефир, спиртовые растворы и прочие средства, а также прикладывать к ране листья алоэ, сок каланхоэ, золотой ус и прочие. При легких ожогах первой степени без обширного повреждения кожи и пузырей можно не накладывать повязку, а только нанести гель.
— При обширных ожогах рук и ног надо зафиксировать конечность с помощью шины или подручных средств и придать конечности возвышенное положение.
— При обширных ожогах и при возникновении признаков ожогового шока (бледность, слабость, беспокойство, холодный пот, тахикардия, падение артериального давления, нарушение сердечной деятельности и дыхания) дать пострадавшему пить много жидкости – чистую воду, чай, компот. Жидкость уменьшает интоксикацию, которая возникает из-за всасывания в кровь продуктов распада обожженной кожи, подкожной клетчатки, мышц.
— При сильных болях для предупреждения болевого шока пострадавшему дают любое обезболивающее средство (анальгин, парацетамол и пр.).
— Приступить к проведению сердечно-легочной реанимации (искусственному дыханию и непрямому массажу сердца) при отсутствии у пострадавшего дыхательной и (или) сердечной деятельности.
— При показаниях для госпитализации вызвать «Скорую помощь» или доставить пострадавшего в лечебное учреждение. Лучше все же воспользоваться услугами «Скорой помощи», так как обычно мы не знаем, в каком отделении какой больницы производят лечение ожогов. По возможности, это должна быть специализированная клиника или специализированное отделение.
Когда можно лечить термические ожоги кожи в домашних условия.
Далеко не все ожоги требуют дальнейшего лечения в стационаре и даже поликлинике. В домашних условиях самостоятельно можно лечить поверхностные небольшие ожоги без инфицирования (без красных отечных краев раны, без гнойного отделяемого из раны, повышения температуры тела, озноба, усиления болей в ране, появления дергающих болей в ране и т.д.).
Взрослым можно начинать лечить дома ожоги площадью до 1% тела (размером с ладонь этого человека), если только это не обширные ожоги кисти, стопы, лица, половых органов. Это важно знать, так как при заживлении могут образовываться рубцы, которые нарушат функцию этих частей тела. В домашних условиях можно лечить только неинфицированные ожоги кисти, стопы или лица (размером приблизительно с монету).
Следует помнить о том, что в случае длительно незаживающего ожога, особенно нижних конечностей при сопутствующей нервно-сосудистой патологии ног, углублении раны, появлении гнойного отделяемого, неприятного запаха из раны, при усилении болей и нарушении общего состояния следует обязательно обратиться к хирургу поликлиники.
Любые ожоги у новорожденных требуют врачебной помощи и, как правило, лечения в стационаре.
Если в рану во время ожога попала земля, или ожог был получен на природе, следует в тот же день обратиться в любой травмпункт или к хирургу поликлиники, чтобы сделать прививку от столбняка – опасного инфекционного заболевания. Хорошо, если врач еще и обработает эту ожоговую поверхность. В дальнейшем можно будет продолжать лечение в домашних условиях.
Что необходимо приготовить для лечения ожогов в домашних условиях
— Стерильный бинт – 1-2 упаковки в день (размер и объем – в зависимости от площади ожога).
— Средство для обработки рук (антисептик).
— Стерильные медицинские перчатки – 1 пара перчаток на одну перевязку.
— Перекись водорода (3%-раствор) – 1-2 флакона на перевязку.
— Спиртовые растворы йода или бриллиантового зеленого (так называемая «зеленка») – 1 флакон.
— Ватные палочки – 1 упаковка.
— Тампоны из марли (для обработки раны) – их можно сделать самостоятельно из стерильного бинта, надев стерильные перчатки. Хранят их в упаковке от стерильного бинта. Лучше готовить новые тампоны из марли перед каждой перевязкой.
— Пластырь (иногда бывает необходим для фиксации повязки к неповрежденной коже).
Как лечить термические ожоги кожи в домашних условиях
Внимание! Нельзя самостоятельно вскрывать ожоговые пузыри и использовать вату и пластырь при обработке раневой поверхности. Максимум, что допустимо – наполненный содержимым плотный пузырь можно осторожно надрезать по одному из краев стерильным лезвием или проколоть стерильной иглой.
Перевязки (обработку ожога) производят 1- 2 раза в день. Предварительно надо подготовить все материалы и обработать руки того, кто будет это делать. Если была наложена повязка, следует ее снять. Если внутренняя часть повязки зафиксировалась на ране, смочить ее 3%-ной перекисью водорода и дождаться ее отделения от раны.
Неповрежденную кожу вокруг раны необходимо обработать раствором йода или бриллиантового зеленого, а на рану нанести препарат, который улучшит питание тканей и активизирует заживление раны.
ФЛЕГМОНЫ И АБСЦЕССЫ — современные возможности лечения
В чем трудность лечения флегмон и абсцессов? Почему нецелесообразно применять мази на вазелиново-ланолиновой основе? Какие местные препараты соответствуют современным представлениям о лечении флегмон и абсцессов? Несмотря на активное внедрение
В чем трудность лечения флегмон и абсцессов?
Почему нецелесообразно применять мази на вазелиново-ланолиновой основе?
Какие местные препараты соответствуют современным представлениям о лечении флегмон и абсцессов?
Несмотря на активное внедрение в клиническую практику новых групп антибиотиков, проблема профилактики и лечения гнойно-септических осложнений в хирургии по-прежнему актуальна. Так, согласно литературным данным, частота гнойно-воспалительных осложнений после грыжесечений достигает 28,3%, после резекций желудка — 28,4%, холецистэктомий — 32%, аппендэктомий — 40,4%, панкреатитов — 50% (Прискарь В. И., 1999).
Летальность при перитоните колеблется от 16 до 80% (Даценко Б. М. с соавт., 1998, Гельфанд Б. М. с соавт., 1999, Камзакова Н. И., 2000).
В структуре внутрибольничных инфекций послеоперационные инфекции составляют 12,2%, а постинъекционные инфекции — 17%. Необходимо отметить, что процент тяжелых последствий внутрибольничных инфекций практически одинаков для хирургических стационаров и амбулаторно-поликлинических учреждений — 15,2% и 15,6% соответственно.
Особую тревогу вызывают случаи запоздалой диагностики осложненного течения абсцессов или флегмон. Так, например, в зависимости от локализации первичного гнойного процесса могут формироваться тяжелые гнойные артриты (после внутрисуставного введения гормональных, обезболивающих препаратов), тромбофлебиты (после внутрисосудистого введения различных лекарственных средств) с последующей генерализацией инфекционного процесса, с формированием гнойных очагов во внутренних органах (в сердце, легких, почках).
Ретроспективный анализ тяжелых абсцессов и флегмон, осложнившихся сепсисом после длительного консервативного или недостаточно активного хирургического вмешательства, показывает, что одной из основных причин возникновения осложнений можно считать недостаточное внимание к ранней диагностике формирующихся абсцессов и флегмон различной локализации, предполагающей использование современных неинвазивных методов исследования (ультразвука, компьютерной томографии), а также инвазивных диагностических методов, и прежде всего диагностической пункции области инфильтрата. Особую тревогу вызывает так называемая выжидательная тактика, когда, выполнив диагностическую пункцию и удалив некоторое количество гноя, хирурги пытаются дренировать гнойную полость с помощью резиновой трубки и назначают какой-либо антибактериальный препарат.
Радикальные оперативные вмешательства на уже сформированном гнойном очаге выполняются слишком поздно, дренирование послеоперационной раны бывает, как правило, неадекватным.
Кроме того, не уделяется должного внимания проблеме асептики и антисептики при оказании помощи пострадавшим, а также при выполнении различных диагностических и лечебных манипуляций как на амбулаторно-поликлиническом, так и стационарном этапах лечения. Использование традиционных антисептиков в данных ситуациях, к сожалению, не предупреждает развитие инфекционного процесса, так как проблема устойчивости микроорганизмов в равной степени актуальна как для группы антибактериальных препаратов, так и для традиционных антисептиков.
К примеру, чувствительность S.aureus, E.coli, B.fragilis к раствору фурациллина составляет менее 3, 1 и 3% соответственно. Массивность контаминации P.aeruginosa в растворе фурациллина может достигать 106 КОЕ/мл. Частота контаминации раствора фурациллина грибами достигает 58%.
В табл. 1 приводится далеко не полный перечень традиционных препаратов, от которых необходимо отказаться полностью и которые, тем не менее, используются как в домашних условиях, так и в медицинских учреждениях.
В данном сообщении приводится анализ результатов лечения 166 больных с постинъекционными флегмонами и абсцессами в специализированном отделении ран и раневой инфекции Института хирургии им. А. В. Вишневского РАМН. Больных, как правило, переводили из других хирургических стационаров ввиду прогрессирующего нарастания клиники интоксикации, с полиорганной недостаточностью, с сепсисом.
Возраст пациентов колебался от 18 до 84 лет. 124 больных были в возрасте от 30 до 60 лет. Длительность лечения на предыдущем этапе от начала формирования гнойного процесса составляла от 12 суток до 1,5 месяцев.
Сопутствующие заболевания: гипертоническая болезнь — 46 больных, остеохондроз тазобедренных суставов — 31 пациент, пояснично-крестцовый радикулит — 27 больных, почечная колика — 16 и другие заболевания — 46.
Гнойно-воспалительные процессы возникали после введения обезболивающих препаратов (анальгина, баралгина), гипотензивных (папаверина с дибазолом, магнезии), гормональных препаратов, кордиамина, масляных растворов витаминов, кокарбоксилазы и др.
Инфекционный процесс в 139 случаях возникал после инъекций, выполненных медицинскими работниками (бригады «скорой помощи», процедурные и хирургические кабинеты поликлиник, стационары). В остальных 27 случаях препараты вводились в домашних условиях не медицинскими работниками. Локализация абсцессов: в подавляющем большинстве случаев — это места внутримышечных инъекций (ягодичные области, реже — предплечья и места паранефральных, паравертебральных блокад).
 |
| Рис. 1 |
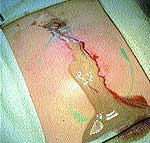
При первичном обращении больного за помощью по месту жительства в случае появления первых признаков формирования воспалительного процесса в качестве препаратов первой помощи использовались 3%-ный раствор йода («йодная сетка»), компрессы со спиртом, мазью Вишневского, ихтиоловой мазью. Консервативное медикаментозное лечение с подключением физиотерапевтических методов иногда продолжалось до 2–3 недель (рис. 1).
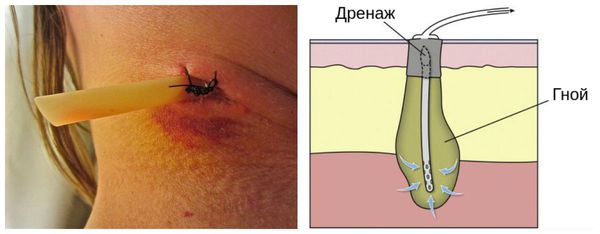
В дальнейшем, уже в условиях хирургических стационаров после хирургического вмешательства, послеоперационные раны тампонировались либо марлевыми тампонами, пропитанными 10%-ным раствором хлорида натрия, мазью Вишневского, раствором фурациллина, либо с дренирующей целью в раны устанавливались перчаточные резинки или резиновые трубки.
Такой метод лечения быстро приводил к распространению гнойного процесса за пределы первичной локализации, нарастанию интоксикации, развитию сепсиса.
Ввиду неэффективности лечения после развития септического состояния больные переводились для дальнейшего лечения в специализированное отделение гнойной хирургии им. А. В. Вишневского.
При поступлении практически все больные сразу помещались в блок интенсивной терапии отделения гнойной хирургии, где они получали необходимую пред- и послеоперационную корригирующую медикаментозную терапию.
В Институте хирургии им. А. В. Вишневского РАМН разработан метод активного хирургического лечения гнойных ран, основанный на следующих принципах:
Использование вышеперечисленных дополнительных методов воздействия на раневую поверхность позволяет уменьшить обсемененность раневой поверхности патогенной флорой до уровня ниже «критического» — с 10 7-9 до 10 2-3 микробных тел в 1 г ткани раны.
Клинические примеры закрытия ран с помощью швов, дренирования и окончательный результат приведены на рис. 2, 3, 4.
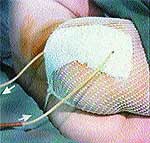 |
| Рис. 3 |
Во время поступления больного в отделение, а также в процессе лечения (во время перевязок, при повторных хирургических обработках ран, перед окончательным закрытием ран) проводятся бактериологические исследования видового состава ран. Результаты представлены в табл. 2.
Как видно из табл. 2, в подавляющем большинстве случаев из ран была выделена грамположительная микрофлора и в единичных случаях — ассоциация грамположительных и грамотрицательных микроорганизмов. Обращает на себя внимание достаточно большое число случаев выявления в ранах неклостридиальной анаэробной инфекции.
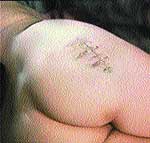 |
| Рис. 4 |
Все штаммы, выделенные из послеоперационных ран больных, ранее прооперированных в других лечебных учреждениях, были полирезистентны к традиционно используемым антибактериальным препаратам, что указывает на госпитальную принадлежность инфекции.
С учетом видового характера выделяемой из ран микрофлоры и чувствительности ее к антибактериальным препаратам назначались общая и местная антибактериальная терапии.
Наиболее часто (38,5%) использовались полусинтетические пенициллины (карбенициллин, ампиокс, диклоксациллин), в 15,7% случаев — аминогликозиды (гентамицин, тобрамицин, сизомицин, нетилмицин), в 12,5% — фторхинолоны (офлоксацин, пефлоксацин, ципрофлоксан), в 10,3% — цефалоспорины (цефотаксим, цефтазидим, цефтриаксон).
При обнаружении гнойно-воспалительного процесса, вызванного неклостридиальной анаэробной инфекцией (27 больных — 16,3%), как правило, назначалась комбинированная антибактериальная терапия — метронидазол с гентамицином или нетилмицином либо клиндамицин с гентамицином или нетилмицином. В последние годы в подобных ситуациях препаратом выбора считается имипенем, позволяющий активно воздействовать как на аэробный, так и анаэробный компонент микрофлоры ран. При локальном гнойном процессе, в случае выявления чувствительности стафилококков к фузидину, назначение этого препарата в комплексном лечении было также оправданно.
Выбор антисептиков, используемых для промывания ран
Как уже было сказано, использование раствора фурациллина в настоящее время нецелесообразно ввиду его крайне низкой антимикробной активности. В настоящее время перспективными можно считать растворы диоксидина, мирамистина, фурагина растворимого.
Прежде всего, очень важно следить за чистотой не только самой раны, но и окружающей рану кожи.
При выборе кожных антисептиков, используемых как с профилактической, так и лечебной целью, предпочтение отдается препаратам с универсальным, широким или умеренным спектром действия, активным против смешанной микрофлоры и обладающим микробоцидным или микробостатическим действием.
1%-ный йодовидон, 1%-ный йодопирон — йодофоры, представляющие собой комплекс поливинилпиролидона с йодом. Различия между этими препаратами связаны со способом их получения, а также разной молекулярной массой поливинилпиролидона. Растворы йодовидона более стабильны при хранении, чем растворы йодопирона, готовящиеся обычно ex tempore. По степени бактерицидного действия эти препараты практически идентичны.
Сульйодопирон представляет собой пенистую жидкость, которая предназначена для мытья грязных инфицированных ран, лечения ран под повязкой, обработки рук хирурга и операционного поля. Сульйодопирон при местном применении оказывает бактерицидное действие.
Бактерицидный эффект при микробной нагрузке 106-107 бактерий на 1 мл среды наступает в течение 1-4 минут, превосходя по этим показателям растворы йодопирона.
1%-ный диоксидин обладает выраженной активностью против большинства аэробных, анаэробных и факультативно анаэробных патогенных бактерий.
К диоксидину чувствительны клинические штаммы бактерий с полирезистентностью к антибиотикам. Препарат используется для промывания и тампонирования гнойных ран, а также может вводиться внутривенно, внутриартериально, интратрахеально через катетер или ингаляционно, внутриплеврально, в брюшную полость через ирригаторы.
Наш 20-летний опыт применения диоксидина в комплексном лечении больных с сепсисом, перитонитом, медиастинитом, с развернутой клиникой интоксикации, прогрессирующей полиорганной недостаточностью не подтверждает мнение некоторых специалистов о высокой токсичности этого препарата. Строгое соблюдение правил введения, разовых, суточных и курсовых доз позволяет избежать таких нежелательных побочных явлений, как тошнота, рвота или судороги.
0,1%-ный фурагин (солафур) — антимикробное средство из группы нитрофуранов. Препарат преимущественно действует на грамположительную микрофлору. Его МПК в 10-20 раз ниже, чем у фурациллина. Используется либо внутривенно при тяжелых формах течения раневой инфекции, при инфекционном процессе в легких, органах мочевыводящих путей, либо местно в виде 0,1%-ного раствора при лечении ран, инфицированных стафилококками, а также для промывания мочевого пузыря.
0,01%-ный мирамистин (миристамидопропилдиметилбензиламмоний хлорид) — новый антисептик из группы катионных ПАВ.
0,01%-ный водный раствор мирамистина с профилактической и лечебной целью используется в хирургии, травматологии и комбустиологии при незначительном количестве гнойного отделяемого в ране. Препаратом орошают поверхность ран и ожогов, рыхло тампонируют раны и свищевые ходы, марлевыми тампонами, смоченными антисептиком, промывают брюшную полость, вводят в плевральную полость и мочевой пузырь.
При обильной гнойной экссудации использование марлевых тампонов с растворами антисептиков для местного лечения ран неоправданно, так как тампоны, помещаемые в рану, быстро высыхают и, следовательно, не обладают необходимой для удаления гноя длительной осмотической активностью. В крайнем случае, рана может заполняться комбинированным тампоном — в центр марлевого тампона помещается силиконовая трубка, через которую 2-3 раза в сутки шприцем в рану вводится антисептик по 10-20 мл. Вместо 10%-ного раствора хлорида натрия для тампонирования послеоперационных ран в настоящее время используются современные мази на водорастворимой основе, высокую клиническую значимость которых можно считать доказанной.
Возможности использования мазей
К сожалению, до сих пор в ряде клиник используются мази на жировой основе с антибиотиками: линимент синтомицина, тетрациклиновая, эритромициновая и др. Однако мази на жировой основе с антибиотиками оказывают только кратковременное действие, поскольку вазелин-ланолиновая основа нарушает отток раневого отделяемого, не обеспечивает достаточного высвобождения активного ингредиента из композиции, не способствует проникновению антибиотика в глубь тканей, где находятся микробы, что приводит к переходу острых воспалительных заболеваний в хронические. Ввиду формирования в стационарах высокорезистентных штаммов микроорганизмов практически полностью утратили свою клиническую значимость и ихтиоловая мазь, и мазь Вишневского.
В последние годы в клиническую практику лечения гнойных ран в первой фазе раневого процесса внедрены новые мази — на полиэтиленоксидной основе (комбинации полиэтиленоксидов с молекулярным весом 400 и 1500).
Полиэтиленоксиды являются производными окиси этилена и обладают низкой токсичностью и выраженными осмотическими свойствами. При создании препаратов для лечения гнойных ран чаще всего используются полиэтиленоксид с молекулярным весом 400 (ПЭО-400) и полиэтиленоксид с молекулярным весом 1500 (ПЭО-1500).
В гнойной ране ПЭГ-1500 активно связывает воспалительный экссудат, отдавая его в повязку, с которой жидкость испаряется, а освободившиеся молекулы ПЭГ-1500 вновь присоединяют к себе экссудат, накапливающийся на дне раны.
Более мелкие молекулы (ПЭГ- 400) способны проникать в глубь тканей. Образуя с антибиотиком комплекс, ПЭГ-400 проводит его в ткани раны, где локализуются микробы. Этим он принципиально отличается от мазей на ланолин-вазелиновой основе, которые способны оказывать антимикробное действие только кратковременно и только на поверхности раны.
В состав современных мазей на полиэтиленоксидной основе введены различные антимикробные препараты:
Кроме того, в состав мазей введены такие препараты, как тримекаин, имеющий обезболивающий эффект, и метилурацил, обладающий анаболической и антикатаболической активностью, в целях стимуляции процессов клеточной регенерации.
Все мази на основе ПЭО отличаются от традиционных препаратов прежде всего многонаправленностью действия — осмотический эффект наблюдается до 18 часов, что позволяет делать перевязки только один раз в сутки, в то время как при использовании 10%-ного хлорида натрия повторные перевязки необходимо выполнять через каждые 3-4 часа, в противном случае повязка, пропитанная раствором и раневым отделяемым, полностью теряет осмотическую способность.
Еще одно преимущество мазей на полиэтиленоксидной основе — это широкий спектр антимикробной активности.
Причем по эффективности воздействия в силу однотипности мазевой основы все мази практически равноценны. При создании новых мазей особое внимание уделялось их антибактериальной активности. А. В. Вишневский по этому поводу писал: «Мы интересуемся силой, степенью бактерицидных свойств мази, ибо снизить, сбить, уничтожить инфекцию в ране всегда является задачей необходимой и благодарной» (Вишневский А. В., 1937).
Антимикробная активность новых мазей в отношении S.aureus находится на уровне 86-97,3%, Е. coil — 71-97%, Р.aeruginosa — 64-90,8%, Proteus spp. — 76-100%.
Для подавления в ранах грамотрицательных бактерий, в частности синегнойной палочки, широко применяется 10%-ная мазь мафенида-ацетата на гидрофильной основе.
Несмотря на интенсивное применение мазей, содержащих левомицетин или диоксидин, их высокая антимикробная активность сохраняется на протяжении более 20 лет, что указывает на слабый процесс нарастания резистентности госпитальных штаммов.
С внедрением полиэтиленгликолевой основы в технологию создания новых лекарственных форм появилась возможность создать мази с нитрофурановыми соединениями. На их основе выпускаются две мази: 0,5%-ная мазь хинифурила, а также фурагель, где в качестве основы использован сополимер акриловой кислоты (СОКАП) и ПЭГ-400.
Новые отечественные мази, содержащие нитрофурановые соединения, показывают высокую клиническую и бактериологическую эффективность. Так, фурагель более активен (94%) при наличии в ране S.aureus и менее активен (79%) при Р.aeruginosa. Maзь хинифурила одинаково высоко активна при наличии в ране грамположительной и грамотрицательной микрофлоры (87-88%). Оба препарата хорошо переносятся даже в случае их длительного использования при лечении трофических язв. Применение сополимера акриловой кислоты с полиэтиленгликолем в различных весовых соотношениях в качестве мазевой основы позволяет регулировать осмотическую активность мази как в сторону ее повышения, так и снижения, что очень важно при переходе раневого процесса во вторую фазу и необходимости продолжения лечения раны под повязкой.
Клиническая эффективность 1%-ной йодопироновой мази и многокомпонентной йодсодержащей мази (йодметриксилена) в качестве лечебного средства составляет 92,6-93,4%. Бактериологическая активность этих двух препаратов была одинаково высокой (91,8-92,6%) в отношении всех основных возбудителей острых гнойных процессов мягких тканей. Побочные эффекты (клинически значимые) наблюдались в 0,7% случаев и клинически незначимые — в 2,3% случаев. Следует особо подчеркнуть высокую эффективность этих препаратов при лечении ран с грибковым поражением, что часто наблюдается у больных ослабленных, с обширными ожоговыми ранами, трофическими язвами, пролежнями.
В настоящее время в клиническую практику внедрены только зарубежные йодсодержащие мази (повидон-йод и бетадин), хотя отечественный аналог был разработан более десяти лет назад.
Установлено, что уровень обсемененности ран аэробной микрофлорой при лечении мазями на ПЭГ-основе опускается «ниже критического» к 3-5-м суткам. Появление грануляций в среднем достигается к 4-м суткам, начало эпителизации — к 5-м.
Широкий спектр антимикробной активности мазей на полиэтиленгликолевой основе, их высокая и длительная осмотическая активность позволяют более чем в 80% случаев в течение 4-5 суток купировать острый гнойный процесс и закончить лечение неосложненных гнойных ран мягких тканей наложением первично-отсроченных швов, тогда как при использовании гипертонического раствора хлорида натрия в 90% случаев только в конце 2-3-й недели лечения под прикрытием системной антибактериальной терапии удается закрыть рану путем наложения вторичных швов.
Для лечения неспорогенной анаэробной инфекции наряду с диоксидином перспективные возможности открылись после изучения препарата нитазола, показавшего высокое антибактериальное действие на стафилококки, стрептококки, кишечную палочку, аэробные спорообразующие бактерии, патогенные анаэробные микроорганизмы как клостридиальные, так и неклостридиальные в виде монокультур и микробных ассоциаций. По спектру антибактериального действия нитазол имеет преимущества перед метронидазолом, к которому нечувствительны стафилококки, кишечная палочка, стрептококки. Нитазол оказывает противовоспалительное действие, являясь нестероидным противовоспалительным средством.
На основе нитазола были созданы пенообразующий аэрозоль «Нитазол» и две многокомпонентные мази «Стрептонитол» и «Нитацид». По антимикробной активности стрептонитол и нитацид значительно превосходят зарубежный препарат «Клион» (Венгрия), в состав которого входит метронидазол. Осмотическая активность стрептонитола гораздо ниже, чем у нитацида, что обусловлено введением в его состав вазелинового масла с водой. И стрептонитол, и нитацид, созданные для лечения ран с неклостридиальной анаэробной инфекцией, обладают равнозначным широким спектром антимикробной активности как в отношении грамположительной, так и грамотрицательной микрофлоры (84,2-88,5%). Обращает на себя внимание высокая активность этих препаратов при наличии в ране Р.aeruginosa (86,3-91,1%). Обе позиции показывают хорошую клиническую эффективность при наличии в ране анаэробной инфекции (88-89%).
Различие в осмотической активности позволяет использовать эти препараты ступенчато — сначала нитацид (с высокой осмотической активностью), затем стрептонитол.
Специалисты, занимающиеся лечением гнойных ран, хорошо знают, что бывают ситуации, когда одного скальпеля для полного удаления некротических тканей недостаточно: необходимы протеолитические препараты.
В настоящее время доказана высокая клиническая эффективность комплексного ферментного препарата «Протогентин», содержащего фермент природного происхождения «протеаза С» с протеолитическим действием, антибиотики (гентамицин и эритромицин), консерванты.
Мазевая основа препарата состоит из полиэтиленоксида с вазелиновым маслом. Умеренная осмотическая активность обеспечивает удаление из раны гноя.
Протогентин, наиболее активный в отношении P.aeruginosa и Е.coli, подавляет рост 83,4-90,4% штаммов.
Антимикробные компоненты мази «Протогентин» хорошо проникают под струп раны, вследствие чего в тканях раны создаются концентрации, намного превышающие МПК.
Достаточная осмотическая активность, широкий спектр антимикробной активности, хорошие фармакокинетические свойства протогентина способствуют сокращению сроков некролизиса. Мазевая основа не повреждает грануляционную ткань, что позволяет использовать этот препарат в течение длительного времени, пока требуется ферментативная очистка раневой поверхности.
После очищения раны от гнойно-некротического содержимого и достижения ее бактериологической санации наступает вторая фаза раневого процесса. Этот период характеризуется появлением в ране островков грануляционной ткани, которая, развиваясь, покрывает раневую поверхность полностью. Здоровая грануляционная ткань всегда яркая, сочная, легко кровоточит. При малейшем ухудшении процессов биосинтеза в ране изменяется внешний вид грануляций: они теряют яркую окраску, становятся мелкими, покрываются слизистым налетом. Одной из причин такого осложнения считается суперинфекция. Всякое замедление развития грануляций ведет к задержке и остановке процесса эпителизации.
Большое значение для скорейшего заживления ран во второй фазе имеет способность препаратов, используемых для местного лечения, оказывать бактерицидное действие в целях предупреждения вторичной инфекции, защитить грануляционную ткань от механических повреждений, а также оказывать умеренное влагопоглощающее действие и стимулировать рост грануляций.
Оптимальный вариант — сочетание этих факторов в одном препарате. К таким препаратам относятся современные комбинированные мази на регулируемой осмотической основе: метилдиоксилин, стрептонитол, а также пенные аэрозоли «Cульйодовизоль», «Гипозоль-АН», раневые покрытия на основе натриево-кальциевой соли альгиновой кислоты, масла, аэрозоли, гидроколлоидные покрытия (табл. 3).
Мазь «Метилдиоксилин» — многокомпонентная мазь, содержит диоксидин, метилурацил и гидрофобную эмульсионную основу с наличием касторового масла. Композиция винилина с эмульгатором и ПЭГ-400 в качестве основы мази позволила снизить осмотическую активность этого препарата до такого уровня, чтобы новая мазь не пересушивала молодую грануляционную ткань.
Мазь «Стрептонитол» содержит антибактериальные вещества стрептоцид и нитазол на гидрофильной эмульсионной основе, которая оказывает слабое осмотическое действие, удаляя избыток влаги, и одновременно защищает грануляционную ткань от механических повреждений. Препарат показан для лечения во второй фазе воспаления ранее инфицированных анаэробной, грамположительной и грамотрицательной микрофлорой ран при наличии ярких сочных грануляций.
Аэрозоли
На переходном этапе первой фазы раневого процесса во вторую высокую клиническую эффективность показывают современные пено- и пленкообразующие аэрозоли. Пенные препараты в аэрозольной упаковке перспективны для профилактики и лечения гнойных осложнений. Это обусловлено тем, что пены создают барьер для инфицирования ран, они не обладают «парниковым эффектом»; небольшим количеством препарата в составе пены можно покрывать большие по площади раневые поверхности и заполнять объемные раневые каналы и «карманы». Преимуществом аэрозольной формы является быстрота обработки, что важно при массовом поступлении пострадавших. Аппликации пен атравматичны.
В настоящее время создан ряд пенных препаратов:
В состав современных пенных препаратов обязательно входит какое-нибудь антимикробное средство, действующее на аэробную или на анаэробную микрофлору, включая неклостридиальную (бактероиды, пептококки, пептострептококки). Чаще всего используются диоксидин, йодовидон, циминаль и нитазол. Исследования антибактериальных свойств этих препаратов на моделях гнойных ран, вызванных анаэробной инфекцией, показывают выраженный терапевтический эффект, заключающийся в снижении высеваемости бактерий из ран к 3-5-му дню лечения до 10 1-2 микробов на 1 г ткани, уменьшении отечности и гиперемии, прекращении гнойной экссудации и в дальнейшем в заживлении ран.
Цимезоль кроме антисептика циминаля содержит анестетик тримекаин и гемостатик — порошок окисленной целлюлозы. Антисептическое действие циминаля усиливается благодаря сочетанию с димексидом и 1,2-пропилен-гликолем, которые обеспечивают проникновение циминаля в зоны некрозов и умеренный осмотический эффект.
Диоксизоль приготовлен на высокоосмотичной основе, а дегидратирующее действие диоксипласта сведено до минимума. Это определяет их применение соответственно в первой и во второй фазах раневого процесса при отсутствии в ранах большого количества гнойного отделяемого. Изучение антимикробной активности нового аэрозоля-диоксизоля показало преимущество этого препарата в случае выявления в ранах грамотрицательной микрофлоры. Диоксизоль подавляет Ps.aeruginosa в 92,5%.
Сульйодовизоль — пенообразующий аэрозольный препарат, расширяет возможности лечения ран йодовидоном в хирургии. Препарат показан для лечения ран во второй фазе раневого процесса, ранее инфицированных грамположительной и грамотрицательной аэробной микрофлорой.
Широкие клинические исследования показали необходимость использования пенообразующих аэрозолей только при отсутствии выраженного гнойно-воспалительного процесса на этапах подготовки раны к ее закрытию швами или методом пластики.
Масла
В настоящее время для лечения ран широко используются различные масла, в том числе и растительного происхождения (масло облепихи, масло шиповника, просяное масло — милиацил). Первые публикации о применении с этой целью различных масел относятся к эпохе Возрождения (Джованни де Виго, 1460-1520, Ambroslse Pare, 1510-1590).
Сравнительные экспериментальные исследования показали, что просяное масло прежде всего обладает более широким антимикробным спектром действия по сравнению с маслом шиповника или облепихи.
Просяное масло (милиацил) имеет высокое кислотное число (151,5-178,3), обусловленное большим содержанием свободных, ненасыщенных жирных кислот (олеиновой, линолевой, линоленовой). Этим объясняются стерильность препарата и его достаточный антимикробный эффект. Кроме того, входящее в состав просяного масла сложное стероидное соединение — пентациклический тритерпеноид — милиацин — обладает анаболическим действием и является стабилизатором мембран. Стабилизируя лизосомальные мембраны, милиацин предохраняет их от действия мембраноповреждающих факторов, например токсинов. В связи с этим уменьшается активность катепсинов, кислых РНК-азы и ДНК-азы, что приводит к уменьшению экссудации ткани, гипоксии, деполяризации РНК и ДНК.
Раневые покрытия
Широкие возможности в местном медикаментозном лечении ран открылись с появлением различных раневых покрытий, обладающих такими ценными качествами, как антимикробная активность, способность надежно предупреждать реинфицирование раневой поверхности, способность обеспечивать локальный гемостаз, ускорять образование грануляций, эпидермиса и активно поглощать раневой экссудат. Кроме того, современные раневые покрытия активно стимулируют образование грануляций и эпидермиса. При смене повязок эти препараты не вызывают болезненных ощущений. При длительном нахождении раневых покрытий на ране не возникает неприятного запаха.
В целях стимуляции процессов регенерации в ране наиболее широко используются перевязочные средства на основе производных белков и полисахаридов. С учетом специфического воздействия коллагеновых соединений на репаративные процессы в ране, а также данных по эффективности полисахаридных соединений с позиций создания оптимальных условий для формирования грануляционной ткани и миграции эпителиальных клеток разработаны раневые покрытия на основе белково-полисахаридных комплексов и их композиций с лекарственными препаратами. В качестве полисахаридных соединений использованы растительный полисахарид (альгинат натрия) и полисахарид животного происхождения (хитозан).
Биологически активные стимулирующие раневые покрытия
Биологически активные стимулирующие раневые покрытия с антимикробным и местно-анестезирующим действием выпускаются в четырех вариантах:
Перечисленные раневые покрытия благотворно влияют на течение регенераторных процессов в ране. Коллаген-альгинатные покрытия стимулируют рост грануляционной ткани, а коллаген-хитозановые — рост эпителиальных клеток.
В последние годы наибольшее распространение получили препараты на основе альгиновой кислоты и коллагена.
На основе смешанного натриево-кальциевой альгиновой кислоты созданы полифункциональные влагопоглощающие препараты для местного лечения ран во второй фазе (альгипор, альгимаф).
Стимулирующие раневые покрытия хорошо моделируются на различных участках тела, обеспечивают нормальный парообмен в ране, сорбируют избыток раневого экссудата, обладают пролонгированным антимикробным и обезболивающим действием, создают влажную среду, оптимальную для миграции эпителиальных клеток. Выход лекарственных средств из стимулирующих раневых покрытий осуществляется в течение 48-72 часов в зависимости от количества раневого экссудата в ране.
Все современные раневые покрытия обладают высокой антимикробной активностью за счет введенных в них противомикробных компонентов (сизомицин — в сипролине, мафенид-ацетат — в альгимафе, фурагин — в альгиколе АКФ и коллахите ФА).
Сравнительная оценка антибактериальной активности этих препаратов показывает, что элиминация S.aureus, Proteus spp. из ран быстрее происходит при использовании альгимафа и сипролина.
Гидроколлоиды
В последние годы за рубежом для лечения больных с длительно незаживающими ранами, трофическими язвами, пролежнями нашли применение гидроколлоидные лекарственные средства, в частности содержащие пектин — дуодерм (США), варигесив (США).
В НПО «Биотехнология» (Россия) совместно с Институтом хирургии им. А. В. Вишневского РАМН разработаны две гидроколлоидные лекарственные формы нового поколения на основе пектина: галактон — жидкий гидроколлоид, предназначенный для лечения длительно незаживающих глубоких ран мягких тканей с умеренным количеством гнойного отделяемого; галагран — сухой гидроколлоид (порошок) для лечения поверхностных ран мягких тканей, пролежней, трофических язв.
За счет введенного в состав диоксидина гидроколлоиды показывают лучшую активность по сравнению с другими препаратами в отношении P.auruginosa.
При сравнении гидроколлоидов (галаграна и галактона) с сорбентами (дежизаном и дебризаном) выявляется более широкий спектр положительных свойств гидроколлоидов. Прежде всего, гидроколлоиды стимулируют процессы регенерации и эпителизации, предупреждают реинфицирование раневой поверхности, поддерживают влажную среду под повязкой. Показатель сорбционной способности галаграна невысок: по воде — 3,56 г/г, по крови — 2,57 г/г; при этом верхний слой галаграна не смачивается модельными жидкостями на протяжении всего срока наблюдения (одни сутки).
Основное поглощение воды идет в течение 5 часов, далее наблюдается снижение количества сорбированной жидкости за счет подсыхания верхнего слоя и образования корочки, затрудняющей процесс дренирования. Частицы галаграна в контактном слое набухают, превращаясь в гелеобразную массу, которая равномерно растекается по ране.
По данным цитологического исследования, в первые трое суток использования галаграна в раневых отпечатках выявляется тенденция интенсивного формирования грануляционной ткани.
Учитывая природу биополимера, гидроколлоиды (галагран и галактон) целесообразно применять на стадии развития в ране репаративных процессов.
Гентацикол
Высокоэффективным препаратом для лечения длительно незаживающих ран, трофических язв, остеомиелита, диабетической стопы является препарат гентацикол — пролонгированная форма гентамицина на биодеградируемой (коллагеновой) основе.
Содержание антибиотика в биоптатах ран, получаемых от больных различных клинических групп, зависит от количества раневого отделяемого и скорости рассасывания коллагеновой основы.
Длительные и высокие концентрации гентамицина обнаруживаются при использовании гентацикола в лечении остеомиелита или в случаях окончательного закрытия швами остеомиелитической полости.
Гентацикол создает высокие концентрации гентамицина в тканях раны на протяжении 2 недель, причем эти концентрации намного превышают МПК основных возбудителей хирургической инфекции.
Биодеградируемая коллагеновая губка с гентамицином способствует купированию инфекционного процесса, активизирует пролиферацию всех клеточных элементов грануляционной ткани, усиливает коллагеногенез. Препарат может использоваться в ургентной хирургии в качестве местного гемостатика. Использование гентацикола в комплексном лечении различных ран позволяет сократить показания к проведению общей антибактериальной терапии с 16,6 до 5,5%; при этом в 98,2% случаев ранние реконструктивно-восстановительные кожно-пластические операции оказываются успешными.