витамин в12 чем вырабатывается
Витамин в12 чем вырабатывается
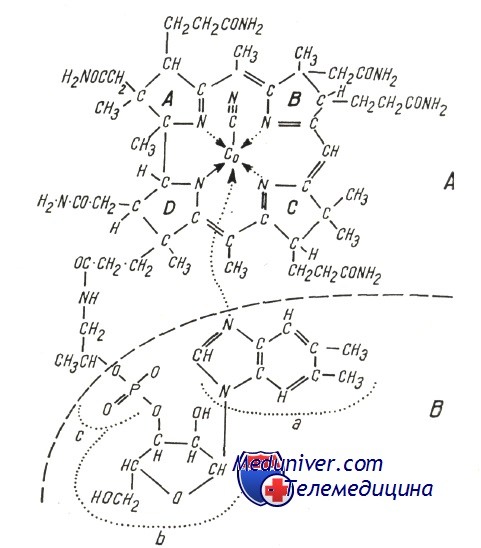
Молекула витамина В12 (цианкобаламин) состоит из двух частей:
а) хориновой — порфирин, в котором 4 восстановленных пирола связаны тремя мостиками метена и одной прямой связью, при этом к внешним позициям прикреплены радикалы, такие как аминоэтанол, аминопропанол и метил, в то время как в центре расположен атом кобальта, с которым связана группировка циан (свреху) и нуклеотидная часть (под хориновым планом);
б) нуклеотидной, в состав которой входят 5,6-диметилбензимидазол (а), рибоз (b) и фосфат (с) (которая осуществляет связь с пропионовым радикалом пирола D). Заменой связанных с кобальтом радикалов образуются различные производные (естественные и синтетические); при этом коферментной активностью обладают лишь высокозаменяемые произволные, в которых группа —С—N заменяется радикалом 5′-дезоксиаденозил или метил.
В качестве кофермента 5′-дезоксиадеознилкобаламин является межмолекулярным (реакция восстановления) или внутримолекулярным (реакция изомеризации) переносчиком водорода. Был обнаружен целый ряд реакций подобного типа, однако из них, у млекопитающих и человека, доказано наличие лишь реакции изомеризации метил-малонил-СоА в сукцинил-СоА в процессе метаболизма пропионовой кислоты (Silber и Moldow).
Реакцию восстановления рибонуклеотидов в дезоксирибонкулеотиды, обнаруженную в отдельных микроорганизмах, посредством которой можно было бы объяснить мегалобластоз за счет дефицита BJ2 независимым от метаболизма фолатов путем, еще не удалось доказать у человека (тем не менее добавление тимидина может преобразовать мегалобласты в нормобласты только при недостатке фолиевой кислоты; исключаются случаи дефицита витамина В12).
В бактериях метилкобаламин участвует в различных реакциях синтезирования, выполняя роль переносчика радикала метил. У человека доказано наличие лишь реакции метилирования гомоцистеина (в одном из путей синтезирования метионина). Поскольку источником группы метил является метилтетрагидрофолат, эта реакция составляет одновременно путь к «регенерации» тетрагидрофолиевой кислоты (FH4) из метил-тетрагидрофолиевой кислоты, что служит признанным в настоящее время объяснением мегалобластоза за счет дефицита витамина В12.
При этом теория «капкан метилфолата» (Nixon и Bertino) составляет другое последствие дефицита витамина В12, заключающееся в недостаточной задержке клетками метилтетрагидрофолиевой кислоты (Тисман и Герберт).
Дозировка витамина В12 осуществляется бактериологическими методами, при этом применяется либо фотометрическое измерение роста численного показателя отдельных микроорганизмов, находящихся в зависимости от этого витамина (Lactobacillus leishmanii, Euglena gracilis и пр.), когда вступают в контакт с материалом реакции, либо метод радиоактивных изотопов.
Кругооборот витамина В12 в организме человека
Витамин В12 синтезируется отдельными микроорганизмами, находящимися в почве, воде, на кормовых растениях или в пищеварительном тракте животных, далее витамин поступает в ткани (в частности в железы, печень, мышцы, также, яйца, в меньшей мере в молоко), которые составляют основной источник для человека.
Из 5—30 мкг среднесуточного подвоза с пищей поглощаются лишь 1—5 мкг, остальное количество выделяется с испражнениями. За сутки теряются примерно 2,5 мкг витамина В12 (Hellmuth), составляющие, следовательно, суточную потребность. Его передача плоду, в период беременности, различные гиперметаболические состояния, в период роста и пр. увеличивают потребность.
Поглощение витамина В12 обусловлено наличием внутреннего фактора (ВФ), который связывает находящийся в пищевых продуктах витамин В12 и затем переносит его к кишечным рецепторам.
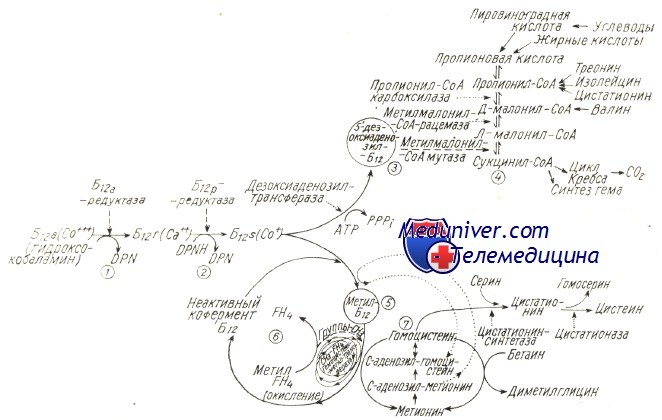
Приводятся два последовательных восстановительных процесса гидроксокобаламина (1), (2), образование 5′-дезоксиаденозил-В12 (3) и его участие в метаболизме пропионовой кислоты (4); образование метип-В12 (5), его «каталитическая» функция в переносе группы — СН3 от метил-FH4 к гомоцистеину (пусковая роль s-аденозилметионина в реакции и «регенерации’» кофермента), также взаимосвязь с метаболизмом фолатов (6) и серных аминокислот (7).
Внутренний фактор это, по существу, гликопротеид, который, у человека, выделяется пристеночными клетками слизистой оболочки дна желудка. Этот фактор отличается свойством осуществлять специфическую связь (при кислом рН) того небольшого количества В12, которое выделяется в результате пептического пищеварения.
Далее, при нейтральном рН и наличии Са2+ комплекс ВФ-В12 закрепляется на специальных рецепторах слизистой оболочки подвздошной кишки, где витамин диссоциируется а затем, с помощью еще не выведенного механизма, переходит в воротновенную кровь (Састле).
При введении большого количества витамина В12 его поглощение осуществляется путем пассивной диффузии (с быстрым поступлением в кровь) в размере примерно 1% назначенной дозы (Hellmuth).
Перенос с плазмой витамина В12 осуществляется посредством транскобаламина (прежде называемого транскобаламин II), связывающего поглощаемый из кишечника и частично эндогенный витамин В12, равно как кобалофилина (современное название «белков вида Р », включающих транскобаламин I и III), переносящего наибольшую часть эндогенного витамина В12. При хронической гранулоцитной лейкемии, а иногда и гепатомах показатель кобалофилина значительно растет. Недавно был выявлен внутриклеточный белок, связывающий кобаламин (Stenman).
Нормальная концентрация витамина В12 в плазме колеблется от 200 до 900 пг/мл.
Запасы витамина В12 в организме взрослого человека составляют примерно 2000—5000 мкг, причем в основном он сохраняется в печени (примерно 1000 мкг) и в меньшей мере в почках; мышцы содержат примерно 3000 мкг этого витамина.
Витамин В12 выделяется с мочой в незначительном количестве (примерно (0,25 мкг/сутки). Видимо его выделение через кишечник составляет основную причину потерь (доказано наличие кишечно-печеночного кругооборота с повторным поглощением примерно 3/4 выделяемого с желчью витамина В12), к этому следует добавить выпадение клеток желудочно-кишечного эпителия, выделения пищеварительной системы и пр.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Витамин В12
Витамин B12 — является водорастворимым витамином, который принадлежит к группе B. Другое название кобаламины. Кобаламины представляют целую группу витаминов, принимающих участие в метаболизме каждой клетки, оказывающих влияние на синтез и регуляцию ДНК.
Витамин B12 может быть синтезирован только бактериями и археи (одноклеточные микроорганизмы), которые обладают уникальными ферментами, необходимыми для его синтеза. Лучшие пищевые источники витамина B12 — продукты животного происхождения, поскольку в них присутствует бактериальный симбиоз.
Формы витамина В12
То, что обычно принимают за витамин B12 — это цианокобаламин. Эта форма встречается практически в большинстве витаминных продуктов. Цианокобаламин полностью синтетический, не встречается в природе, однако широко используется из-за своей низкой цены и простоты производства. Когда цианокобаламин попадает в организм, он должен быть преобразован в активные формы. В ходе преобразования выделяется токсичный цианид. Несмотря на токсичность, его количество пренебрежимо мало, чтобы иметь явные негативные последствия, и поэтому его не следует считать явным побочным эффектом.
Другая проблема с цианокобаламином возникает при его усвоении. Для того чтобы цианокобаламин мог быть использован организмом, он должен пройти через процесс, удаляющий молекулу цианида, для чего требуется антиоксидант глутатион. Минус реакции деацианирования заключается в ненужном использовании этого ценного антиоксиданта, а также зависимости метаболизма витамина В12 от доступности глутатиона.
В отличие от цианокобаламина, две коферментные формы витамина B12 — метилкобаламин и аденозилкобаламин — являются биологически активными. Они принимают активное участие в метаболических и ферментативных реакциях.
Метилкобаламин предварительно метилирован, что означает, что он готов к усвоению организмом. Метилкобаламин локализован в цитоплазме клетки, является кофактором в реакциях метилирования. Аденозилкобаламин важен в процессах окисления жирных кислот и основная точка его действия — митохондрии клеток.
Метаболизм и абсорбция витамина В12 в желудочно-кишечном тракте
Витамин B12 связан с белком пищи и становится доступным для поглощения после того, как высвободится. Процесс отщепления витамина происходит под действием соляной кислоты, вырабатываемой слизистой желудка. Высвобожденный кобаламин присоединяется к белку R и переходит в двенадцатиперстную кишку, после чего белок R удаляется, а свободный кобаламин связывается с внутренним фактором Касла. Внутренний фактор Касла образуется в железах дна и тела желудка, он помогает перевести В12 в легкоусвояемую форму. Комплекс витамин B12-фактор Касла — поглощается дистальным отделом подвздошной кишкой, и витамин поступает в кровоток.
Сывороточный витамин B12 связан с белками-переносчиками, известными как транскобаламины. Большая часть витамина, приблизительно 80%, связана с неактивным белком — гаптокорином. Активным транспортным белком для витамина B12, является транскобаламин II, который удерживает 20% витамина в кровотоке. Голотранскобаламин доставляет витамин B12 во все клетки. Низкая концентрация витамина B12 в сыворотке, может быть связана с дефицитом белка-транспортера, в то время как уровни транскобаламина и статус витамина B12 остаются нормальными.
Проблема дефицита витамина В12
Основная проблема с витамином B12 — трудное усвоение. Алиментраный дефицит витамина B12 встречается в группах людей, которые употребляют только растительную пищу, минимизируя продукты животного происхождения в своем рационе. Также распространен дефицит вследствие недостаточного усвоения витамина В12 или повышенных потребностей на фоне нормального усвоения.
Потенциальную группу риска составляют беременные женщины, находящиеся на вегетарианском, веганском или сыроедческом типе питания.
Пожилые люди также составляют группу риска. Они в большей степени подвержены риску недоедания из-за сопутствующих заболеваний, им присущи трудности в самообслуживании и приготовлении пищи и, как правило, они страдают в той или иной степени атрофическим гастритом. Воспалительным процессам в слизистой оболочке желудка свойственна тенденция к увеличению частоты с возрастом, что приводит к снижению выработки соляной кислоты — одного из факторов усвоения витамина В12.
Дефицит фактора Касла — одна из типичных причин недостатка витамина В12. Наличие аутоантител к фактору Касла, является ведущей причиной появления пернициозной анемии на фоне аутоиммунного гастрита. Резекция антрального отдела желудка также сопровождается дефицитным состоянием по витамину В12.
Всасывание витамина В12 может быть нарушено и при любых воспалительных заболеваниях кишечника. Например, болезнь Крона, паразитарные инвазии, синдром избыточного бактериального роста — лишь небольшой перечень из возможного списка недугов.
Последствия дефицитных состояний
Типичные проявления дефицита витамина В12. Нарушение процесса кроветворения с развитием мегалобластной анемии, а также неврологические расстройства.
Длительный и хронический дефицит витамина В12 рассматривается, как один из факторов ряда других глобальных медицинских проблем.
Активная форма витамина B12 непосредственно участвует в метаболизме гомоцистеина — независимого фактора развития сердечно-сосудистой патологии. Превращая гомоцистеин в метионин, он усиливает синтез SAMe (S-аденозилметионина), самого важного донора метильных групп в организме.
Оценка статуса витамина B12, является частью процесса скрининга на деменцию. Повышенные концентрации метилмалоновой кислоты (ММА) связаны со снижением когнитивных функций и болезнью Альцгеймера. У пожилых людей низкий уровень витамина B12 и высокие концентрации фолатов в сыворотке крови, ассоциированы с повышенными шансами когнитивных расстройств. Напротив, у пациентов с нормальным статусом витамина B12, высокий уровень фолиевой кислоты сыворотки обладает протективным действием в отношении сохранения памяти, внимания, способности к восприятию, интеллекту и прочее.
Недостаток витамина B12 связан с развитием возрастной макулярной дегенерации (ВМД) и риском хрупкости, которые являются основными причинами инвалидности у пожилых людей. ВМД является основной причиной потери зрения у пожилых людей. Повышенный риск слабости и инвалидности связан с плохим витаминным статусом В12.
Низкий уровень витамина B12 рассматривается, как потенциальный фактор риска развития дефекта нервной трубки. Витамин B12 действует как кофактор метионинсинтазы в цикле фолиевой кислоты. Когда запас витамина B12 низок, фолат остается в ловушке цикла метилирования, вследствие чего нарушается процесс репликации клеток.
Определение дефицита витамина В12
Традиционно статус витамина B12 оценивается по его концентрации в сыворотке, однако только лишь измерение сывороточного уровня не всегда позволяет выявить субклинический дефицит или недостаточность витамина В12.
Метилмалоновая кислота и гомоцистеин являются признанными индикаторами статуса витамина В12. Их измерение имеет первостепенное значение при выявлении недостаточности витамина В12.
MMA считается специфическим индикатором метаболизма кобаламина, и отражает доступность аденозилкобаламина в клетке. Гомоцистеин повышается при дефиците витамина B12 наряду с недостатком фолатов и витамина B6. Именно недостаток такой коферментной формы, как метилкобаламин провоцирует увеличение уровня гомоцистеина.
Концентрации в плазме MMA повышается также при почечной недостаточности, полиморфизмах в метилентетрагидрофолатредуктазе (MTHFR) или при использовании некоторых лекарств. Концентрация ММА в плазме повышена при почечной недостаточности, что характерно для пожилых людей, поэтому этот маркер нецелесообразно использовать в этой группе пациентов.
Использование голотранскобаламина в качестве маркера статуса витамина B12, увеличивает прогностическую ценность определения субклинических дефицитных состояний. Уровень голотранскобаламина отражает доступность витамина В12 для всех клеток организма, и его определение желательно при оценке статуса витамина в организме.
Витамин B12 является особенно важным витамином для женщин детородного возраста и пожилых людей, однако для оптимального здоровья необходим адекватный статус витамина B12 на протяжении всего периода жизни.
Микробиологический синтез витамина В12
СИНТЕЗ ВИТАМИНА В12
Общая информация о получении витамина В12
Молекулярная структура кобаламинов (витамина В12)
Структура витамина В12 не только очень сложная, но содержит некоторые необычные части: 1) корриновая структура ранее не была известна в органической химии (до открытия витамина В12 в 1948 г. независимо Риксом и Смитом); 2) Na-гликозидная связь встречается в природе очень редко и обнаружена лишь в нескольких соединениях, содержащих рибозо-3-фосфат; 3) 5,6 ДМБ тоже принадлежит к уникальным соединениям и встречается в природе только в составе кобаламинов.
In vivo чаще всего встречаются дезоксиаденозильная группа (Co-B12-I), метильная группа (метилкобаламии, СН3-B12-CoB-II) или оксогруппа (оксокобаламин). Кроме этих соединений, известных как кобаламины, есть другие корриноидные соединения с иным нуклеотид-аным основанием.
Продуценты витамина B12.
Получение и применение витамина В12

Сухой концентрат КМБ-12, помимо витамина В12 (100 мг/кг препарата), содержит ряд других ростстимулирующих веществ. Особенно хорошие результаты в животноводстве получают при сочетании витамина В12 с малыми дозами антибиотиков, в частности, с биомицином.
См. также:
Дополнительно:
Технология получения витамина В12
Витамин В12 получают путем микробиологического синтеза из Propionobacterium, а также Pseudomonas и смешанных структурных бактерий.
Основной метод включает использование Propionobacterium. Процесс ведут в реакторе объемом 1 м 3 при коэффициенте заполнения 0,65-0,7.
Технология получения В12 включает две стадии:
1) перемешивание в реакторе в течение 80-88 ч в анаэробных условиях до полной утилизации сахара, после чего полученную массу центрифугируют;
2) процесс обработки суспензии во втором аппарате, уже при доступе воздуха; расход воздуха составляет 2м 3 /ч (рис. 6.10). Для питательной среды используют глюкозу, до 10% солей железа, марганца, магния и кобальта (концентрация соли колеблется от 10 до 100 мг/л), сульфат аммония.

Выход кристаллического витамина В12 составляет 40 мг/л.
Разработана также технология получения В12 из термических бацилл. Bacillus Circulans в течение 18 ч при температуре 65-75°C в нейтральных условиях. Выход витамина составляет 2-6 мг/л.
Источник:
При наличии желания более подробно ознакомиться с некоторыми нюансами биосинтеза В12 и его промышленного производства рекомендуем к изучению обзорный материал: Piwowarek K, Lipińska E, Hać-Szymańczuk E, Kieliszek M, Ścibisz I. Propionibacterium spp.-source of propionic acid, vitamin B12, and other metabolites important for the industry . Appl Microbiol Biotechnol. 2018 Jan;102(2):515-538.
Ультразвуковая модуляция метаболической активности Propionibacterium freudenreichii subsp. shermanii при получении пищевых продуктов, обогащённых витамином В12
Витамин В12 – одно из важнейших биологически-активных соединений, участвующих во многих процессах в организме человека. В современных условиях жизни часто наблюдается его дефицит, из-за чего необходимо введение в рацион специальных обогащѐнных продуктов. Однако его синтез очень сложен и в настоящее время он является одним из наиболее дорогостоящих витаминов. Статья посвящена модуляции ультразвуком метаболизма основного промышленного продуцента витамина В12 Propionibacterium shermanii с целью повышения эффективности биотехнологического процесса его производства.
Одним из важнейших продуцентов витамина являются пропионовокислые бактерии. Морфологически это неподвижные бесспоровые палочки разной величины, от коккообразных до длинных, располагаются единично, парами или короткими цепочками, способные расти как в анаэробных, так и в аэробных условиях. Они активно сбраживают глюкозу, сахарозу, лактозу и пентозы, благодаря чему способны активно развиваться на различных субстратах, например в молочной сыворотке [6]. В клетках Propionibacterium shermanii корриноиды находятся в 5′-аденозильной форме, в виде которой они проявляют свое биокаталитическое действие и осуществляет метаболические функции и в организме человека, однако для их максимального накопления в культуральной среде необходимо создавать специальные условия культивирования [3].
Одним из способов направленного изменения метаболизма в клетках бактерий является обработка жидких сред ультразвуком, под действием которого ускоряются реакции механохимического происхождения, имевшие место в озвучиваемой среде до воздействия ультразвука и инициируются специфические сонохимические реакции, в основе которых лежит механизм разрыва химических связей и образования свободных радикалов [1].
Таким образом, с помощью ультразвуковой обработки можно проводить направленную модуляцию метаболической активности бактерий для обеспечения увеличения конечного выхода витамина В12 без увеличения длительности производственного процесса [5]. Для определения влияния ультразвука на метаболизм бактерий производилось культивирование клеток штамма Propionibacterium freudenreichii ssp. shermanii I-63, используемого в промышленном производстве витамина В12, в субстрате на основе восстановленной молочной сыворотки с концентрацией лактозы 5%, а также добавками 0,002% CoCl2·6H2O и 0,001% MgSO4. рН в процессе культивирования удерживался на уровне порядка 6,9 с помощью периодической нейтрализации среды.
Во время культивирования раз в сутки производилось кратковременное озвучивание сред ультразвуком низкой интенсивности и различной частоты. Для исследования метаболической активности бактерий в процессе культивирования были выбраны метод определения титруемой кислотности для определения количества синтезируемых бактериями органических кислот, по результатам титрования выяснено, что обработка ультразвуком вызывает повышение титруемой кислотности, причѐм на частоте 20 КГц этот эффект более выражен, чем на 22 КГц при одинаковой интенсивности облучения. Следующим этапом был выбор длительности озвучивания; при этом производилось культивирование пропионовокислых бактерий на аналогичной среде с обработкой субстрата ультразвуком на частоте 20 КГц в течение 10 и 20 минут каждые 24 часа.
Для сравнения различных режимов обработки использовались метод определения титруемой кислотности и спектрофотометрический метод для мониторинга состава сброженной сыворотки [4], а также микроскопический метод для сравнения морфологии клеток.