вирусостатическое действие что это
Вирусостатическое действие что это
Вирусы состоят в основном из генетического материала (нуклеиновой кислоты) и защитной оболочки, образованной белками, которая часто покрыта фосфолипидным бислоем со встроенными белками. У них отсутствует метаболическая система, а рост и репликация зависят от инфицированной клетки.
Целенаправленная терапевтическая супрессия репликации вируса достигается за счет ингибирования метаболических процессов, которые являются специфическими для вирусной репликации в инфицированных клетках.
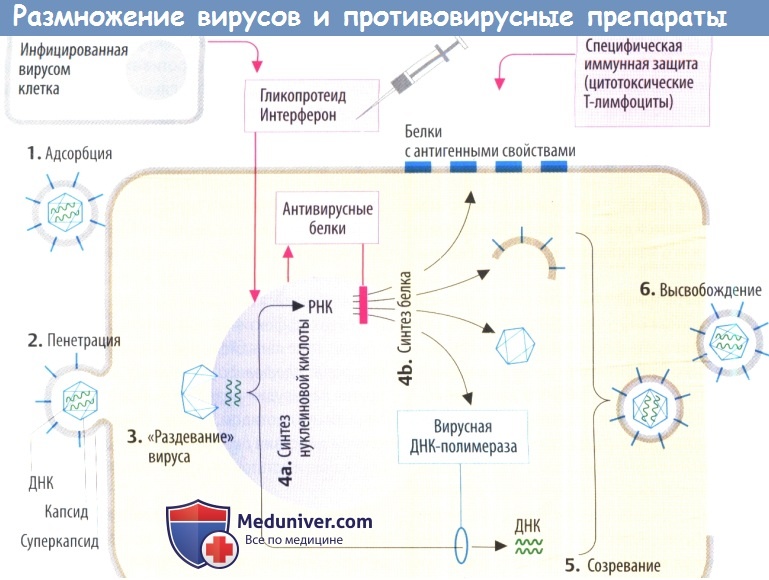
I. Вирусная репликация рассмотрена на примере вируса простого герпеса:
1. Вирусные частицы связываются с мембраной клетки хозяина (адсорбция) посредством оболочечных гликопротеидов, которые контактируют со специфическими структурами клеточной мембраны.
2. Вирусная оболочка сливается с плазмолеммой клеток хозяина, а нуклеокапсид (нуклеиновая кислота + капсула) проникает во внутреннюю среду клетки (пенетрация).
3. Капсид сбрасывается («раздевание» вируса) около ядерных пор, а вирусная ДНК направляется к клеточному ядру. С этого момента генетический материал вируса начинает управлять системой клеточного метаболизма.
4а. Синтез нуклеиновой кислоты. Происходит репликация генетического материала (ДНК в данном примере) и продукция РНК с целью синтеза белка.
4b. Белки используются в качестве вирусных ферментов, катализирующих размножение вирусов (ДНК-полимераза и тимидинкиназа), при встраивании в клеточную мембрану хозяина капсомеров или компонентов оболочки.
5. Отдельные компоненты образуют новые вирусные частицы (созревание).
6. Высвобождение дочерних вирусов приводит к распространению вируса внутри и вне организма.
У вируса герпеса репликация приводит к разрушению клеток хозяина и развитию симптомов заболевания.
II. Противовирусные механизмы. Организм нарушает репликацию вируса с помощью цитотоксических Т-лимфоцитов, которые распознают и разрушают вируспродуцирующие клетки (на их поверхности находятся вирусные белки) или с помощью антител, которые связывают и инактивируют внеклеточные вирусные частицы. Вакцинация разработана с целью запуска специфической иммунной защиты.
а) Интерфероны (IFN) — гликопротеиды, которые в отличие от других препаратов высвобождаются из инфицированных вирусом клеток. В соседних клетках интерферон стимулирует образование антивирусных белков. Они ингибируют синтез вирусных белков за счет (предпочтительного) разрушения вирусной ДНК или ингибирования трансляции. Интерфероны не направлены против конкретного вируса, а имеют широкий спектр антивирусной активности, который, тем не менее, является видоспецифическим.
Следовательно, интерферон для использования у человека необходимо получать из его клеток, а именно лейкоцитов (IFN-a), фибробластов (IFN-β; или лимфоцитов (IFN-y). Интерфероны используются при лечении определенных вирусных заболеваний, а также злокачественных новообразований и аутоиммунных расстройств. Например, IFN-a применяется при хроническом гепатите С, волосатоклеточном лейкозе и рассеянном склерозе.
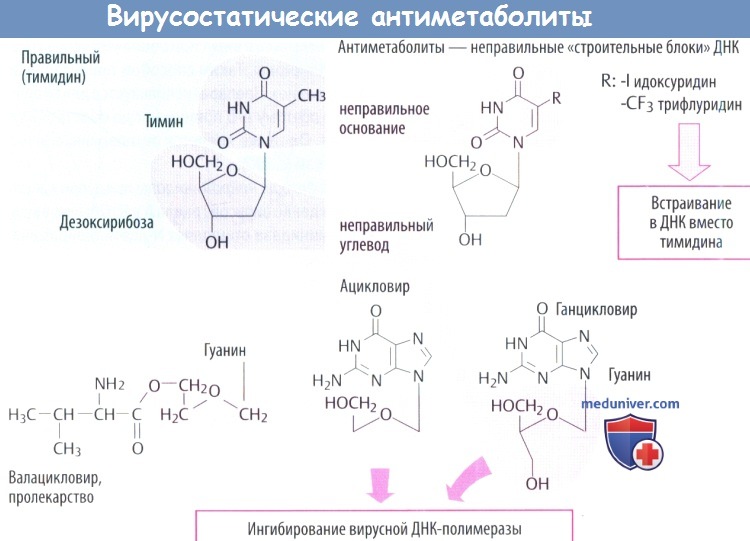
б) Вирусостатические антиметаболиты являются ложными «строительными блоками» ДНК или нуклеозидами. Нуклеозид (тимидин) состоит из нуклеотидного основания (тимин) и углевода дезоксирибозы. В антиметаболитах один из компонентов имеет дефект. В организме измененные нуклеозиды подвергаются биоактивации путем присоединения трехфосфатных остатков.
в) Идоксуридин и синергисты встраиваются в ДНК с отрицательными последствиями, в т. ч. нарушением синтеза ДНК человека. Поэтому идоксуридин и аналоги подходят только для местного использования (при простом герпетическом кератите).
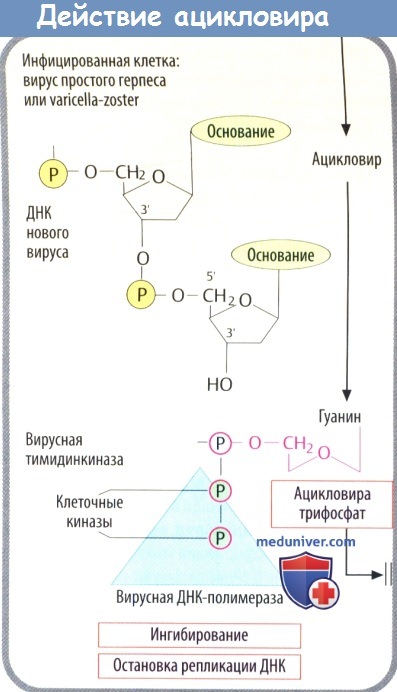
г) Среди вирусостатических антиметаболитов ацикловир имеет высокую специфичность, т. к. его биоактивация происходит только в инфицированных клетках, где он предпочтительно ингибирует синтез вирусной ДНК.
1. Кодируемая вирусом тимидинкиназа (специфичная для вирусов простого герпеса и ветряной оспы) осуществляет первый этап фосфорилирования. Два других фосфатных остатка присоединяются клеточной киназой.
2. Полярные фосфатные остатки делают мембрану непроницаемой для ацикловира трифосфата, что приводит к его накоплению в инфицированных клетках.
3. Ацикловира трифосфат является предпочтительным субстратом вирусной ДНК-полимеразы. Он ингибирует активность ферментов, а после встраивания в вирусную ДНК вызывает расщепление нити, т. к. у него отсутствует З’-ОН-группа дезоксирибозы, которая необходима для присоединения дополнительных нуклеотидов. При тяжелых инфекциях, вызванных вирусом простого герпеса (энцефалит, генерализованная инфекция) и вирусом ветряной оспы (тяжелый опоясывающий лишай), его вводят в виде в/в инфузии.
Ацикловир также применяют внутрь, несмотря на неполное (15-30%) кишечное всасывание. Кроме того, он используется местно.
г) У валацикловира гидроксильная группа этерифицирована с аминокислотой L-валином. Это позволяет использовать дипептидный переносчик тонкой кишки, что почти удваивает скорость кишечного всасывания препарата по сравнению с ацикловиром. В дальнейшем при отщеплении остатка валина образуется ацикловир.
д) Ганцикловир используется при лечении тяжелых цитомегаловирусных инфекций (тоже принадлежащих к группе герпеса). Они не образуют тимидинкиназу, поэтому фосфорилирование начинается другим вирусным ферментом. Ганцикловир хуже переносится, нередко приводит к развитию лейкопении и тромбопении. Он вводится в виде инфузии или внутрь как эфир валина (валганцикловир).
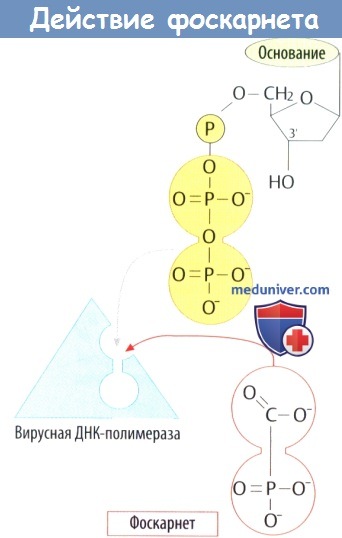
е) Фоскарнет представляет собой аналог дифосфата. Встраивание нуклеотида в нить ДНК приводит к отщеплению дифосфатного остатка. Фоскарнет ингибирует ДНК-полимеразу за счет взаимодействия со связывающим участком. Показания: системная терапия тяжелых цитомегаловирусных инфекций у больных СПИДом; местное лечение герпесвирусных инфекций.
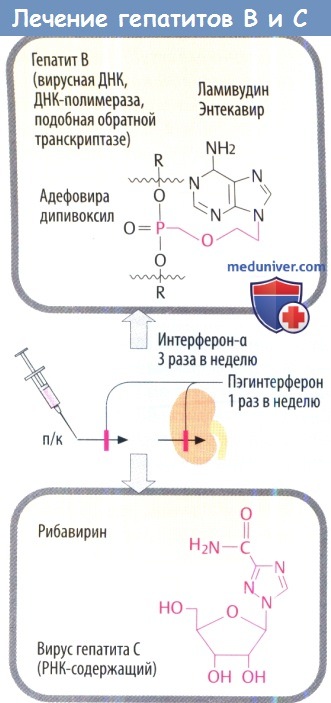
ж) Препараты для лечения вирусных гепатитов. Интерферон-а действует против вирусов гепатитов В и С (HBV, HCV) во время репликации. Присоединение молекулы полиэтиленгликоля к IFN-a (пегилирование) позволяет пегилированному IFN-a медленнее высвобождаться из места инъекции и выводиться почками, что увеличивает продолжительность действия пегилированного препарата.
Вирусостатические антиметаболиты необходимо рассматривать индивидуально в зависимости от возбудителя. Гепатит В: ламивудин, первоначально использовавшийся только как анти-ВИЧ препарат, в низких дозах эффективен против HBV. Телбивудин и энтекавир тоже являются производными нуклеозидов. Фосфонат адефовира дипивоксил, который активен против ламивудин-резистентного HBV, является атипичным нуклеотидом. Гепатит С: молекулярный механизм действия рибавирина, в котором изменены основание и остаток сахара (D-рибоза), неясен.
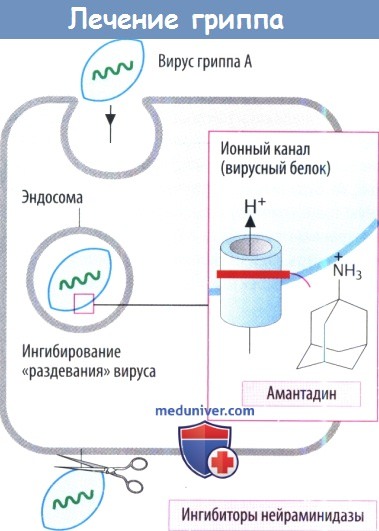
з) Препараты против вируса гриппа. Амантадин обладает специфическим свойством в отношении репликации вирусов гриппа А (РНК), этиологических факторов истинного гриппа. Эти вирусы захватываются клетками путем эндоцитоза. Для «раздевания» вирусной РНК и дальнейшего проникновения вируса внутрь клетки необходимы протоны водорода из кислотного содержимого эндосом. Амантадин блокирует белок канала в вирусной оболочке, через который входят протоны. Таким способом предотвращается «раздевание».
Препарат используется для профилактики, и поэтому его принимают до обострения симптомов. Он также является антипаркинсоническим средством.
Ингибиторы нейраминидазы предупреждают высвобождение вирусов гриппа А и В. Обычно вирусная нейраминидаза отщепляет N-ацетилнейраминовые (сиаловые) кислотные остатки на поверхности клеточной оболочки, что дает возможность вновь образованным вирусным частицам отделиться от клетки хозяина. Занамивир вводится в виде ингаляции. Оселтамивир подходит для применения внутрь, т. к. представляет собой сложный эфир пролекарства. Он используется при лечении и профилактики инфекций, вызванных гриппом.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
К вопросу о современной тактике лечения вирусных гепатитов
Вирусные гепатиты (ВГ) в настоящее время представляют серьезнейшую медико-биологическую и социальную проблему для всего человечества. Сейчас в мире насчитывается более 500 млн. носителей вирусных гепатитов с парентеральным путем заражения, которые
Вирусные гепатиты (ВГ) в настоящее время представляют серьезнейшую медико-биологическую и социальную проблему для всего человечества. Сейчас в мире насчитывается более 500 млн. носителей вирусных гепатитов с парентеральным путем заражения, которые в большинстве случаев приобретают хроническое течение с формированием тяжелых исходов — цирроза печени и гепатоцеллюлярной карциномы [1]. С 1961 года, по данным ВОЗ, в США и странах Западной Европы среди причин смерти хронические гепатиты и циррозы печени переместились с 10-го на 5-е место [1]. В настоящее время выделяют семь типов ВГ: А, В, С, D, Е, F, G. Недавно открыт вирус ТТV, передающийся при трансфузии и рассматривающийся как этиологический фактор гепатита ни А, ни Е. В настоящее время лабораторным путем можно обнаружить маркеры всех видов вирусов, за исключением возбудителя вирусного гепатита F. В большинстве регионов мира и Российской Федерации среди всех ВГ преобладают гепатиты В и С. Именно для этих форм гепатитов характерны непрерывный рост заболеваемости и частые неблагоприятные исходы. Эпидемия наркомании также привела к широкому распространению HBV- и HCV-инфекции. От 50 до 90% инъекционных наркоманов инфицированы этими вирусами [2, 3].
Целью нашей статьи является рассмотрение комплекса средств противовирусной терапии, применяющихся для лечения вирусных гепатитов на современном этапе.
В 70 — 80-е годы ХХ века происходил интенсивный поиск этиотропной терапии острых и хронических вирусных гепатитов. Во многих странах мира создавались и изучались препараты, направленные на подавление репликации вирусов гепатита и их элиминацию. В настоящий момент проводятся теоретические и клинические исследования следующих групп препаратов: интерфероны, противовирусные средства (аналоги нуклеозидов), индукторы интерферонов, иммуномодуляторы, блокаторы кода вирусов — препараты, действующие на молекулярном уровне и обеспечивающие полное торможение репликации вируса и экспрессии гена (стратегическое направление терапии, имеющее большие перспективы в будущем) [1].
Интерфероны
Наиболее эффективными в лечении ВГ препаратами в настоящее время признаны интерфероны. Интерфероны (ИФН) — группа аутогенных гликопротеинов, биомеханизм действия которых связан с одновременным противовирусным эффектом — активацией клеточных генов, в результате чего синтезируются белки, ингибирующие синтез вирусной ДНК (РНК) и обладающие иммуномодулирующим эффектом — способностью усиливать экспрессию антигенов HLA на клеточных мембранах и увеличивать активность цитотоксических Т-клеток и естественных киллеров [4]. ИФН подразделяются на два типа. К первому типу, действующему как ингибиторы репликации вируса и оказывающему преимущественно противовирусный эффект, относятся 22 различных подтипа ИФН-α и один подтип ИФН-β. Ко второму типу, проявляющему иммуномодуляторную активность, относятся ИФН-γ.
Существует три иммунологически различных класса ИФН: ИФН-α, ИФН-β, ИФН-γ. К ИФН естественного происхождения относятся лимфобластоидный и лейкоцитарный ИФН (ИФН-α), синтезируемые соответственно стимулированными моноцитами и В-лимфоцитами человека, которые затем экстрагируются и очищаются; фибробластный ИФН (ИФН-β), получаемый из культуры фибробластов человека, и Т-лимфоцитарный ИФН (ИФН-γ). К искусственно синтезируемым ИФН относится рекомбинантный ИФН-α, который представляет собой высокоочищенный единственный подтип ИФН-α, получаемый по рекомбинантной молекулярной технологии.
Среди рекомбинантных ИФН выделяют ИФН-α-2а (роферон-А), ИФН-α-2b (интрон-А), ИФН-α-2с (бероферон). Коммерческое название препарата лимфобластоидного ИФН-α — веллферон, а человеческого лейкоцитарного интерферона — реаферон (Россия). Кроме того, совсем недавно в клинической практике начали использоваться препараты рекомбинантных ИФН-α пролонгированного действия (конъюгированные ИФН-α), производимые в виде коммерческих препаратов пегасис и пегинтрон. Пегасис — это препарат ИФН-α-2а, соединенный с молекулой полиэтиленгликоля с общей молекулярной массой 40 кDa, пегинтрон — препарат ИФН-α-2b, объединенный с молекулой полиэтиленгликоля с молекулярной массой 12 кDa. Данные препараты обладают наибольшей противовирусной активностью среди всех рекомбинантных ИФН-α.
Рекомбинантные ИФН-α являются в настоящее время препаратами выбора при лечении гемоконтактных ВГ. Основными показаниями для лечения ими стало наличие активной вирусной репликации, маркерами которой в крови являются: при HBV-инфекции — HBeAg, DNA HBV; при HDV-инфекции — anti-HDV-IgM, RNA HDV; при HCV-инфекции — RNA HCV.
Благоприятными в прогностическом отношении факторами у больных хроническими вирусными гепатитами B, C, D при проведении ИФН-терапии могут считаться: небольшая длительность заболевания (менее 5 лет), молодой возраст (менее 45 лет), отсутствие гистологических признаков цирроза печени, низкий уровень аминотрансфераз сыворотки крови (не более 3 норм), низкое содержание железа в ткани печени (менее 650 мкг/г нативной массы) и нормальные показатели сывороточного железа (17–22 мкмоль/л) [5, 6, 7].
Противопоказаниями к назначению ИФН-терапии являются: декомпенсированный цирроз печени, тяжелые сопутствующие сердечно-сосудистые и психические заболевания, наркомания, алкоголизм, аутоиммунные заболевания, хроническая почечная недостаточность.
Использующиеся сейчас многочисленные схемы лечения различных по этиологии и активности вирусных гепатитов можно подразделить на три вида (терапия интроном А).
Режим высоких доз — 10 000 000 МЕ ежедневно до получения нормальных трансаминаз, затем 3 000 000 МЕ 3 раза в неделю в течение 6 месяцев.
Режим средних доз — 5 000 000 МЕ 3 раза в неделю в течение 2 — 3 месяцев, затем 3 000 000 МЕ 3 раза в неделю в течение 4 — 12 месяцев.
Режим малых доз — 3 000 000 МЕ 3 раза в неделю в течение 3 месяцев.
Режим высоких доз часто применяется при острой фазе течения вирусных гепатитов. При хроническом течении начинают с режима высоких или средних доз, если имеется неудовлетворительная переносимость ИФН, переходят на режим малых доз [5, 6, 8].
Оценка эффективности ИФН-терапии проводится в соответствии с тестами контроля за лечением хронических вирусных гепатитов: нормализацией уровня трансаминаз, устранением маркеров фазы репликации вирусов гепатита В, С, D и морфологическим изменением ткани печени до и после курса лечения.
На фоне проводимой терапии рекомбинантными ИФН-α могут наблюдаться побочные эффекты, наиболее распространенным из которых является гриппоподобный синдром (лихорадка, озноб, головные боли, миалгии), развивающийся в первую или вторую неделю лечения, который может быть ослаблен, как показали клинические наблюдения, инъекциями ИФН-α в вечерние часы. Кроме того, у пациентов отмечаются диспепсические явления, нарушения сна, потеря веса, слабость, лейкопения, тромбоцитопения у 12% больных, а также развитие тиреотоксикоза [15]. Большинство побочных эффектов являются дозозависимыми и могут быть устранены тщательным подбором дозы препарата [1, 5, 6].
Эффективность терапии ИФН-α довольно высока. Примерно у трети больных с хроническим гепатитом В и С и у 10% больных с HDV-инфекцией достигается устойчивый положительный ответ на лечение ИФН-α в обычных дозах (отсутствие репликации вируса, нормальный уровень АЛТ и АСТ через 6 месяцев после окончания монотерапии ИФН-α). Вместе с тем большинство авторов сегодня разделяют мнение о том, что лечение гемоконтактных вирусных гепатитов уже не может и не должно осуществляться с помощью одной только ИФН-терапии [9, 10, 11, 12]. Стала очевидной необходимость одновременного использования нескольких препаратов, способных воздействовать как на различные звенья собственно репликации вируса, так и на иммунную систему в целом, хотя интерфероны продолжают оставаться базисным компонентом лечения. Например, в случае возникновения рецидива после первого курса монотерапии ИФН-α предусматриваются комбинации ИФН-α с ламивудином при HBV-инфекции [5] и ИФН-α с рибавирином при HCV-инфекции с положительным эффектом у значительной части больных [11]. Изложенные на 36-м конгрессе Европейской ассоциации по изучению болезней печени в Праге в апреле 2001 года результаты исследования клинической эффективности применения конъюгированного рекомбинантного ИФН-α — пегинтрона в сочетании с рибавирином свидетельствуют о еще более высокой противовирусной активности комбинированной терапии HCV-инфекции. Частота доказанного ответа у пациентов с не-1b-генотипом HCV превышает 55%. Еще более обнадеживающими кажутся результаты, полученные при использовании конъюгированного рекомбинантного ИФН-α — пегасиса: даже монотерапия этим новым препаратом, согласно предварительным данным, по своей эффективности превосходит комбинированное применение пегинтрона и рибавирина [12].
Аналоги нуклеозидов
Аналоги нуклеозидов — это группа средств, проявляющих свое действие в отношении генома вирусов гепатита.
Ламивудин (зеффикс) является препаратом, ингибирующим РНК-зависимую обратную транскриптазу, необходимую для транскрипции прегенома HBV РНК в HBV ДНК. Ламивудин обладает выраженной противовирусной активностью в отношении вируса гепатита В. Препарат снижает уровень митохондриальной ДНК и вызывает незначительную митохондриальную токсичность [1, 14]. Лечение ламивудином показано больным с доказанной репликацией вируса гепатита В (наличие НВеАg и HBV ДНК), при наличии мутантного штамма HBV в pre-core-зоне, при повышении уровня активности АЛТ в 3 и более раза и изменении гистологической картины в печени, а также у пациентов в стадии декомпенсации хронического гепатита и цирроза печени с сохраняющейся репликацией HBV [5, 14].
Детям до 12 лет ламивудин назначается в дозировке 3 мг/кг массы тела в день, детям старше 12 лет в дозе 100 мг 1 раз в день, взрослым в дозе 100 — 300 мг в день в течение 12 недель.
Критериями эффективности терапии ламивудином служат снижение концентрации HBV ДНК, исчезновение HBe Ag и появление anti-HВe, нормализация цифр АЛТ, уменьшение прогрессирования фиброза в печени и замедление перехода в цирроз [14].
Побочные эффекты при лечении ламивудином (недомогание, головная боль, тошнота, повышение температуры, лейкопения, депрессивный синдром) наблюдаются у 1 — 5% больных [14].
Терапия ламивудином, по данным литературы [16], позволяет уже через 1 — 3 месяца лечения добиться подавления репликации и снижения уровня HBV ДНК до минимальных значений. Однако после завершения годичного и даже трехгодичного курса терапии у большинства больных уровень HBV ДНК в сыворотке крови вновь повышается, хотя и не достигает первоначальных значений. Кроме того, при длительной терапии ламивудином у больных развивается резистентный к ламивудину штамм HBV с мутациями в YMDD-зоне [16], вероятность появления которого после годичной терапии составляет 24%, а после 3 лет лечения — 49% [14]. С целью повышения эффективности специфической терапии HBV-инфекции многими клиниками мира проводится сочетание ИФН-терапии с ламивудином.
Фамцикловир, также являющийся аналогом нуклеозидов, обладает сходным с ламивудином механизмом действия, однако несколько уступает последнему по эффективности. Он подавляет репликацию ДНК НВV, снижая уровень ДНК НВV в сыворотке крови до минимальных определяемых значений. Назначается в дозе 500 мг 3 раза в день per os на 1 — 6 месяцев. После курса монотерапии фамцикловиром только у 19% больных уровень HBV ДНК не возрастает вновь до исходных значений [5].
Рибавирин — это аналог гуанозина, который вызывает торможение РНК-полимеразы вируса и непрямое торможение синтеза протеина. Он оказывает вирусостатическое действие в отношении многих ДНК- и РНК-содержащих вирусов. Доза препарата 1000–1200 мг/сутки в два приема в течение 12–24–48 недель. Рибавирин является достаточно токсичным препаратом. Среди его побочных эффектов головокружение, тошнота, депрессия, гемолиз эритроцитов. Кроме того, даже длительная монотерапия рибавирином не приводит к элиминации вируса. Поэтому применение рибавирина в комбинированной терапии с ИФН-α значительно усиливает противовирусный эффект, особенно у больных, «не ответивших» на монотерапию интерферонами, и у больных, у которых не удалось добиться стойкого эффекта при лечении ИФН [9,10]. Сочетание ИФН-α с рибавирином является официально лицензированной Минздравом России схемой лечения хронического гепатита С [12]. Препарат пегасис пока не рекомендован Минздравом для этих целей. ИФН назначается в дозе 3 000 000 МЕ 3 раза в неделю в течение 24 недель, рибавирин — в дозе 1000–1200 мг/сутки в два приема также на 24 недели. После курса лечения у 40% больных стойко исчезает HCV РНК, снижается активность АЛТ и уменьшается воспалительно-некротический процесс по данным пункционной биопсии печени [1]. Следует отметить, что появился отечественный производитель рибавирина — компания «Верофарм». Выпускаемый ею препарат веро-рибавирин сопоставим по качеству с европейскими аналогами, но значительно ниже по цене.
Индукторы интерферонов
Индукторы интерферонов являются препаратами с комбинированным эффектом: этиотропным, направленным непосредственно на вирус-возбудитель, и иммуномодулирующим, то есть корригирующим нарушения системы иммунитета. Индукторы интерферонов представляют собой весьма разнородное по составу семейство высоко- и низкомолекулярных природных и синтетических соединений, объединенных способностью вызывать в организме образование собственного эндогенного интерферона. Они индуцируют синтез всех иммунологических классов интерферонов: α, β и γ в разных пропорциях. Все они хорошо сочетаются друг с другом, рекомбинантными ИФН-α, иммуномодуляторами и химиотерапевтическими средствами. Комбинированное применение с другими препаратами часто приводит к потенцированию эффектов индукторов интерферонов.
Индукторы интерферонов относятся к новому поколению лекарств и имеют ряд преимуществ перед рекомбинантными ИФН.
В настоящий момент проходят период клинических испытаний и уже применяются в практическом здравоохранении более десяти индукторов интерферона природного и синтетического происхождения. Часть из них используются для профилактики и лечения вирусных гепатитов.
Амиксин — известный отечественный препарат, является первым пероральным индуктором эндогенных интерферонов α, β, γ. Он наиболее полно сочетает в себе все преимущества индукторов интерферона. Являясь поликлональным стимулятором, амиксин вызывает синтез интерферонов первого и второго типа в Т-лимфоцитах, энтероцитах кишечника, гепатоцитах, проникает через гематоэнцефалический барьер и индуцирует интерферон в клетках мозга. У него отсутствуют мутагенный, тератогенный, эмбриотоксический, канцерогенный и другие токсические эффекты. Препарат не обладает антигенностью. Важной особенностью амиксина является вызываемая им длительная циркуляция в организме терапевтической концентрации интерферонов (50 — 100 ЕД/мл в сыворотке крови).
Препарат выпускается в таблетках по 0,125 г, по 6 или 10 таблеток в упаковке.
Сочетание в одном препарате этиотропных, иммуномодулирующих и патогенетических свойств, а также его полная совместимость с антибиотиками и другими средствами традиционного лечения вирусных и бактериальных инфекций позволяют применять амиксин для лечения таких заболеваний, как острые и хронические вирусные гепатиты, грипп, другие ОРВИ, герпес, рассеянный склероз, клещевой энцефалит, СПИД и др.
Исследования, проводившиеся в клинике инфекционных болезней РМАПО (Москва) и в клинике детских болезней ВМА по изучению эффективности амиксина при вирусных гепатитах, показали, что при остром течении вирусных гепатитов амиксин сокращает «вирусную нагрузку», способствует элиминации вирусов в первые 2 — 3 недели лечения, ускоряет процессы нормализации клинико-биохимических показателей. При лечении хронических гепатитов, особенно вызываемых HCV, или микст-инфекции, в случае удовлетворительного ближайшего эффекта требуется дальнейшее курсовое применение амиксина в течение года [13].
Лечение амиксином острых и хронических форм вирусных гепатитов В, С, В + С проводится на фоне общепринятой базисной терапии под контролем маркеров вирусной инфекции в крови: HBeAg и ДНК HBV при HBV-инфекции, РНК HCV при HCV-инфекции, а также HBsAg и показателей уровня билирубина, АлТ, АсТ, щелочной фосфатазы.
Для лечения острой формы вирусных гепатитов В, С, В + С амиксин назначается одним курсом по схеме: в первый день — 2 таблетки по 0,125, затем через каждые 48 ч по 0,125 (10 — 12 таблеток на курс).
Для лечения хронических вирусных гепатитов В, С, В + С назначается от 4 до 6 курсов по 10 — 12 таблеток (общее количество — от 40 — 48 до 60 — 72 таблеток).
Неовир — низкомолекулярный синтетический супериндуктор ИФН. Представляет собой производное карбоксиметилакридона с молекулярной массой менее 300. Неовир активирует стволовые клетки костного мозга, устраняет дисбаланс в субпопуляциях Т-лимфоцитов с активацией эффекторных звеньев Т-клеточного иммунитета и макрофагов. Неовир усиливает активность естественных киллеров, стимулирует продукцию интерлейкина-2 (ИЛ-2), нормализует продукцию фактора некроза опухоли, обеспечивая антитуморогенный эффект. Он также оказывает выраженный стимулирующий эффект на активность полиморфно-ядерных лейкоцитов.
Неовир применяется при остром гепатите А, хронических гепатитах В и С, герпесвирусных инфекциях, а также для лечения и профилактики респираторных инфекций, вызванных вирусами парагриппа, риновирусами, РС-вирусом, аденовирусами, вирусом гриппа.
Неовир выпускается в инъекционной форме в виде стерильного 12,5%-ного раствора в 2 мл физиологически совместимого буфера. Проводится системное (в/в, в/м) введение препарата.
У 3 — 4% больных на фоне лечения неовиром наблюдается подъем температуры до субфебрильных цифр, сопровождающийся артралгиями. В этих случаях рекомендуется комбинированная терапия неовиром и НПВС [13].
Циклоферон — метилглюкаминовая соль карбоксиметилакридона, является синтетическим аналогом природного алкалоида Citrus Grandis. Он обладает пролонгированным противовирусным, противовоспалительным и иммуномодулирующим действием. Циклоферон способен вызывать образование α-, β- и γ-интерферонов в организме. Стимулированная индукция интерферона достигает 60 — 80 ЕД/мл в сыворотке крови. Эндогенный интерферон продуцируют иммунокомпетентные клетки — лейкоциты, макрофаги, фибробласты и эпителиальные клетки человека. Для циклоферона характерна низкая токсичность, отсутствие мутагенного, тератогенного, эмбриотоксического, канцерогенного эффекта, мягкое пролонгированное иммуномодулирующее действие, препарат хорошо сочетается с традиционными средствами терапии.
Выпускается циклоферон в виде 12,5%-ного стерильного водного раствора в ампулах по 2 мл, а также лиофилизированного порошка в ампулах или флаконах по 0,25 г активного вещества. В упаковке содержится 5 ампул или флаконов.
Циклоферон эффективен в отношении вирусов гепатита А, В, С, D, Е, клещевого энцефалита, герпеса, цитомегаловирусной инфекции, ВИЧ-инфекции и др. С успехом применяется для лечения хламидиоза, в комплексной терапии реактивного и ревматоидного артрита. Циклоферон вводится в/в или в/м 1 раз в сутки в дозе 2 мл — 250 мг на 1, 2, 4, 6, 8, 10, 12-й день курса лечения. В острый период заболевания в первый день дополнительно назначается одна в/в или в/м инъекция 4 мл — 500 мг. Для закрепления эффекта возможно повторение курса лечения. Схемы лечения гепатитов: гепатит А — курс лечения 23 дня (на курс 10 инъекций), острая фаза гепатита В — курс лечения 23 дня (на курс 10 инъекций), хронические гепатиты В и С — лечение в течение 70 дней (3 курса по 10 инъекций по 4 мл — 500 мг в/в). Положительный эффект от лечения наблюдается при гепатите А в 98% случаев, остром гепатите В — 75%, хроническом гепатите В — в 60%, хроническом гепатите С — в 25% случаев.
Полудан (полиаденур) — синтетический индуктор интерферона, состоит из двухнитевого комплекса полиадениловой и полиуридиновой кислот. Он обладает иммуномодулирующим действием, индуцируя образование эндогенного α- и β-интерферона. Показано применение полудана при гепатите В, герпетических кератитах и кератоконъюнктивитах. При лечении хронического гепатита В полудан вводится в/в по 150 мг дважды в неделю на 24 недели. Для повышения эффекта от лечения сразу после окончания 6-месячного курса полуданом больного переводят на терапию ИФН-α.
Полигуацил — индуктор интерферона, относящийся к синтетическим полимерам с двуспиральной ДНК. Он стимулирует выработку эндогенного интерферона в клетках крови, печени, затем повышение уровня интерферона наблюдается в селезенке, легких, мышечной ткани, лимфоидных органах. Спектр активности полигуацила охватывает острую фазу вирусных гепатитов, острые энцефалиты, грипп, бешенство. Применение полигуацила системное: в/в, в/м, возможно подкожное, интраназальное и аэрозольное применение препарата.
Кагоцел — препарат природных индукторов интерферонов, который относится к низкомолекулярным полифенолам, производным госсиптола. Он вызывает повышение уровня эндогенного интерферона в крови, печени, селезенке, почках, лимфоидных органах. Кагоцел применяется при гепатитах, клещевом энцефалите, бешенстве, гриппе, ОРВИ. Вводится в/м, п/о.
Рогасин — препарат природных индукторов интерферонов из той же группы, что и кагоцел. Вызывает повышение уровня эндогенного интерферона в крови, печени, селезенке, кишечнике. Доклиническими исследованиями было установлено, что рогасин эффективен в лечении гепатитов А и В и новообразований. Вводится он системно: в/в, в/м, п/к, п/о.
Иммуномодуляторы со способностью индукции эндогенных интерферонов
Интерлейкин-2 (ИЛ-2) представляет собой гликопротеин, индуцирующий пролиферацию и дифференцировку Т-лимфоцитов. Усиление с помощью ИЛ-2 продукции ИФН-α ведет к активации макрофагов.
Интерлейкин-12 (ИЛ-12) активирует ТНJ-лимфоциты и NK-клетки, а также индуцирует выработку ИФН-α и ИЛ-2.
ИЛ-2 и ИЛ-12 назначаются в дозе 500 мкг п/к 2 — 5 раз в неделю на 4 — 6 месяцев. Неспецифическая стимуляция ими ингибирует репликацию ДНК НВV без уничтожения инфицированных гепатоцитов. Биохимическая ремиссия достигается в 20% случаев. Однако после окончания лечения уровень трансаминаз вновь повышается и нормальные показатели сохраняются лишь у 8% больных.
Глицирризин оказывает выраженный иммуномодулирующий эффект, характеризующийся усилением Т-клеточной активности, стимуляцией и продукцией эндогенного g-интерферона, повышением фагоцитарной активности и антителообразования. Глицирризин применяется в лечении хронического репликативного гепатита В. В первый месяц лечения препарат назначают по 40 мл 3 раза в неделю, затем 2 раза в неделю. Терапию глицирризином продолжают не менее года, после чего назначается ИФН. Такое предлечение потенцирует последующий эффект интерферонотерапии у 60% больных с сероконверсией HBeAg, а у части больных наблюдается исчезновение ДНК HBV. Допускается и прямое ингибирующее влияние глицирризина на репликативную активность HBV.
Амантадин — препарат, широко применяющийся для лечения гриппа. В последние годы он стал использоваться для лечения больных хроническими гепатитами. Амантадин использовался в качестве монотерапии в дозе 1000 мг 2 раза в день в течение 6 месяцев. У 30% больных к концу лечения была достигнута биохимическая ремиссия и у более 50% снизилась виремия [1]. В ряде европейских стран (Австрия, Германия) официально применяются схемы «тройной» терапии хронического гепатита С, в ходе которой наряду с ИФН-α и рибавирином используются препараты амантадиновой группы (амантадин, ремантадин, симметрель, мидантан) в суточной дозе 200 мг. Частота доказанного ответа при таком режиме лечения у пациентов с не-1b-генотипом вируса составляет 60 — 70% и 50% у больных с 1b-генотипом вируса, не ответивших до этого на монотерапию ИФН-α или с рецидивом после ее отмены [12].
Тимозин-α — пептид, состоящий из 28 аминокислот, способный модифицировать иммунный ответ организма человека. Используется в клинической практике для лечения «дикого типа» (HBeAg+) HBV-инфекции. Назначается 1 мг тимозина-α 2 раза в день на 6 — 12 месяцев. Однако более целесообразно комбинированное лечение тимозином-α в дозе 1мг 2 раза в день и лимфобластоидным ИФН-α в дозе 3000000 ЕД 3 раза в неделю. После курсового лечения в 1 год эффективность терапии составляет 40 — 73% [1].
Все вышеуказанные препараты уже нашли свое место в клинической практике. Однако в гепатологии существует еще несколько перспективных направлений создания новых противовирусных лекарственных препаратов, о которых нельзя не упомянуть. Помимо недавно вышедших на рынок конъюгированных рекомбинантных ИФН-γ пролонгированного действия, которые сейчас всесторонне изучаются практической медициной, интересным представляется применение в будущем высокоактивных химических соединений, блокирующих ряд ферментов вируса гепатита С — геликазу, протеазу, РНК-зависимую РНК-полимеразу, принимающих участие в механизмах репликации. Клинические испытания проходит схема генной терапии хронического гепатита В с использованием противосмысловых олигонуклеотидов и рибозимов. Разработан также принципиально новый подход к лечению хронического гепатита С, когда в качестве объекта внешнего воздействия («рибосомальные ножницы», Pipe-line) выступает наиболее стабильная часть генома — Core-протеин. Результатом такого подхода стало создание препарата heptozyme, проходящего сейчас вторую фазу клинических испытаний [11, 12].
Литература
В. В. Недогода, доктор медицинских наук
В. В. Скворцов, кандидат медицинских наук
З. С. Скворцова, кандидат медицинских наук
Р. Г. Мязин, кандидат медицинских наук
ВМА, Волгоград
Обоснование длительности терапии и дозы препаратов
Инфицированные вирусом с генотипом 1 и с высоким уровнем HCV-РНК (>2х10 6 копий/мл) лучше реагировали на 48-недельный курс комбинированной терапии рибавирином и интерфероном, чем на 24-недельный.
Международный консенсус Европейской Ассоциации по изучению печени (EASL, 1999 г.)
Эффективность терапии рибавирином
В настоящее время комбинированная терапия пигелированным интерфероном α + рибавирином признана новым «золотым» стандартом в лечении гепатита С.