вирусный метаморфоз что это
Что такое папилломавирусная инфекция (ВПЧ)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Борисова Э. В., гинеколога со стажем в 34 года.
Определение болезни. Причины заболевания
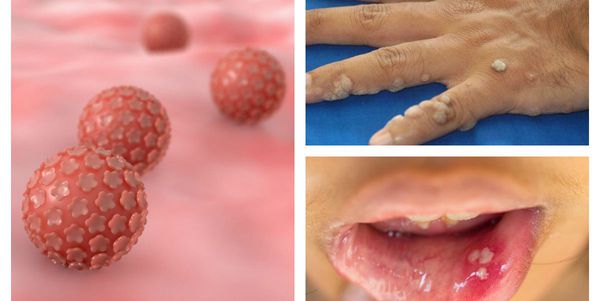
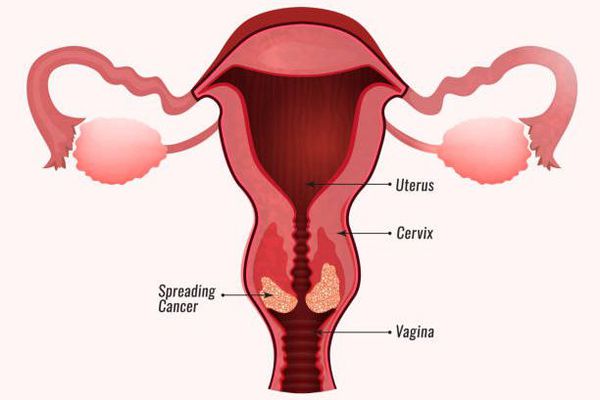
Папилломавирусная инфекция — это состояние, развивающееся при заражении какой-либо разновидностью вируса папилломы человека (ВПЧ). Возбудители данной группы могут существовать только в человеческом организме, поражая кожу и слизистые оболочки, приводя к появлению папиллом, бородавок, плоских и остроконечных кондилом. [1] [2] [4]
ВПЧ довольно широко распространён в человеческой популяции, особенно среди сексуально активных людей, а это свыше 80% всего населения. До недавнего времени вирусы этой группы считались относительно безобидными, вызывающими лишь косметические дефекты, но последние научные исследования показывают, что проблема гораздо серьёзнее. [9]
Чаще всего заражение происходит в молодом возрасте, как правило, с началом половой жизни, при этом возможно неоднократное инфицирование. Наиболее уязвимой группой в плане вероятности заражения ВПЧ и развития неблагоприятных последствий являются молодые женщины в возрасте 15-30 лет.
Помимо этого ВПЧ может перейти от инфицированной матери к ребёнку, например, при родах. Не исключается и контактно-бытовой способ передачи возбудителя, например, при соприкосновениях и даже при совместном использовании предметов личной гигиены.
К факторам риска, способствующим заражению ВПЧ, развитию хронической папилломавирусной инфекции и её переходу в предраковые состояния с потенциальным перерождением в злокачественную опухоль, относятся:
Симптомы папилломавирусной инфекции
Далеко не всегда человек догадывается о наличии в своём организме папилломавирусной инфекции, оставаясь при этом источником заражения для потенциальных партнёров. [1] [2] Дело в том, что заболевание может долгое время протекать бессимптомно: вирус скрыто существует в организме от нескольких месяцев до нескольких лет, никак себя не проявляя. Кроме того, уже имеющиеся проявления инфекции не всегда доступны для наружного обзора. Например, если папилломы, бородавки и кондиломы на открытых участках тела и поверхности гениталий ещё можно заметить самостоятельно, то патологические изменения, локализующиеся на шейке матки, сможет обнаружить только специалист в ходе осмотра с применением соответствующих инструментов.
И всё же существует несколько симптомов, которые прямо или косвенно могут указывать на наличие папилломавирусной инфекции и её неблагоприятных последствий. [3] К ним относятся:
Наиболее тревожными признаками заболевания являются:
Патогенез папилломавирусной инфекции
Заражение папилломавирусной инфекцией происходит при попадании вирусных частиц на кожу или слизистую оболочку. [1] [2] Излюбленная локализация инфекции на теле женщины — промежность, большие и малые половые губы, вульва, влагалище и шейка матки, у мужчин — половой член. Может также произойти поражение слизистой полости рта, пищевода, мочевого пузыря, трахеи, конъюнктивы и других органов и тканей.
Заражению способствуют микротравмы и потёртости. Особенно благоприятные для инфицирования условия создаются при половом акте. В 60–80% случаев достаточно однократного сексуального контакта с больным папилломавирусной инфекцией или бессимптомным носителем ВПЧ. К развитию заболевания может привести попадание в организм буквально единичных вирусных частиц.
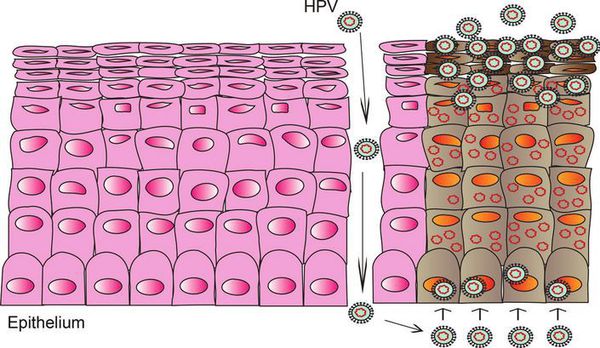
При наличии предрасполагающих факторов (микроповреждения, слабого иммунитета и других) возбудитель проникает в эпителиальную ткань до её базального слоя. Там он прикрепляется к оболочке незрелой клетки и внедряется сначала в её цитоплазму, а затем и в ядро, где повреждает генетический аппарат. После этого начинается деление клеток с изменённым геномом, что приводит к появлению в месте внедрения вируса генитальных кондилом (образований, которые постепенно разрастаются), а, например, на шейке матки — к развитию диспластических процессов различной степени тяжести (дисплазия шейки матки).
В случае ВПЧ высокого онкогенного риска определённые гены в вирусной ДНК кодируют синтез специфических белков-онкопротеинов (Е6 и Е7), которые подавляют противораковую защиту клеток. Под действием онкопротеинов нарушается стабильность генома клеток, стимулируется их размножение и снижается способность к дифференцировке — всё это со временем может привести к онкопатологии. [12]
Формирование новых полноценных вирусных частиц, способных инфицировать другого человека, происходит уже не в базальном, а в самых поверхностных слоях поражённого эпителия. Возбудитель может содержаться в слущивающихся отмирающих клетках, которые отделаются слизистой оболочкой. Таким образом они переходят к новому хозяину при тесном (сексуальном или бытовом) контакте.
Классификация и стадии развития папилломавирусной инфекции
По способности индуцировать развитие злокачественных новообразований ВПЧ подразделяют на четыре группы: [8]
Максимально опасными считаются 16-й и 18-й типы: на их долю приходится до 70% случаев рака шейки матки. [7] [8]
Клинические формы папилломавирусной инфекции: [5]
Латентная инфекция может переходить в субклиническую и манифестную форму в случае возникновения предрасполагающих условий (факторов риска), но чаще всего она протекает бессимптомно, не манифестируя.
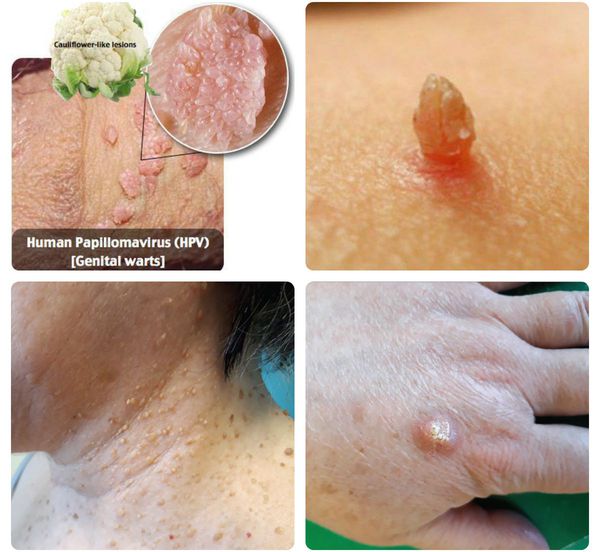
Клинические проявления папилломавирусной инфекции:
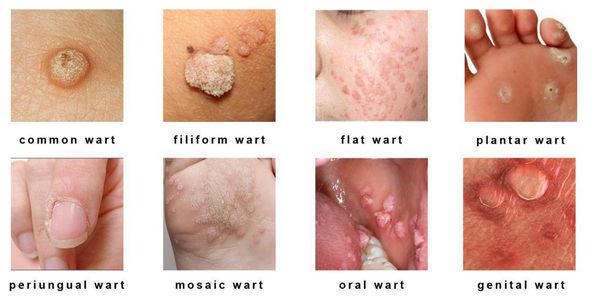
Разновидности поражений:
Осложнения папилломавирусной инфекции
Основными наиболее опасными осложнениями папилломавирусной инфекции являются злокачественные новообразования. Но возможны и другие серьёзные последствия:
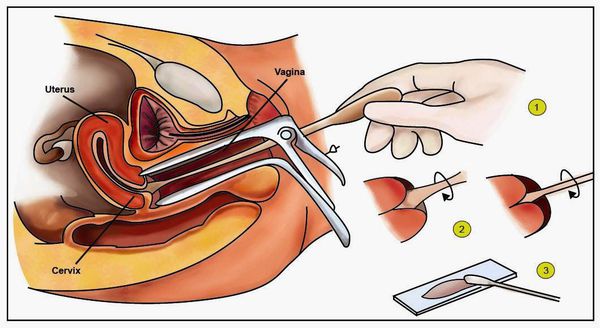
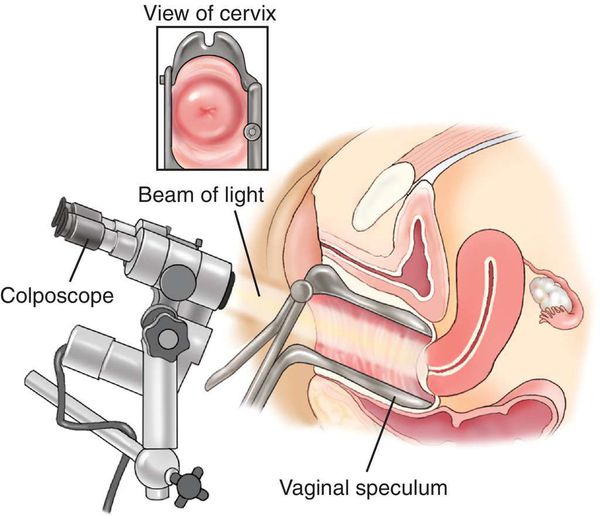
Диагностика папилломавирусной инфекции
Основные цели диагностических мероприятий: [3]
Для выявления папилломавирусной инфекции на сегодняшний день существует целый комплекс диагностических процедур:
Целесообразно дополнительное обследование пациента на наличие других инфекций, передающихся половым путём, так как папилломавирус в 90% случаев с ними сочетается, и это может осложнять течение заболевания.
Лечение папилломавирусной инфекции
Лечение папилломавирусной инфекции должно быть комплексным и включать следующие составляющие: [3] [5]
Деструктивные методы делятся на две основные группы:
Лечение сопутствующих половых инфекций проводят до начала деструктивной терапии на фоне адекватной иммунокоррекции.
Удаление видимых проявлений папилломавирусной инфекции должно сочетаться с противовирусной терапией — как с общей, так и с применением препаратов местного действия после удаления кондилом.
Следует помнить, что успешно проведённое лечение не исключает развитие рецидивов в дальнейшем, особенно у пациентов с нарушениями иммунитета. Поэтому за ними устанавливается динамическое наблюдение в течение как минимум 1-2 лет.
Прогноз. Профилактика
В 90% случаев здоровая иммунная система человека справляется с папилломавирусной инфекцией самостоятельно за период от полугода до двух лет с момента инфицирования, после чего происходит полное выздоровление с исчезновением вируса из организма. При этом не формируется напряжённого пожизненного иммунитета, то есть человек может заразиться повторно.
В других случаях, при наличии предрасполагающих факторов, заболевание приобретает хроническую форму, склонную к длительному скрытому течению с периодическими рецидивами и возможным развитием тяжёлых осложнений.
От момента попадания вируса в организм до развития предраковых состояний и тем более возникновения рака может пройти достаточно много времени, иногда десятки лет. Поэтому регулярные профилактические обследования, своевременное выявление и лечение предраковых состояний — вполне реальный и эффективный способ избежать самого неблагоприятного варианта развития событий. [13] С этой целью Всемирная организация здравоохранения рекомендует всем женщинам старше 30 лет при первичном скрининге проходить не только “рутинное” цитологическое исследование, но и делать тест на наличие ВПЧ. [10]
Регулярное посещение гинеколога (при отсутствии каких-либо жалоб — раз в год) с проведением теста Папаниколау позволяет своевременно обнаружить начальные признаки дисплазии и предпринять все необходимые меры для предотвращения прогрессирования процесса и его перехода в онкологическое заболевание.
Использование методов барьерной контрацепции хоть и не полностью защищает от инфицирования, но несколько снижает его вероятность.
Главным методом первичной профилактики папилломавирусной инфекции считается вакцинация. [11] Современные вакцины разработаны с целью защиты от наиболее опасных, высокоонкогенных штаммов ВПЧ, ответственных за 70-80% случаев развития рака шейки матки. Стандартный курс, состоящий из трёх прививок, даёт вполне надёжную защиту.
Целесообразно вакцинировать детей (девочек, а для сдерживания распространения инфекции и мальчиков) с 9-10 до 17 лет, а также молодых женщин (18-25 лет) до вступления в половую жизнь, так как вакцина предотвращает заражение, но не является средством лечения уже развившейся инфекции. Если пациентка уже живёт половой жизнью, то перед вакцинацией ей необходимо пройти исследование на наличие папилломавирусной инфекции. Однако даже при выявлении одного из штаммов, входящих в состав вакцины, проводить вакцинирование всё равно можно, так как это не является противопоказанием.
Как вирусы обманывают человека?
Метафорическая зарисовка. Представители различных генетических вариантов SARS-CoV-2 собрались за круглым столом и обсуждают план захвата мира. Рисунок в полном размере.
Автор
Редакторы
Статья на конкурс «Био/Мол/Текст»: Вирусы умеют не только размножаться внутри клеток хозяина, но и прятаться от его иммунитета. Способов избежать фатальных встреч с оборонными силами организма существует множество, но один из самых хитрых (и потому особенно интересных) механизмов демонстрируют вирусы с измененными генетическими последовательностями. Эта статья расскажет, что такое генотипы и генетические варианты вирусов и почему так важно о них знать.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Вирусы и микроорганизмы» конкурса «Био/Мол/Текст»-2020/2021.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.
Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Зачем нам знать о генетических вариантах вирусов?
Новости о коронавирусе на протяжении всего 2020 года оставались самыми читаемыми, а количество научных публикаций о SARS-CoV-2 почти в пять раз превысило число статей по другой «громкой» теме — системам CRISPR/Cas: по данным PubMed их уже больше 60 тысяч! И здесь важнее следить не столько за драматической статистикой заражений и исходов, сколько за потенциалом и способностями возбудителя. Ведь вирусы умеют мутировать и порождать таким образом новые генетические варианты [1].
Генетические варианты вируса — это геномы какого-то вида (или штамма) вируса, отличающиеся друг от друга по последовательности нуклеотидов, и эти отличия могут обусловливать появление новых штаммов. «Генотип», «субтип», «генетический вариант» — термины, отражающие степень геномных различий (в порядке убывания).
По мере накопления знаний по этой теме опасения ученых лишь крепли: мутации могут влиять как на вирулентность, так и на тяжесть протекания заболевания, развитие лекарственной устойчивости и вероятность повторного заражения [2].
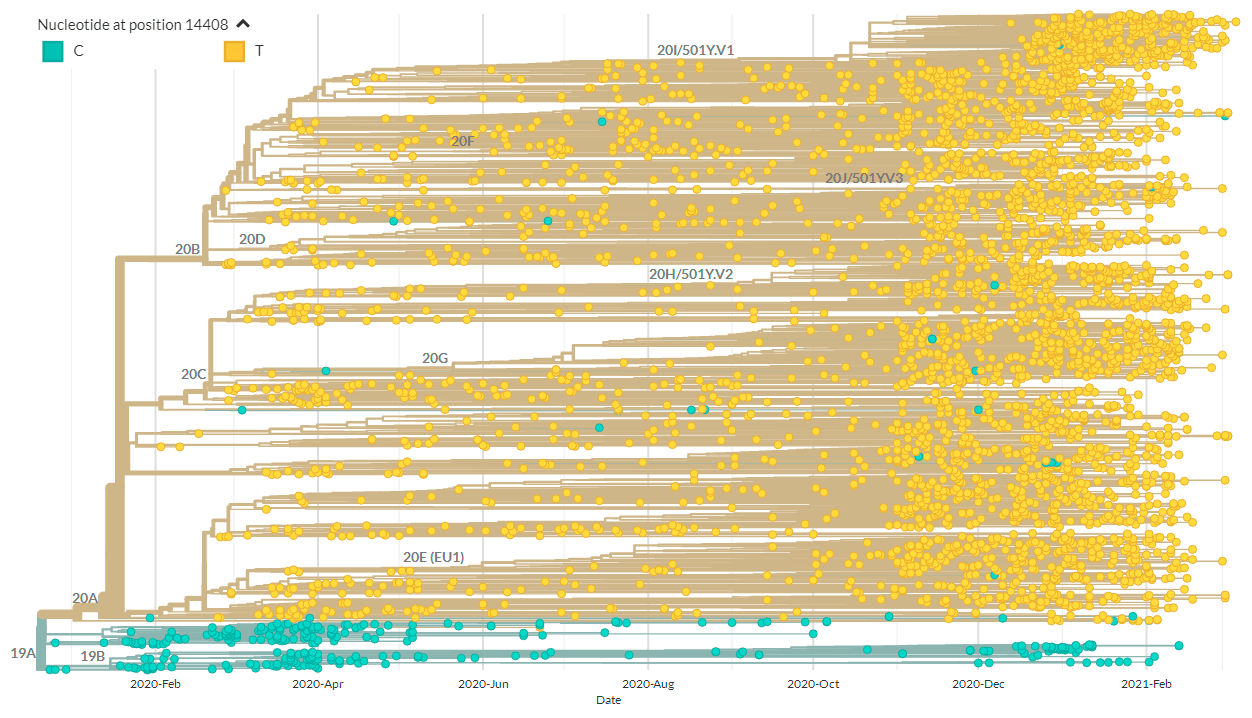
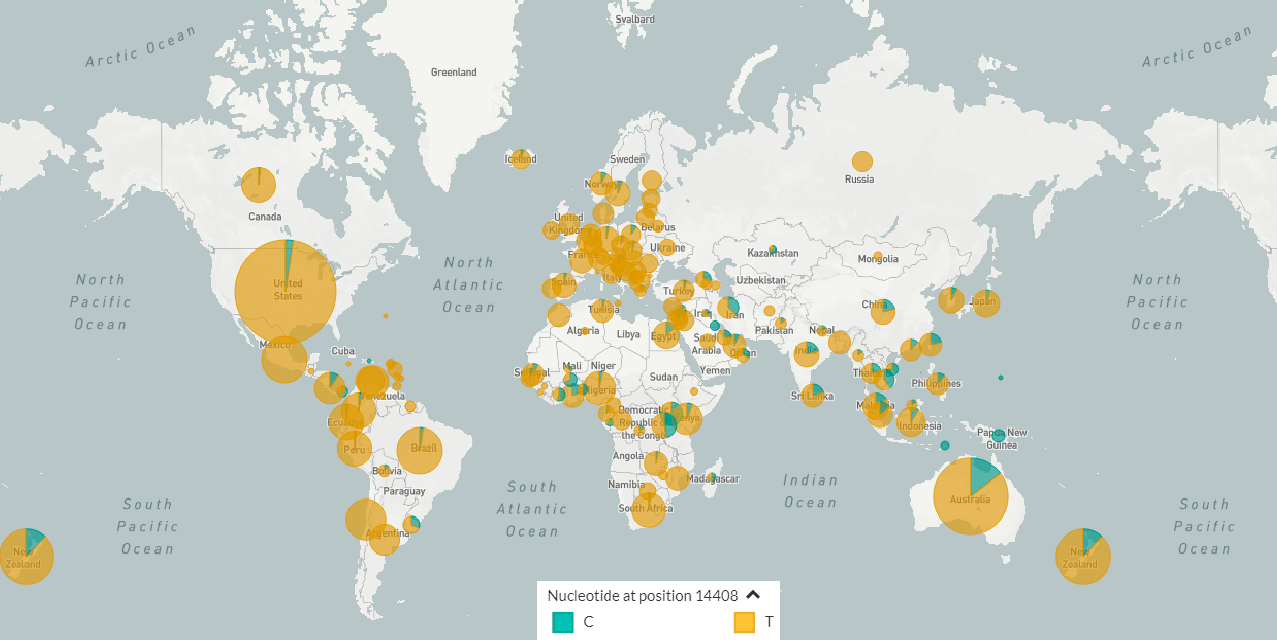
У SARS-CoV-2 весной 2020 года выделяли 3 генотипа: A, B и C [1]. Но сейчас особое внимание обращают на некоторые генетические варианты этого вируса и их географическое распределение (рис. 1) [3]. Известно, что даже самое маленькое изменение в генетическом материале возбудителя способно сильно сказаться на протекании либо распространении заболевания. На что же могли повлиять мутации в геноме SARS-CoV-2?
Рисунок 1а. Схематическое изображение эволюции SARS-CoV-2
Рисунок 1б. Карта распространения генетических вариантов SARS-CoV-2
Например, единственная мутация в гене поверхностного белка (spike-белка), вызвавшая замену его 614-й аминокислоты — D614G, — способствовала распространению SARS-CoV-2 по миру [4], [5].
Другая мутация, C14408T, в последовательности, кодирующей вирусную РНК-зависимую РНК-полимеразу (RdRp), потенциально способна влиять на развитие лекарственной устойчивости [6], [7]. Но самым поразительным можно считать случай, когда у пациента один генетический вариант SARS-CoV-2 заместился другим [8]. Дело в том, что наша иммунная система выстраивает защиту, по сути, от определенного вирусного генотипа. Если же вирус меняется, организм, встречавшийся с его предшествующим вариантом, новый может и не узнать.
Однако можно чуть-чуть успокоиться: мутации SARS-CoV-2 хоть и устроили хорошую суматоху, но так и не показали пока явной клинической значимости — в отличие от изменений ряда других вирусов. О них и пойдет речь дальше.
Вирусы гепатитов и компания
Гепатиты
В 2020 году Нобелевскую премию по физиологии или медицине вручили за открытие возбудителя одного из гепатитов — вируса гепатита С (ВГС, HCV) [9]. Болезнь может протекать без видимых симптомов, но при этом вирус сильно поражает печень. В крайних случаях развивается цирроз или даже рак печени [10]. К счастью, уже есть эффективные средства от гепатита С: по словам нобелевского лауреата Харви Олтера, противовирусные препараты прямого действия позволяют излечивать 95–98% пациентов [9]. Так в чем же подвох?
Интересно, что ВГС генотипов 1 и 4 обычно хуже поддаются терапии и требуют более продолжительного лечения, чем 2 и 3 [12].
| Генотипы ВГС | Субтипы |
|---|---|
| Генотип 1 | 1a, 1b |
| Генотип 2 | 2a, 2b, 2c, 2d |
| Генотип 3 | 3a, 3b, 3c, 3d, 3e, 3f |
| Генотип 4 | 4a, 4b, 4c, 4d, 4e, 4f, 4g, 4h, 4i, 4j |
| Генотип 5 | 5a |
| Генотип 6 | 6a |
| Генотип 7 |
При этом из-за высокой генетической вариативности, то есть больших различий между вирусными генотипами (до 30–35%), против ВГС не получается создать эффективную вакцину. Проблема усугубляется тем, что для тестирования прототипов вакцин нужны небольшие модельные животные, а получить мышей, способных одновременно болеть гепатитом С и имитировать человеческий иммунный ответ на инфекцию, очень трудно. И наконец, для изучения вируса in vitro нужно нарабатывать заразные частицы ВГС, а способные на это клеточные культуры появились лишь недавно [14].
Секвенирование вирусного генома показало, что в России циркулирует рекомбинантный вариант ВГС (RF2k/1b), генетически сходный с генотипами 1 и 2 одновременно. Из-за такой маскировки детекция этого генотипа затруднительна, а значит, и лечение бывает менее эффективным [15].
Итак, чтобы эффективно справиться с гепатитом С, нужно определить генотип его возбудителя. Не менее важно знать и генотип вируса, вызывающего другой гепатит — гепатит B. Да, от ВГВ (HBV) существует прививка [16]. Но! Есть основания считать, что генотипы ВГВ, несмотря на относительно небольшую вариативность (около 8% генома), по-разному влияют на тяжесть заболевания [17], [18].
Стоит, однако, учитывать, что результаты исследований связи вирусных генотипов с особенностями течения болезни весьма противоречивы. Чаще всего это связано с недостаточным размером изученных выборок, что, в свою очередь, обусловлено сложностями массового генотипирования. Из-за этого, например, на Тайване развитие гепатоцеллюлярной карциномы связывают с ВГВ генотипа В, а в Японии и КНР — с ВГВ генотипа С [19]. Тем не менее некоторые авторы приходят к выводу, что генотип ВГВ вообще не имеет большого клинического значения [20].
Хоть пока и нет общих рекомендаций проводить генотипирование ВГВ, ряд ученых призывает сделать его обязательным, поскольку пангенотипной терапии в случае гепатита В не разработано, а эффективность лекарств порой разнится в зависимости от генотипа.
Детекция генотипа вируса может стать хорошим подспорьем для врачей как минимум в двух направлениях: в определении вероятности развития той или иной формы болезни у конкретного пациента и в персонализации лечения. Однако подобных исследований крайне мало, можно даже сказать, что это поле еще совсем не пахано.
Денге
Мы уже заметили, что при разработке вакцин необходимо знать и учитывать разнообразие генотипов вируса. В этом отношении яркими примерами могут служить подходы к производству вакцин от гриппа и менее распространенной болезни — лихорадки денге, о возбудителе которой мы сейчас и расскажем [21].
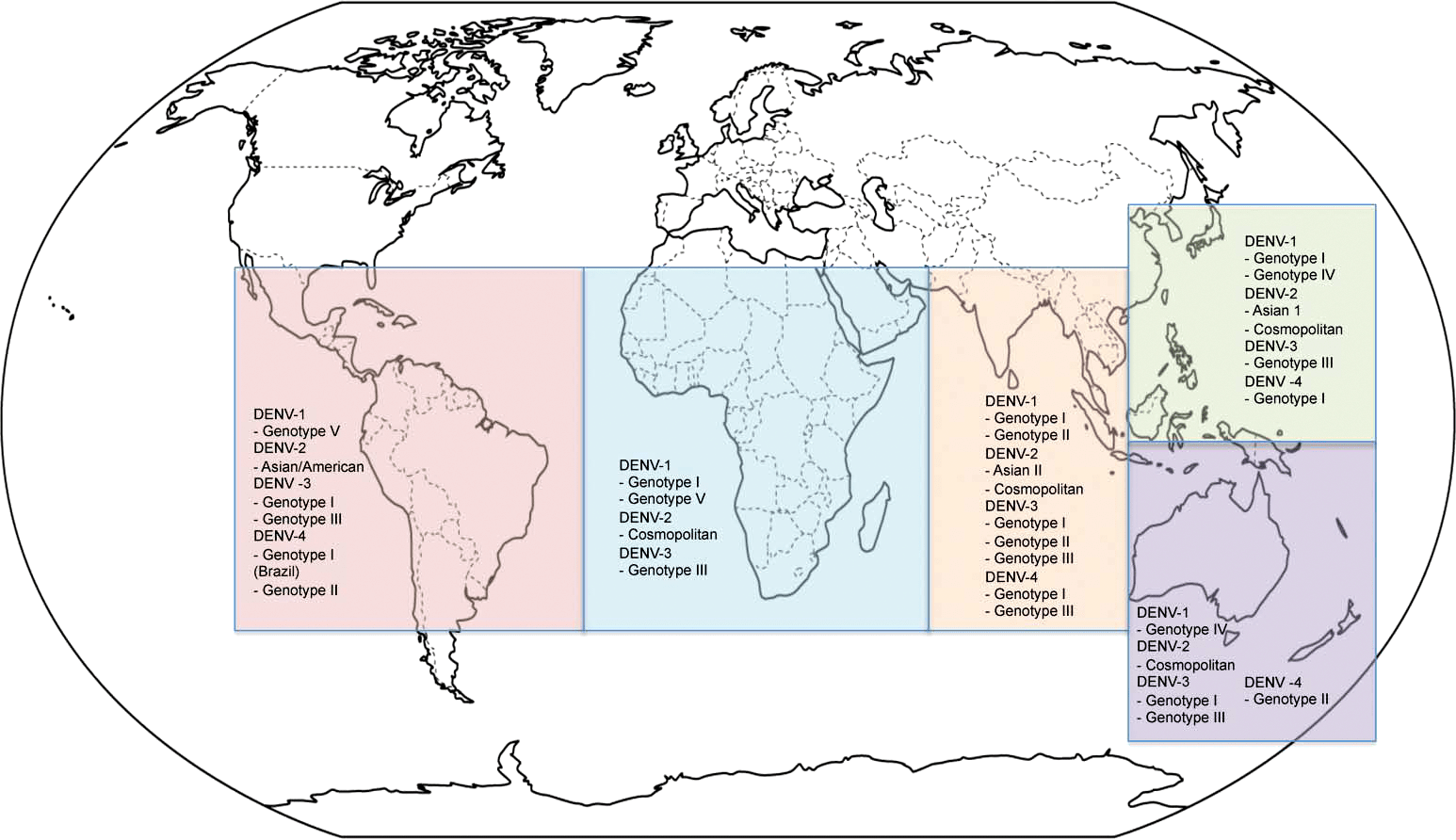
Рисунок 2. Географическое распределение эндемичных по вирусу денге районов в 2011 году
У вируса денге выделяют четыре серотипа, то есть четыре группы вирусов с общей антигенной структурой. Генотипов у этого возбудителя больше, соответственно, и отслеживать их сложнее. Увы, но знания серотипа порой недостаточно для качественной вакцинации. Например, низкую эффективность одной из проходивших клинические исследования вакцин против серотипа 2 можно объяснить большой вариативностью составляющих его генотипов [22].
Существует мнение, что если эффективность вакцин против денге в новых клинических исследованиях останется низкой, при создании вакцинных препаратов необходимо будет отталкиваться именно от результатов генотипирования [21]. Это нужно и для исключения возможного антителозависимого усиления инфекции в случае, если вакцина будет защищать не от всех серотипов/генотипов, с которыми может встретиться отдельный организм.
Примечание
Антителозависимое усиление инфекции (ADE, antibody-dependent enhancement) — феномен, при котором связывание вируса с cубоптимальными нейтрализующими или не нейтрализующими антителами способствует его проникновению в иммунные клетки с последующей репликацией в них. Из-за ADE непроверенные вакцины могут быть очень опасными: при встрече с инфекцией вместо обеспечения защиты некоторые из них способны утяжелять течение заболевания [23].
Подводя итог, можно сказать, что знание генотипов вирусов необходимо для отслеживания распространения заболеваний по миру, для их лечения, а также для получения эффективных вакцин. К сожалению, пока генотип-специфичная борьба с инфекциями сильно ограничивается в том числе и недостатком информации о вирусных штаммах.
Но как вообще появляется это штаммовое разнообразие?
Вирусная хитрость: механизмы изменения геномов
Вирусы способны изменять свои свойства внутри клеток хозяев и в результате становиться заразнее и опаснее. Впрочем, не стоит пугаться. Обычно вирусная эволюция протекает в сторону снижения летальности, поскольку вирусу, который не убивает своего носителя и почти не вызывает симптомов, намного проще распространиться в популяции. Хоть геномы вирусов и изменяются с довольно высокой частотой, на деле мутации чаще оказываются нейтральными, не влекущими заметных последствий для вируса и его хозяина. Очень немногие из них действительно вносят вклад в дальнейшую эволюцию [24].
В основе способности вирусов к изменениям лежат мутации и/или обмен генетическим материалом между разными вирусами, результаты которых закрепляются или не закрепляются давлением естественного отбора.
Мутация — это изменение последовательности нуклеотидов в определенном участке генома, нередко приводящее к изменениям структуры и/или функций организма или вируса. Мутации могут возникать из-за ошибок работы ферментов, создающих копии геномов, или под действием среды.
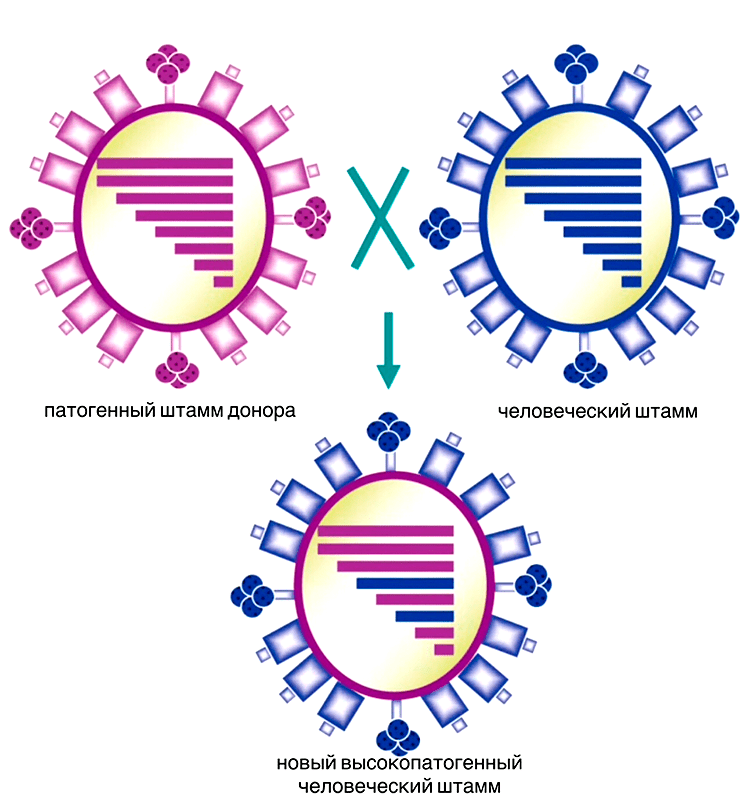
Когда одну и ту же клетку заражает два родственных вируса, могут образовываться гибридные вирусы, содержащие измененный по сравнению с родительскими формами генетический материал. Этот процесс называют рекомбинацией или реассортацией, если у вирусов сегментированный геном (в частицу он упаковывается отдельными сегментами типа мини-хромосом) [25].
Для справки
До введения термина «реассортация» в научный обиход рекомбинацией называли любой обмен генами, включая и те процессы, которые сейчас со знанием дела именуют реассортацией [25].
Реассортация очень напоминает появление детей у родителей: когда два разных вириона попадают в одну клетку и приступают к размножению, они могут обменяться частями геномов (рис. 3). В результате получится новая вариация (штамм) вируса, которая может значительно отличаться от своих предков [25]. Такие вирусы порой становятся неузнаваемыми для иммунной системы и распространяются, вызывая эпидемии и пандемии. Этот сценарий характерен, например, для вирусов гриппа. Некоторые исследователи винят в пандемии той же «испанки» именно вирусную реассортацию [26].
Рисунок 3. Реассортация вирусов, которая приводит к появлению штамма с измененным генетическим материалом
Благодаря мутациям и обмену генетическим материалом вирус может даже менять своего хозяина. Так SARS-CoV-1 от летучих мышей перешел в семейство виверровых (к мусангам и циветам), а затем и к людям. В начале 2000-х этот вирус вызвал эпидемию, охватившую 29 стран [28].
Новые генотипы могут возникать и в ходе лабораторных пассажей, когда вирусом последовательно заражают нескольких животных, выделяя из них новую чистую культуру возбудителя [29]. Такая процедура нужна, в частности, для тестирования противовирусных лекарств и вакцин.
Свойства вируса во время пассажей меняются ступенчато. В первых пассажах в основном обнаруживают вирионы, изменившие какой-то один генетический признак. Но с увеличением числа пассажей у подавляющего большинства вирусных частиц наблюдают изменение многих генетических признаков.
Кроме рекомбинации и мутаций, изменчивость вируса может быть обусловлена влиянием хозяина (host-controlled variation). Такие модификации не затрагивают генетический материал вируса и встречаются, например, у ДНК-содержащих бактериофагов, вирусов гриппа и Сендай. Клетка может влиять на характер синтезируемых в ней вирусных компонентов. Или в вирусную частицу могут попадать хозяйские белки и липиды. Поэтому при смене клетки-хозяина в структуре оболочки вириона меняются и антигены, с помощью которых организм узнает вирус.
Итак, образование новых вирусных генотипов — совершенно обычное явление, основанное на стандартных эволюционных процессах. Однако как нам эти генотипы детектировать?
Как выявляют генотипы вирусов?
Теперь, когда мы знаем, как возникают вирусные генотипы и как от генетического варианта возбудителя могут зависеть течение, распространение и лечение заболевания, перейдем к обсуждению лабораторных методов. Они позволяют нам определять, вирус какого генотипа вызвал болезнь у конкретного пациента. Рассмотрим методы детекции генотипов на примере вируса ВГС. В настоящее время лабораторные анализы, используемые в схемах диагностики и лечения гепатита C, представлены серологическими тестами для обнаружения антител к ВГС, молекулярными тестами для выявления и количественной оценки РНК ВГС, а также методами генотипирования возбудителя [30].
При первоначальной диагностике гепатита C учитывают симптоматику и уровни ферментов печени (особенно аланинаминотрансферазы, АЛТ) в крови. У пациентов с подозрением на гепатит C иммуноферментным анализом (EIA) [31] или хемилюминесцентным иммуноанализом (CIA) выявляют антитела к ВГС. В популяциях с низким риском инфицирования этим вирусом отрицательного результата EIA или CIA достаточно, чтобы исключить заражение гепатитом C. Но важно помнить, что у пациентов с ВИЧ или последней стадией почечной недостаточности серологические тесты на антитела к ВГС могут давать ложноотрицательные результаты. Если тест выявил антитела или допускается возможность ложноотрицательного результата, в организме пациента должны искать РНК самогό вируса.
Определение статуса инфекции ВГС, решение о лечении и мониторинг ответа на него зависят от трех важных факторов: обнаружения РНК вируса гепатита С, ее количества и вирусного генотипа. Для оценки всех этих параметров есть несколько коммерческих тест-систем. Они различаются по диапазону обнаружения, чувствительности, специфичности, стоимости и сложности использования.
Выявление РНК вируса гепатита С основано на принципе амплификации нуклеиновых кислот [32], причем применяют здесь комбинацию разновидностей полимеразной цепной реакции (ПЦР): качественную ПЦР, опосредованную транскрипцией амплификацию (ТМА) и количественную ПЦР в реальном времени.
Генотипирование ВГС необходимо для назначения оптимальной схемы лечения. Генотип этого вируса можно определить несколькими методами, нацеленными на гены вирусных белков (E1, NS4 и NS5) и на 5′-нетранслируемую область (5′-UTR) генома ВГС. Они включают простую ПЦР, гибридизацию с генотип-специфичными зондами и ПЦР в реальном времени. Однако для более точного определения вирусного генотипа следует прибегать к методам секвенирования нового поколения (NGS) [33].
Наш проект HaploSense
Как мы уже поняли, определять генотипы сложно, поскольку практически нет быстрых и доступных тестов. Наша команда студентов и аспирантов под названием Moscow 2020 решила изменить эту ситуацию.
На международном конкурсе iGEM в этом году мы представили проект детектора генотипов вируса гепатита С. В основе детекции лежит система CRISPR-Cas, с которой многие читатели уже знакомы [34], [35], а принцип работы напоминает популярные методы детекции SHERLOCK (Specific High sensitivity Enzymatic Reporter unLOCKing) и DETECTR (DNA Endonuclease Targeted CRISPR Trans Reporter) [35]. Но есть и важные отличия, о которых сейчас расскажем.
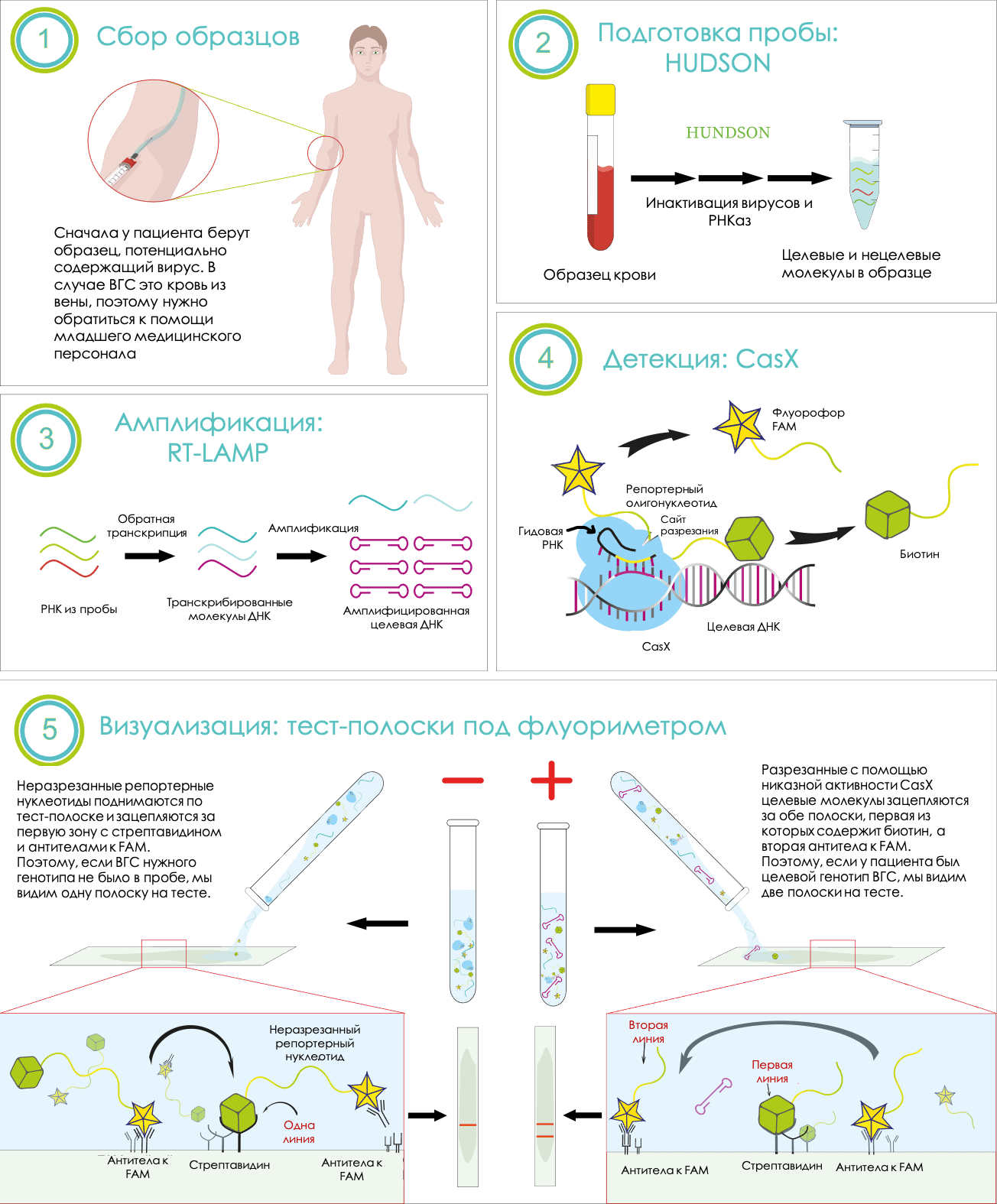
В своей тест-системе мы использовали самый маленький из открытых к этому моменту Cas-белков — CasX (или Cas12e) из Deltaproteobacteria: он состоит из 980 аминокислотных остатков по сравнению с 1300 у Cas9 [36]. Как и Cas13a с Cas12a, маленький CasX обладает коллатеральной нуклеазной активностью (может неспецифически резать нуклеотидные последовательности, с которыми встретится после связывания с мишенью): она позволяет разрезать олигонуклеотиды с флуоресцентными метками после прикрепления белка к геному вируса. Но ВГС — РНК-содержащий вирус, поэтому для связывания с ним CasX нужно провести дополнительную реакцию: с помощью обратной транскрипции получить комплементарную последовательность ДНК.
Итак, в нашей системе четыре основные стадии (рис. 4):
Пока наша тест-система предполагает определение только одного генетического варианта ВГС — рекомбинантного RF2k/1b, распространенного в России. В 2020 году доступ в лабораторию для нас был закрыт, поэтому систему предстоит еще собрать и протестировать. Если все лабораторные испытания пройдут успешно, мы планируем расширить специфичность системы на все генотипы вируса, не умножая при этом количество приборов.
Рисунок 4. Схема детекции генотипов ВГС с помощью HaploSense
Такая на первый взгляд сложная система позволит определять генотип возбудителя гепатита С быстрее, вне специально оборудованной лаборатории и с не меньшей точностью, чем ПЦР. Мы надеемся, что когда-нибудь такой подход поможет сделать тестирование массовым и доступным.
Подробнее о iGEM
В 2020 году команда студентов с биологического факультета МГУ представила свою разработку на самом престижном международном конкурсе по синтетической биологии — The International Genetically Engineered Machines competition (iGEM). С английского название переводится как «Международное соревнование генно-инженерных машин». Это соревнование учредили в 2003 году в Массачусетском технологическом институте (Бостон, США). Школьники, студенты и аспиранты со всего мира и с разным академическим бэкграундом, начиная от журналистов и экономистов и заканчивая айтишниками и биологами, собираются в команды, в течение года работают над актуальной задачей и представляют свои проекты на осенней, финальной конференции Giant Jamboree. Конкурс iGEM уникален тем, что формирует открытое сообщество людей, которые обмениваются друг с другом и миром своими наработками. Выгодно отличают конкурс также комплексность и разноплановость проектов: упор делается на применение инженерных принципов и подходов, использование методов моделирования, обсуждение и проработку проекта с потенциальными пользователями и экспертами из разных областей (науки, бизнеса, права, государственного управления и т.д.). Образовательная деятельность, популяризация наук, налаживание между учеными и обществом мостов с целью обсуждения актуальных проблем — все это тоже входит в задачи команды. В этом году из-за пандемии конкурс проходил онлайн. Ядро нашей команды составляли студенты биологического факультета МГУ, которые получили бесценный опыт и выиграли золотую медаль. Однако подробнее об iGEM мы поговорим с вами в следующий раз [39].
Работа в команде
В конце марта 2020 года команда Moscow 2019 собрала новый состав для участия в конкурсе iGEM (рис. 5). Тогда впервые встретились незнакомые друг другу люди с общим желанием — создать проект в области синтетической биологии, который мог бы что-то изменить в мире.
Идея нашего проекта появилась только спустя полтора месяца, в начале мая. iGEM предлагает полную тематическую свободу: можно делать хлеб из дрожжей на Марсе, очищать воду бактериями, синтезировать натуральную краску для волос или разрабатывать системы мониторинга заболеваний. На выбор темы для нашего проекта сильно повлиял руководитель команды, Алексей Константинович Шайтан. Его лаборатория использует в работе системы CRISPR-Cas, а на их основе можно создавать детекторы заболеваний. Пандемия COVID-19 только начиналась, но уже было ясно, что SARS-CoV-2 необходимо выявлять быстро, массово и с высокой точностью. Так мы и создали наш проект — с целью детектировать генотипы коронавируса.
Очень важное требование конкурса — актуальность разработки. Другими словами, важно было понять, что наш проект нужен людям и его будут использовать. Этим проекты iGEM сильно отличаются от рутинной работы научных лабораторий. Именно поэтому мы встречались с экспертами, писали письма главному эпидемиологу Министерства здравоохранения, Николаю Ивановичу Брико, размещали посты в социальных сетях. Обратная связь полностью изменила наш проект: HaploSense переориентировался на детекцию генотипов вируса гепатита С.
С другой стороны, важен был сам детектор — как он будет работать, выглядеть, сможем ли мы его вообще собрать. Здесь нам на помощь пришел спонсор, компания BIOCAD. Эксперты компании консультировали нас относительно идеи проекта и ее реализуемости в столь короткие сроки. Они рассказали нам, как готовить патенты и выводить продукт на рынок. А это далеко не простые процессы.
В результате мы проанализировали гору тематической литературы, смогли придумать целостную систему на основе технологий CRISPR-Cas, провели ее моделирование и биоинформатический анализ.
Надо сказать, что организаторы iGEM помогают командам на протяжении всего пути: устраивают семинары, знакомят со специалистами, создают удобные платформы. А особенно поддерживают взаимодействие между командами. Все полгода мы общались и встречались с мотивированными ребятами из Америки, Эстонии, Индии, Франции, Германии и России (в этом году в конкурсе участвовали две команды из нашей страны). После таких встреч мы понимали, что можем сделать хороший, качественный проект, даже будучи студентами.
Рисунок 5. Команда iGEM Moscow 2020
Пандемия, конечно, сыграла свою роль в работе нашей команды: мы работали дистанционно и встречались друг с другом офлайн всего четыре раза. По-настоящему сплоченными мы стали, когда приблизились конкурсные дедлайны. Мы уложились в срок благодаря слаженной работе команды. Одному человеку было бы невозможно справиться: кроме разработки идеи проекта, моделирования и проведения экспериментов нам предстояло сделать сайт с описанием проекта, два видео о команде и работе, заполнить форму безопасности, написать обзор по теме, да и это еще не все. Именно поэтому проект iGEM — прежде всего командная работа.
Итоги конкурса подводятся осенью, в начале ноября, на Giant Jamboree — огромной конференции, где команды, профессора, лекторы и судьи собираются, чтобы обсудить проекты, подметить их сильные и слабые стороны, сформировать новые коллаборации и просто хорошо провести время. Это финал iGEM: проекты уже подготовлены, критерии конкурса соблюдены. Казалось бы, можно выдохнуть… Но здесь же команды встречаются с судьями — исследователями, которые будут оценивать проекты и детально их рецензировать. Мы, конечно, тоже общались с судьями (в этом году онлайн): в воскресенье, в 17:00, нас спрашивали, почему мы использовали LAMP, сколько тест-полосок будем применять, ну и много чего другого. А после нашу команду ждала неделя, полная лекций по синтетической биологии и общения с коллегами со всего мира, а также викторины по синтетической биологии и церемония награждения. В итоге мы выиграли золотую медаль и создали хороший проект, который продолжим развивать и, надеемся, доведем до состояния полноценной тест-системы, подходящей для обычных поликлиник.
Мы советуем всем молодым исследователям принимать участие в iGEM. Этот конкурс стал для нас лучшим событием 2020 года. Создать проект с нуля возможно, нужно только желание!