вирусная репликация что это
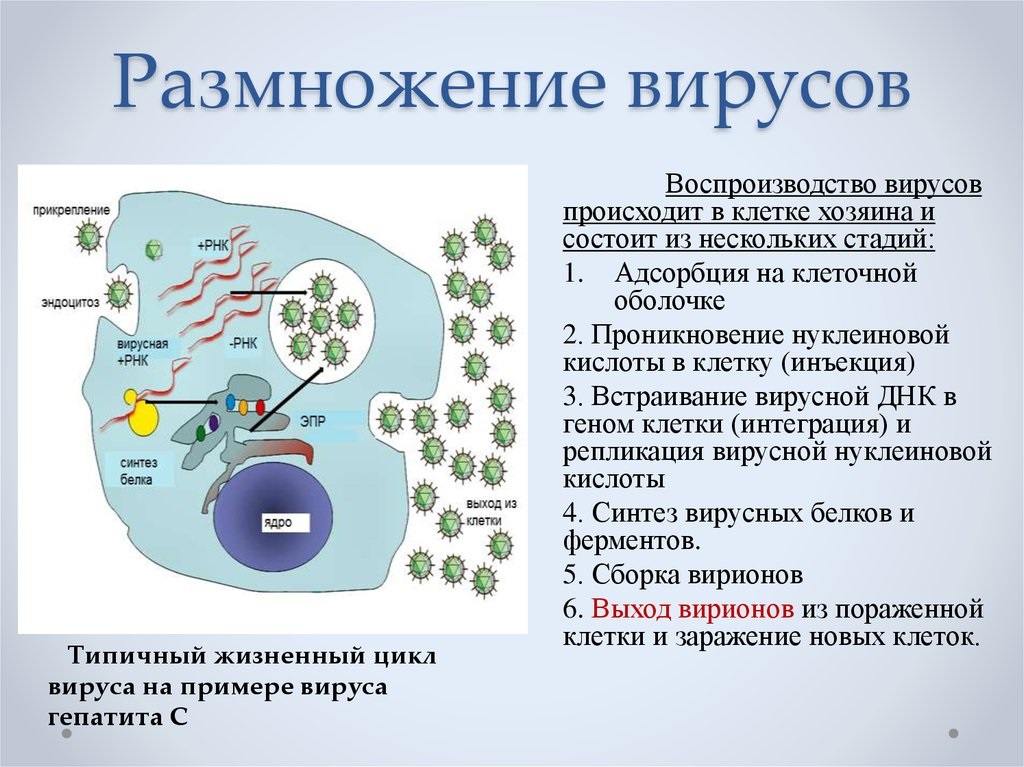
Репликация вирусов
Репликация вирусов
Размножение вируса, или репликация, является весьма характерным процессом, свойственным только обитателям этого особого мира природы. Как известно, рост организмов растительного и животного мира природы невозможен без деления клеток. Вирус же вообще не увеличивается в размерах. Вирусные частицы появляются сразу «взрослыми» в результате своеобразного процесса, названного репликацией. Но самое поразительное — то, что в продуцировании новых вирусных частиц участвует только одна нить: одинарная цепочка нуклеиновой кислоты.
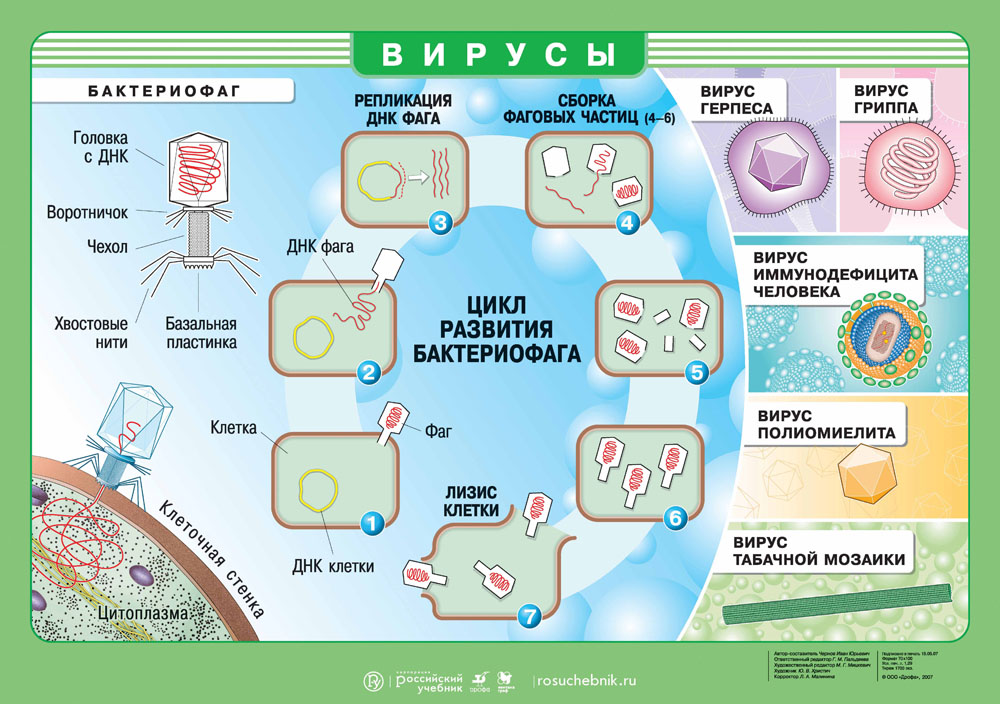
Проследим за нуклеиновой кислотой бактериофага, проникшей в клетку бактерии. Первым делом ДНК выключает жизненно важные для клетки хозяина процессы. Затем начинают образовываться специфические вещества ферменты, идущие на строительство молекул ДНК, точно таких же, какие были и у бактериофага. Примерно через 8 мин образование ферментов замедляется и начинают образовываться белки капсидов. На строительство цепочек нуклеиновых кислот потомства кроме ферментов идет часть родительской ДНК бактериофага и разбитая ДНК хозяина. Капсиды новых бактериофагов строятся из вновь образованных белков; сюда же идет часть белков разрушенной клетки и старого бактериофага.
Примерно через 15 мин после инфицирования в клетке бактерий образуется столько вирусных частиц, что им становится тесно. Они разрывают оболочку хозяина и вырываются наружу, заражают новые клетки бактерий и т. д.
Репликация вирусов как сборочный конвейер
Часто процесс репликации вирусов сравнивают с заводским сборочным конвейером, действующим по заранее разработанному технологическому процессу. Сначала под руководством ДНК идет изготовление строго определенных элементов деталей. Далее ДНК вырабатывает белки своей сферы и ядрышко, вокруг которого белки под влиянием электростатических сил собираются в сферу. Ядрышко уничтожается, после того как образовалась головка-сфера. Один из ответственейших моментов сборки — заполнение сферы цепочкой ДНК. К этому моменту из отдельных участков «цеха сборки» к «главному конвейеру» подаются недостающие детали бактериофага: стержень, сократительные кольца, пластинки, нити. Эти детали друг за другом прикрепляются к сфере.
Интересно, что «рабочие» операции по сборке вирусов сходны с процессами зарождения и развития более сложных организмов. Не заимствованы ли эти приемы из мира вирусов?
Кстати, технические приемы репликации различных видов вирусов не только состоят из общих операций, но имеют и некоторые особенные черты. Так, вирусы оспы размножаются в цитоплазме, а вирусы группы герпеса и аденовирусы — в ядре. В процессе построения нуклеиновых кислот участвуют разрушенные системы клетки хозяина. Следовательно, вирусам оспы и аденовирусам придется использовать различный строительный материал. Эти вирусы относятся к группе крупных вирусов. Например, в молекуле ДНК вируса осповакцины закодировано около 500 белков. Цикл размножения длится более 20 ч. Можно представить, как сложно контролировать процесс репликации вируса! И если системы, отвечающие за последовательность сборки, хоть раз ошибутся, вирусу не удастся «самособраться». Запомните это уязвимое место в процессе репликации.
Не только ВИЧ. Как устроены вирусы?
Галина Вирясова
Сайт СПИД.ЦЕНТР немало рассказывает своим читателям о вирусе иммунодефицита человека, но как устроены остальные вирусы? Чтобы помочь увидеть общую картину, наши авторы подготовили небольшой гид по вирусам с объяснением, как они работают, размножаются и как работают противовирусные лекарства.
Одни вирусы способны интегрироваться в геном клетки-мишени и таким образом оставаться во всех дочерних клетках, которые будут в будущем получены после ее деления. К таким вирусам относятся гаммаретровирусы и лентивирусы. Другие делать этого не умеют (например, адено- и аденоассоциированные вирусы). Но для производства белков и репликации (размножения) все они используют клетку и ее синтетический аппарат.
Несмотря на некоторую «несамостоятельность» в размножении, вирусы способны наследовать генетические мутации и подвержены эволюционному отбору. Выживает сильнейший, а в случае вируса — самый устойчивый и заразный.
Как это работает?
Для того чтобы вирус мог проникнуть в клетку, белки его оболочки должны связаться с мембранными белками клетки-мишени. Важно отметить, что проникает вирус только в те клетки, которые могут в дальнейшем помочь его репликации. Вирус ВИЧ живет в клетках иммунной системы, вирус гепатита С — в клетках печени. Есть особые вирусы, которые поражают только растения или даже только бактерии.
В целом у вирусов существуют разные стратегии доставки вирусного материала в клетку. Какие-то вирусы размножаются в ее цитоплазме, а какие-то — в ядре. Некоторые умеют «впрыскивать» свою генетическую информацию прямо через мембрану, когда сам капсид остается снаружи.
Объединяет их одно: после того как вирусная информация доставлена в клетку, та, «забывая» о своей изначальной функции, начинает заниматься в первую очередь репликацией вируса. Клетка производит матричную РНК (мРНК), с которой затем синтезируются вирусные белки и копируется геном, и сама собирает новую вирусную частицу.
В большинстве случаев вирус убивает клетку, чтобы выйти наружу и приступить к поиску новой «жертвы». Но иногда этого не происходит: некоторые вирусы, в том числе ВИЧ, могут отделяться от клетки, обзаведясь собственной оболочкой и оставив клетку в живых, чтобы та продолжила производить новые вирусные частицы.
Содержащие неактивный вирус и оставшиеся в живых клетки иногда сохраняют возможность нормального функционирования. В этом случае клетки могут быть заражены, но вирус проявит себя спустя длительный период времени. Так устроен герпес.
В зависимости от того, каким типом нуклеиновой кислоты представлен генетический материал, выделяют ДНК-содержащие вирусы и РНК-содержащие вирусы. И тут стоит остановиться на классификации.
Типы вирусов. Коротко о главном
Современная типология вирусов содержит 7 классов и была предложена Дэвидом Балтимором еще в 1971 году. С тех пор, впрочем, она была уточнена и расширена, в том числе советскими учеными. И выглядит в настоящее время таким образом:
Вирусы, содержащие двухцепочечную ДНК
Описание
Для репликации вирусу необходимо попасть в ядро клетки-мишени и воспользоваться ее ДНК-полимеразой. Иногда вирус вызывает незапланированное деление самое клетки, то есть становится онкогенным. Эти вирусы хорошо изучены.
Пример: Вирус герпеса, адено- и папилломавирусы
Вирусы, содержащие одноцепочечную ДНК
Описание
Попадая в ядро клетки, вирусы образуют двухцепочечную ДНК, после чего реплицируются так же, как вирусы класса I.
Пример: Парво- и цирковирусы
Вирусы, в которых РНК способна к репликации (редупликации)
Описание
Вирусы этого класса могут размножаться в цитоплазме клетки, им не нужна молекула ДНК. Каждый ген, находящийся в РНК вируса, кодирует только один вирусный белок.
Пример: Бирна- и реовирусы
Вирусы, содержащие одноцепочечную (+) РНК
Описание
Из геномной (+) РНК на рибосомах хозяина создаются вирусные белки. В одном фрагменте РНК могут быть закодированы разные белки, что увеличивает сложность вируса без удлинения генов.
Пример: Пикорнавирусы (полиомиелит, гепатит А) и коронавирусы
Вирусы, содержащие одноцепочечную (–) РНК
Описание
(–) РНК этих вирусов предварительно должна быть транскрибирована в (+) РНК вирусными РНК-полимеразами, после чего может начаться синтез вирусных белков. Вирусы этого класса делятся еще на две группы, в зависимости от их генома и места его репликации (цитоплазма или ядро).
Пример: Филовирусы, аренавирусы (геморрагическая лихорадка Ласса), ортомиксовирусы (вирусы гриппа) и так далее.
Вирусы, содержащие одноцепочечную (+) РНК, реплицирующиеся через стадию ДНК
Описание
Такие вирусы используют фермент обратную транскриптазу для превращения (+) РНК в ДНК, которая встраивается в геном хозяина ферментом интегразой. Дальнейшая репликация происходит при помощи полимераз клетки хозяина.
Пример: Ретровирусы (в том числе ВИЧ)
Вирусы, содержащие двухцепочечную ДНК, реплицирующиеся через стадию одноцепочечной РНК
Описание
Молекула ДНК замкнута в кольцо и является матрицей для синтеза мРНК и дополнительных молекул РНК, которые используются при репликации вирусного генома обратными транскриптазами.
Пример: Колимовирусы (вызывают инфекции растений) и гепаднавирусы (например, гепатит В)
Вакцинация и лечение
Как правило, организмы умеют бороться с паразитирующими на них вирусами. На примере млекопитающих и человека мы обычно говорим о главном инструменте — врожденном иммунитете.
Впрочем, наиболее эффективен этот вид защиты в отношении бактериальных инфекций и не может обеспечить продолжительную и надежную защиту, особенно от инфекций вирусных.
Именно поэтому огромное значение имеет приобретенный иммунитет, в результате которого клетки иммунной системы обучаются вырабатывать специфические к вирусу антитела, способные уничтожать как саму вирусную частицу, так и зараженные ею клетки.
Еще одна врожденная система борьбы с вирусными инфекциями — внутриклеточная. Как правило, клетка способна распознать чужеродную РНК в своей цитоплазме, куда ее сперва и доставляют многие вирусы, и имеет специальные комплексы для ее деградации. Но часть вирусов научились обходить и эту ловушку. К примеру, ротавирусы, которые даже внутри клетки сохраняют капсид с геномной РНК.
С приобретенным иммунитетом тоже не все гладко. Некоторым вирусам, например, ВИЧ, удается избежать иммунного ответа. Другим, например нейротропным вирусам, — уклониться от него, выбрав безопасную среду обитания: они распространяются среди клеток нервной системы, где их не может «достать» иммунная система. Самый известный из таких вирусов — вирус бешенства, который способен проникать в нейроны.
Миссия: уничтожить
Основная сложность в лечении вирусных заболеваний заключается в том, что они используют естественные функции клеток-мишеней для своего размножения, поэтому ученым зачастую оказывается не так-то просто придумать препарат, который будет токсичен для вируса и безопасен для самой клетки. Если такой безопасности достичь не удастся, лекарство будет иметь слишком много побочных эффектов, повреждающих сам организм, что окажется нецелесообразно для использования.
По принципу действия противовирусные препараты подразделяются на две группы: стимулирующие иммунную систему атаковать вирусы (например, за счет индукции синтеза белков-интерферонов) и атакующие вирусы напрямую. Препараты второй группы различаются по этапу жизненного цикла вируса, на котором они активны: это препараты, препятствующие проникновению вируса в клетку, препятствующие размножению вируса внутри клетки и препятствующие выходу копий вируса из клетки.
Чтобы помешать проникновению вируса, препарат должен заблокировать рецептор на клетке, с которым связывается вирусная частица. Так работает, например, ибализумаб — зарегистрированный в США новый препарат против ВИЧ, о котором мы недавно писали.
Такие противовирусные препараты, как уже давно известный ацикловир (им лечат инфекции, вызванные простым вирусом герпеса) или ламивудин (активен против ВИЧ и гепатита В), представляют собой синтетические аналоги нуклеозидов — «букв», из которых состоят нуклеиновые кислоты. Если эти модифицированные, неправильные нуклеозиды попадают в клетку, вирусный геном, в который они оказались встроены, становится непригоден для дальнейшего распространения вируса.
Еще один класс противовирусных препаратов блокирует ферменты, необходимые для создания и модификаций белков вируса. Такие лекарства называют протеазными ингибиторами.
Вместо заключения: а могут ли вирусы приносить пользу?
Безусловно, да. Несмотря на то, что вирусы ассоциируются у большинства людей с однозначным вредом, они могут приносить и пользу — если речь идет о так называемых вирусных векторах и терапевтических подходах на их основе.
Исследователи давно научились помещать в белковую оболочку вируса интересующие их нуклеиновые кислоты, чтобы доставлять нужный ген в клетки, а также убирать те гены, которые делают вирус опасным для организма.
Это позволило сделать возможной генную терапию, помогающую бороться с заболеваниями, вызванными известными генетическими мутациями. Создание вирусных векторов — достаточно непростая задача, к тому же ограниченная свойствами самих вирусных частиц: количеством помещающейся генетической информации, местом ее вставки, стабильностью. Кроме того, вирусный вектор, используемый в медицине, не должен вызывать иммунного ответа или критично влиять на жизнедеятельность клетки. Тем не менее эти сложности решаются, поэтому уже одобрен ряд вполне успешных и безопасных генных терапий. А в качестве основы для вирусных векторов чаще всего используются ретро-, ленти-, адено- и аденоассоциированные вирусы.
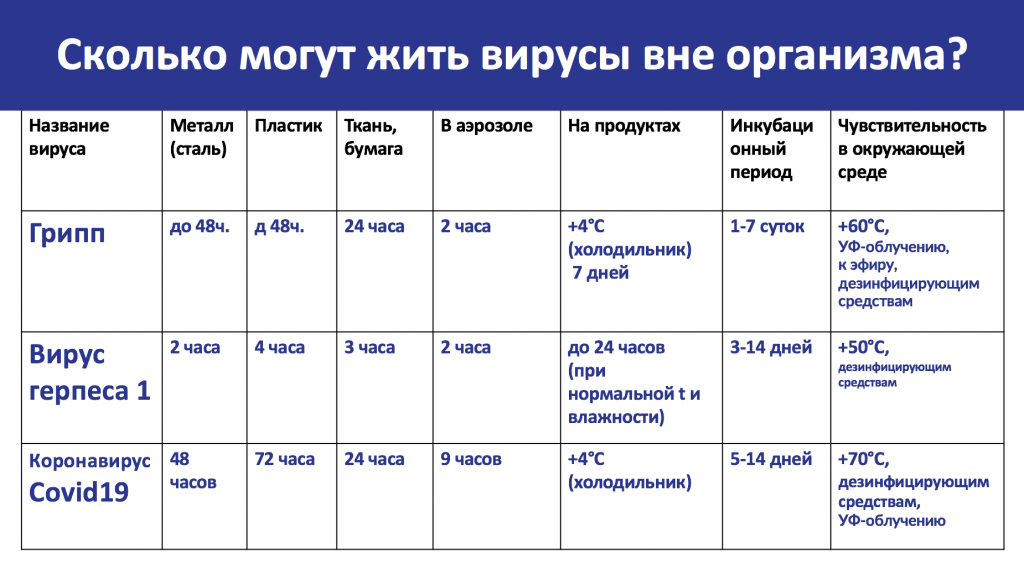
Что мы знаем о вирусах и методах защиты от них?
Что такое вирус?
Как устроен вирус?
В центре агента находится генетический материал РНК или ДНК, вокруг которого располагается белковая структура — капсид.
Капсид служит для защиты вируса и помогает при захвате клетки. Некоторые вирусы дополнительно покрыты липидной оболочкой, т.е. жировой структурой, которая защищает их от изменений окружающей среды.
Вирусолог Дэвид Балтимор объединил все вирусы в 8 групп, из которых некоторые группы вирусов содержат 1-2 цепочки ДНК. Другие же содержат 1 цепочку РНК, которая может удваиваться или достраивать на своей матрице ДНК. При этом каждая группа вирусов производит себя в различных органеллах зараженной клетки.
Вирусы имеют определенный диапазон хозяев, т.е. он может быть опасен для одних видов и абсолютно безвреден для других. Например, оспой болеет только человек, а чумкой только некоторые виды плотоядных. Вирус не способен выжить сам по себе, поэтому активируется только в хозяйской клетке, используя ее ресурсы и питательные вещества. Цель вируса — создание множества копий себя, чтобы инфицировать другие клетки!
Вирусы. Цикл развития бактериофага. Скачать наглядное пособие в большом разрешении можно здесь.
Как вирус попадает в организм?
Геном вируса встраивается в одну из органелл или цитоплазму и превращает клетку в настоящий вирусный завод. Естественные процессы в клетке нарушаются, и она начинает заниматься производством и сбором белка вируса. Этот процесс называется репликацией. И его основная цель — это захват территории. Во время репликации генетический материал вируса смешивается с генами клетки хозяина — это приводит к активной мутации самого вируса, а также повышает его выживаемость. Когда процесс репликации налажен, вирусная частица отпочковывается и заражает уже новые клетки, в то время как инфицированная ранее клетка продолжает производство.
«Для проникновения в клетку белки поверхности вируса связываются со специфическими поверхностными белками клетки. Прикрепление, или адсорбция, происходит между вирусной частицей и клеточной мембраной. В мембране образуется дырка, и вирусная частица или только генетический материал попадают внутрь клетки, где будет происходить размножение вируса. Сегодня ученые всего мира сделали важное открытие о том, что заражение коронавирусом людей преклонного возраста объясняется тем, что у пожилых людей накапливается специфический белок, который помогает COVID-19 проникать внутрь клетки эпителия».
Выход вируса
Скорость распространения вирусной инфекции
Вирусная латентность
Как вирус распространяется?
Почему с вирусами так тяжело бороться?
Сегодня людям уже удалось победить некоторые вирусы, а некоторые взять под жесткий контроль. Например, Оспа (она же черная оспа). Болезнь вызывается вирусом натуральной оспы, передается от человека к человеку воздушно-капельным путем. Больные покрываются сыпью, переходящей в язвы, как на коже, так и на слизистых внутренних органов. Смертность, в зависимости от штамма вируса, составляет от 10 до 40 (иногда даже 70%), На сегодняшний день вирус полностью истреблен человечеством.
Кроме того, взяты под контроль такие заболевания, как бешенство, корь и полиомиелит. Но помимо этих вирусов существует масса других, которые требуют разработок или открытия новых вакцин.
Коронавирус
К наиболее распространенным симптомам COVID-19 относятся повышение температуры тела, сухой кашель и утомляемость. К более редким симптомам относятся боли в суставах и мышцах, заложенность носа, головная боль, конъюнктивит, боль в горле, диарея, потеря вкусовых ощущений или обоняния, сыпь и изменение цвета кожи на пальцах рук и ног. Как правило, эти симптомы развиваются постепенно и носят слабо выраженный характер. У некоторых инфицированных лиц болезнь сопровождается очень легкими симптомами.
Поскольку пока не изобретено вакцины от COVID-19, в целях защиты от инфекции самым важным для нас является соблюдение гигиены.
Гигиена — раздел медицины, изучающий влияние жизни и труда на здоровье человека и разрабатывающая меры (санитарные нормы и правила), направленные на предупреждение заболеваний, обеспечение оптимальных условий существования, укрепление здоровья и продление жизни.
Сегодня следует соблюдать определенные правила гигиены:
«Мы пытались рассказать Вам не только о существующих научных фактах о вирусах, но и показать, что определенные знания помогают нам в нынешней практической ситуации сохранить свое здоровье и здоровье своих близких. Мы понимаем, что сегодня коронавирус может находиться практически везде: на поверхностях любых предметов, в окружающей среде и т.д. Поэтому самоизоляция – это один из важнейших способов защиты от инфекции. Находясь дома, вы защищаете не только свое здоровье, но и помогаете медикам и ученым, которые сражаются с этим вирусов и день и ночь. Ведь, чем меньше шансов у нас с вами заболеть, тем больше шансов появляется у них, чтобы победить коронавирус. Пожалуйста, оставайтесь дома и соблюдайте режим самоизоляции и нормы гигиены».
Вирусная репликация что это
В журнале Nature опубликован очень подробный обзор, характеризующих особенности строения и жизненный цикл SARS-CoV2, механизмы инфицирования и избегания своевременного иммунного ответа, обозначены потенциальные мишени для создания противовирусных препаратов. Также представлены результаты компьютерного моделирования строения вируса и механизмов проникновения в клетку.
Особенностью данного вируса является наличие очень большого количества гликанов на поверхности спайк-протеина, маскирующих его от иммунной системы человека. Поэтому на первом этапе заболевания вирус подобен «волку в овечьей шкуре» и остается невидим для иммунной системы. В дальнейшем, когда вирус уже размножился, иммунный ответ может развиться даже избыточно, что, по-видимому, лежит в основе тяжелого течения заболевания.
В S2- субъединице спайк-протеина есть три участка, делающих «ножку» спайк-протеина гибкой, что позволяет ей «искать» рецепторы на клетках хозяина более эффективно. Такая структура довольно редка для вирусов, обычно аналогичные «шипики» на поверхности вириона ригидны (такова, например, ситуация у вируса гриппа).
Важной частью спайк-протеина является RBD-домен, функцией которого является связь с рецептором ACE2 на поверхности клетки-хозяина. У SARS-CoV2 эта связь в 2-4 раза сильнее, чем у вируса SARS. Во время взаимодействия с рецептором этот домен «выдвигается» из-за двух маскирующих его молекул гликанов. Исследования in vitro показали, что мутации в этих двух гликанах могут полностью нарушать процессы проникновения вируса в клетку. Для эффективного взаимодействия RDB и ACE2 предпочтительна более «высокая» позиция этого домена на остальными структурами. У альфа варианта вируса найдено 10 дополнительных мутаций, приводящих RBD – домен в более «высокое» положение, а у дельта вируса – еще 3 мутации.
Попав в клетку, вирус подавляет экспрессию генов клетки-хозяина, в том числе – образование интерферонов, сигнализирующих о вирусной инфекции. Для ковидной инфекции типична очень низкая концентрация интерферонов в крови.
В дальнейшем может происходить формирование синцитиев из клеток легочной ткани. Считается, что синцитии позволяют дольше и эффективнее вырабатывать вирусные белки. Такой тип агрессии типичен для персистирующих вирусов – например, ВИЧ. SARS-CoV2 индуцирует даже формирование синцитиев клеток респираторного эпителия с лимфоцитами, что мешает нормальному иммунному ответу. Такой тип «маскировки» от иммунитета типичен для опухолей, а не вирусов.
В дальнейшем перестраивается эндоплазматический ретикулум с формированием шарообразных двухмембранных структур, в которых происходит активный синтез белков вируса. Выход вирионов наружу осуществляется в лизосомах, формирующихся в комлексе Гольджи, путем экзоцитоза. Считается, что молекулярные механизмы, ответственные за описанные процессы, могут быть мишенями для противовирусной терапии.
В месте соединения S1 и S2 субъединиц спайк-протеина есть зона, которая способна связывать и быть расщепленной фурином – протеазой клетки-хозяина, содержащейся в лизосомах. Такое предварительное расщепление значительно упрощает в дальнейшем взаимодействие с трансмембранной протеазой TMPRSS2 и значительно увеличивает проникновение вирусной частицы в следующую клетку. Для вируса SARS показано, что порядка 10% вирусных частиц на выходе из клетки – хозяина связано с фурином. У вируса SARS-CoV2 в соответствующем локусе, отвечающем за связь с фурином, идентифицированы мутации. Как следствие, до 50% вирионов альфа-разновидности SARS-CoV2, выходящих из клетки-хозяина, связаны с фурином, а в случае дельта-вируса – до 90%, что, по-видимому, и объясняет более агрессивное распространение этого варианта вируса. Есть данные, что у пациентов с дельта-формой в тканях легких и носоглотки содержание вирионов достоверно выше, чем у носителей альфа-формы.
По материалам: Megan Scudellari. How the coronavirus infects cells — and why Delta is so dangerous. Nature 595, 640-644 (2021). doi:
Двуликие геномы! Что такое амбисенсные вирусные РНК?
Двусмысленные вирусные геномы содержат участки как положительной, так и отрицательной «полярности»
здесь и далее рисунки Андрея Занкевича
Автор
Редактор
Статья на конкурс «Био/Мол/Текст»: Некоторые РНК-вирусы человека, животных и растений демонстрируют чудеса организации структуры генома, который, хотя и представлен одноцепочечной молекулой РНК, кодирует две трансляционные рамки, направленные в разные стороны. Что это за вирусы, и как им это удаётся? Давайте попробуем разобраться.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Вирусы и микроорганизмы» конкурса «Био/Мол/Текст»-2020/2021.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.
Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Напомним, что РНК (рибонуклеиновая кислота) — это такая молекула, представляющая собой одну цепочку нуклеотидов. В составе каждого нуклеотида присутствует остаток моносахарида рибозы. На сегодняшний день известно множество разных типов РНК, которые выполняют совершенно разные функции: от кодирования клеточных белков (мРНК) до противовирусной защиты (некоторые микроРНК) [1–5]. РНК, входящие в состав многих вирусов, могут иметь ряд оригинальных функций, таких как регуляция времени экспрессии различных вирусных генов путем изменения пространственной организации цепи РНК или привлечение клеточных белковых комплексов.
Биологи привыкли думать об РНК главным образом как о «молекуле-посреднике» между ДНК и белком. Именно молекулы матричной РНК (мРНК) распознаются рибосомами — молекулярными машинками, расшифровывающими последовательность РНК в процессе синтеза белка. мРНК имеют в своем составе кодирующие последовательности и, как правило, некодирующие области на 5′- и 3′-концах. Для мРНК эукариот характерно наличие особой кэп-структуры (которая узнается рибосомой) на 5′-конце и полиаденозиновой последовательности на 3′-конце («ключик» для выхода из ядра, вдобавок повышающий стабильность такой мРНК). мРНК называют РНК положительной полярности, или (+)РНК, то есть РНК, с которой не нужно проводить никаких дополнительных операций — у нее есть всё, что нужно для «посадки» рибосомы и последующей трансляции! У некоторых вирусов встречаются молекулы РНК отрицательной полярности, или (–)РНК, несущие комплементарные кодирующим последовательностям участки. В таком случае для образования вирусной мРНК необходима эта самая (–)РНК, а также вирусный фермент, осуществляющий матричный синтез комплементарной РНК-цепи.
Но бывает ли такое, что в пределах одной молекулы РНК одна ее часть, кодирующая некоторый белковый продукт, имеет положительную полярность, в то время как другая часть цепи представлена участком отрицательной полярности, кодирующим другой белок? Могла ли такая молекула возникнуть в процессе эволюции живых форм?
Ответ — да! И для того, чтобы разобраться, как функционируют такие молекулы, нам предстоит погрузиться в таинственный мир вирусов.
Давным-давно, в далекой-далекой галактике.
Сегодня очень популярна гипотеза «РНК-мира» [6], указывающая на РНК как на главного кандидата в прародители жизни на нашей планете. Поскольку РНК может как кодировать информацию, так и проявлять иногда каталитическую (рибозимную) активность (то есть специфически ускорять протекание определенных химических реакций), молекулы РНК, включающие обе эти функции, вполне могли бы являться первыми объектами живой природы, так как при наличии субстрата они способны реплицировать сами себя.
Как известно, все формы жизни обладают определенной наследственностью, которая определяет степень генетической идентичности живых объектов. В качестве молекул, ответственных за поддержание такой наследственной идентичности, выступают нуклеиновые кислоты (ДНК и РНК). Клеточные формы жизни для хранения и передачи информации используют только один тип нуклеиновых кислот — дезоксирибонуклеиновую кислоту (ДНК), в то время как вирусы в качестве основной молекулы наследственности могут использовать либо ДНК, либо РНК.
В случае ДНК-содержащих вирусов реализуется, как правило, Центральная догма молекулярной биологии в классическом виде: попав в клетку, ДНК удваивается в процессе репликации вирусного генома, на матрице ДНК в ходе транскрипции синтезируются мРНК, которые затем прочитываются рибосомой, синтезирующей по ним вирусные белки, то есть осуществляется трансляция. Далее вирусные белки ассоциируются с ДНК-геномом вируса в вирусную частицу (вирион), которая способна заражать новые клетки.
Очевидно, что РНК-содержащие вирусы используют иные стратегии размножения и, следовательно, реализации своего генома. Непривычные для большинства биологов молекулярные механизмы, которые используются такими вирусами, вероятно, унаследованы от далеких предков из того самого РНК-мира.
Размножение РНК-вирусов подразумевает использование разных типов РНК:
Немного истории
Первым найденным РНК-вирусом стал бактериофаг f2, инфицирующий бактерию кишечную палочку (Escherichia coli) [7]. Выделенная геномная РНК фага f2 имела свойства мРНК, то есть она распознавалась рибосомой и могла транслироваться. На родственном РНК-бактериофаге Qβ была изучена РНК-зависимая РНК-полимераза (RdRp), которая, как оказалось, может синтезировать цепь РНК на матрице другой цепи РНК, то есть осуществлять репликацию вирусного РНК-генома! В ходе работы с РНК-бактериофагами f2 и его родственником Qβ были получены общие представления о биологии таких РНК-вирусов [8].
РНК, способную распознаваться рибосомой с осуществлением синтеза белка, назвали «(+)РНК». Эта РНК, попав в клетку-хозяина, может сразу использоваться в качестве мРНК для синтеза вирусных белков. У многих вирусов такая (+)РНК инфекционна сама по себе, т. к. кодирует все нужные для полноценной вирусной инфекции белки, включая RdRp, осуществляющую репликацию генетического материала вируса.
После РНК-бактериофагов были найдены (+)РНК-вирусы животных, такие, как вирус полиомиелита [9], [10], представитель группы пикорнавирусов. Подобные вирусы не содержат репликативных белков в составе вирусной частицы (вириона).
Вирус везикулярного стоматита (VSV), как и вирус полиомиелита, был также одним из первых исследованных РНК-вирусов животных, однако в составе вириона нашли фермент RdRp, синтезирующий комплементарную (антигеномную) цепь РНК [11]. Антигеномная цепь является интермедиатом репликации и не участвует в трансляции. Матрицами для синтеза белка в данном случае выступают более короткие вирусные мРНК (субгеномные РНК), транскрибируемые с геномной цепи. Хотя антигеномная РНК не транслируется, ее последовательность совпадает с последовательностями мРНК, поэтому говорят, что она имеет ту же полярность — положительную. Итак, в рассматриваемом случае антигеномная и субгеномные цепи являются (+)РНК, а геномная РНК играет роль матрицы для синтеза (+)РНК и оттого называется «РНК противоположной полярности», то есть «(–)РНК». У (–)РНК-вирусов как раз такая РНК в качестве геномной упаковывается в вирион вместе с вирусной RdRp, которая ответственна за матричный синтез антигеномной и субгеномных (+)РНК после проникновения в клетку. Cреди (–)РНК вирусов выделяют вирусы с несегментированным геномом (вирион содержит одну молекулу (–)РНК, вместе с RdRp необходимую для инфекции; порядок Mononegavirales) и сегментированным геномом (для инфекции необходимо несколько разных молекул геномной РНК, каждая из которых связана со своей молекулой RdRp; порядок Articulavirales). Хорошо известный вирус гриппа А является представителем второй группы. Каждая (–)РНК (геномный сегмент), упакованная в вирусную частицу, «обёрнута» молекулами белка нуклеокапсида NP, в комплексе с которым образуется РНП (рибонуклеопротеин). Также в этот комплекс входит мультисубъединичная RdRp.
Встречаются вирусы, геном которых представлен двухцепочечной РНК. Как и в случае (–)РНК-вирусов, у дцРНК-вирусов во время репликации в клетке первым делом происходит синтез (+)цепи. Вирусные частицы этой группы также включают в свой состав RdRp.
Наша статья посвящена очень занятной группе вирусов, имеющих «двусмысленный РНК-геном». Сегментированная природа генома роднит их с представителями порядка Articulavirales, однако, в отличие от последних, один или два РНК-сегмента являются «(±)РНК». Такие РНК называют амбисенсными: это значит, что в пределах одной молекулы РНК есть последовательности, по смыслу соответствующие мРНК ((+)участки), а также участки отрицательной полярности ((–)участки), то есть комплементарные мРНК. Согласно таксономии, вирусы с двусмысленным РНК-геномом определяют в семейства Bunyaviridae и Arenaviridae.
Исторически одним из первых выделенных вирусов с двусмысленной РНК был флебовирус — вирус лихорадки долины Рифт (RVFV) [12]. Открытие амбисенсной природы РНК некоторых вирусов [13], [14] пришлось на период, когда были достаточно хорошо исследованы (+)- и (–)РНК-содержащие вирусы, что и позволило предположить возможность «двусмысленной» молекулы РНК в составе таких вирусов.
Вирусы с двусмысленным РНК-геномом из семейства Bunyaviridae
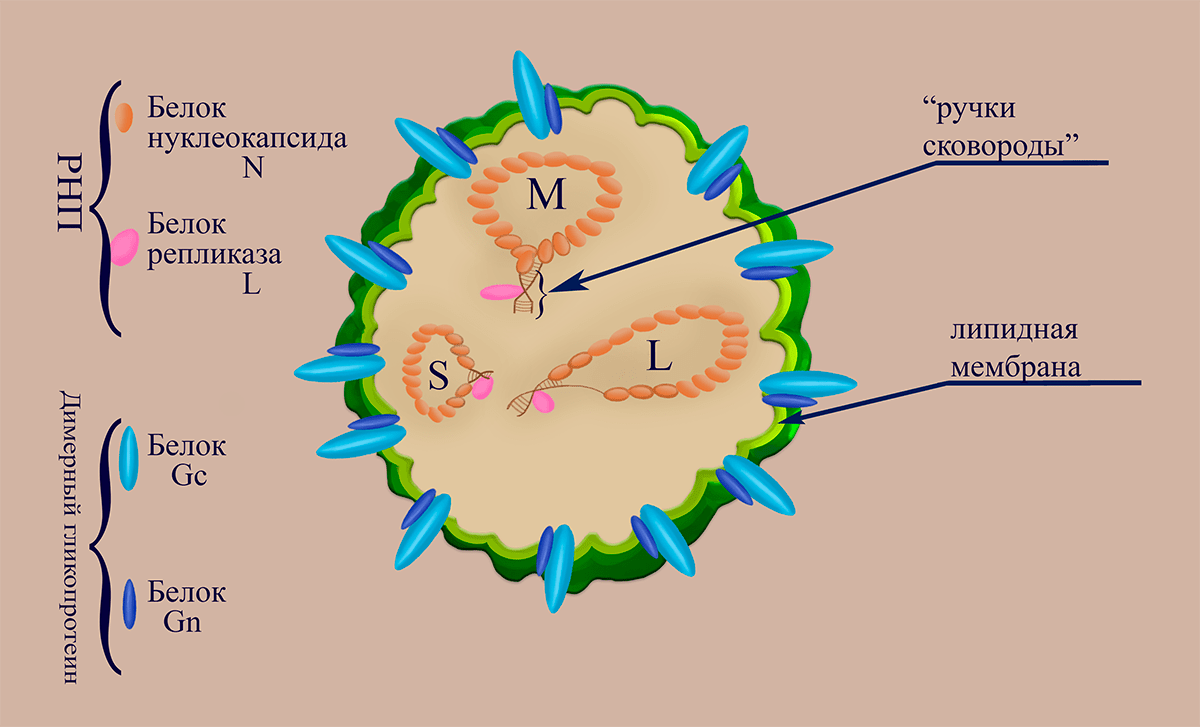
Вирусные частицы (вирионы) Bunyaviridae диаметром от 80 до 130 нанометров могут иметь изменчивую (плеоморфную) форму. Липопротеидная оболочка, образованная фосфолипидной мембраной и вирусными гликопротеинами Gn и Gc, содержит внутри три нуклеокапсида (рибонуклеопротеина, состоящих из молекулы РНК (сегмента), «одетой» в молекулы белка нуклеокапсида N, и ассоциированной с ней одной молекулы репликазы L (RdRp)). Три сегмента РНК-генома, несущих на концах комплементарные участки (благодаря которым РНК «циклизуются» в вирионе), получили названия в соответствии с длинами их нуклеотидной последовательности: L (large,
7000 нуклеотидных остатков), M (medium,
3000 н.о.), S (small,
1000 н.о.) (рис. 1.). В семействе встречаются (–)РНК-вирусы (роды Orthobunyavirus, Hantavirus и Nairovirus), имеющие концептуальную схожесть молекулярной стратегии репликации с таковой, например, вируса гриппа. Однако вирусы семейства Bunyaviridae не имеют матриксного белка — широко распространенного типа полипротеинов, встречающегося у большинства липид-содержащих РНК-вирусов животных и человека.
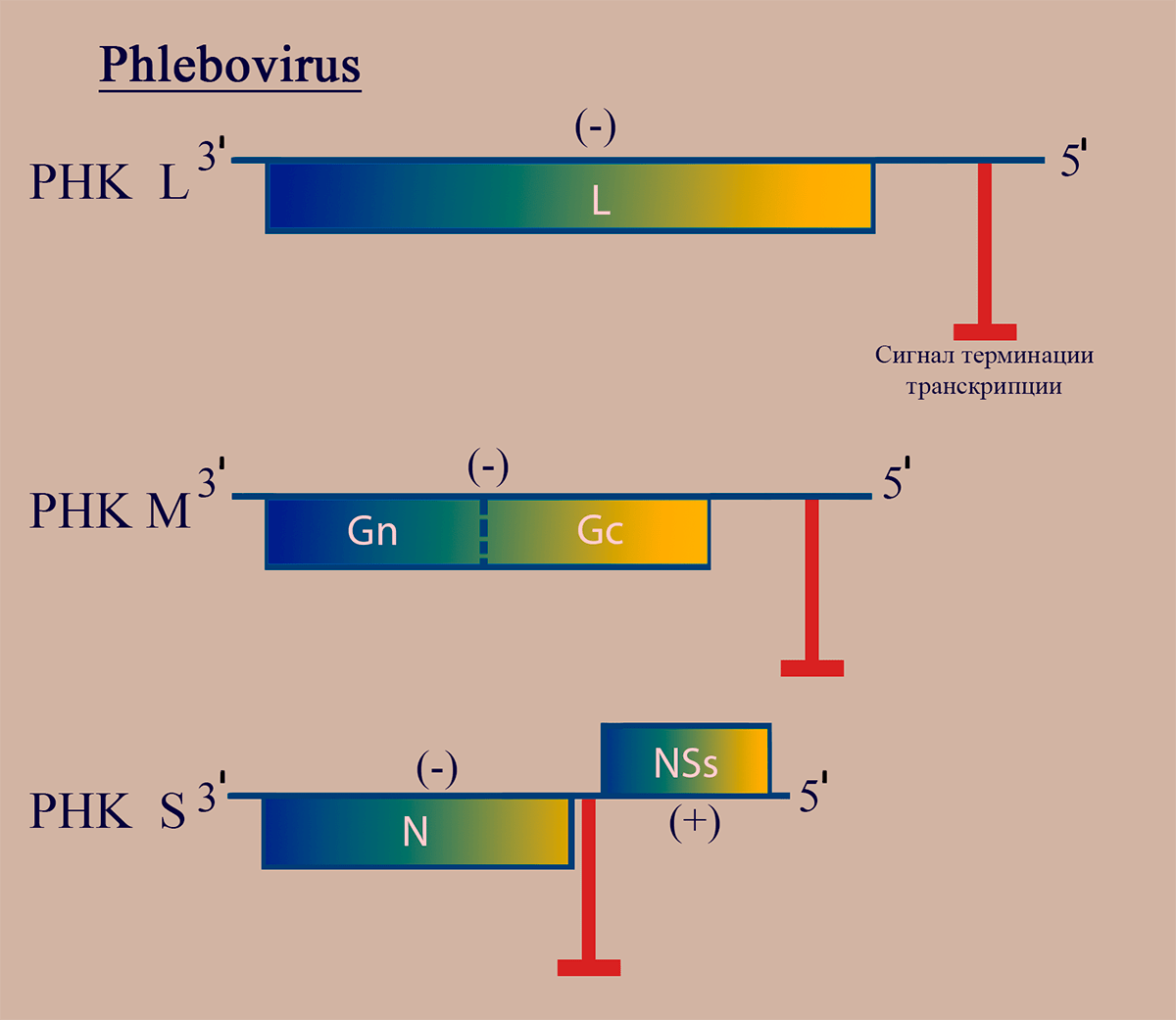
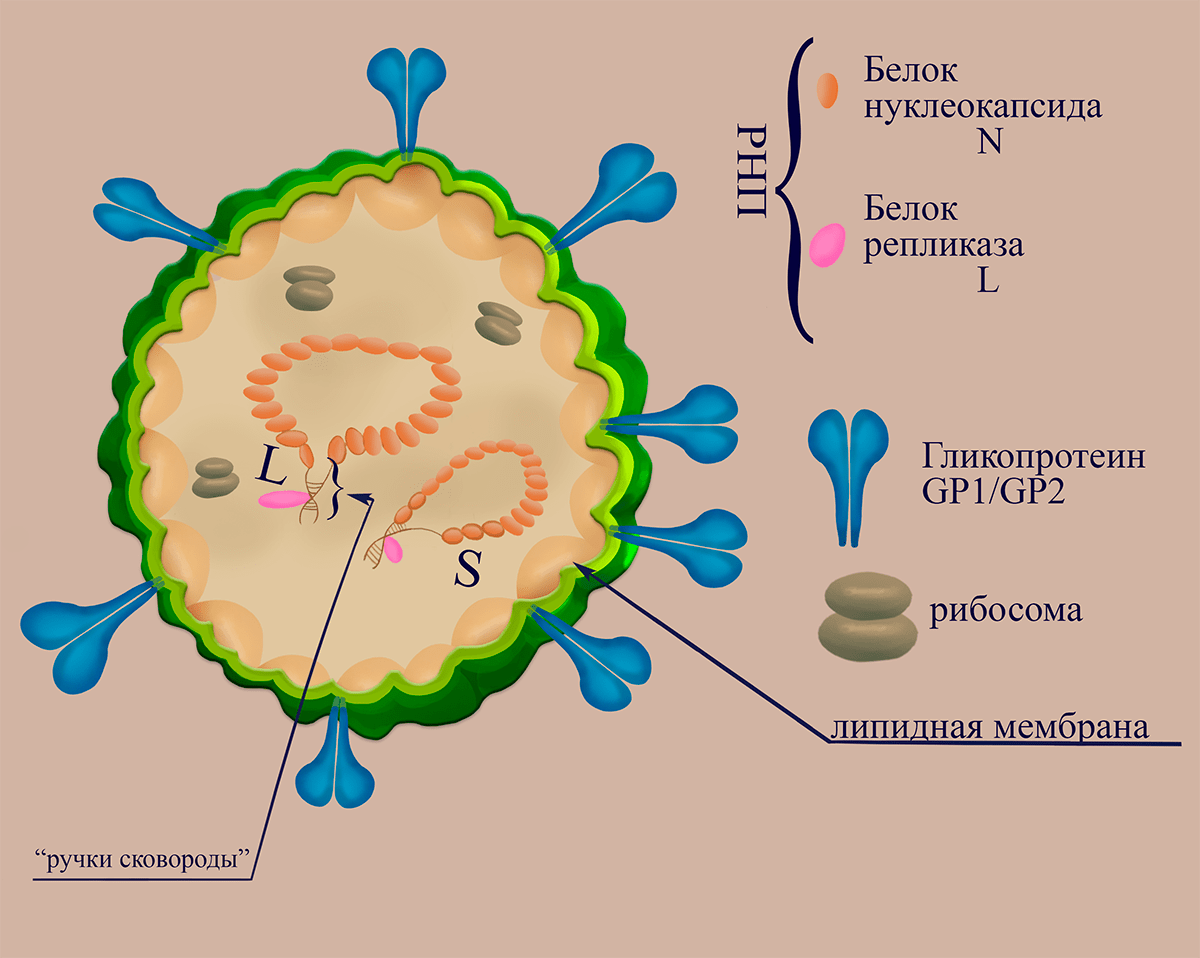
Рисунок 1. Схематичное изображение структуры вириона флебовирусов
В семействе Bunyaviridae роды Phlebovirus, Tospovirus и Tenuivirus являются вирусами с двусмысленным РНК-геномом и, в отличие от остальных представителей семейства, имеют чуть более длинный S-сегмент генома (РНК S) (±)полярности. Род Tospovirus имеет вдобавок (+)участок на РНК M, который делает и эту РНК амбисенсной.
Флебовирусы
Вирусы рода Phlebovirus выделяют практически по всему миру и относят к нетаксономической группе арбовирусов, распространяющихся в членистоногих переносчиках и в позвоночных, на которых питаются переносчики. Члены этого рода переносятся кровососущими членистоногими. Инфекции не обходят стороной человека: вирусы сицилийской и неаполитанской москитных лихорадок широко распространены по территории Средиземноморья [15]. Среди симптомов таких инфекций — продолжительная сильная лихорадка, тошнота, рвота, диарея и головные боли. Вирус Тосканы, также переносимый москитами, обладает способностью проникать в нервную ткань и, вдобавок к вышеперечисленным симптомам, вызывает асептический менингит и менингоэнцефалит. Флебовирусы, переносимые клещами, например, вирус Бханджа, вирус тяжелой лихорадки с синдромом тромбоцитопении, или вирус Хартленд, вызывают серьезные вспышки инфекций среди людей [16].
Эти вирусы получили свое имя от латинского названия москитов (Phlebotominae), которые являются их основными переносчиками. Вирионы флебовирусов имеют диаметр 100-125 нанометров. Внутри вириона находятся три вирусных рибонуклеопротеина (вРНП), содержащих геномные сегменты, однако для вируса лихорадки долины Рифт (RVFV) было показано [17], что вирионы также могут содержать ещё три дополнительных вРНП, образованных цепочками антигеномных РНК, комплементарных геномным вирусным РНК. Рецептор-распознающий аппарат вирусов представлен гетеродимерами гликопротеинов Gn и Gc, которые организованным способом распределены по мембране вириона.
Структура генома флебовирусов
Геном флебовирусов как и других представителей семейства Bunyaviridae, включает три молекулы РНК: PHК L, РНК M, РНК S, имеющие на 5′- и 3′- концах уникальные для каждого геномного сегмента комплементарные последовательности. РНК L (–)полярности кодирует белок репликазы L. (–)РНК M кодирует предшественник гликопротеинов G1 и G2. (±)РНК S кодирует белок нуклеокапсида N на (–)полярном участке (ближе к 3′) и неструктурный белок NSs на (+)полярном участке (ближе к 5′) (рис. 2).
Рисунок 2. Схема структуры генома флебовирусов. Отмечены участки РНК, обладающие (–)- и (+)полярностью. Пунктирной линией обозначен сайт протеолиза белкового продукта.
NSs выполняет ряд функций, среди которых подавление индукции интерферона, усиление репликации и транскрипции вирусной РНК и определение круга хозяев [18]. NSs через цепочку белковых факторов способен приводить к инактивации противовирусной протеинкиназы R организма-хозяина [19].
При одевании вирусных РНК белок N распознаёт последовательность на ее 5′-конце. В вирионе каждая молекула РНП закольцована за счет комплементарных взаимодействий 5′- и 3′-концевых последовательностей (образование т.н. «ручек сковороды»). Таким образом, сегменты генома организуются в шпилечные структуры с короткими (около 12 пар нуклеотидных остатков) стебельками и большими (весь остальной геном) петлями, которые покрыты белком N.
Главный промотор транскрипции и репликации располагается в области спаренных 5′- и 3′-концевых участков («ручки»). Транскрипция и репликация генома флебовирусов осуществляются репликазой L (RdRp).
Как вирусы «воруют» у клеток кэп для синтеза своих мРНК?
Зрелая мРНК эукариот на 5′-конце имеет т.н. кэп — 7-метилгуанозин-5′-трифосфат, соединенный с соседним нуклеотидом 5′,5′-трифосфатной связью. Такая структура делает 5′-конец устойчивым к многим 5′-экзонуклеазам (ферментам, которые «едят» цепочку нуклеотидов с 5′-конца), но самое важное — она распознается рибосомой и необходима для осуществления трансляции.
Кажется, что синтез белков вирусов эукариот возможен только в том случае, если вирусные мРНК имеют кэп. Разные группы вирусов решают «вопрос кэпа» по-разному: кто-то использует ковалентно-пришитый к 5′-концу белок, имитирующий кэп, кто-то имеет образованные вторичными структурами РНК внутренние сайты посадки рибосом (IRES), кто-то может кодировать свои системы кэпирования или привлекать клеточный аппарат созревания РНК. В случае (±)РНК-вирусов, равно как и для многих (–)РНК-вирусов, имеет место процесс, называемый «стащить кэп» (cap snatching). Рассмотрим этот механизм на примере флебовирусов.
Белок L имеет РНК-полимеразную (т.е. может синтезировать комплементарную РНК-цепь) и эндонуклеазную (т.е. может разрезать цепочку нуклеиновой кислоты в определенных сайтах) активности. Последняя направлена на создание разрыва в 5′-нетранслируемой области (НТО) клеточных мРНК, что ведет к декэпированию этих мРНК. Продукт этого «откусывания», короткая кэпированная РНК, используется в дальнейшем в качестве затравки для транскрипции вирусной РНК в цитоплазме. После осуществления такого разрыва вирусная репликаза вместе с 5′-концевым фрагментом клеточной мРНК запускает транскрипцию на матрице геномной вирусной РНК [18]. Таким образом синтезируются способные взаимодействовать с рибосомами субгеномные вирусные РНК. Подход «стащить кэп» не используется для репликации вирусных РНК, то есть для синтеза геномных и антигеномных РНК.
Механизмы транскрипции и репликации РНК флебовирусов
Транскрипция кодирующей белок N последовательности на РНК S, как и для генов других геномных сегментов, происходит с участием геномной (–)РНК по принципу «стащить кэп», а мРНК, кодирующая белок NSs (закодирован в (+)последовательности РНК S), транскрибируется по этому же принципу, но с антигеномной цепи. То есть (+)участок геномной цепи не способен сразу распознаваться рибосомой — для трансляции этого участка необходимо сначала синтезировать полноразмерную антигеномную РНК, с нее — содержащую клеточный кэп субгеномную РНК, и только на субгеномную РНК «сядет» рибосома.
Остановка транскрипции (–)участка РНК S определяется межгенным сигналом терминации. Похожие сигналы терминации находятся в 5′-концевой области РНК M и РНК L. В результате синтезируются кэпированные, но неполиаденилированные (и, следовательно, не такие стабильные, как клеточные мРНК) субгеномные РНК [18]. Также было показано [17], что в инфицированных клетках наблюдается ранняя экспрессия белка NSs, к тому же при детальном анализе состава вирионов обнаружили, что в вирусную частицу может упаковываться как три геномных цепи, так и еще три антигеномных цепи. Считается, что антигеномная РНК S присутствует в вирионе для осуществления ранней транскрипции мРНК, кодирующей NSs, поскольку этот неструктурный белок способен регулировать клеточные процессы, и чем раньше он начнёт работать в зараженной клетке, тем интенсивнее будет протекать вирусная инфекция.
Когда белка N накапливается некоторое «пороговое» количество, происходит переключение режима работы белка L с транскрипционного на репликационный, в результате чего синтезируются не субгеномные РНК, а антигеномные. Инициация репликации не требует затравок клеточной природы, полимеризация комплементарной цепи начинается с одного рибонуклеотида, который и является затравкой [18]. Репликация прекращается, когда репликаза доходит до конца геномной цепи. Геномные РНК синтезируются по аналогичной схеме с антигеномных цепей. Все вышеописанные процессы протекают в цитоплазме — для эффективных транскрипции, репликации, созревания гликопротеинов и, в конце концов, формирования вирусных частиц необходимо образование «вирусных фабрик», представляющих собой трубчатые структуры, образованные мембранами комплекса Гольджи. Такие «фабрики» позволяют повысить локальную концентрацию компонентов репликации вируса [20].
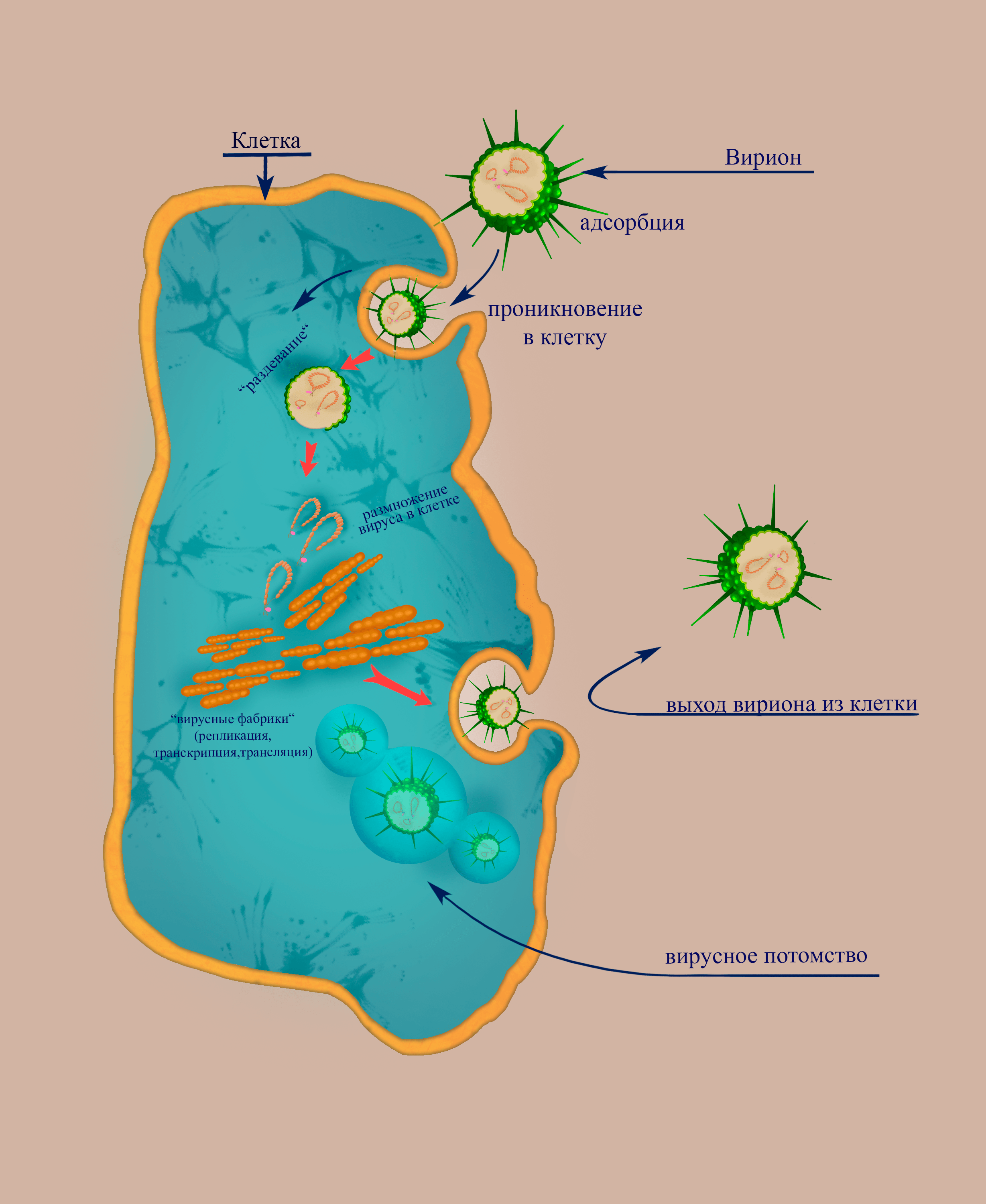
Жизненный цикл флебовирусов
Жизненный цикл состоит из следующих стадий (рис. 3):
Рисунок 3. Схема, демонстрирующая основные этапы цикла флебовируса
Тосповирусы и тенуивирусы
Тосповирусы имеют сходную с флебовирусами структуру вириона. Они являются патогенами растений, использующими в качестве переносчика и второго хозяина трипсов, отряд мелких насекомых-фитофагов [21] и способными к межклеточному транспорту через плазмодесмы в растениях благодаря наличию транспортного белка NSm. Этот белок не входит в состав вириона и синтезируется в течение короткого периода на ранних стадиях инфекции. Он способен связываться с белком нуклеокапсида N, вирусной РНК и клеточными белками, оказываясь ответственным не только за межклеточный транспорт вРНП, без упаковки в вирион, но и за образование вышеупомянутых «вирусных фабрик» в клетке, что в совокупности сказывается на степени вирулентности тосповирусов [22].
Название рода Tospovirus происходит от сокращения названия вируса пятнистого увядания томатов (tomato spotted wilt virus, ТоSWV), впервые выделенного в 1930 году из зараженных растений томата. Этот вирус имеет очень широкий спектр хозяев и важное хозяйственное значение, борьба с ним ведется, в основном, за счет контроля численности трипсов.
Структура генома тосповирусов и тенуивирусов
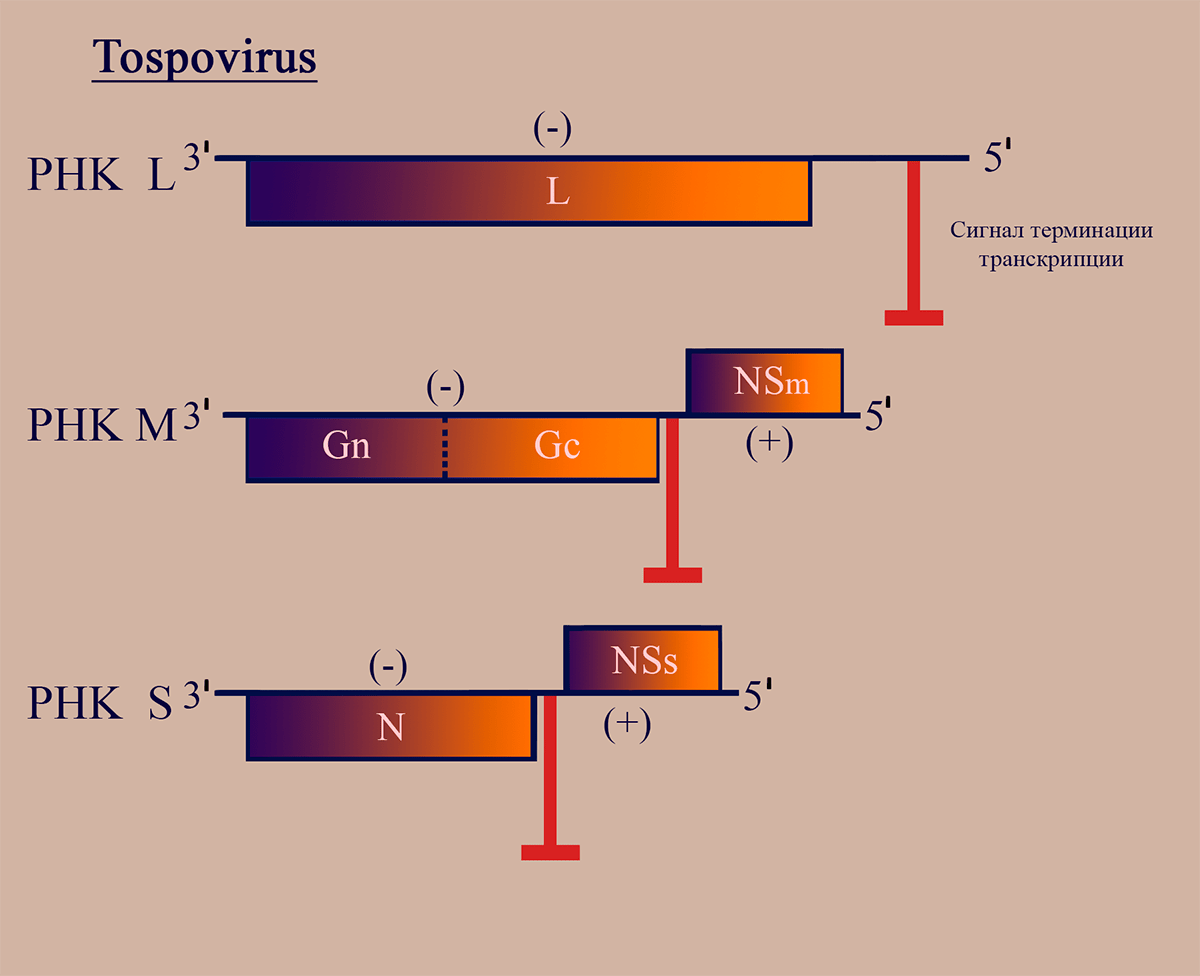
Представители родов Тospovirus и Tenuivirus (тенуивирусы близки к тосповирусам, но не имеют липидной оболочки) являются единственными известными РНКвирусами растений с двусмысленным геномом [23]. Геном тосповирусов представлен тремя РНК-сегментами: большим, средним и малым (L, M, S). РНК L кодирует репликазу L. РНК S, подобно таковой у флебовирусов, кодирует белок нуклеокапсида N в (–)области и неструктурный белок NSs в (+)области. Эти области не пересекаются, они разделены межгенным некодирующим участком, содержащим сигналы терминации транскрипции. М-сегмент генома имеет принципиально отличную от РНК М флебовирусов структуру, являясь амбисенсной РНК. РНК М тосповирусов имеет область (–)полярности, в которой находится последовательность, кодирующая мРНК GnGc — предшественника поверхностных гликопротеинов, а также участок (+)полярности в 5′-области, кодирующий белок межклеточного транспорта NSm. Эти последовательности также разделены межгенным участком (рис. 4). Механизмы транскрипции и репликации РНК этих вирусов сходны с таковыми у флебовирусов [18].
Рисунок 4. Схема структуры генома тосповирусов. Отмечены участки РНК, обладающие (–)- и (+)полярностью. Пунктирной линией обозначен сайт протеолиза белкового продукта.
Отдельного внимания заслуживает неструктурный белок, закодированный в S-сегменте генома тосповирусов — NSs. Основной его функцией является супрессия противовирусного сайленсинга РНК, системы малых интерферирующих РНК [5], [24], распознающих вирусные РНК, что приводит к деградации последних [25]. Логично предположить, что синтез такого белка должен происходить как можно раньше, поэтому, возможно, по аналогии с белком NSs флебовирусов, ранняя транскрипция такой последовательности происходит в результате наличия в вирионе, помимо геномной цепи РНК S, еще и соответствующей ей антигеномной.
Вирусы с двусмысленным РНК-геномом из семейства Arenaviridae
Помимо семейства Bunyaviridae, амбисенсные РНК имеют представители семейства Arenaviridae. Аренавирусы являются таксономической группой вирусов позвоночных с сегментированным двусмысленным РНК-геномом. Вирусы, инфицирующие млекопитающих, определены в род Mammarenavirus, а заражающие рептилий — в роды Reptarenavirus и Hartmanivirus [26].
Вирионы аренавирусов, как и рассмотренных выше буньявирусов, плеоморфны, а их диаметр может варьировать от 40 до 200 нанометров в зависимости от вида, однако и частицы одного вида могут заметно различаться по размерам [27]. Границы вириона представлены липопротеидной оболочкой — производной клеточной мембраны, модифицированной равномерно распределёнными гликопротеиновыми комплексами (гетеродимерный гликопротеин GP1/GP2). Гликопротеины синтезируются в виде предшественника, который разрезается примерно пополам клеточной протеиназой на рецептор-распознающую субъединицу GP1 и трансмембранную субъединицу GP2. Последняя ответственна за слияние мембран при проникновении в цитоплазму [28]. В вирионе гликопротеины ассоциированны с лежащими на внутренней стороне мембраны молекулами матриксного белка Z, выстилающего внутреннюю поверхность мембраны, и белка нуклеокапсида N. Белок N способен связываться с РНК, распознавать кэп и ингибировать интерфероновый ответ. Структурный белок Z в клетке выполняет ряд функций (в том числе ингибирование трансляции клеточных мРНК и подавление апоптоза), являясь фактором созревания вирусных частиц (отвечает за инициацию сборки вирионов и за их отпочковывание).
Во время сборки вирусных частиц при формировании внешней оболочки иногда происходит захват субъединиц клеточных рибосом, по всей видимости, не играющих роли в вирусной инфекции (рис. 5).
Рисунок 5. Схематичное изображение структуры вириона аренавирусов
Значительная часть представителей семейства вызывает хронические и, как правило, бессимптомные инфекции у грызунов. При контакте человека с такими вирусами может развиваться острая и тяжелая инфекция, часто — геморрагическая лихорадка (например, в случае инфекции вирусом лихорадки Ласса, LasV). Вирус лимфоцитарного хориоменингита (LCMV), первый выделенный аренавирус, является нейроинвазивным. Попав в организм человека (например, через выделения грызунов), вирионы с током крови преодолевают гематоэнцефалический барьер центральной нервной системы и вызывают воспаления мозговых оболочек [29].
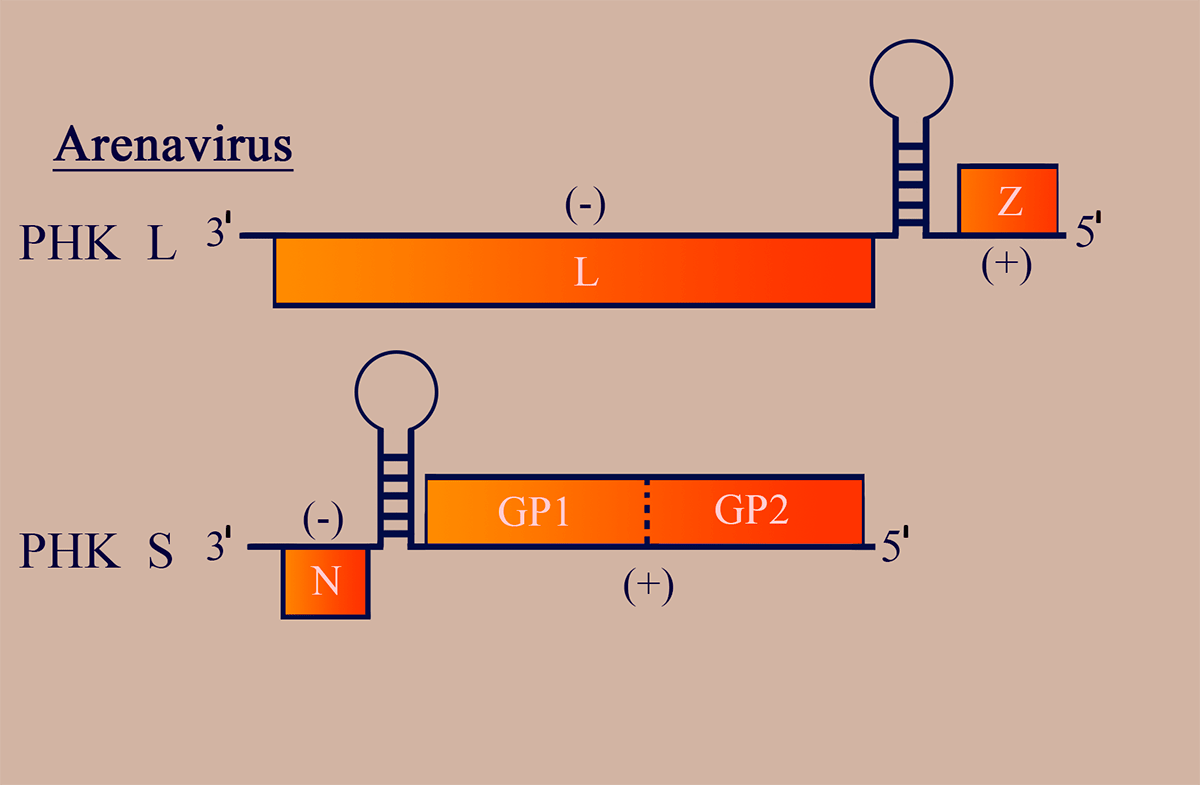
Структура генома аренавирусов
Геном аренавирусов имеет ряд особенностей и представлен двумя сегментами (РНК L
3000 н.о.), циклизованными уже известными нам «ручками сковороды» и закрученными в спиральный рибонуклеопротеиновый комплекс (рис. 6). Обе молекулы РНК — двусмысленные!
Рисунок 6. Схема структуры генома аренавирусов. Отмечены участки РНК, обладающие (–)- и (+)полярностью. Пунктирными линиями обозначены сайты протеолиза белковых продуктов.
РНК L на (–)участке несет последовательность, комплементарную гену репликазы L, и рамку матриксного и регуляторного белка Z на (+)участке в 5′-концевой части геномной РНК.
РНК S кодирует белок нуклеокапсида N в области (–)полярности и содержит рамку считывания GP1GP2 — предшественника поверхностных гликопротеинов GP1/GP2 (также в 5′-концевой части геномного сегмента).
(–)- и (+)участки разделены межгенными сайтами, образующими прочные вторичные структуры шпилечного характера. На 5′-конце геномных и антигеномных цепей присутствует сигнал инициации инкапсидации (то есть «одевания» РНК вирусными белками с образованием вРНП), распознаваемый белком N [18].
Транскрипция и репликация генома аренавирусов
Оба процесса проходят в цитоплазме инфицированной клетки. Транскрипция начинается при участии репликазы L по уже описанному выше для флебовирусов принципу «стащить кэп» (cap snatching). Терминация транскрипции обусловлена наличием соответствующего сигнала в стабильных шпильках межгенного пространства геномной или антигеномной РНК. Вирусные субгеномные РНК не полиаденилируются [18].
Переключение на репликацию связано с наличием белка N: когда его накапливается такое количество, что он начинает покрывать строящиеся цепи РНК, это, вероятно, влияет на конформацию репликазы и приводит к проскоку сигналов терминации транскрипции в виде межгенных шпилек. РНК S при репликации накапливается в больших количествах, так как нужно много копий белка нуклеокапсида, а также гликопротеинов (для экспрессии последних необходим предварительный синтез антигеномной РНК).
Заключение
Принимая во внимание всё вышеизложенное, можно сделать выводы относительно общих особенностей вирусов, содержащих амбисенсную РНК. Геном таких вирусов является сегментированным, и хотя бы один сегмент представлен амбисенсной РНК. Каждый геномный сегмент содержит комплементарные 3′- и 5′-концевые последовательности, образующие «ручки сковороды». В составе этого не очень протяженного дуплекса в геномной РНК присутствует главный промотор транскрипции и репликации, распознаваемый репликазой L. 5′- концевые последовательности геномных и антигеномных молекул РНК связываются белком нуклеокапсида N. Затравкой для синтеза вирусных мРНК, как и в случае типичных вирусов с сегментированным (–)РНК-геномом, является «откушенный» кэпированный фрагмент клеточной мРНК.
Что же касается самих амбисенсных РНК, они содержат последовательности отрицательной полярности в 3′-части и положительной полярности в 5′-части геномной цепи. Терминация транскрипции в таких двусмысленных РНК связана с наличием соответствующих сигналов в межгенном участке. При этом (+)участок амбисенсной РНК не может сразу выступать в качестве мРНК, необходим последовательный синтез антигеномной, а только потом субгеномной РНК положительной полярности. Все эти процессы занимают определенное время, поэтому вопрос «отсрочки» синтеза белков из (+)участка геномной РНК может решаться для вируса путем включения в зрелую вирусную частицу, помимо геномной (±)РНК, ещё и антигеномной (±)РНК.
Такая необычная организация двусмысленных геномных сегментов является интересным способом представления двух кодирующих последовательностей в одном геномном сегменте. На примере вирусов с двусмысленными РНК-геномами заметно, насколько изобретательной может быть эволюция вирусных РНК. Поскольку вирусы с двусмысленными РНК-геномами до сих пор удерживают определенную нишу, можно утверждать, что такой способ кодирования обладает некоторыми преимуществами по сравнению с более привычным для родственных вирусов способом, использующим только (–)РНК-сегменты.
Как возникли амбисенсные РНК и почему поддержались отбором, до сих пор остается одной из загадок современной вирусологии.
И как сказал один известный принц: «Есть многое на свете, друг Горацио, что и не снилось нашим мудрецам!»
Благодарности от автора
Я благодарю доктора биологических наук, профессора кафедры вирусологии биологического факультета МГУ им. М.В. Ломоносова Аграновского Алексея Анатольевича за интересные и содержательные лекции по молекулярным процессам РНК-вирусов и вдохновение на написание данной статьи. Также выражаю благодарность художнику Андрею Занкевичу, чьи наглядные и яркие иллюстрации украшают данную статью.