вгч что это такое
Герпес 6 типа
Вирус герпеса человека 6 типа – это инфекция, не менее распространенная, чем известные многим вирусы герпеса 1 и 2 типов. Поначалу этот вирус долго оставался «вирусом без болезни», но в последнее время все шире обсуждается его возможная роль как причины многих заболеваний человека. Вирус 6 типа встречается во всех странах мира и требует самого пристального внимания ученых.
В настоящее время внимание врачей всех специальностей привлекают заболевания, вызванные представителями огромного семейства вирусов герпеса. Актуальность герпеcвирусных инфекций обусловлена их так называемой «универсальностью» и способностью приводить к развитию острых и хронических заболеваний различных органов и систем.
Все дело в том, что вирус герпеса человека (Human Herpes Virus) может вызвать гораздо более грозную болезнь, чем кажется большинству. Он способен стать причиной развития многих заболеваний, в том числе в виде тяжелых поражений центральной нервной системы, печени, желудочно-кишечного тракта, легких и костного мозга. Также герпес приводит к преждевременным родам у беременных женщин, препятствует правильному развитию новорожденных и даже может привести к инвалидности ребенка. Вирусы семейства Herpes viridae способны избегать влияния иммунной защиты, что позволяет им длительное время существовать в организме.
Пять фактов о герпесе 6 типа
Как передается вирус герпеса 6 типа
Источником инфекции являются больные с явными клиническими признаками заболевания и носители ВГЧ-6. Ведущий путь передачи – воздушно-капельный, но не исключаются и другие пути, в частности, контактно-бытовой, хотя это случается реже. Также возможна передача вируса половым путем, при переливании инфицированной крови и пересадке органов и тканей от инфицированных доноров. Возможна вертикальная передача вируса от инфицированной матери плоду как во время беременности, так и после родов. Вирус может передаваться даже через слюну.
По версии американских и японских ученых, у детей чаще всего инфицирование вирусом происходит в возрасте от 6 месяцев до года.
Симптомы герпеса 6 типа у детей и его проявления у взрослых
Симптомы и состояния, которые должны насторожить и заставить обратиться к врачу:
Анализ на выявление герпесвируса 6-го типа также необходимо сдать при таких заболеваниях, как краснуха, корь, инфекционная эритема, энтеровирусная инфекция, отиты, менингиты, бактериальная пневмония, аллергия на лекарства, заражение крови. Во время проведения профилактических скрининговых исследований тоже может потребоваться проведение подобной диагностики.
Какой анализ сдают на выявления герпеса 6?
Дифференциацию между типами А и В невозможно осуществить на основе проведения серологических тестов и обнаружения IgM (антител, формирующихся при первом контакте с инфекцией) и/или IgG (антител, показывающих более ранний контакт с инфекцией, т.е. они появляются после уже перенесенного инфекционного заболевания) в крови. С этой целью проводят ПЦР – экспериментальный метод молекулярной биологии, способ значительного увеличения малых концентраций определенных фрагментов нуклеиновой кислоты (ДНК) в биологическом материале. Для проведения ПЦР можно использовать кровь, слюну или спинномозговую жидкость.
Симптомы ГВЧ-6 у детей
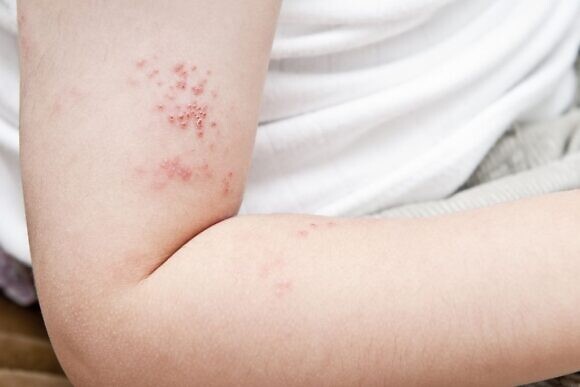
У маленьких детей (0,5-3 года) о заражении вирусом герпеса шестого типа может свидетельствовать развитие внезапной эритемы (детской розеолы), которая дает о себе знать внезапным повышением температуры тела до 40 °С. При этом какие-либо другие симптомы чаще всего отсутствуют. После понижения показателей температуры на теле ребенка появляется розовая сыпь, которая сначала охватывает лицо, грудь и живот, а далее распространяется по всему телу. Как правило, после появления сыпи температура тела больше не повышается. Может наблюдаться увеличение лимфатических желез. Детскую розеолу не следует путать с ветрянкой или ОРВИ. Заболевшего ребенка необходимо изолировать до исчезновения клинических признаков и сразу же обратиться к врачу.
Какие еще встречаются проявления ГВЧ-6 у взрослых
Если вас продолжительное беспокоит субфебрильная температура тела, повышенная ночная потливость, проблемы со сном, слабость, вялость, чувство подавленности, вам стало трудно заниматься своими привычными делами и все это не проходит даже после отдыха – возможно, у вас синдром хронической усталости, и одновременно с этим вы заражены герпесом 6-го типа. Вам также необходима помощь специалиста.
Лечение герпеса 6 типа у детей
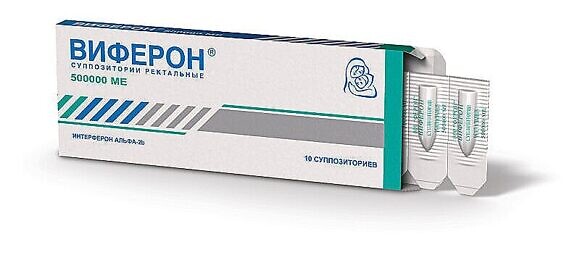
Наверное, ни для кого не секрет, что для ребенка подобрать лекарственные препараты, которые помогут избавиться от заболевания и при этом не нанесут вреда, гораздо сложнее, чем для взрослых. Многие лекарства нельзя применять новорожденным детям и детям до года, что создает огромную проблему как для родителей, так и для врачей. Но все же существуют препараты, которые можно применять для борьбы с герпесом 6-го типа даже у новорожденных малышей. Один из таких препаратов – это препарат ВИФЕРОН Свечи (суппозитории), который содержит интерферон альфа-2b человеческий рекомбинантный. Курс лечения составляет пять дней, ВИФЕРОН Свечи 150 000 ME применяются 1 раз в 12 часов. При необходимости врач может подобрать для ребенка другую дозировку.
Схема применения препарата ВИФЕРОН Гель и Мазь для детей
Для лечения детей всех возрастов, в том числе новорожденных, также можно применять противовирусный препарат ВИФЕРОН Гель. Для борьбы с проявлениями герпеса 6-го типа необходимо 3-5 раз в день в течение 5-6 дней полоску геля длиной не более 0,5 см наносить на предварительно подсушенную пораженную поверхность при помощи шпателя или ватного тампона.
ВИФЕРОН Мазь применяют у детей старше года. Для лечения герпеса шестого типа необходимо 3-4 раза в день в течение тонким слоем на предварительно подсушенную пораженную поверхность. Совместное применение суппозиториев ВИФЕРОН и ВИФЕРОН Мазь/Гель позволяет усилить клинические эффекты проводимой терапии.
Лечение герпеса 6 типа у взрослых
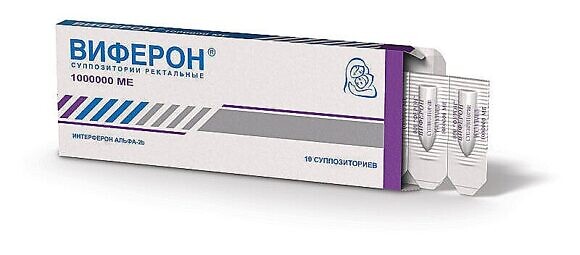
Для лечения взрослых применяется ВИФЕРОН 1 000 000 МЕ два раза в день в течение 10 дней. Терапия заболеваний, ассоциированных с герпесом 6 типа, – это трудоемкая и длительная задача, поэтому, возможно, потребуется повторение курса лечения несколько раз с небольшими интервалами.
Что принимать при беременности
Беременным женщинам с 14-й недели гестации рекомендуется препарат ВИФЕРОН Свечи в дозировке 500 000 ME с дальнейшим назначением поддерживающих курсов согласно инструкции по медицинскому применению. Гестация – это, по сути, та же самая беременность, только ее срок определяется количеством полных недель вынашивания, которые прошли с даты первого дня последней менструации до рождения ребенка.
Схема применения препарата ВИФЕРОН Гель и Мазь при ГВЧ-6 во время беременности
При лечении препаратом ВИФЕРОН Гель полоску геля длиной не более 0,5 см наносят при помощи шпателя или ватного тампона / ватной палочки на предварительно подсушенную пораженную поверхность 3-5 раз в день, курс лечения – 5-6 суток. При необходимости продолжительность курса увеличивают до исчезновения клинических проявлений.
ВИФЕРОН Мазь 3-4 раза в день наносят тонким слоем на предварительно подсушенную пораженную поверхность. Такая схема лечения препаратом ВИФЕРОН Гель и Мазь подходит и для беременных женщин с первой недели гестации.
Автор статьи
Врач общей практики
Справочно-информационный материал
Герпес
Вирус герпеса проявляется не только не эстетичным видом, но и неприятными ощущениями. Чаще всего он появляется на губах, хотя может затрагивать и другие части тела, в том числе половые органы. Опасен ли герпес и как его лечить, разберем в этой статье.
Отчего появляется герпес?
Возбудителем заболевания является группа вирусов, которые поражают кожный покров, нервные клетки, слизистые оболочки человека. На теле появляются высыпания в виде группы пузырьков, которые высыхают и исчезают после применения лекарственных средств.
Герпетическая инфекция самая распространенная среди взрослого населения. Вирус поражает более 90% людей, у 10-20% из которых отмечается острая форма герпеса. Попадая в организм человека, возбудители накапливаются и проявляются при ослабленном иммунитете. Вы наверняка замечали, что патологические высыпания появляются на теле периодами, при чем чаще всего на одном и том же месте.
Герпес передается следующими путями:
Попав в организм человека, вирус герпеса разносится с кровотоком. Он проникает в нервные клетки периферической нервной системы и встраивается в геном нейронов. С этого момента вирус сопровождает человека всю его жизнь.
Виды герпеса
Существует 8 основных типов герпесвирусов:
Как проявляется вирус герпеса в теле человека?
Наличие вируса герпеса в организме никак не проявляется у здорового человека. Он начинает появляться только тогда, когда угнетается работа иммунитета. Такое может произойти при переохлаждении, злоупотреблении алкоголем, табакокурении, внезапном стрессе, травме кожи в периоральной области (вокруг рта), переутомлении или недосыпании.
Чаще всего герпес на губах проявляет себя мелкопузырчатой сыпью в области рта. Спустя несколько дней содержимое пузырьков мутнеет. Если не потревожить образование, происходит подсыхание пузырьков, они покрываются корочкой, которая через несколько дней самостоятельно отпадает. Но если пузырь был поврежден, на его месте образуется язвочка. Также может чувствоваться покалывание, жжение кожи в поврежденной зоне и наблюдаться отечность.
Что такое врожденный герпес?
Он передается от матери к ребёнку во время внутриутробного развития или через родовые пути. Распространенность врожденного герпеса – один случай на 3-60 тысяч новорожденных. В 80% случаев возбудитель – ВПГ второго типа, в 20% – ВПГ первого типа.
Врожденный герпес может иметь локальную форму, церебральную или генерализованную. Первая форма проявляется только пузырчатыми высыпаниями. Может поражать разные части тела. Часто затрагивает глаза, в результате чего образуется герпетический кератит и конъюнктивит.
Церебральная форма характеризуется нарушением сознания вплоть до его потери, судорогами, развитием отека мозга. В этом случае сыпь появляется очень редко, спустя 4-7 дней после первых симптомов и имеет слабовыраженный характер.
Последняя форма, генерализованная, самая опасная. Она проявляет себя и сыпью, и неврологическими симптомами. В дополнение к этим проявлениям присоединяется поражение внутренних органов: почек, печени, селезенки, легких. Если ребёнок выжил, он, как правило, остается инвалидом.
Герпес во время беременности и грудного вскармливания
Для беременной женщины особую опасность представляют вирусы герпеса первого, второго и четвертого типа. Они способны привести к развитию серьезных внутриутробных аномалий.
На раннем сроке развитие вируса герпеса может привести к гибели плода. А половой герпес передается малышу во время родов через прохождение родовых путей. Новорожденные тяжелее переносят последствия инфицирования.
Если развитие герпеса пришлось на период грудного вскармливания, его не нужно прекращать. Наоборот, материнское молоко повышает иммунитет малыша и бережет его от поражения инфекциями. Молодая мама должна помнить, что перед каждым прикладыванием к груди, нужно мыть руки, особенно если до этого притрагивались к части тела, пораженной герпесом.
Герпес в детском возрасте
В большинстве случае именно в детском возрасте происходит первый контакт со всеми вирусами герпеса. Самый тяжелый вариант герпеса у детей – врожденный герпес, но и герпетическая инфекция у детей в более позднем возрасте может несколько отличаться от течения заболевания у взрослых.
В детском возрасте помимо развития герпеса первого типа в области вокруг рта, пузырьки появляются и на слизистой. То есть развивается герпетический стоматит. Второй тип вируса может вызвать у детей герпетическую ангину – она протекает тяжелее обычной.
Герпес третьего типа, как мы уже упоминали выше в этой статье, вызывает ветряную оспу, после чего к ней появляется пожизненный иммунитет. В дальнейшем третий тип может проявляться опоясывающим лишаем, который в детском возрасте регистрируется крайне редко – только на фоне выраженного иммунодефицита.
Диагностика и лечение герпеса
Определить вирус первого типа не составляет никакой сложности. Обычно пациент делает это самостоятельно в домашних условиях. Сложнее дело обстоит с определением цитомегаловируса, инфекционного мононуклеоза. Определить их можно только в лабораторных условиях. В первом случае нужно взять мазок с высыпаний, во втором – провести анализ крови.
Окончательно подтвердить диагноз герпеса помогает ПЦР – реакция выявления элементов вирусных ДНК из биологического материала: содержимого пузырьков, крови. Выявление антител не позволяет поставить точный диагноз, а только доказывает, что пациент когда-то контактировал с вирусом.
Чтобы не допустить осложнений, нужно придерживаться некоторых правил: не срывать подсохшие высыпания, стараться не травмировать кожу, а при генитальном герпесе носить натуральное не стягивающее белье. При появлении пузырьков на лице мужчинам лучше воздержаться от бритья, а женщинам – от использования декоративной косметики.
Излечиться полностью от герпеса невозможно – вирус остается в организме человека на всю жизнь после первичного инфицирования. Все средства лишь убирают симптомы. Основной класс препаратов, используемых в лечении герпетической инфекции – противовирусные средства. Используются, как таблетки и инъекции, так и мази, кремы для местного действия. Для предупреждения рецидивов назначаются иммуностимулирующие препараты, позволяющие восстановить и поддержать иммунитет.
Чтобы пройти диагностику и лечение герпеса, обратитесь за помощью дерматовенеролога в частном медицинском центре «Медюнион». Чтобы узнать расписание работы врачей и записаться на прием, позвоните по номеру телефона +7 391 201-03-03.
Герпесвирусы 6, 7, 8-го типов
За последние 15 лет выделены три новых антропонозных представителя этого семейства — HHV-6, HHV-7, HHV-8, которые характеризуются многообразием клинических проявлений и бессимптомным носительством. HHV-6 Герпесвирус 6-го типа (HHV-6, ВГЧ-6) относительн
За последние 15 лет выделены три новых антропонозных представителя этого семейства — HHV-6, HHV-7, HHV-8, которые характеризуются многообразием клинических проявлений и бессимптомным носительством.
Герпесвирус 6-го типа (HHV-6, ВГЧ-6) относительно недавно внесен в список известных человеческих патогенов и является серьезным претендентом на роль этиологического агента рассеянного склероза и лихорадки новорожденных с судорожным синдромом, инфекционных мононуклеозов негативных по вирусу Эпстайна–Барр (ВЭБ) и цитомегаловирусу (ЦМВ) и ассоциированного с HHV-6 энцефалита. HHV-6 также является кофактором СПИДа, некоторых форм карцином шейки матки и назофарингеальных карцином.
Впервые HHV-6 был выделен в 1986 г. из лимфоцитов периферической крови пациентов с различными лимфопролиферативными заболеваниями, в том числе инфицированных ВИЧ. Новый вирус был назван В-лимфотропным вирусом человека (HBLV — human B-lymphotropic virus). HBLV инфицировал только свежие В-лимфоциты in vitro. Позднее был описан более широкий спектр клеточного тропизма, преимущественно к Т-клеткам, вследствие чего вирус переименовали в HHV-6.
HHV-6 сходен с остальными герпесвирусами, но отличается от них по биологическим, иммунологическим свойствам, спектру чувствительных клеток, антигенной структуре, составу генома, количеству и молекулярной массе структурных вирусных белков. Диаметр вириона — 160–200 нм, тип симметрии икосаэдрический, содержит 162 капсомера, имеет суперкапсидную липидосодержащую оболочку. Геном представлен двунитчатой ДНК. Рестрикционный анализ ДНК HHV-6 установил вариабельность генома различных изолятов вируса. При сравнении первичной структуры геномов HHV-6 и ЦМВ было обнаружено их определенное сходство. Степень гомологии между HHV-6 и ЦМВ была большей, чем между HHV-6 и другими герпесвирусами, что свидетельствует о тесной связи геномов этих двух вирусов.
Исследования изолятов HHV-6 от людей с различной патологией показали, что они принадлежат к двум вариантам: А или В (HHV-6А и HHV-6В). Варианты различаются между собой по клеточному тропизму in vitro, рестрикционному эндонуклеазному профилю, нуклеотидной последовательности, реактивности с моноклональными антителами, сероэпидемиологии и причастности к различным заболеваниям. Инфекция, индуцированная HHV-6А, наблюдается реже, и роль данного варианта вируса в патологии человека недостаточно ясна, а HHV-6В является основным этиопатогеном внезапной экзантемы (Exantema subitum).
Эпидемиология HHV-6-инфекции. Первые клинико-эпидемиологические исследования, проведенные в 1986 г., выявили наличие этой инфекции в зоне отдыха в штате Невада (США). Клинически заболевание выражалось в гриппоподобной симптоматике с повышением температуры, ночным потом, увеличением лимфатических узлов, рядом психологических симптомов (усталость, депрессия). Заболевание получило название «синдром хронической усталости». При этом у 75% больных выявлялись антитела к HHV-6. Год спустя первый больной с клинически сходным заболеванием и антителами к HHV-6 в крови был зарегистрирован в Германии. В дальнейшем эта инфекция была выявлена в Европе (Англия, Швеция) и Африке. При этом разные исследователи сообщили о выделении HHV-6 из клеток крови не только от лиц с различными лимфопролиферативными и гематологическими заболеваниями, инфицированных HTLV-1, ВИЧ-1 и ВИЧ-2 или больных СПИДом, но и от здоровых взрослых.
По данным российских авторов, у 80% здоровых доноров, у 65% ВИЧ-инфицированных и 73% онкологических больных выявляются антитела к HHV-6. При рождении большинство детей серопозитивны за счет материнских антител, титр которых снижается к 5 мес. Однако к одному году процент серопозитивных малышей оказывается таким же, как среди старших детей и взрослых. Высокая частота выявления антител и ранний возраст инфицирования указывают на присутствие вируса в ближайшем окружении. Выделение HHV-6, определение вирусных белков и ДНК в образцах слюны и мокроты указывают на то, что вирус находится в организме человека в слюнных железах, а эксперименты in vitro показали, что он в латентной фазе сохраняется в моноцитах/макрофагах. В естественных условиях основным путем передачи вируса является воздушно-капельный. Нельзя исключить вертикальный путь заражения; антигены вируса присутствовали в абортивном материале в ряде случаев при спонтанных абортах. Также не исключаются половой путь передачи вируса и перинатальная инфекция. Длительная репродукция при острой инфекции и персистенция HHV-6 в клетках крови внешне здоровых людей, включая доноров, является серьезным фактором риска передачи вируса при переливании крови и ее компонентов, трансплантации органов и тканей. Посттрансплантационная серологическая конверсия к HHV-6 отмечается у 43% реципиентов. При этом повышенный титр антител к HHV-6 в крови реципиентов персистировал в течение 2 лет после трансплантации.
Диагностика. Диагностика HHV-6-инфекции основана на сравнительном анализе результатов выделения вируса на чувствительных культурах клеток от больного, обнаружении вирусных белков (при использовании иммунопероксидазного и иммунофлюоресцентного методов, электронной микроскопии) или его генома (при использовании методов гибридизации и полимеразной цепной реакции (ПЦР)) в материалах от больного и выявлении вирусспецифических антител в крови. Вирусспецифические иммуноглобулины класса М (IgM) синтезируются через 2 нед после острой первичной инфекции, достигая титра 1:1280, по данным непрямой иммунофлюоресценции, а класса G (IgG) — на неделю позже и достигают более высокого титра — 1:10240. Поскольку титр IgM быстро снижается и они исчезают через 4–6 нед, острая первичная HHV-6-инфекция диагностируется по наличию IgG (положительным считается титр выше 1:20). Синтез IgM возможен как при первичной, так и при реактивации латентной HHV-6-инфекции. Периодическая реактивация и активная персистентная HHV-6-инфекция у больных с дефектом иммунного ответа, как и при других герпесвирусных инфекциях, приводит к повышению титра вирусспецифических IgG, зачастую без соответствующего повышения титра IgМ.
Первичная HHV-6-инфекция у иммунокомпетентных лиц диагностируется на основании корреляции наличия и нарастания титров вирусспецифических IgG и IgМ с динамикой развития клинических проявлений заболевания. Серологическое исследование должно дополняться выделением вируса и/или обнаружением генома. При иммунных нарушениях и реактивации HHV-6-инфекции число таких геномнесущих клеток возрастает до 50–70, а обнаружение геномнесущих клеток в пределах 200-7500 свидетельствует о патогенетической связи реактивированной HHV-6-инфекции с заболеванием.
Клиника. Спектр заболеваний, связанных с HHV-6, довольно широк. Полиморфизм патологии зависит как от формы инфекции, так и от штаммовых различий вируса.
К заболеваниям, ассоциированным с первичной острой HHV-6-инфекцией, относятся: синдром хронической усталости (миалгический энцефаломиелит); внезапная экзантема у новорожденных и более старших детей (roseola infantum exantema subitum); инфекционный мононуклеоз у подростков и взрослых, не связанный с ВЭБ-инфекцией; гистиоцитарный некротический лимфаденит (KiKuchi’s lymphadenitis).
Заболевания, ассоциированные с персистентной HHV-6-инфекцией, включают: лимфопролиферативные (иммунодефицит, лимфаденопатия, поликлональная лимфопролиферация); злокачественные лимфомы (неходжкинская лимфома, периферическая Т-клеточная лейкемия, В-клеточная лимфома, дерматопатическая лимфаденопатия, болезнь Ходжкина, синусоидальная В-клеточная лимфома, плеоморфная Т-клеточная лимфома).
HHV-6 связывают с различными лимфопролиферативными и иммуносупрессивными заболеваниями, с внезапной экзантемой новорожденных, злокачественными новообразованиями, аутоиммунной патологией, некоторыми заболеваниями ЦНС и др. Реинфекция HHV-6 наблюдается у больных с нарушенным иммунным статусом, иммуносупрессией (трансплантация органов, СПИД и др.).
Доказана этиологическая роль HHV-6 в развитии внезапной экзантемы — широко распространенного заболевания детей в возрасте от 3 мес до 3 лет. В части случаев причиной молниеносной экзантемы является HHV-7. Инкубационный период заболевания — 5–15 дней. Заболевание характеризуется высокой лихорадкой (38,5–40°С) в течение 3–5 дней, в дальнейшем в течение 1–3 дней наблюдаются эритематозная или макулезная кожная сыпь, которая совпадает со снижением температуры. Около половины всех случаев первой в жизни лихорадки новорожденных связаны с первичным инфицированием HHV-6.
С развитием экзантемы связывают преимущественно вариант HHV-6В. В период лихорадки (и даже перед этим) вирус присутствует в CD4+-клетках; в это время выделить вирус из крови больных удается более чем в 90% случаев.
Антитела к HHV-6 отсутствуют в острой фазе болезни и начинают определяться в большинстве случаев на 6–8-й день от начала заболевания. IgM-антитела выделяются на 5-й день лихорадки и обнаруживаются в течение 2–3 нед. IgG-антитела появляются на 7-й день, достигая максимума через 2–3 нед, и персистируют длительное время. Обычно заболевание заканчивается без осложнений, но описаны клинические случаи манифестной инфекции с различными симптомами: лихорадка выше 40°С, воспаление барабанной перепонки, респираторные и гастроинтестинальные симптомы, неврологические осложнения (энцефалиты, менингоэнцефалиты, асептический менингит, судороги с последующей эпилепсией); имеются сообщения о протекании первичной HHV-6-инфекции с гепатоспленомегалией, фатальным фульминантным гепатитом, фатальной диссеминированной инфекцией.
Потенциальная онкогенность HHV-6 и роль в характеризующемся множеством стадий процессе онкогенеза подтверждается следующими фактами. HHV-6 активирует онкопротеины Е6 и Е7 вируса папилломы человека при цервикальной карциноме. ДНК HHV-6 способна индуцировать неопластическую трансформацию клеток NIH3T3 in vitro и на животных моделях.
При анализе образцов слюны от больных назофарингеальной карциномой, методом ПЦР в ряде случаев выявлена ДНК HHV-6. У этих же больных было отмечено достоверное повышение титров антител к HHV-6 класса IgG и, в отличие от здоровой популяции, найдены антитела класса IgA. Таким образом, можно полагать, что наличие антител класса IgA к HHV-6 может служить признаком назофарингеальной карциномы.
Методом ПЦР, гибридизации in situ, ДНК HHV-6 была идентифицирована в тканях и клетках биопсийных образцов ходжкинских, смешанных В- и Т-клеточных неходжкинских лимфом, при ангиоиммунобластоидной лимфаденопатии, африканской лимфоме Беркитта, Т-клеточной острой лимфобластоидной лейкемии, лимфогранулематозе, инфекционном мононуклеозе, не связанном с ВЭБ, и ряде других лимфопролиферативных заболеваний.
Роль HHV-6 в возникновении синдрома хронической усталости обсуждается различными авторами, однако доказательства, которые приводятся в подтверждение этой гипотезы, неоднозначны.
Позднее вирус с аналогичными характеристиками был выделен другими исследователями.
При электронно-микроскопическом исследовании ультратонких срезов клеток, инфицированных HHV-7, выявлены типичные для герпесвируса вирионы диаметром до 170 нм, ДНК 150Кб. Вирионы содержали электронно-плотное цилиндрическое ядро, капсид, тегумент и внешнюю оболочку и имели значительное морфологическое сходство с HHV-6. Гибридизационный анализ показал, что ДНК HHV-7 отличается от ДНК вируса простого герпеса, ВЭБ, опоясывающего лишая и ЦМВ. В то же время ДНК ЦМВ имеет ограниченную перекрестную гибридизацию с ДНК HHV-7 (гомология находится на уровне 36%). Несколько большее сходство выявлено между ДНК HHV и ДНК HHV-7 (по разным данным, гомология находится на уровне 57,5–58,8%). Однако на основании ряда критериев можно сделать вывод, что речь идет о разных вирусах, а не о различных штаммах одного вируса. К настоящему времени HHV-7 классифицируется как член подсемейства β-герпесвирусов.
Распространенность инфекции и пути ее передачи неизвестны. Имеются данные и о выделении HHV-7 из слюны инфицированных, а также персистенции вируса в Т-лимфоцитах, в связи с чем предполагается возможность наличия воздушно-капельного пути передачи инфекции, особенно у детей раннего возраста, и передачи инфекции при переливании крови и ее компонентов. Для выделения и идентификации HHV-7 используют культуру мононуклеаров периферической крови, метод непрямой иммунофлюоресценции, электронной микроскопии, молекулярной гибридизации и сиквенс-анализа ДНК.
Значение HHV-7 в патологии не изучено. HHV-7 ассоциируется с лимфопролиферативными заболеваниями, синдромами хронической усталости и иммунодефицита.
Как самостоятельное заболевание синдром хронической усталости впервые был выделен в 1988 г. Центром по контролю заболеваний (The Centers for Disease Control–CDC, Атланта, США). Поводом для этого послужило внезапное увеличение в штате Невада в 1984 г. числа больных, жалующихся на постоянную усталость, сопровождающуюся рядом соматических и психологических симптомов — при отсутстви видимой причины заболевания. Подобные вспышки заболевания наблюдались и раньше: в Лос-Анжелесе в 1934 г., в Исландии в 1948 г., в Лондоне в 1955 г., во Флориде в 1956 г. Работы по изучению синдрома хронической усталости в США возглавили P. Cheney и D. Peterson. Вскоре в США были открыты специальные клиники для этих больных и создана Национальная ассоциация. Данное заболевание в настоящее время изучается также в Великобритании, Германии, Австралии, Японии и других странах.
В опубликованном CDC в марте 1988 г. в журнале «Annals of Internal Medicine» докладе были сформулированы диагностические критерии (большие и малые) синдрома хронической усталости. Этот диагностический комплекс подвергался пересмотру в 1991, 1992, 1994 гг. К большим (обязательным) диагностическим критериям относят наблюдающиеся в течение не менее 6 мес у ранее здоровых людей постоянную усталость и снижение работоспособности на 50% и более. Вторым обязательным критерием является отсутствие заболеваний или других причин, которые могут вызвать такое состояние.
Малые критерии можно объединить в несколько групп. Первая из них включает симптомы, отражающие наличие хронического инфекционного процесса: субфебрильная температура, хронический фарингит, увеличение лимфатических узлов (шейных, затылочных, подмышечных), мышечные и суставные боли. Вторая группа — психические и психологические проблемы: нарушение сна (гипо- или гиперсомния), снижение памяти, повышенная раздражительность, снижение интеллекта, невозможность концентрации внимания, депрессия и т. д.). Третью группу составили симптомы вегетативно-эндокринной дисфункции: быстрое изменение массы тела, нарушение функции желудочно-кишечного тракта, снижение аппетита, аритмия, дизурия, быстрая физическая утомляемость с последующей продолжительной (более 24 ч) усталостью и др. Четвертая группа объединяет симптомы аллергии и повышенной чувствительности к лекарственным препаратам, инсоляции, алкоголю и некоторым другим факторам.
Согласно диагностическим критериям 1994 г., диагноз синдрома хронической усталости считается достоверным, если у больного выявлены два обязательных критерия и четыре признака из приведенных ниже восьми дополнительных (которые также наблюдаются не менее 6 мес): нарушение памяти или концентрации внимания; фарингит; болезненные шейные лимфатические узлы; мышечные боли; полиартралгии; необычная, новая для больного головная боль; неосвежающий сон; недомогание после физического напряжения.
Распространенность синдрома хронической усталости, по данным большинства исследователей, в разных странах и социально-демографических группах приблизительно одинакова. Заболеванию подвержены люди любого возраста, однако замечено, что женщины в возрасте 25–49 лет болеют чаще, чем мужчины.
Предполагается, что HHV-7 может быть причиной exanthema subitum, но не прямо, а опосредованно, за счет реактивации HHV-6 из латентного состояния. HHV-7 селективно тропен к CD+-Т-клеткам. Показано что вирус инфицирует CD4+ в 42%, а CD8+ в 4% случаев. При взаимодействии HHV-7 и HIV ВИЧ появляется конкурирующий эффект за очередность инфицирования CD+-лимфоцитов.
HHV-8 — это герпесвирус, ассоциированный с саркомой Капоши (KS). Был недавно открыт и идентифицирован молекулярным клонированием с использованием тканей саркомы Капоши. KS — многоочаговая злокачественная опухоль сосудистого происхождения с преимущественным поражением кожных покровов и вовлечением внутренных огранов и лимфатических узлов. Выделяют четыре различные эпидемиологические формы KS: классическая, африканская, ятрогенная и СПИД-ассоциированная KS. HHV-8 подразделяют на три варианта: А, В и С — на основании различий в нуклеотидных последовательностях субсегментов генома.
Вариант А связывают с классической KS и со СПИД-ассоциированными поражениями кожи и внутренних органов, а В и С — с лимфопролиферативными заболеваниями (лимфомами, генерализованными лимфаденопатиями, болезнью Кастлемана).
Вирусная теория развития KS первые была выдвинута в 1967 г. B. MacKinney, изучавшим ее эпидемиологию у жителей Африки. В дальнейшем эту концепцию поддержали многие другие ученые, предполагавшие причастность к этому заболеванию вирусов группы Herpes: ВЭБ, ЦМВ в ассоциации с вирусом простого герпеса 1-го и 2-го иммунотипа, также вируса Т-клеточной лимфомы человека (HTLV).
Новый этап в понимании роли вирусов в развитии KS наступил в 1994 г., когда Y. Chang и соавторы обнаружили в ПЦР с использованием синтезированного ими праймера KS 330233 присутствие уникальной ДНК-последовательности в геноме опухолевых клеток, выделенных из биоптата очагов поражений кожи больного со СПИД-ассоциированным типом KS.
С учетом высокой частоты обнаружения HHV-8 в клетках очагов поражений KS, данных эпидемиологических исследований (обнаружение HHV-8 в очагах поражений больных различными типами KS как из эндемичных, так и неэндемичных регионов), а также подтверждения трансформирующего потенциала некоторых его генов, этот вирус в настоящее время рассматривается как наиболее вероятный кандидат на роль этиологического фактора данного заболевания. Это подтверждается и биологическими свойствами HHV-8: было установлено, что он кодирует белки, контролирующие рост и пролиферацию клеток, и обладает генетическим сродством по отношению к представителям подсемейства радиновирусов, обладающих трансформирующими свойствами. Этиологическая роль HHV-8 в развитии KS также была подтверждена в России. Причем сывороточные антитела к этому вирусу у здоровых доноров из России обнаруживались в 9,6% случаев.
Данные подтверждают возможность персистенции вируса в группах здоровых лиц и его активации в условиях иммуносупресии.
Высокая частота выявления HHV-8 в эякуляте здоровых доноров жителей Италии, которая также является эндемичным по KS регионом, не исключает возможности полового пути передачи данной инфекции. В связи с этим представляют интерес данные S. Lin и соавторов (1995), показавших, что у 13 из 30 ВИЧ-позитивных пациентов с наличием в эякуляте HHV-8 в течение 5 лет развилась KS, тогда как в эякуляте 30 ВИЧ-негативных пациентов без HHV-8 в те же сроки наблюдения KS не развилась ни в одном случае. Проведенные исследования отечественных авторов и полученные ими данные свидетельствуют о том, что ткани урогенитального тракта в некоторых случаях могут быть местом латенции HHV-8. При этом высокая частота хронических воспалительных поражений мочеполовых органов в группе больных c KS должна рассматриваться в качестве фактора, нарушающего гематотестикулярный барьер и тем самым способствующего проникновению в эякулят клеток воспаления, включая инфицированные HHV-8 В-лимфоциты. Необходимо учитывать роль хронического воспаления в снижении общего иммунитета и местного иммунного контроля в тканях репродуктивной системы.Такое воспаление может приводить к активации персистирующего там HHV-8. Установлено, что до 10% вирусов HHV-8, выявляемых в очагах поражения KS, находятся в литической фазе, в связи с чем этот вирус должен с высокой частотой обнаруживаться в лимфоцитах периферической крови. Однако HHV-8 в лимфоцитах периферической крови выявляется, как правило, только у больных с выраженной иммуносупрессией (СПИД-ассоциированным и иммуносупрессивным типом заболевания), тогда как у пациентов с другими типами KS инфицированные клетки содержатся в очагах поражения в эякуляте, а из крови, по-видимому, достаточно эффективно элиминируются. HHV-8 обнаруживали в эякуляте только при наличии у больных с KS хронического воспалительного процесса мочеполовых органов (хронический уретропростатит). Таким образом, эякулят у больных с KS является естественным резервуаром инфекции HHV-8. Инфицированные вирусом HHV-8 лимфоциты проникают в эякулят и сохраняются в нем в условиях аккумуляции CD8+ Т-лимфоцитов, ингибирующих иммунный ответ не только на сперматозоиды, но и на эти инфицированные клетки.
Вирус широко распространен в популяции: более 25% взрослого населения и 90% ВИЧ-инфицированных имеют антитела к литическим белкам HHV-8. HHV-8, как и ВЭБ или HVS, инфицирует в первую очередь лимфоциты и ассоциирован с клеточной трансформацией и иммортализацией. HHV-8 является возможным этиологическим агентом всех форм KS, связан с развитием некоторых В-клеточных лимфом, ангиоиммунобластоидной лимфаденопатии, болезни Кастлемана и ряда других лимфопролиферативных заболеваний.
Несмотря на большой арсенал антигерпетических препаратов терапия заболеваний, вызванных данными вирусами, представляет значительные трудности. Это обусловлено генотипическими особенностями возбудителя, длительной персистенцией вируса в организме, различной чувствительностью к препаратам. Исследования антивирусного действия некоторых препаратов показали, что HHV-6, 7, 8 малочувствительны к аналогам нуклеозидов. С определенным успехом в лечении были использованы ганцикловир и фоскарнет. Однако препаратов, которые были бы достаточно эффективны в лечении инфекции, вызванной HHV-6, 7, 8, пока не найдено.
Литература
Е. Г. Белова, кандидат медицинских наук, доцент
Т. К. Кускова, кандидат медицинских наук
МГМСУ, Москва