везикар или омник что лучше
Современные возможности медикаментозного лечения доброкачественной гиперплазии ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
К числу наиболее распространенных урологических заболеваний у пациентов пожилого возраста относится доброкачественная гиперплазия предстательной железы (ДГПЖ) [2].
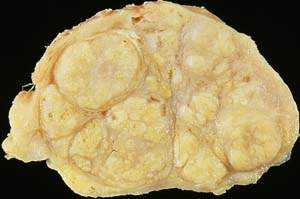 |
| Рисунок 1. Доброкачественная гиперплазия предстательной железы (макропрепарат) |
К числу наиболее распространенных урологических заболеваний у пациентов пожилого возраста относится доброкачественная гиперплазия предстательной железы (ДГПЖ) [2]. Около 80% мужчин старше 80 лет страдают этим заболеванием. Другая статистика свидетельствует, что из всех заболеваний, которым подвержены мужчины старше 50 лет, на долю доброкачественной гиперплазии простаты приходится 36% [1]. Эти сведения настолько общеизвестны, что ухудшение качества мочеиспускания часто рассматривается как естественное явление.
Клинически данное заболевание проявляется различными симптомами, связанными с нарушением пассажа мочи по нижним мочевым путям. При значительно выраженной инфравезикальной обструкции, как правило, прибегают к хирургическому вмешательству. Оперативное лечение по поводу ДГПЖ показано 30% больных в возрасте от 50 до 80 лет [4]. Однако в последние годы все большую популярность завоевывает медикаментозная терапия доброкачественной гиперплазии предстательной железы. Это, с одной стороны, объясняется вполне логичным желанием врача и пациента по возможности избежать операции, с другой — развитием представлений о патогенезе расстройств мочеиспускания при доброкачественной гиперплазии предстательной железы.
До недавнего времени патогенез расстройств мочеиспускания при доброкачественной гиперплазии предстательной железы рассматривали с позиции классических представлений о механической инфравезикальной обструкции и развитии вторичных структурно-функциональных изменений детрузора (компенсация, декомпенсация). За последние два десятилетия получены принципиально новые данные о природе повышенного внутриуретрального сопротивления. Его перестали отождествлять исключительно с механическим сдавлением шейки мочевого пузыря и задней уретры. Обнаружен динамический компонент обструкции, который состоит в повышении тонуса указанных анатомических структур за счет активности a-адренорецепторов. Появились также иные трактовки происхождения ирритативных симптомов. Их считают проявлением первичного нестабильного мочевого пузыря и не связывают напрямую с обструкцией [5].
Результаты нашей работы свидетельствуют, что при ДГПЖ клиническая симптоматика развивается вследствие недостаточности энергетического метаболизма и гипоксии детрузора в условиях повышенного уретрального сопротивления [3]. Об этом свидетельствуют:
Причины нарушений энергетического метаболизма и функций детрузора крайне многообразны. В частности, к таким нарушениям могут привести повышение активности симпатической нервной системы, расстройства органного кровообращения, авитаминоз (группа В), хронические заболевания дыхательной и сердечно-сосудистой систем, влияние приема ряда фармакологических препаратов, угнетающих дыхательную цепь, и, естественно, обструктивные нарушения уродинамики и т. д. Весьма важно, что нарушения гипоксического характера в гладкомышечной ткани могут иметь и первичный митохондриальный генез (первичные нарушения энергетического метаболизма детрузора [3].
Необходимо отметить, что у больных ДГПЖ в нижнем отделе мочевого тракта протекают два параллельных процесса — формирование уретральной обструкции и нарушение энергетического метаболизма детрузора (митохондриальная недостаточность).
Подобное представление патогенеза расстройств мочеиспускания открывает широкие возможности для фармакотерапии. Сокращения и расслабления детрузора можно достичь с помощью средств метаболической терапии, прямого улучшения снабжения детрузора кислородом и т. д. Наиболее значимые расстройства основных функций мочевого пузыря все же опосредованы расстройствами кровообращения. И если процесс обратим, то до или после хирургического вмешательства можно существенно влиять на функциональное состояние мочевого пузыря с помощью вазоактивных препаратов, к которым в первую очередь относятся a1-адреноблокаторы.
При определении критериев отбора пациентов для медикаментозной терапии ДГПЖ мы воспользовались рекомендациями IV Международного консультативного комитета по ДГПЖ.
Основу настоящего исследования составили собственные клинические наблюдения за 1724 пациентами (средний возраст 61,4 года), страдающими ДГПЖ и получавшими различные варианты медикаментозного лечения. Нами применялись препараты всех групп, использующихся в настоящее время для лечения ДГПЖ: a-адреноблокаторы, блокаторы 5-a-редуктазы, препараты растительного происхождения и их комбинации. Схемы проведенного лечения и характеристика групп пациентов приведены в табл. 1.
Из наиболее многочисленной и популярной сегодня группы препаратов для медикаментозного лечения ДГПЖ — селективных a-адреноблокаторов мы использовали альфузозин, теразозин, доксазозин и тамсулозин. Общее число пациентов, получавших a-адреноблокаторы, составило 1408. Финастерид был взят нами как классический представитель блокаторов 5-a-редуктазы. Из препаратов растительного происхождения мы использовали пермиксон и таденан.
В пяти группах общей численностью 1305 человек проводилась терапия селективными a-адреноблокаторами в течение длительного периода времени по стандартным схемам и в стандартных дозах. Результаты лечения приведены в табл. 2.
Улучшение качества мочеиспускания отметили в среднем 86,74% пациентов. Суммарный балл I-PSS сократился на 38,68% к окончанию первого года лечения и на 43,4% к окончанию курса терапии. Балл QOL уменьшился на 29,04% и 35,58% соответственно. Максимальная скорость потока мочи увеличилась на 45,25% к окончанию первого года лечения и стабилизировалась на достигнутом уровне. Количество остаточной мочи сократилось в среднем на 57,6%. Процент пациентов, по тем или иным причинам выбывших из исследования, был тождествен во всех группах и равнялся 14,38%.
Особо следует остановиться на препарате тамсулозин (омник, Yamanouchi) — пока единственном простатселективном a1А-адреноблокаторе на отечественном рынке. Этот препарат обладает рядом свойств, которые позволяют его использовать в различных функциональных тестах. Прежде всего это возможность назначения единой терапевтической дозы (один раз в сутки по 0,4 мг). А отсутствие выраженного влияния на артериальное давление и сердечную деятельность избавляет от необходимости титрования дозы. Мы согласны с рядом авторов, которые считают возможным применение коротких курсов терапии тамсулозином в качестве прогностических тестов эффективности лечения a1-адреноблокаторами, что может иметь решающее значение при выборе того или иного метода медикаментозного лечения ДГПЖ [4].
Части больных (группа А5) проведена проверка возможности разрешения острой задержки мочеиспускания (ОЗМ) приемом альфузозина по 5 мг два раза в сутки. Эта терапия проводилась пациентам с впервые возникшей ОЗМ и отсутствием симптомов нарушения мочеиспускания в анамнезе. Положительный эффект был достигнут у 8 из 14 пациентов (57,1%), которым параллельно приему альфузозина производилось кратковременное (трое суток) дренирование мочевого пузыря катетером. Единовременный прием суточной дозы альфузозина (10 мг) способствовал восстановлению самостоятельного мочеиспускания лишь у одного из четырех пациентов, которым проводилась подобная терапия. Вероятно, это объясняется гипотонией детрузора, усугубляющейся в ситуации длительного перерастяжения мочевого пузыря на фоне задержки мочеиспускания.
Для изучения эффективности и безопасности комбинированной медикаментозной терапии ДГПЖ препаратами разных групп, а также для уточнения целесообразности проведения терапии нами были созданы три группы.
В первой группе (К1) пациенты получали проскар по 5 мг/сут. параллельно с приемом теразозина по 5-10 мг/сут. Обращало на себя внимание значительное повышение показателей максимальной скорости потока мочи (+40%), характерное для группы монотерапии a-адреноблокаторами, и постепенное, на протяжении курса лечения, снижение объема предстательной железы (-20,4%), характерное для группы монотерапии финастеридом. Очевидно, что положительные изменения показателей мочеиспускания в этой группе являются следствием воздействия обоих препаратов. Тем не менее процент выбывших пациентов в этой группе был крайне высоким — 32,3%. Основной причиной прекращения комбинированной терапии ДГПЖ пациенты называли неприемлемо высокую стоимость лечения.
В третьей группе комбинированной терапии (К3) лечение проводилось финастеридом по 5 мг/сут. в сочетании с пермиксоном по 160 мг два раза в сутки. Через два года после начала лечения 50% пациентов покинули группу, приводя причиной отказа от дальнейшей терапии высокую стоимость лечения при отсутствии быстрого улучшения качества мочеиспускания. При сравнении полученных данных с результатами в других группах очевидно, что эффективность лечения в третьей существенно ниже.
Таким образом, эффективность медикаментозной терапии больных ДГПЖ при соблюдении показаний и противопоказаний к ее назначению, правильном выборе препарата и схемы его назначения высока и достигает в среднем 80,2%. При этом эффективность монотерапии a-адреноблокаторами составляет 86,7%, блокаторами 5a-редуктазы — 69,4%, препаратами растительного происхождения — 69,3% и при комбинированной терапии — 95,45%. Комбинированная медикаментозная терапия a-адреноблокаторами в сочетании с блокаторами 5a-редуктазы эффективнее монотерапии этими препаратами. С целью снижения стоимости лечения возможен переход на монотерапию блокаторами 5a-редуктазы после достижения выраженного регресса обструктивной симптоматики. Медикаментозная терапия a-адреноблокаторами является эффективным способом консервативного лечения острой задержки мочеиспускания. Терапия должна проводиться на фоне кратковременного (трое суток) дренирования мочевого пузыря уретральным катетером.
Литература
1. Гориловский Л. М. Эпидемиология и факторы риска развития доброкачественной гиперплазии предстательной железы. В кн.: Доброкачественная гиперплазия предстательной железы / Под ред. Н. А. Лопаткина. М., 1997, с. 10-18.
2. Лопаткин Н. А., Перепанова Т. С. Клинический опыт лечения больных доброкачественной гиперплазией предстательной железы a1-адреноблокатором альфузозином // Урол. и нефрол., 1997, № 5, с. 14-17.
3. Лоран О. Б., Вишневский Е. Л., Вишневский А. Е. Лечение расстройств мочеиспускания у больных доброкачественной гиперплазией простаты a-адреноблокаторами. Монография. М., 1998.
4. Сивков А. В. Медикаментозная терапия доброкачественной гиперплазии предстательной железы. В кн.: Доброкачественная гиперплазия предстательной железы / Под ред. Н. А. Лопаткина. М., 1997, с. 67-83.
5. McConnell J. D. Prostatic growth: new insights into hormonal regulation // Br. J. Urol. 1995. Vol.76.(suppl.1). P. 5-10.
Лечение гиперактивного мочевого пузыря и императивного недержания мочи у женщин
Гиперактивный мочевой пузырь (ГМП), проявлениями которого являются симптомы учащения мочеиспускания, императивные позывы и императивное недержание мочи, — частый повод обращения к гинекологам и урологам. Состояние требует длительного лечения, первой лини
Гиперактивный мочевой пузырь (ГМП), проявлениями которого являются симптомы учащения мочеиспускания, императивные позывы и императивное недержание мочи, — частый повод обращения к гинекологам и урологам. Состояние требует длительного лечения, первой линией которого специалисты единодушно считают поведенческую терапию [1].
Применение поведенческой терапии при ГМП основано на предположении, что это состояние вызвано утратой выработанного в детстве контроля коры головного мозга над мочеиспускательным рефлексом или наличием патологически сформированного рефлекса. Известно, что больше половины пациенток с ГМП имеют выраженные психические и социальные проблемы, а у 20% из них гиперактивность связана именно с неправильной моделью мочеиспускания. Чтобы восстановить этот контроль, устанавливают определенный ритм мочеиспусканий и постепенно увеличивают интервалы между ними. Перед началом лечения пациентке объясняют, что в норме диурез составляет 1500–2500 мл/сут, средний объем мочеиспускания — 250 мл, функциональная емкость мочевого пузыря — 400–600 мл, допустимое количество мочеиспусканий — в среднем 7–8 раз в сутки. Если этот объем превышает норму, необходимо научить пациентку избегать употребления жидкости без необходимости: пить только во время приема пищи, отказаться от кофе и чая, особенно вечером, ограничить употребление острой пищи и соли, которые вызывают жажду. Исключением являются пациентки, принимающие диуретики. Важно обосновать и необходимость отказа от «вредных» привычек: мочиться «на всякий случай», перед едой или выходом из дома. Целью тренировки мочевого пузыря является постепенное удлинение интервалов между мочеиспусканиями (в начале лечения интервалы между мочеиспусканиями должны быть короткими, например 1 ч, постепенно их доводят до 2,5–3 ч) и увеличение функциональной емкости мочевого пузыря. Таким образом, больная «приучает» свой мочевой пузырь опорожняться только произвольно. Ночью больной разрешается мочиться только в том случае, когда она просыпается из-за позыва на мочеиспускание.
Основным инструментом при таком методе лечения является дневник регистрации мочеиспусканий, в котором должны быть отмечены не только объем выделенной мочи и время мочеиспускания, но и эпизоды недержания мочи (НМ) и смена прокладок. Дневник в обязательном порядке должен изучаться и обсуждаться с врачом на плановых регулярных осмотрах.
Поведенческая терапия особенно эффективна при идиопатической гиперактивности детрузора. Прогноз, безусловно, определяется тем, насколько точно больная следует рекомендациям врача. Высокая эффективность лечения ГМП отмечается при сочетании тренировки мочевого пузыря и медикаментозной терапии.
Упражнения для укрепления мышц тазового дна имеют большое значение не только при стрессовом НМ, когда с их помощью может быть увеличено уретральное давление. Клиническое применение упражнений при ГМП основано на эффекте рефлекторного торможения сокращений детрузора при произвольных и достаточных по силе сокращениях мышц тазового дна [2].
Система выполнения упражнений Кегеля включает поочередное сокращение и расслабление мышц, поднимающих задний проход. Упражнения выполняются 3 раза в сутки. Длительность сокращений постепенно увеличивают: от 1–2 с, 5 с, 10–15 с и от 30 с до 2 мин. Иногда для контроля правильности выполнения упражнений используют перинеометр. Он состоит из баллончика, соединенного с манометром. Больная вводит баллончик во влагалище и определяет силу мышечных сокращений во время упражнений по манометру. «Функциональные» упражнения в дальнейшем предполагают их выполнение не только в позиции релаксации, но и в ситуациях, провоцирующих НМ: при чихании, вставании, прыжках, беге. Несмотря на простоту и широкую известность, упражнения Кегеля в настоящее время применяют редко. Иногда врач советует больной по нескольку раз в день прерывать и возобновлять мочеиспускание. Однако такие упражнения не только устраняют НМ, но и приводят к нарушениям мочеиспускания.
Основное условие эффективности терапии — регулярное выполнение упражнений и врачебный контроль с постоянным наблюдением и обсуждением результатов.
 |
| Рисунок 1. Влагалищные конусы |
Пациенткам, которые не могут идентифицировать необходимые группы мышц, вследствие чего оказываются не в состоянии корректно выполнять упражнения, рекомендуется использовать специальные устройства: влагалищные конусы, баллоны и др. (рис. 1). Конусы имеют одинаковый размер и разную массу (от 20 до 100 г). Больная вводит конус наименьшей массы во влагалище и удерживает его в течение 15 мин. Затем используют более тяжелые конусы [3].
По данным различных исследователей, количество пациенток, не способных сокращать m. pubococcygeus, достигает 40% [4]. Это послужило одной из причин широкого использования метода биологической обратной связи (БОС), целью которого является обучение навыкам сокращения специфических групп мышц и обеспечение обратной связи с пациенткой. Эффективность методики обусловлена активной ролью пациенток в процессе лечения путем вовлечения зрительного (картинки, фильмы, анимация) или слухового (голосовая поддержка) анализаторов. Осуществление обратной связи может проводиться моно- и мультиканально путем регистрации активности тазового дна, абдоминального и детрузорного давлений.
 |
| Рисунок 2. Видео-компьютерный комплекс |
Нами накоплен опыт проведения тренировки мышц тазового дна (ТМТД) в режиме БОС на видео-компьютерном комплексе «УРОПРОКТОКОР» (рис. 2), представляющем собой стационарный прибор, оснащенный периферийным оборудованием, необходимым для лечения расстройств функций тазового дна, и обладающий возможностями мотивационного подкрепления.
Технология использования прибора заключается во введении во влагалище специального датчика, измеряющего электромиограмму (ЭМГ) окружающих мышц, который выполнен из фарфора с золотым напылением. Его можно использовать многократно после предварительной стерилизации. ЭМГ-сигнал анализируется компьютером, который производит построение графиков на экране монитора, информируя пациентку о том, как работают мышцы промежности. Пациентка периодически напрягает и расслабляет мышцы тазового дна («втягивание» ануса) по командам прибора. При этом размеры кривых на мониторе увеличиваются и достигают индивидуально установленного порога. Для максимальной эффективности процедуры используют технологию мотивационного подкрепления: каждое правильно выполненное упражнение сопровождается показом фильма, слайдов и т. п. При некачественном выполнении задания все поощряющие факторы минимизируются, что стимулирует пациентку к более активной работе мышц. Курс лечения состоит из 15–20 получасовых сеансов.
Везикар (солифенацин) в лечении гиперактивного мочевого пузыря
Гиперактивный мочевой пузырь (ГАМП) является повсеместно распространенным хроническим заболеванием. На фармацевтическом рынке существует достаточное количество антимускариновых средств, как неселективных (оксибутинин, толтеродин, троспия хлорид, пропиверин), так и селективных (солифенацин, дарифенацин), используемых для лечения ГАМП. Представлены результаты многочисленных рандомизированных многоцентровых исследований по оценке эффективности и безопасности солифенацина (Везикара). Установлено, что прием этого препарата достоверно снижает выраженность проявлений ГАМП и ведет к улучшению качества жизни пациентов. Неоспоримым преимуществом солифенацина являются возможность варьирования доз в зависимости от тяжести симптомов, а также простота применения (1 раз в сутки). Обладая минимальным числом побочных эффектов, солифенацин (Везикар) может быть рекомендован в качестве “золотого” стандарта в лечении ГАМП у всех групп пациентов.
Гиперактивный мочевой пузырь (ГАМП) является повсеместно распространенным хроническим заболеванием. По данным проведенных эпидемиологических исследований, симптомы ГАМП отмечают около 16,6 % взрослого населения США и приблизительно 100 млн людей во всем мире [1, 2].
Впервые термин “гиперактивный мочевой пузырь” предложил Poul Abrams в 1997 г. [3]. При этом он предполагал изолированное развитие таких симптомов данного заболевания, как ургентность, ургентная инконтиненция, учащенное мочеиспускание и ноктурия. Со времени первого представления данной патологии в виде синдрома понятие о ГАМП существенно эволюционировало, что отражает более полное понимание природы этого заболевания. C учетом очевидного несоответствия первого определения заболевания современным представлениям о ГАМП Международное общество по удержанию мочи (International Continence Society – ICS) в 2002 г. предложило его новое определение: “ургентность с ургентным недержанием мочи или без наличия такового, обычно сопровождающееся учащенным мочеиспусканием и ноктурией” [4].
ГАМП не может быть диагностирован в отсутствие ургентности, и это говорит о том, что ургентность, определяемая ICS как “внезапный сильный труднопреодолимый позыв на мочеиспускание” [4], является единственным обязательным симптомом заболевания и играет ведущую роль в его клинической картине. Широко известно, что различные патологические состояния могут проявляться схожими с ГАМП-симптомами, что требует их исключения перед постановкой диагноза “гиперактивный мочевой пузырь”. Нарушенная почечная функция, камни МП и мочевая инфекция могут приводить к учащенному мочеиспусканию и появлению ургентности. Запоры способны вызвать затруднение опорожнения МП, сахарный диабет – приводить к учащенному мочеиспусканию, а сердечная недостаточность – к ноктурии [5, 6]. У пациентов с деменцией (болезнь Альцгеймера) сохранен нормальный физиологический механизм мочеиспускания, однако ввиду неспособности головного мозга различать импульсы о наполнении МП может развиться недержание мочи [6, 7]. У мужчин с доброкачественной гиперплазией простаты заболевание может проявляться ургентностью, учащенным мочеиспусканием и инконтиненцией [8]. Терапия диуретическими препаратами также может привести к учащенному мочеиспусканию и ноктурии [5].
Диагностировать ГАМП и назначать эффективную терапию заболевания можно лишь на основании субъективной и объективной его оценки. Поскольку заболевание проявляется симптомами, лечение ГАМП по большей части зависит от субъективной оценки. В то же время объективные данные, получаемые при использовании дневников мочеиспускания и уродинамических исследований, позволяют выявить патофизиологические механизмы ГАМП, в т. ч. гиперактивность детрузора [9].
Пациенты с предполагаемым ГАМП подвергаются ряду физикальных и лабораторных исследований. Диагноз может быть установлен на уровне первичного звена медицинской помощи на основании сбора анамнеза и полного физикального обследования. При недостаточном эффекте от проводимой поведенческой и медикаментозной терапии пациенты могут быть направлены в стационар для проведения более детального обследования [10, 11].
Поведенческая терапия у пациентов с ГАМП включает несколько методик, направленных на тренировку МП. Пациентам предлагается вести дневник мочеиспускания, выполнять мочеиспускание через определенные промежутки времени и тренировать мышцы тазового дна. Заполняя дневник мочеиспускания, пациент предоставляет врачу важнейшую информацию касательно своего питьевого режима, коррекция которого может снизить интенсивность ургентного недержания мочи, поскольку зачастую пациенты бесконтрольно потребляют большое количество жидкости [13]. Тщательное заполнение пациентом всех граф дневника позволяет получить информацию о возможном наличии триггеров симптомов, что несомненно имеет важнейшее значение для выбора правильной тактики поведенческой терапии [12].
В работе Ostaszkiewicz J. и соавт. (2004) был проведен анализ клинических исследований по изучению эффективности применения такого метода поведенческой терапии, как мочеиспускание через определенные промежутки времени (мочеиспускание по часам). Основной целью при этом являлось снижение числа эпизодов ургентной инконтиненции. В одном из исследований в группе пациентов, использовавших поведенческую терапию, включавшую мочеиспускание по часам, лишь 20 % больных отмечали эпизоды недержания мочи, тогда как в контрольной группе этот показатель достигал 80 %. В другом исследовании в группе, использовавшей тактику мочеиспускания по часам, наблюдалось снижение числа эпизодов недержания мочи в дневное и ночное время в сравнении с контрольной группой [14].
Burgio K.L. в своей работе высказал предположение о “порочном круге”, представляющем собой причинно-следственную связь между наличием ГАМП, учащенным мочеиспусканием и прогрессивным снижением емкости МП [15]. Исходя из этого автор предложил пациентам, страдающим ГАМП, применить тактику постепенного удлинения интервалов между эпизодами мочеиспускания. Был выполнен систематический обзор клинических исследований, посвященных тренировке МП у взрослых пациентов с ГАМП. Критерием эффективности лечения являлись эпизоды ургентного недержания мочи. В одном из проанализированных исследований тактика увеличения интервалов между эпизодами мочеиспускания оказалась в 1,7 раз эффективнее применения оксибутинина [16]. Тренировка мышц тазового дна чаще применяется у больных со стрессовым недержанием мочи, реже у пациентов с ГАМП [12, 13]. При этом наблюдается более выраженное торможение непроизвольных сокращений детрузора [12].
Несмотря на достаточное количество вариантов поведенческой терапии, в целом ее эффективность остается невысокой. Поэтому в настоящее время первой линией терапии ГАМП является фармакотерапия.
В норме процесс мочеиспускания контролируется сложным механизмом с вовлечением в процесс центральных и периферических центров мочеиспускания (рис. 2). При накоплении в МП около 200 мл мочи происходит передача импульсов в спинной, а затем головной мозг, где формируется сознательное решение совершить акт мочеиспуска-ния. Назад информация поступает по симпатическим, парасимпатическим и соматическим нервам. При положительном решении о мочеиспускании парасимпатические нервы высвобождают ацетилхолин, который связывается с мускариновыми рецепторами детрузора и приводит к его сокращению, что и проявляется мочеиспусканием. Известно, что М3-мускариновые рецепторы в МП непосредственно определяют сокращение детрузора, а М2-рецепоры тормозят его расслабление, вызываемое симпатической нервной системой, косвенно содействуя сокращению. При отрицательном решении симпатические нервы высвобождают норадреналин, который связывается с β-адренорецепторами, вызывая расслабление детрузора [18–20].
В настоящее время для фармакотерапии ГАМК применяются в основном препараты, блокирующие связывание ацетилхолина с мускариновыми рецепторами, находящимися в стенке МП [17]. Это препятствует возникновению непроизвольных сокращений детрузора и уменьшает симптомы ургентности, учащенного мочеиспускания и ургентной инконтиненции [19]. Помимо МП как М2-, так и М3-рецепторы локализуются в других тканях организма. М2-рецепто-ры обнаруживаются в ЦНС, сердце и желудочно-кишечном тракте, а М3-рецепторы – в слезной железе глаза, слюнных железах, желудочно-кишечном тракте и гладкой мускулатуре сосудов. Так как антимускариновые препараты блокируют мускариновые рецепторы во всех тканях, где они расположены, это может привести к таким побочным явлениям, как запоры, сухость во рту, размытое зрение и т. п. Снизить частоту возникновения побочных эффектов позволило появление селективных препаратов, воздействующих исключительно на М3-рецепторы. В настоящее время на фармацевтическом рынке существует достаточное количество антимускариновых средств, как неселективных (оксибутинин, толтеродин, троспия хлорид, пропиверин), так и селективных (солифенацин, дарифенацин).
Одним из наиболее часто применяемых при ГАМП препаратов в настоящее время является Везикар. Входящий в его состав солифенацина сукцинат является активным метаболитом солифенацина – антагониста мускариновых М3-рецепторов. По этой причине Везикар принадлежит к классу препаратов, известных как антихолинергические или антимускариновые средства [21]. Солифенацин избирательно блокирует мускариновые М3-рецепторы, проявляя небольшую аффинность к другим типам мускариновых рецепторов или вовсе не взаимодействуя с ними.
В исследованиях на животных по оценке силы воздействия различных антимускариновых препаратов на рецепторы, расположенные в МП и слюнной железе, у солифенацина была обнаружена более высокая аффинность к рецепторам МП [22]. Эта относительная селективность препарата по отношению к МП выражается в сравнительно низкой частоте возникновения сухости во рту при его применении, что было доказано в последующих исследованиях.
В клиническом исследовании II фа-зы изучался ответ пациентов с идиопатической гиперактивностью детрузора на применение солифенацина в различных дозировках. Больные были рандомизированы к приему в течение 4 недель солифенацина в дозах 2,5; 5,0; 10,0 или 20,0 мг 1 раз в день или плацебо [23]. Всего в исследовании приняли участие 225 пациентов. Авторы пришли к выводу, что при применении 5, 10 и 20 мг солифенацина был достигнут больший эффект, чем при приеме плацебо (рис. 3). Частота побочных эффектов была выше при приеме 20 мг препарата. Поэтому дозировки 5 и 10 мг были отобраны для дальнейшей клинической оценки в исследованиях III фазы [22].
Известны результаты четырех плацебо-контролируемых исследований III фазы [25–28]. В них было включено более 3000 пациентов с ГАМК. Везикар назначался в дозах 5 и 10 мг в течение 12 недель [24]. После обобщения данных оказалось, что солифенацин был эффективнее плацебо при оценке эпизодов мочеиспускания за 24 часа, эпизодов инконтиненции, ургентности и ноктурии к моменту окончания терапии. Около 50 % пациентов, страдавших от недержания до начала лечения, не отмечали эпизодов инконтиненции после его окончания (табл. 1).
Таблица 1. Оценка эффективности солифенацина. Обобщенные данные 4 клинических исследований III фазы [21]