венофер или монофер что лучше
Опыт внутривенной ферротерапии препаратом железа (III) гидроксида олигоизомальтозата при лечении анемии у беременных

Показана эффективность внутривенного применения препарата железа (III) гидроксида олигоизомальтозата у беременных с анемией во II и III триместрах беременности. Своевременное проведение внутривенной ферротерапии во II триместре приводит к лучшим результат
Efficiency of intravenous use of the iron (III) hydroxide oligoizomaltozat in the pregnant with anemia in II and III trimesters of pregnancy is shown. Earlier performance of intravenous ferrotherapy results in the best outcomes: in the II trimester before labor authentically smaller number of women has anemia. In comparison of different methods of therapy (single infusion and fractional course of equivalent dosages of iron) more expressed effect when performing therapy by fractional course is noted.
Анемия беременных является фактором возникновения осложнений беременности, родов и послеродового периода, таких как невынашивание (в 15–42%), преждевременные роды (в 11–42%), гипогалактия (в 39%), гипоксия плода (в 35%), преждевременная отслойка плаценты (в 25–35%), гипотрофия плода (в 25%), кровотечения в III триместре и раннем послеродовом периодах (в 10%) [10, 14]. Кроме того, анемия у матери является фактором задержки развития плода и новорожденного, снижения уровня умственного, моторного, речевого развития, приводит к ухудшению метаболизма клеточных структур, нарушению гемоглобинообразования, ухудшению иммунного статуса и устойчивости к инфекциям у детей до 2 лет [3, 12].
Среди анемий принято условно выделять истинные железодефицитные, возникающие при абсолютном дефиците железа, и функциональные, или анемии хронических заболеваний (АХЗ). Частота встречаемости анемии при ряде хронических заболеваний достигает 100% [2, 19]. По распространенности АХЗ занимает второе место после железодефицитной анемии [2, 19, 27], и вместе они составляют порядка 85% всех анемий [6]. Основной отличительной чертой АХЗ является сочетание дефицита железа и, соответственно, недостатка железа в кроветворной ткани костного мозга с интенсивным захватом железа макрофагами и дендритными клетками ретикулоэндотелиальной системы. Эту патофизиологическую особенность обеспечивает действие гепсидина [30]. Главенствующее влияние гепсидина на возникновение дефицита железа при АХЗ в своих работах доказал Nicolas [28].
Свой вклад в формирование анемий у беременных вносит возрастающая в течение беременности потребность организма в железе: в I триместре она возрастает на 16%, во II — на 59%, в III — на 67%, а в общем за период беременности и после родов расходуется около 1 400 мг железа [8, 22].
Диагностика наличия анемии основана на оценке гематологических (уровень гемоглобина, количество эритроцитов, гематокрит и др.) и феррокинетических (ферритин, свободный трансферрин, свободное сывороточное железо) показателей. «Золотым стандартом» диагностики анемии является определение ферритина — белкового комплекса, выполняющего роль основного депо железа в организме [4].
Вопрос эффективности профилактики и лечения анемии при беременности до сих пор открыт и обсуждается. Энтеральная терапия зачастую является методом выбора ввиду отсутствия системных побочных эффектов и возможности назначения ее вне стационара. Однако необходимо помнить, что прием препаратов железа должен происходить в течение длительного времени (как правило, более 40 дней), пероральные препараты не всегда хорошо переносятся пациентками (в 30–40% случаев имеют побочные эффекты со стороны пищеварительной системы, что снижает комплаентность), биодоступность этих препаратов может сильно варьировать, а эффект наступать сравнительно медленно [23]. Также существует понятие устойчивости, или резистентности, к терапии. Резистентностью к ферротерапии называют повышение уровня гемоглобина менее чем на 7 г/л через две недели от начала терапии и отсутствие ретикулоцитарной реакции. При отсутствии эффекта от проводимой терапии тактика ведения пациента должна быть пересмотрена. В первую очередь необходимо пересмотреть этиопатогенетический аспект возникновения анемии, в частности, обратить внимание на возможность отсутствия истинного железодефицита и наличия АХЗ. Также необходимо оценить адекватность дозировки препарата [12]. Помимо этого, причинами устойчивости к терапии может быть отказ пациента от приема препаратов железа, синдром нарушенного всасывания железа или одновременный прием препаратов, нарушающих всасывание железа, продолжающееся кровотечение и неадекватно низкая степени анемии продукция эритропоэтина [12].
При наличии в организме беременной хронической инфекции происходит активация белков острой фазы, в том числе фибриногена и гепсидина. При этом функционально гепсидин является отрицательным регулятором метаболизма железа [9]. В случае гипоксии по принципу обратной отрицательной связи концентрация гепсидина уменьшается [29, 30]. Пониженный уровень выработки гепсидина способствует улучшению абсорбции железа и сокращению его задержки в макрофагах [33]. Активация синтеза гепсидина гепатоцитами опосредованно регулируется инфекцией (при наличии воспаления может увеличиваться в 100 раз) или избытком железа [11, 18]. При увеличении количества гепсидина абсорбция железа уменьшается и увеличивается его задержка в макрофагальной системе. Таким образом, при АХЗ, за счет увеличения синтеза гепсидина, происходит угнетение захвата железа из просвета кишечника и накопление его в макрофагах, поэтому в таких случаях алиментарный прием препаратов железа будет неэффективным [32, 33].
Внутривенный путь применения препаратов железа в этом отношении более эффективен: железо попадает непосредственно в кровяное русло, поэтому способно обойти действие гепсидина и может использоваться для гемопоэза, что, в свою очередь, позволяет быстро восполнить запасы железа в организме (достижение эффективной стимуляции эритропоэза и ускорение темпов прироста запасов железа отмечается на 1-й неделе терапии) [4, 26].
В целом эффективность противоанемической терапии при применении внутривенных препаратов железа гораздо больше по сравнению с энтеральными препаратами. Однако при внутривенном применении железа есть опасность одномоментного попадания большого количества свободного железа в кровь. Чтобы избежать этого, требуется целая система, контролирующая попадание свободного железа в кровь. Большинство современных препаратов для внутривенного введения представляют собой сферические железоуглеводные коллоиды. Они имеют схожую структуру, фармакодинамические и фармакокинетические показатели. В центре каждой макромолекулы находится полиядерный железо-(III)-оксигидроксид со структурой, схожей с ферритином, что ограждает организм от токсического действия несвязанного Fe 3+ неорганической природы, так как обеспечивает контролируемое и медленное высвобождение биодоступного железа при незначительном риске образования свободного железа. Этот центр окружен углеводной оболочкой, которая придает комплексу высокую стабильность, замедляет высвобождение железа и поддерживает образующиеся формы в коллоидной суспензии [3, 13]. Эффективность и безопасность различных препаратов железа характеризует молекулярная масса препарата. Комплексы с низкой молекулярной массой, такие как глюконат железа, менее стабильны и быстрее высвобождают в плазму железо, которое в свободном виде может катализировать образование реактивных форм кислорода, вызывающих перекисное окисление липидов и повреждение тканей. Значительная часть дозы подобных препаратов выводится через почки в первые 4 часа после приема препарата и не используется для эритропоэза. Высокомолекулярные соединения более стабильны, высвобождают железо постепенно и более физиологичны. После внутривенного введения многоядерное железосодержащее ядро комплекса захватывается преимущественно клетками ретикулоэндотелиальной системы (печень, селезенки и костный мозг). Углеводный остаток метаболизируется и выводится из организма. Железо связывается с трансферрином и ферритином и используется для синтеза гемоглобина, миоглобина и других железосодержащих ферментов [21]. Препараты декстрана железа обладают высокой молекулярной массой и стабильностью, но их недостатком является повышенный риск аллергических реакций. Это наиболее характерно для декстрана железа в связи с выработкой к нему антител. Подобной реакции не наблюдается на введение глюконата железа и крайне редко отмечается на сахарат железа [7, 12, 31].
Несмотря на то, что подобные реакции у наиболее современных препаратов встречаются гораздо реже, внутривенную ферротерапию по-прежнему проводят только при наличии показаний к ней [7, 14, 20]. К ним относятся:
1) тяжелая форма анемии;
2) неэффективность пероральной терапии;
3) индивидуальная непереносимость солей железа;
4) нарушение всасывания железа при заболеваниях пищеварительного тракта (в том числе неспецифический язвенный колит, болезнь Крона, обострение язвенной болезни;
5) необходимость быстрого насыщения организма железом;
6) наличие противопоказаний к гемотрансфузии или переливанию эритроцитарной массы.
Парентеральное применение препаратов железа показано беременным при неэффективности проводимой энтеральной терапии, при непереносимости энтеральных препаратов железа, при прогрессировании анемии на фоне проводимой терапии, при необходимости быстро восполнить запасы железа в организме (перед родами или после кровотечения) [5, 17].
При планировании проведения парентеральной терапии препаратами железа у беременных необходимо помнить, что существуют некоторые ограничения, связанные с беременностью. Необходимо отметить, что контролируемых клинических исследований по изучению препаратов внутривенного железа не проводилось, в связи с чем препараты рекомендуется применять только в клинически оправданных случаях, когда предполагаемая польза для матери превышает возможный риск для плода. Лечение этими препаратами возможно во II и III триместрах беременности, применение в I триместре не рекомендуется [1].
Современные препараты железа, к которым относится железа (III) гидроксид олигоизомальтозат, не имеют ярко выраженных побочных реакций, и аллергические реакции при их введении встречаются крайне редко, в отличие от более старых, но все еще активно применяющихся препаратов на основе декстрана [15].
Железа (III) гидроксид олигоизомальтозат (Монофер) представляет собой комплекс гидроксида железа (III) и олигоизомальтозата. Олигоизомальтозат — инновационная высокомолекулярная структура, наиболее сходная по строению с ферритином, прочно связывающая железо и имеющая низкую иммунологическую активность. Система доставки железа обладает контролируемым медленным и постепенным высвобождением его в кровь при расщеплении олигоизомальтозного комплекса гидроксида железа (III) на железо и олигоизомальтозат. В дальнейшем железо связывается с трансферрином и ферритином, а олигоизомальтозат метаболизируется и выводится из организма. Небольшие количества железа выводятся почками и кишечником. Риск передозировки при применении данного препарата крайне невысок. Препарат обладает низкой токсичностью и хорошей переносимостью, в связи с чем возможно проведение терапии в виде однократной инфузии, без проведения тест-дозы. Максимальная разовая доза — 20 мг/кг и должна вводиться не менее 60 мин [3, 24].
Несмотря на то, что внутривенная терапия препаратами железа в последние годы достаточно широко используется для лечения анемии у беременных, на сегодняшний день отсутствуют глубокие исследования об эффективности применения внутривенной ферротерапии в течение беременности при коррекции анемических состояний, связанных с различными этиологическими факторами.
Целью данного исследования было оценить эффективность внутривенной терапии препаратом железа (III) гидроксид олигоизомальтозат (Монофер) у беременных с анемией различной этиологии.
Материалы и методы исследования
Исследование проводилось в отделении патологии беременности ФГБНУ НИИ АГиР им. Д. О. Отта. В ходе исследования были изучены истории родов 65 беременных с анемией различной степени тяжести. Критериями включения в исследование были наличие одноплодной беременности; возраст пациенток от 24 до 42 лет; уровень гемоглобина 2 = 7,88; р 2 ) с поправкой Йейтса. Различия считались статистически значимыми при уровне достоверности p и их обсуждение
В основной группе до начала терапии уровень гемоглобина в среднем составил 102,1 ± 4,2 г/л, перед родами — 113,3 ± 3,4 г/л, после родов — 105,1 ± 6,3 г/л.
Уровень ферритина у беременных, взятых в исследование во II триместре (n = 17), составил 28,2 ± 11,4 мкг/л; в III триместре (n = 20) — 14,5 ± 3,7 мкг/л, то есть ко II триместру уровень запасов железа в организме у всех беременных был снижен, а к III триместру — на нижней границе нормы. Уровень фолиевой кислоты составлял 29,8 ± 13,5 нмоль/л, а витамина В12 – 251,6 ± 91,4 нмоль/л, то есть у всех женщин основной группы (n = 37) данные показатели были в пределах нормы.
В группе сравнения уровень гемоглобина в среднем составил 103,4 ± 6,1 г/л до родов и 94,5 ± 5,8 г/л — после родов. Исходя из этого можно сказать, что у женщин, получавших терапию препаратом Монофер в течение беременности, к моменту родов уровень гемоглобина был достоверно выше (t = 2,5, p = 0,015). После родов прослеживалась четкая тенденция в сохранении более высокого уровня гемоглобина у родильниц, получавших внутривенную ферротерапию во время беременности (105,1 ± 6,3 г/л, по сравнению с 94,5 ± 5,8 г/л в контрольной группе). Значимых различий в изменениях количества эритроцитов и уровня гематокрита до и после родов у женщин двух групп не было.
Во II триместре внутривенная ферротерапия препаратом железа (III) гидроксид олигоизомальтозат (Монофер) проводилась 17 женщинам, и 16 из них впоследствии перед родами не имели анемии (Hb > 110 г/л; р 2 = 2,5; p
* ФГБНУ НИИ АГиР им. Д. О. Отта, Санкт-Петербург
** ФГБОУ ВО СПбГУ, Санкт-Петербург
Опыт внутривенной ферротерапии препаратом железа (III) гидроксида олигоизомальтозата при лечении анемии у беременных/ Е. В. Мозговая, С. Р. Юсенко, О. Н. Аржанова, Т. Г. Ковалева
Для цитирования: Лечащий врач № 12/2018; Номера страниц в выпуске: 11-19
Теги: женщины, беременные, недостаток железа, кровопотеря
Фармакоэкономическая оценка эффективности препаратов железа при коррекции анемии в ходе подготовки пациентов к обширным плановым оперативным вмешательствам
к.ф.н. Ряженов В.В.*, д.м.н. проф. Горохова С.Г.**, Емченко И.В.***
*Первый МГМУ им. И.М. Сеченова, кафедра фармакологии и фармацевтической технологии
** Первый МГМУ им. И.М. Cеченова, кафедра семейной медицины
*** Первый МГМУ им. И.М. Сеченова, кафедра организации и экономики фармации
Адекватная терапия анемии у хирургических больных относится к важнейшим задачам, решаемым в предоперационном периоде врачами различных специальностей. Это обусловлено широкой распространенностью анемии в хирургической практике и доказанной корреляцией уровня гемоглобина с ранними и отдаленными послеоперационными исходами. На сегодняшний день убедительно доказано, что уровень гемоглобина крови ниже 10 г/дл является независимым предиктором неблагоприятного исхода операции. В связи с этим, меры, направленные на предупреждение и коррекцию анемии в ходе предоперационной подготовки пациентов и на последующих этапах их ведения, потенциально снижают риск послеоперационной смерти, сердечно-сосудистых событий, пневмонии и других осложнений послеоперационного периода [1,2].
Тактика лечения железодефицитной анемии в предоперационном периоде строится с учетом необходимости быстрого восстановления уровня гемоглобина и депо железа в организме [11,12]. Несмотря на то, что в ряде случаев применение пероральных железосодержащих препаратов удобнее для пациента, они неэффективны при синдроме мальабсорбции и часто вызывают нежелательные реакции со стороны желудочно-кишечного тракта (у 10-40% пациентов). Кроме того, для достижения значимого эффекта необходим их длительный прием, что в итоге негативно влияет на приверженность к лечению. Вместе с этим, в последние годы получила распространение альтернативная стратегия: применение препаратов железа для внутривенного введения [13,14]. Данные препараты показаны в тех случаях, когда необходимо быстро восполнить запасы железа в организме, имеются нарушения всасывания железа в кишечнике или выявлена плохая переносимость пероральных железосодержащих препаратов [15].
Наиболее часто применяемыми препаратами для внутривенного введения, как в мире, так и в России являются карбоксимальтозат железа, сахарат железа, глюконат железа и декстран железа. Безопасность и эффективность указанных препаратов зависят от их молекулярной массы, стабильности и состава. Комплексы с низкой молекулярной массой (глюконат железа) менее стабильны и, соответственно, более легко высвобождают железо в плазму. «Свободное» железо в плазме может катализировать образование реактивных форм кислорода, которые способны вызвать перекисное окисление липидов и, как следствие, повреждение тканей, в частности, ткани печени [16]. Еще одним недостатком комплексов с низкой молекулярной массой является то, что значительная часть препарата выводится через почки в первые 4 часа после приема и недоступна для использования в процессах эритропоэза [17]. Кроме того, при использовании декстрана и глюконата железа могут развиваться тяжелые анафилактические реакции [18].
Исходя из изложенного, целью настоящего исследования стал фармакоэкономический анализ эффективности карбоксимальтозата железа (КМЖ) и сахарата железа (СЖ) при коррекции железодефицитной анемии (ЖДА) в ходе подготовки пациентов к плановым обширным хирургическим вмешательствам.
Матералы и методы
Фармакоэкономический анализ применения препаратов железа для внутривенного введения, используемых для коррекции анемии при подготовке пациентов к плановой обширной операции, выполняли методом моделирования с определением затратной эффективности рассматриваемых медицинских технологий в рамках анализа влияния на бюджет [24]. Исследование проводили с позиции государственной системы здравоохранения.
В ходе исследования было принято, что коррекцию анемии у хирургических больных проводят на догоспитальном этапе, и в каждом случае препараты железа вводят под медицинским наблюдением в условиях дневного стационара.
На втором этапе исследования в рамках анализа влияния на бюджет оценивали затраты системы здравоохранения на этапах до и после внедрения новой технологии. Новой внедряемой технологией считали применение карбоксимальтозата железа (Феринжект ® ), текущей стратегией – использование сахарата железа (Венофер ® ).
Анализ эффективности. В качестве показателя клинической эффективности проводимой терапии в условиях модели считали число пациентов с восполненным дефицитом железа и достигнувших целевых уровней гемоглобина. Также учитывали вероятность проведения гемотрансфузий в зависимости от применяемой медицинской технологии.
Таблица 2. Зарегистрированные предельные отпускные цены производителя на рассматриваемые препараты парентерального железа по состоянию на 7.04.2013 и расчетная стоимость 100 мг железа в условиях модели.
| Лекарственный препарат | Цена, руб. | Стоимость 100 мг железа в составе препарата, руб. |
| Феринжект ® * р-р для инф. 50мг/мл 10мл фл. №1 р-р для инф. 50мг/мл 2 мл фл. №5 | 4 300,00* | 860,00 |
| Венофер ® р-р для в/в введ. 20мг/мл 5мл амп. №5 | 3 423,79 | 684,76 |
| Ликферр100 ® р-р для в/в введ. 20мг/мл 5мл амп. №5 | 2 848,00 | 569,60 |
| Аргеферр ® р-р для в/в введ. 20мг/мл 5мл амп. №5 | 3 423,00 | 684,60 |
* Моделируемая цена.
Затраты на 1 сеанс гемотрансфузии были равны расчетным данным Е.Б. Жибурт и соавт. (2012 г.) и составили в условиях модели – 8 438,18 руб. (Табл. 3.).
Таблица 3. Стоимость медицинских услуг в условиях разработанной модели.
| Услуга | Стоимость, руб. | Источник |
| 1 пациенто-день лечения в условиях дневного стационара | 504,42 | ТПГГ* в г. Москва на 2013 г. |
| Гемотрансфузии, | 8 438,18 | Жибурт Е.Б. и соавт. [2012] |
* Территориальная программа государственных гарантий оказания гражданам РФ бесплатной медицинской помощи в городе Москва на 2013 год
Анализ «затраты-эффективность». Показатель «затраты-эффективность» (costeffectiveness ratio, CER) рассчитывали по формуле:
где С – стоимость фармакотерапии терапии всех пациентов в группе (в рублях); Ef – эффективность терапии.
Коэффициент эффективности приращения затрат (инкрементальный коэффициент, ICER), который демонстрирует объем средств, который необходимо затратить на достижение терапевтического эффекта у 1 дополнительного пациента при назначении более эффективной и более дорогостоящей медицинской технологии, рассчитывали по формуле:
ICER = (C1 – C2) / (Ef1 – Ef2),
где С1 и С2 – общие прямые затраты в сравниваемых группах (в рублях);
Ef1 и Ef2 – эффективность терапии в группах.
Результаты
Таблица 4. Затраты на терапию железодефицитной анемии из расчета на 1 пациента.
| Группа пациентов | Кумулятивная доза железа | Затраты на препарат | Число введений | Затраты на дневной стационар | Суммарные затраты |
| Феринжект ® | 1 120 | 9 632,00 | 2 | 1 008,84 | 10 640,84 |
| Венофер ® | 1 010 | 6 916,06 | 5 | 2 522,10 | 9 438,16 |
Таблица 5. Затраты в анализируемых группах в расчете на 100 пациентов и значения коэффициента «затраты-эффективность» по показателям частоты устранения железодефицитного состояния и коррекции анемии.
| Группа пациентов | Затраты на 100 пациентов, руб. | Восполнение дефицита железа | Коррекция анемии | ||
| Число пациентов | CER | Число пациентов | CER | ||
| Феринжект ® | 1 064 084,00 | 82 | 12 976,63 | 72 | 14 778,94 |
| Венофер ® | 943 815,58 | 62 | 15 222,83 | 59 | 15 996,87 |
При проведении анализа влияния на бюджет было выявлено, что затраты на коррекцию анемии в предоперационном периоде в группе КМЖ по сравнению с группой СЖ оказались выше в 1,4 раза (963 200,00 и 691 605,58 руб., соответственно). Однако, стратегия применения КМЖ является более предпочтительной за счет меньших затрат на дневной стационар (в 2,5 раза) и затрат на проведение гемотрансфузий (в 3 раза) (Табл. 6).
Таблица 6. Анализ влияния на бюджет в расчете на 100 пациентов.
| Группа пациентов | Этап оказания медицинской помощи | Суммарные затраты, руб. | ||
| Догоспитальный | Госпитальный | |||
| Затраты на препараты железа, руб. | Затраты на дневной стационар, руб. | Затраты на ГТ, руб. | ||
| Феринжект ® | 963 200,00 | 100 884,00 | 75 943,62 | 1 140 027,62 |
| Венофер ® | 691 605,58 | 252 210,00 | 202 516,32 | 1 146 331,90 |
Проведенный анализ чувствительности результатов исследования выявил устойчивость показателя затратной эффективности к изменению цены (Табл. 7, 8).
Таблица 7. Анализ чувствительности показателя «затраты-эффективность» в восполнении дефицита железа при изменении стоимости препаратов железа для внутривенного введения.
| Группа пациентов | Изменение стоимости препаратов | ||||||
| -30% | -20% | -10% | Базовый вариант | +10% | +20% | +30% | |
| Феринжект ® | 9 452,73 | 10 627,37 | 11 802,00 | 12 976,63 | 14 151,27 | 15 325,90 | 16 500,54 |
| Венофер ® | 11 876,35 | 12 991,85 | 14 107,34 | 15 222,83 | 16 338,32 | 17 453,82 | 18 569,31 |
Таблица 8. Анализ чувствительности показателя «затраты-эффективность» в коррекции анемии при изменении стоимости препаратов железа для внутривенного введения
| Группа пациентов | Изменение стоимости препаратов | ||||||
| -30% | -20% | -10% | Базовый вариант | +10% | +20% | +30% | |
| Феринжект ® | 10 765,61 | 12 103,39 | 13 441,17 | 14 778,94 | 16 116,72 | 17 454,50 | 18 792,28 |
| Венофер ® | 12 480,24 | 13 652,45 | 14 824,66 | 15 996,87 | 17 169,09 | 18 341,30 | 19 513,51 |
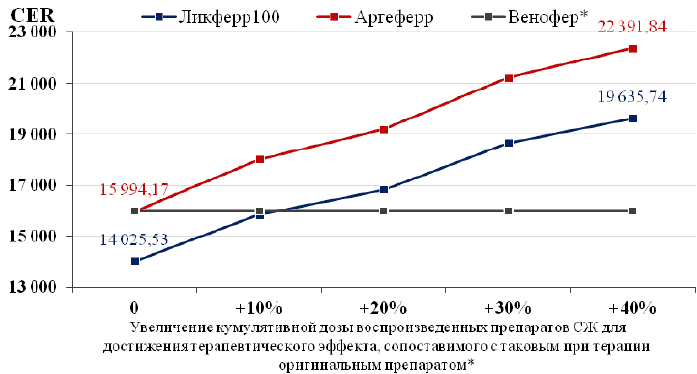
Рисунок 1. Анализ чувствительности результатов в группе сахаратов железа. Изменение показателя «затраты-эффективность» при увеличении кумулятивной дозы генерических препаратов СЖ для достижения терапевтического эффекта (коррекция анемии), сопоставимого с таковым при терапии оригинальным препаратом.
Таблица 9. Анализ влияния на бюджет для генерических препаратов сахарата железа.
| Группа пациентов | Этап оказания медицинской помощи | Суммарные затраты, руб. | ||
| Догоспитальный | Госпитальный | |||
| Затраты на препараты железа, руб. | Затраты на дневной стационар, руб. | Затраты на ГТ руб. | ||
| Ликферр100 ® | 575 296,00 – 805 414,40 | 252 210,00 – 353 094,00 | 202 516,32 | 1 030 022,32 – 1 361 024,72 |
| Аргеферр ® | 691 446,00 – 968 024,40 | 1 146 172,32 – 1 523 634,72 | ||
Заключение
Фармакоэкономическое преимущество препарата КМЖ (Феринжект ® ) обусловлено, прежде всего, его высокой эффективностью по показателям частоты достижения коррекции анемии, превышающей таковые у препарата СЖ (Венофер ® ). Кроме того, важное значение имеют меньшие сопутствующие затраты, связанные с пребыванием в дневном стационаре.