векторная технология вакцины что это
Векторная технология вакцины что это
В генетическом разнообразии вирусов в природе, особенно корона-, флави-и тогавирусов, важную роль играет рекомбинация. Она может происходить не только между близкородственными, но и отдаленно родственными вирусами.
Важным достижением технологии рекомбинантной ДНК явилось открытие возможности замены удаленного гена чужеродным геном. Этот метод использует вирусы как векторы для переноса генов протективных антигенов других вирусов. В геном авирулентного вируса вставляют ген интересующего вируса, кодирующий антиген, вызывающий протективный ответ в привитом организме.
Модифицированный таким образом авирулентный вирус используют как живую вирусную вакцину. Клетки, в которых векторный вирус реплицируется in vivo, экспрессируют чужеродный белок, вызывающий гуморальный и опосредованный клетками иммунный ответ на данный белок.
Вирусные химеры, как вакцины с репликативным механизмом одного вируса и протективными антигенами другого, являются быстрой формой векторных вакцин. Прообразом таких вакцин можно считать реассортантные вакцины.
Вирус осповакцины был одним из первых вирусов, на примере которого была показана возможность такой замены без потери жизнеспособности рекомби-нантного вируса с экспрессией белка, кодируемого чужеродным геном и индукцией иммунитета на этот белок. Подход к получению безопасной эффективной живой вакцины заключается в использовании стабильного вакцинного вирусного штамма для создания рекомбинантов, которые экспрессируют протективные антигены других вирусов, против которых желательно создать иммунитет. Члены семейства вирусов оспы оказались удобными для получения рекомбинантных гибридов, благодаря их большому геному, позволяющему удалять значительные участки ДНК без потери способности к репликации.
Гены, кодирующие различные антигены многих вирусов, были включены в геном вируса осповакцины. Прививка животных этими рекомбинантными векторными вакцинами каждый раз сопровождалась хорошим антительным ответом. Например, вирус осповакцины, использованный в качестве вектора вакцины против бешенства, будучи включенным в приманку для скармливания, защищал лис и хорьков от бешенства. Возможность включения нескольких генов, кодирующих соответствующие иммуногены, позволяет создать новый тип комбинированных (поливалентных) вакцин.
Потенциальными векторами являются многие ДНК-содержащие вирусы, реплицирующиеся в ядре или цитоплазме. Первые во многих случаях могут быть интегрированы в клеточную ДНК, что может привести к персистенции вируса и клеточной трансформации. Этот факт — хороший аргумент в пользу выбора «цитоплазматических» вирусов, таких как вирусы оспы, которые являются наиболее крупными вирусами животных.
Участок генома вирусов оспы, кодирующий тимидинкиназу, не является геномом, функция которого жизненно необходима для размножения вируса, и его можно заменять на чужеродные ДНК.
Чужеродные белки, экспрессирующиеся рекомбинантным вирусом оспы, сохраняют свои антигенные свойства и способность формировать вирионную структуру.
Использование этого вируса в качестве вектора для вакцинации имеет ряд преимуществ: способность размножаться в клетках многих видов животных, экспрессировать несколько генов, индуцировать гуморальный и опосредованный клетками иммунитет, термостабильность, экономичность производства и легкость применения.
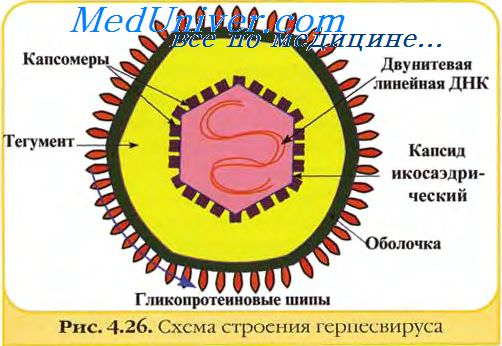
В качестве векторов для создания живых рекомбинантных вакцин могут быть использованы адено-, бакуло- и герпесвирусы. Они, как и вирусы оспы, имеют крупный геном, — по крайней мере с одной несущественной областью для репликации и несколькими участками, в которые могут быть встроены чужеродные гены и экспрессированы без потери инфекционности. В качестве векторов успешно используют вирусы оспы птиц.
Рекомбинантные живые вакцины по существу сочетают в себе свойства живых и компонентных вакцин. Проблема использования вектора живых вакцин в основном аналогична. Основное различие с живыми вакцинами заключается в том, что экспрессируется только один или несколько селективных генов, репли-цируемых вместе с геномом вектора. В этом смысле, данные вакцины похожи на традиционные субъединичные (компонентные), но отличаются от них лишь тем, что являются «реплицирующимися антигенами».
Рекомбинантные векторные вакцины как бы сочетают в себе положительные качества живых и инактивированных вакцин. При репликации в организме рекомбинантного вируса с встроенным чужеродным геном, кодирующим синтез гликопротеина, который может быть экспрессирован на поверхности клеток и может индуцировать развитие как гуморального, так и клеточного иммунного ответа. Субъединичные вакцины могут индуцировать развитие только гуморального иммунного ответа.
Как делают вакцины
Появление векторной вакцины Sputnik V внесло некоторую сумятицу в типичное представление о вакцинах как о некой дозе ослабленных или дезактивированных патогенов, внедренных для тренировки иммунитета. Еще больше вопросов породил тот факт, что именно векторная вакцина появилась первой, а более простые и привычные варианты подоспели позднее. Ну и вопрос на засыпку: в чем проблема налаживания выпуска всех этих вакцин и почему в массовом доступе они только начинают появляться?
Для получения некоторых вакцин от гриппа надо заразить эмбрион в яйце вирусом и дать вирусу размножиться (фото: CDC)
Ниже — расшифровка лекции специалиста по промышленным биотехнологиям, которая прошла при поддержке ярославской Точки при ЯрГУ. В ней — подробно о типах вакцин, механизмах их работы и способах массового производства.
Но сначала я представлю спикера: это Антонина Обласова — биолог, специалист по промышленным биотехнологиям, соучредитель и директор АНО «Коллективный иммунитет» (vaccina.info), а также автор блога «Антонина О. Вакцинах». Далее — переработанный текстовый вариант самой видеолекции.
Типы вакцин
Речь пойдет как о противовирусных вакцинах, так и об антибактериальных. Для начала рассмотрим логику работы действующего вещества вакцины, которое при введении в организм будет вызывать иммунный ответ. Проведем необычную параллель: представим на минуту, что дикая инфекция — это дикий зверь, например волк. Мы стараемся от него всячески защититься и ищем способы избежать последствий от встречи с ним.
Вакцинация — это метод, позволяющий снизить риски от этой встречи. Вакцины не все одинаковы по своей структуре и используют разные подходы.
Первый подход: обезвредить токсин, производимый этой дикой инфекцией. Сравнивая с волком, можно себе представить токсин в виде слюны животного. Мы можем ее собрать, деактивировать и вводить в организм, вырабатывая тем самым защиту — иммунитет.
Второй: ослабить волка, саму инфекцию, натренировав иммунитет на едва живом «звере».
Третий: взять похожий патоген (микроорганизм, вызывающий болезнь у другого существа) и ослабить его. Именно этот метод использовали в процессе разработки вакцины против черной оспы или туберкулеза.
Еще один вариант — искусственно воссоздать отдельные фрагменты патогена при помощи генно-инженерных технологий. По этому принципу устроены вакцины от гепатита B, вируса папилломы человека и некоторые другие редкие или ветеринарные вакцины.
Существуют и другие подходы, например ДНК- и РНК-вакцины, векторные вакцины, о которых чуть ниже.
Фиолетовым обозначены основные подходы к созданию вакцин (источник: www.genscript.com/recombinant-vaccine.html)
Всемирная организация здравоохранения предлагает нам разделить все вакцины на две группы: живые и неживые. В одну группу входят живые ослабленные вакцины, а в группе неживых выделены инактивированные, субъединичные (состоящие из отдельных фрагментов) и анатоксины (обезвреженные яды патогенов). В эту классификацию укладывается большинство существующих сегодня вакцин (но не все).
Среди прочих вариантов — модифицированная бактерия с геном антигенов вируса. Когда пандемия еще только начиналась, возможно, вы слышали в новостях о том, что одна из создаваемых против COVID-19 вакцин будет в виде йогурта, — речь шла как раз о такой технологии. Также многие слышали такие выражения, как «ДНК-вакцины», «РНК-вакцины», «векторные вакцины». Все это — современные технологии, которые пока редко используют в производстве вакцин.
Векторные вакцины
Векторная технология — это палочка-выручалочка.
Она позволяет создать вакцину быстро — гораздо быстрее, чем все другие существующие вирусные технологии.
Дело в том, что производить и ослаблять до нужной степени новый малоизученный вирус — это очень долгий процесс. Гораздо проще сделать подмену.
Вектор — это другой хорошо исследованный вирус, безопасный для человека. Система этого вируса изучена до мелочей: мы знаем, в каких клетках эти вирусы могут расти, в каком количестве, как размножить их в пробирке и как наладить производство больших объемов.
В данный вирус-вектор мы вносим изменения — берем кусочек ДНК или РНК патогена, который кодирует иммуногенную часть на его поверхности, и пересаживаем в генетический материал вектора.
У нас получается химера — безопасный для человека вирус, для которого организм производит антитела и формирует клеточный иммунитет против антигенов дикой инфекции. При этом сама дикая инфекция к нам в организм не попадает.
В современных вакцинах, которые сегодня разрабатывают для борьбы с коронавирусом, эти вирусные векторы не реплицируются, то есть не размножаются в организме, поскольку у них отключен соответствующий ген.
Он может размножаться в клеточной культуре, но непосредственно в организме человека — нет. Если, условно, в организм попали десять копий вируса, десять копий и остались.
Более раннее применение этой технологии нашлось в генной терапии. С ее помощью производят очень дорогие лекарства для детей со спинальной мышечной атрофией.
Например, такой препарат, как золгенсма, делают с использованием векторной технологии. Только используют не аденовирус, а аденоассоциированный вирус, в который встроили ДНК, необходимую для синтеза того белка, которого недостает в организме больных. Внедряя этот вектор в организм ребенка, мы восполняем дефицит белка и вылечиваем его от этой болезни.
Отличие вирусов от бактерий
Перед тем как перейти к рассказу о производстве вакцин, вспомним, что есть два вида патогенов, вызывающих вакциноуправляемые инфекции: вирусы и бактерии. Бактерии — это самые настоящие живые организмы, они самостоятельно питаются и размножаются. Вирусы — облигатные паразиты, это значит, что они не способны размножаться вне клетки. Без клетки (бактериальной, грибной, растительной или животной) вирус не может существовать — это просто пыль.
Сравнение размеров человеческого эритроцита и бактерии кишечной палочки (E. coli) c вирусами оспы (Smallpox) и полиомиелита (Poliovirus)
В этом смысле вирус похож на программу, записанную на флешке: пока вы не подключите носитель к компьютеру, ничего не произойдет. Если же флешку подключить, программа может быть скопирована и запущена.
Чтобы получить большое число бактерий, необходима питательная среда. Например, мы можем посеять бактерии на чашку Петри с питательным агаром. А можем оставить хлеб на столе: на нем размножатся бактерии из спор, витающих в воздухе.
Вирусу недостаточно одной питательной среды. Вирусу нужен хозяин: живая клетка, в которую он внедрится и чей обмен веществ будет использовать, чтобы многократного скопировать самого себя. Это принципиальное различие между вирусами и бактериями, которое определяет принципы создания антибактериальных и вирусных вакцин.
Ну а само классическое производство вакцин — это получение нужного нам патогена, который затем будет ослаблен, убит или разобран на части.
Производство антибактериальных вакцин
Итак, чтобы сделать вакцину для профилактики бактериальных инфекций, надо в достаточном количестве получить патоген, то есть большое количество клеток возбудителя заболевания.
Бактериальную массу выращивают в жидкой питательной среде. Чтобы получить посевной материал, используют колбу, которую ставят в шейкер и постоянно трясут, чтобы обогащать питательную среду кислородом. Затем полученную культуру выращивают на оборудовании, которое называется ферментер (от англ. fermentation).
Ферментеры отличаются по размеру: резервуар, в котором размножаются микроорганизмы, может быть от одного до десятков тысяч литров. В основном эти аппараты изготавливают из стекла и нержавеющей стали — к таким материалам бактерии нечувствительны, поэтому прекрасно растут и размножаются.
Одни из популярных биореакторов Techfors с анализаторами среды и автоподачей питательных веществ для культивирования микроорганизмов. Слева лабораторный емкостью до 6 литров, а справа промышленный — от 150 до 1000 л
Ферментер — сложное оборудование: все процессы проходят в условиях строгой стерильности, по трубкам в автоматическом режиме поступают глюкоза, минеральные вещества, витамины и другие добавки. Стерильный воздух тоже подают автоматически. Внутри емкости поддерживается определенная температура, давление и уровень кислорода, питательная среда постоянно перемешивается.
Чтобы контролировать состав питательной среды, из ферментера условно каждый час отбирают пробы и анализируют количество бактерий и питательных веществ. В зависимости от результата корректируют автоматические программы. В маленьких ферментерах это делают стерильно через шприц, а в больших промышленных может быть встроена целая автоматическая аналитическая лаборатория.
Аналогичным образом делают рекомбинантные вакцины. Например, вакцину против гепатита B создают с помощью генно-модифицированных дрожжей, которые производят поверхностный антиген гепатита B.
Следующий шаг — очистка бактерий от остатков питательной среды, в которой они жили. После него идет добавка стабилизаторов и других веществ, о которых ниже. И — антибактериальная вакцина готова.
Производство вирусных вакцин
Для производства вирусных вакцин нам потребуется субстрат — клетки других организмов. Это могут быть клетки млекопитающих, в том числе человека — обычно предоставлены бессмертными иммортализованными линиями клеток. Также это могут быть клетки куриных и перепелиных эмбрионов, так производят вакцины от клещевого энцефалита, от кори и паротита — первичная не бессмертная клеточная линия.
Использовать оплодотворенные куриные яйца — одна из самых старых технологий, ее применяют только для создания вакцин от гриппа. Она не единственная, но одна из основных.
Чтобы произвести вакцину, в том числе векторную, мы должны сначала получить много-много клеток — некую «почву» или субстрат, чтобы потом заразить их вирусом.
Производство на основе выращенной клеточной массы
Для этого мы берем посевной материал в маленькой пробирке — замороженные клетки, поведение которых хорошо изучено. Клетки размораживаем и помещаем в питательную среду в маленьком объеме. Помещать клетки сразу в большой объем нельзя. Из-за маленькой плотности они просто погибнут (в этом случае говорят, что клетки погибли от одиночества). Поэтому их разводят в маленьком объеме и при достижении определенной плотности помещают в емкости большего размера.
Эту операцию повторяют несколько раз. В процессе размножения среду перемешивают. Если клетки чувствительны к механическому повреждению, для перемешивания используют специальное оборудование — волновой биореактор, в нем закрепленная на оси пробирка выполняет определенные движения. Применяют и биореакторы вертикального перемешивания, максимальный объем которых доходит до двух тысяч литров.
Устройство биореакторов для противовирусных вакцин отличается от биореакторов для производства антибактериальных вакцин. В контейнер, управляемый отдельно стоящим модулем, устанавливают специальный мешок — так называемую одноразовую систему (SUS — single use system), где будет происходить выращивание клеточной массы.
Биореактор и одноразовая система для выращивания клеточной массы
Это долгий процесс, который занимает три — четыре недели. Вдобавок клетки млекопитающих очень чувствительны к бактериальному и постороннему вирусному заражению, поэтому очень важно соблюдать полную стерильность процесса.
На входе в мешок установлен стерилизующий фильтр, не пропускающий бактерии, а также ряд противовирусных фильтров. Кроме того, в устройстве предусмотрена стерильная подача воздуха и стерильные соединения для перекачки содержимого на следующие этапы производства.
Производство на первичных клеточных линиях
Другой вариант — размножение вируса на первичных клеточных линиях, когда клетки не выращивают в реакторе, а получают из готового биоматериала. На изображении ниже вы можете видеть схему производства вирусной вакцины от клещевого энцефалита.
Согласно схеме, вирус инактивируют с помощью формальдегида
Оплодотворенные куриные эмбрионы развиваются в инкубаторе, после чего их достают и фактически перемалывают в мясорубке, получая первичную культуру клеток. Каждый раз, перед каждым производством, ее делают заново. Если бессмертные клетки мы берем из производственного стокового банка, то здесь каждый раз создаем новую клеточную культуру.
Эту клеточную культуру заражают посевным материалом вируса. Дальше вирус размножается в клетках, пока не достигает необходимой плотности. То, что получилось, охлаждают и очищают от всего лишнего, то есть от осадков клеточной культуры, на которой производились вирусы, и затем уже формируется вакцина — финальный продукт. Подробнее обо всем этом чуть ниже.
Производство «на яйцах»
В производстве вакцин «на яйцах» каждый эмбрион, то есть оплодотворенное яйцо, заражают, а затем выдерживают определенное время в специальном инкубаторе.
Инкубатор необходим для того, чтобы и эмбрион сохранял жизнеспособность, и вирус размножался. Грубо говоря, из каждого яйца получают дозу вакцины. Разумеется, это не куриные яйца из супермаркета, а сертифицированные яйца, которые специально отбирают для завода по производству вакцины от гриппа.
Очистка
После того как мы наработали действующее вещество вакцины (например, при помощи клеточной структуры млекопитающих, либо насекомых, либо дрожжей, либо бактерий), мы приступаем к процессу очистки. Это также очень длительный этап.
На схеме показан процесс очистки при производстве пневмококковой вакцины. Убили вирус, затем поместили в центрифугу, затем провели этап осветления и стерилизующую фильтрацию: удалили все компоненты больше 0,2 мкм. После этого проводим диафильтрацию — это фильтрация в ламинарном потоке, когда давление прикладывают не перпендикулярно, а параллельно мембране, что позволяет заменить буфер и полностью удалить остатки среды.
Далее следует несколько этапов очистки, многие из них повторяются. В итоге мы получаем полностью очищенный от всего лишнего действующий компонент вакцины. В данном случае это полисахариды одного конкретного штамма, который мы потом смешаем с полисахаридами других штаммов, внесем дополнительные компоненты для стабильности и эффективности (о них ниже) и получим конечный вариант вакцины.
Состав вакцин
Кроме действующего вещества в вакцину входят вспомогательные компоненты. Если вакцина жидкая, то это вода. Вместе с водой в состав могут входить адъюванты, стабилизаторы и консерванты.
Стабилизаторы и эмульгаторы
Антигены — это сложные молекулы, очень чувствительные к изменениям рH и температуры. Чтобы вакцина оставалась эффективной при любых условиях, используют стабилизаторы. Это могут быть обычные соли калия, магния, натрия — буфер для стабилизации pH. Все эти компоненты входят в состав клеток лимфы человека. В жидкие вакцины могут входить щелочи и кислоты. Обычно это следовые концентрации для стабильности буферного раствора.
Эмульгаторы необходимы для того, чтобы сохранить гомогенность раствора. Чаще всего используют Полисорбат 80, ТРИС или октосинол-10 — это относительно новые в фармацевтике вещества. Существуют всевозможные безумные мифы о вреде и токсичности стабилизаторов — все они лишены оснований. В таких низких концентрациях, при которых эти компоненты обеспечивают гомогенность раствора, они вреда не несут.
В лиофилизированных, то есть, высушенных, вакцинах используют другие стабилизаторы. Например, сахара (лактозу, сахарозу, мальтозу) и многоатомные спирты (сорбитол, маннит). Популярный стабилизатор — желатин, частично или высоко гидролизованный коллаген животного происхождения. Часто используют альбумин: человеческий донорский, рекомбинантный или гидролизат лактальбумина (белок из молочной сыворотки).
Если у прививаемого нет аллергии на эти компоненты, то неважно, какой именно стабилизатор использовали, — вакцина будет одинаково эффективна. Если у человека есть тяжелая аллергическая реакция на один из компонентов, например на желатин, лактозу или альбумин, на это обязательно нужно обратить внимание — состав вакцины всегда указывают в инструкции.
Зачем нам знать про адъюванты и конъюгаты
Адъюванты и конъюгаты — это вещества, усиливающие эффективность вакцины. Некоторые маленькие белковые молекулы могут быть недостаточно заметными для иммунной системы, поэтому к ним добавляют, например, соединения алюминия, гидроксид или фосфат.
В вакцинах от гриппа, произведенных в РФ, используются полиоксидоний и совидон. В ветеринарии активно используют масляные адъюванты (за пределами РФ их можно встретить в вакцинах для человека).
По сути, адъювант — это адсорбент, на поверхность которого налипает антиген. Мы получаем укрупнение частиц, повышаем заметность действующего вещества и, соответственно, большую эффективность.
Алюминий используют в виде очень-очень мелкого песка, на поверхности которого адсорбируют антигены вакцины. Он «переваривается» и выходит из организма точно так же, как и тот алюминий, который попадает к нам в организм вместе с пищей и водой уже в виде растворимых соединений.
То же самое происходит и с адъювантами другого происхождения: они постепенно метаболизируются. Тут стоит вспомнить про еще один антипрививочный миф о вакцинах, о том, что в них якобы находятся тяжелые металлы. Алюминий — металл легкий, так что и это утверждение не имеет оснований.
Еще один способ усилить реакцию на вакцину — конъюгировать маленький белок либо маленький полисахарид с другим белком. Например, у маленьких детей иммунная система незрелая и вообще не распознает полисахариды. Значит, необходима адаптация. Для этого полисахарид из сахарной капсулы бактерии (ее оболочки) соединяют с белком-носителем (как правило, это дифтерийный или столбнячный анатоксин), и в таком варианте вакцина уже работает. По такому принципу устроены вакцины от пневмококковой, гемофильной и менингококковой инфекций.
Консерванты
Это вещества, которые повышают стабильность состава. В вакцине среда не очень питательная, однако и в ней могут завестись посторонние микроорганизмы. Чтобы этого не произошло, добавляют консерванты. Особенно это актуально для многодозовых флаконов.
Вид консерванта зависит от типа вакцины. С одними консервантами антигены сохраняются хорошо, с другими — нет. Какой именно консервант будет наиболее подходящим, определяют «методом научного тыка» — с помощью экспериментов, замеряя стабильность состава вакцины. Например, ртутьорганический антисептик мертиолят (тиомерсал) применяют в многодозовых флаконах с детскими вакцинами и во взрослых вакцинах от дифтерии, столбняка, гепатита В и гриппа.
Обратите внимание, что это не ртуть, а ртутьорганический антисептик, он безопасен и его используют не только для производства вакцин, но и в косметике. Найти его можно в очень ограниченном количестве современных вакцин. Одно время он был предметом споров. В 2000-х годах его со скандалом исключили из числа компонентов под давлением общественности, так как в то время данных о его безвредности было недостаточно. В 2009 году Американская академия педиатрии отозвала собственное заявление, в котором ранее рекомендовала исключить этот консервант из состава вакцин.
Другой консервант — феноксиэтанол. Его применяются в инактивированных вакцинах от полиомиелита, а также от дифтерии, столбняка и гемофильной инфекции. Что касается такого консерванта, как фенол, то это вещество используют только в вакцинах от пневмококковой инфекции, причем только полисахаридных, которые не применяют для детей.
Антибиотики тоже используют в качестве консерванта, но делают это редко. Например, в составе российской оральной полиомиелитной вакцины присутствует канамицин. Это не терапевтическая доза, но ее достаточно, чтобы сохранить стерильность препарата. Переживать относительно антибиотикорезистентности из-за трех доз, которые получит ребенок в процессе вакцинации, не стоит — они очень малы.
Следы производства
Следы производства — это не компоненты вакцины, добавляемые в процессе ее изготовления. Это то, что невозможно удалить на сто процентов, поскольку не существует таких чувствительных методов, которые могли бы показать, что мы удалили компонент полностью. К следам производства можно отнести формальдегид, используемый для инактивации некоторых бактериологических вакцин.
Очевидно, что в следах производства будет присутствовать питательная среда, включая аминокислоты, сыворотку, белок коровьего молока (БКМ, казеин — один из компонентов среды при производстве вакцины от коклюша). Следы питательного субстрата не токсичны для человека и имеют значение только в том случае, если у прививаемого есть тяжелая аллергическая реакция на один из компонентов.
Также могут присутствовать следы продуцента — белки дрожжей, следы белка куриного яйца. Обращать на это внимание стоит тоже только при наличии тяжелой аллергии.
У каждой вакцины свои компоненты и свой процесс изготовления, поэтому следы производства в каждом случае свои. Например, если для вакцины MMR-II от кори, краснухи и паротита нужен рекомбинантный альбумин человека и гидролизат желатина (вероятно, у производителя только так получилось обеспечить стабильность вакцины в течение всего срока годности) — то эти следы производства будут присутствовать. Но при этом там может не быть, скажем, консерванта (строго говоря, его там по определению быть не может, поскольку это живая вакцина и консервант может ее убить). Краснушная вакцина нашего производителя будет содержать только желатин, поскольку таким образом получилось ее стабилизировать.
Что в итоге
Главный вывод — все вакцины разные. Их производят разными способами, поэтому они имеют разный состав.
Важно понимать, почему в отдельно взятой вакцине находятся именно такие компоненты, а не другие. Следует обращать внимание на то, не несут ли составляющие вакцины угрозу в связи с тяжелой аллергической реакцией. Это единственное требование для обеспечения максимального снижения рисков вакцинации.
Любая вакцина состоит только из тех компонентов, которые обеспечивают ее безопасность и эффективность. Не стоит полагаться на мифы о том, что в состав входят какие-то неизвестные вещества. Те компоненты, которые не выполняют никакую полезную функцию, содержатся в очень малых количествах и являются остаточным следом производства.
Чем различаются технологии создания вакцин от коронавируса?
Вакцина против коронавируса от Института Гамалеи — это векторная вакцина. В ее основе аденовирус, измененный таким образом, чтобы заставлять клетки нашего организма синтезировать антигены. Также есть вакцина «ЭпиВакКорона» от научного центра «Вектор», которая создана на основе синтезированных пептидных антигенов белков вируса SARS-CoV-2, конъюгированных с рекомбинантным белком-носителем, синтезированных в бактериальной системе и адсорбированных на алюминийсодержащем адъюванте.
Что такое «процент эффективности вакцины» и как его определяют?
Если рассказывать обо всех способах вычисления эффективности вакцины, длина поста увеличится в несколько раз. В первую очередь нас интересует эпидемиологический фактор эффективности вакцины. На этапе испытания его будут оценивать, основываясь на данных о том, как отличается среди привитых и непривитых количество заболевших, тяжело заболевших и умерших. Если вакцина будет снижать хотя бы в два раза число заболевших, вакцинация уже имеет смысл.
При этом процент эффективности вычисляют путем сопоставления числа заболевших среди привитых и непривитых. Например, 95-процентная эффективность означает, что среди непривитых заболеваемость выше в 20 раз.
Другой способ оценки вакцины — определение ее иммуногенности. В этом случае выясняют, насколько вакцина позволяет получить иммунный ответ — гуморальный либо клеточный.
Эффективна ли вакцина БЦЖ?
Какие обследования нужно проходить до вакцинации?
Единственное обследование, которое регламентировано для всех перед вакцинацией, — осмотр врачом. Врач обязан, кроме оценки общего состояния, выяснить, есть ли у вас противопоказания к отдельным компонентам вакцины. Еще врач может поинтересоваться, нет ли у вас тяжелого иммунодефицита — в этом случае вам нельзя будет использовать живые вакцины, зато другие вакцины будут эффективны. Если вы находитесь в стадии обострения любой инфекции или хронического заболевания, прививку стоит отложить до момента ремиссии, чтобы побочные эффекты этой болезни не были ложно истолкованы как реакция на вакцинацию. Ну и еще некоторые вакцины имеют ограничение по возрасту.