васкуляризация лимфоузлов что это значит
Ультразвуковое исследование лимфатических узлов
УЗИ сканер HS50
Доступная эффективность. Универсальный ультразвуковой сканер, компактный дизайн и инновационные возможности.
Оценка состояния зон регионарного лимфооттока при обследовании онкологических больных имеет решающее значение в определении лечебной тактики и прогнозе течения заболевания. Знание путей лимфооттока позволяет вести целенаправленный поиск метастатически измененных лимфатических узлов у больных со злокачественными новообразованиями. Уточнение локализации и количества выявленных измененных лимфатических узлов дает возможность уточнить стадию опухолевого процесса.
Выявление лимфатических узлов при физикальном осмотре не всегда возможно. Так, по данным R. Chandawarkar и S. Shinde [1], J. Verbanck и соавт. [2], чувствительность пальпации в выявлении лимфатических узлов колеблется от 50 до 88%. Глубоко залегающие лимфатические узлы, например, ретромаммарные, интрапекторальные и др., недоступны для клинической оценки при пальпации. Одним из ведущих методов обнаружения патологии лимфатических узлов является ультразвуковое исследование (УЗИ). Точность УЗИ в выявлении лимфатических узлов различна, она во многом зависит от локализации лимфатических узлов, качества аппаратуры, а также опыта исследователя. Специфичность УЗИ в выявлении и дифференциальной диагностике поражения лимфатических узлов составляет от 30 до 100% 5. Число работ, посвященных ультразвуковой диагностике метастатического поражения поверхностных лимфатических узлов, увеличивается [7, 8].
Периферические лимфатические узлы исследуют линейными датчиками с рабочей частотой 5-12 МГц, линейные и конвексные датчики с рабочей частотой 3-5 МГц можно использовать для осмотра больших периферических конгломератов.
Исследование регионарных чаще проводят на стороне поражения, иногда и на контралатеральной стороне, а при лимфогранулематозе, неходжкинских лимфомах, лейкозах и др. УЗИ необходимо проводить с учетом возможного поражения разных групп лимфатических узлов.
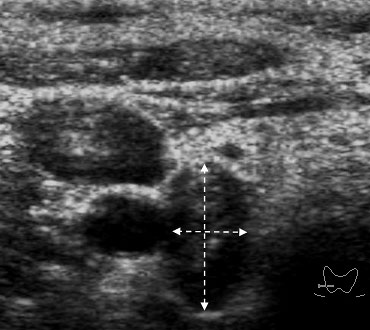
При проведении УЗИ следует определить локализацию лимфатических узлов, их число, форму, размер и структуру.
В норме лимфатические узлы представляют собой образования бобовидной, овальной или лентовидной формы и располагаются группами, чаще по несколько узлов.
Размеры лимфатических узлов зависят от возраста обследуемого, особенностей конституции и др. У клинически здоровых людей можно обнаружить лимфатические узлы, длина которых достигает 3,5 см. Существует разница в величине и форме лимфатических узлов разных регионарных групп и лимфатических узлов, расположенных в разных областях у одного и того же индивидуума.
Форма лимфатических узлов в значительной мере зависит от их топографоанатомических отношений с прилежащими органами, обычно она несколько продолговатая и сплюснутая, немного выпуклая с одной стороны и с небольшой впадиной с другой, напоминает фасоль. Иногда форма лимфатического узла может быть округлой. В пожилом и старческом возрасте нередко встречаются лентовидные формы лимфатических узлов, которые можно рассматривать как результат слияния более мелких узлов. На участках, ограниченных фасциями (например, в затылочной области), узлы более вытянуты в длину, чем те, которые располагаются в рыхлой клетчатке (например, подмышечные) (рис. 1, 2).
Эхогенность лимфатических узлов оценивают по отношению к окружающим тканям (чаще клетчатке) и описывают как высокую, среднюю и низкую (гипер- или гипоэхогенные, изо- или анэхогенные лимфатические узлы) (рис. 3, 4).
Рис. 3. Метастазы в лимфатические узлы (LN) шеи (Ln. Рretrachealis и Lnn. laterotracheales sinistri). Гипоэхогенные округлые гомогенные лимфатические узлы.
Рис. 4. Состояние после тиреоидэктомии. Изоэхогенный лимфатический узел претрахеальный (слева).
Паренхима лимфатического узла подразделяется на корковое вещество, расположенное ближе к капсуле, и медуллярную (мозговую) часть, занимающую центральные отделы узла, находящиеся ближе к воротам органа. Соотношение коркового и мозгового вещества варьирует в зависимости от локализации лимфатических узлов.
Структура лимфатических узлов изменяется в зависимости от этапности их расположения. Так, при оценке структуры лимфатических узлов шеи, расположенных рядом с органом, видно, что наиболее близко расположенные к органу лимфатические узлы (непостоянно присутствующие) имеют относительно небольшие размеры, округлую или веретенообразную форму, в них в меньшей степени выражено корковое вещество. В лимфатических узлах, расположенных дальше от органа, корковое вещество развито лучше.
Под взаимоотношением лимфатического узла с окружающими тканями понимается взаиморасположение узла и окружающих тканей: отсутствие связи или сохранение капсулы лимфатического узла и наличие прослойки клетчатки (или соединительной ткани) между лимфатическим узлом и другими структурами; соприкосновение или прилегание к органу (сосуду и др.) без нарушения его целости; вовлечение в опухолевый процесс.
У лиц пожилого возраста выявляют редукцию и склерозирование лимфатических узлов, некоторые из них срастаются между собой (у пожилых чаще определяются крупные лимфатические узлы). При этом наблюдается замещение больших участков узла жировой тканью. Жировая инфильтрация в старческом возрасте разрушает капсулу узла. Проросшие жиром лимфатические узлы (чаще периферические) выглядят как округлые и овальные структуры с гиперэхогенной гетерогенной (иногда сетчатой) центральной частью и относительно тонким гипоэхогенным ободком. Капсула узла может быть видна фрагментарно.
Локализация лимфатического узла описывается по отношению к анатомической области, сосудисто- нервному пучку либо к органу, рядом с которым находится выявленный лимфатический узел (в средней трети шеи, кнаружи от сосудисто-нервного пучка).
Для удобства диагностики банальные (неспецифические) лимфадениты дифференцируют следующим образом:
Рис. 6. Острый лимфаденит (лимфатический узел в средней трети шеи слева кнаружи от сосудистого пучка у больного с тромбозом яремной вены). Капсула четко не дифференцируется.
Реактивные изменения, возникающие в ответ на различные патологические процессы в организме (воспалительный процесс, проведение вакцинации и др.), способствуют увеличению лимфатического узла, напряжению его капсулы, усилению сосудистого рисунка, расширению корковой и околокорковой зон, отеку и разволокнению капсулы, расширению синусов, в лимфатическом узле могут встречаться единичные анэхогенные «кистозные » структуры, в дальнейшем может происходить абсцедирование. Следует учитывать, что изменения в лимфатических узлах, расположенных рядом с опухолью, могут выражаться в неспецифической реакции воспалительного характера (рис. 8).

а, б) Увеличение лимфатического узла, утолщение гипоэхогенной периферической части, утолщение капсулы (показано стрелкой).
По мнению M. Choi и соавт. [9], сосуды в воспаленном расширены в сравнении с сосудами метастатически измененного лимфатического узла, которые, напротив, могут быть сдавлены клетками опухоли.
В нормальных и реактивно измененных при воспалении лимфатических узлов видимые сосуды чаще расположены в области ворот лимфатических узлов или не определяются вовсе. В крупном гиперплазированном лимфатическом узле сосудистый рисунок в периферических отделах упорядочен, сосуды (артерии) определяются вдоль капсулы и радиально от ворот к периферии.
При гиперплазии в случае положительного эффекта лечения лимфатических узлов становятся менее контрастными, размеры их уменьшаются. При хроническом лимфадените часто отмечается утолщение капсулы, спаяние ее с окружающими тканями.
О метастатическом поражении при больших размерах узлов, их неправильной форме, неровных или нечетких контурах уверенно можно говорить при наличии анэхогенных участков в узлах, выявлении конгломератов лимфатических узлов (рис. 9, 10).
а) Метастаз в лимфатический узел.
б) Гиперплазированный лимфатический узел (сохраняется центральная гиперэхогенная структура).
Рис. 10. Сосудистый рисунок периферического гиперплазированного лимфатического узла (подострый лимфаденит).
При метастатическом поражении лимфатического узла происходит изменение его формы, размеров, эхогенности и структуры. Описанный феномен лежит в основе использования УЗИ для диагностики метастатического поражения лимфатических узлов.
P. Vassallo и соавт. (1993) показали, что опухолевая инфильтрация приводит к изменению формы лимфатического узла (отношение поперечного и продольного размеров или длинной и короткой осей лимфатического узла менее 1,5): он становится округлым, гипо- или анэхогенным, видно расширение кортикального слоя. Таким образом, чем ближе форма лимфатического узла к округлой, тем больше вероятность опухолевого поражения лимфатического узла. Капсула узла при инфильтрации и прорастании в окружающие ткани четко не определяется, контур становится размытым.
Известно, что при метастатическом поражении лимфатических узлов в них увеличивается содержание жидкости. При проведении УЗИ отмечают стирание рисунка лимфатического узла уже на начальном этапе (замещение клетками опухоли) 9. Капсула лимфатического узла дифференцируется, но при прорастании за пределы капсулы контур узла становится размытым. При инфильтрации капсулы, в дальнейшем (прорастании окружающих тканей) распространении за пределы лимфатического узла и срастании нескольких узлов отмечается образование конгломератов.
Таким образом, изображение структуры метастатически пораженных лимфатических узлов может быть: гипоэхогенной вплоть до анэхогенной, гиперэхогенной гетерогенной (полиморфной неоднородной) за счет чередования гипер- и гипоэхогенных участков и с наличием локальных гипоэхогенных участков на фоне неизмененной или гиперплазированной структуры лимфатических узлов.
При злокачественных процессах в лимфатических узлах наиболее часто отсутствует гиперэхогенная центральная часть или отмечается ее истончение, что соответствует диффузному или тотальному замещению центральных отделов опухолевой тканью. В некоторых случаях при метастатическом поражении только центральной части лимфатического узла он может выглядеть неизмененным, так как происходит имитация изображения ворот опухолевой тканью (чаще встречается при высокодифференцированном плоскоклеточном раке или других формах рака, которые сопровождаются коагуляционным некрозом, в случае ишемической дегенерации). Иногда можно наблюдать лимфатический узел в виде полностью гиперэхогенного образования. Хотя последнее более характерно для жировой инфильтрации, в этих случаях все же нельзя полностью исключать опухолевый генез изменений.
Структура лимфатического узла при замещении опухолевой тканью чаще гетерогенная или гипоэхогенная. Встречаются анэхогенные лимфатические узлы (например, при меланоме) или изо- и гиперэхогенные (при папиллярном раке). Иногда могут визуализироваться гиперэхогенные включения (кальцинаты) в метастатически измененном лимфатическом узле, может наблюдаться также внутриузловой некроз с характерной гетерогенной ультразвуковой картиной.
В метастатически измененных лимфатических узлах отмечается диффузное усиление васкуляризации с широким диапазоном скоростей и атипичным сосудистым рисунком (хаотично расположенные сосуды с наличием артериовенозных шунтов). По данным спектрального анализа, имеются низкие значения индекса резистентности при одновременной высокой диастолической составляющей.
Экстракапсулярный рост метастазов в лимфатических узлах часто приводит к объединению нескольких пораженных лимфатических узлах в бесформенный конгломерат и вовлечению в опухолевый процесс окружающих тканей. Признаком инфильтративного роста за пределы капсулы узла является нечеткость его контуров. Следует также определять вовлечение в опухолевый конгломерат прилежащих органов и структур, описывать характер этого вовлечения.
По данным T. Arita и соавт. (1993), УЗИ эффективно и при оценке изменений лимфатических узлов в динамике.
Оценивая состояние лимфатических узлов, следует помнить, что наличие измененного лимфатического узла может свидетельствовать как о гиперплазии узла, так и о метастатическом его поражении, однако при множественном опухолевом поражении метастазы могут принадлежать разным опухолям. Так, Н.И. Богданская (1978) описала случай одновременного поражения шейного лимфатического узла метастазами рака щитовидной железы и лимфосаркомы (рис. 11).

Рис. 11. ЛГМ. Кровоток в лимфатических узлах шеи.
Достаточно характерная ультразвуковая картина лимфатических узлов наблюдается при лимфогранулематозе. При этом в большинстве случаев видно несколько увеличенных лимфатических узлов (одна или несколько групп лимфатических узлов). Узел имеет овальную или округлую форму, четко видимую капсулу, гомогенную, чаще слабо гипоэхогенную структуру. Группа увеличенных лимфатических узлов («пачка») представлена четко отграниченными, не прорастающими капсулу и не сливающимися между собой лимфатические узлы (как при метастатическом поражении, в виде конгломерата) и может локализоваться в какой-либо одной области (например, надключично справа или слева) или в нескольких областях (увеличенные лимфатические узлы средостения, надключичные и в нижней трети шеи с одной или обеих сторон и др.).
Литература
УЗИ сканер HS50
Доступная эффективность. Универсальный ультразвуковой сканер, компактный дизайн и инновационные возможности.
Васкуляризация лимфоузлов что это значит
Рак молочной железы (РМЖ) продолжает оставаться одной из наиболее значимых медико-социальных проблем, поскольку за последние десятилетия не отмечено ни значительного снижения первичного выявления этой патологии (по среднемировым оценкам – 46,3 на 100 тыс. населения, более 40% от всех злокачественных опухолевых процессов у женщин) [1, 2], ни существенного прогресса в предотвращении рецидивов РМЖ, метастазирования опухолевых клеток, что влияет на качество жизни пациентов и их выживаемость (смертность – 13,0 на 100 тыс.). Следует отметить, что около 19% случаев РМЖ диагностируется у женщин в возрасте от 30 до 49 лет, 44% случаев – у женщин в возрасте 65 лет и старше [2]. Одним из безусловных достижений последних десятилетий является снижение смертности от РМЖ в ряде развитых стран, особенно в молодом возрасте, что в основном связывают с внедрением программ раннего скрининга РМЖ с помощью маммографии и разработкой новых, более эффективных противоопухолевых препаратов [3]. В то же время важно подчеркнуть, что во многих развивающихся странах смертность от РМЖ не снижается или растет, что обусловливает общее увеличение смертности от РМЖ в мире в последние десятилетия.
Такая динамика заболеваемости и смертности от РМЖ обусловливает необходимость всестороннего изучения данной патологии, особенно факторов риска, генетической предрасположенности, молекулярных механизмов прогрессирования опухолевого роста, метастазирования опухолевых клеток, а также выделения маркеров прогноза исхода заболевания после проведения хирургического и/или химиотерапевтического лечения [4, 5]. К ценным прогностическим маркерам выживаемости при РМЖ наряду с гистологическим типом опухоли и степенью ее злокачественности относят так называемую вовлеченность регионарных лимфатических узлов в опухолевый процесс, а именно наличие или отсутствие в них метастазов [6]. По данным некоторых авторов, при вовлеченности в опухолевый процесс 10 и более аксиллярных лимфатических узлов риск смерти от РМЖ в течение 10 лет возрастает на 70% по сравнению с теми индивидами, у которых в патологический процесс вовлечены 1–3 лимфатических узла [7]. В связи с этим большое внимание в последнее время уделяется выяснению значимости, надежности и безопасности биопсии аксиллярных лимфатических узлов при РМЖ для установления их метастатического статуса до и после неоадъювантной химиотерапии и, как следствие, для оценки эффективности лечения и определения возможной продолжительности жизни [8–10]. Не все авторы одинаково высоко оценивают диагностическую и прогностическую значимость биопсий лимфатических узлов, нередко подчеркивают, что она разнится в зависимости от гистологических вариантов РМЖ, эффективности химиотерапии или статуса лимфатических узлов после химиотерапии [8, 11], но все исследователи считают необходимым продолжение детального изучения лимфатических узлов при РМЖ с целью получения дополнительной информации о характере их структурной реорганизации, в том числе и при отсутствии в них метастазов.
Анализ литературы свидетельствует о том, что основное внимание при изучении регионарных лимфатических узлов уделяется выяснению их метастатического статуса и его изменению после химиотерапии. Другие структурные преобразования лимфатических узлов, как правило, не оцениваются, что не позволяет устанавливать весь спектр негативных эффектов злокачественного опухолевого роста, в том числе РМЖ, на функционально и анатомически связанные с неопластическими очагами органы и ткани. Значительная структурная реорганизация лимфатических узлов, которые относятся к периферическим органам иммунной системы, может негативно влиять на созревание иммунокомпетентных клеток и, как следствие, на развитие иммунных реакций, что может усугублять состояние онкологических больных, снижать качество их жизни после химиотерапевтического и хирургического лечения [12]. Следует также отметить недостаточное использование структурно-функциональных характеристик лимфатических узлов без метастазов для разработки прогностических критериев не только долгосрочной выживаемости, но и развития коморбидной патологии с учетом агрессивности опухолевого процесса.
Цель работы – с помощью комплексного патоморфологического анализа с применением методов морфометрии и иммуногистохимии изучить выраженность склеротических процессов и интенсивность ангиогенеза в аксиллярных лимфатических узлах пациентов на разных стадиях РМЖ.
Материал и методы исследования
Исследования выполнены в соответствии с этическими принципами проведения медицинских исследований с участием людей в качестве субъектов исследования, изложенных в Хельсинкской декларации Всемирной медицинской ассоциации.
Подмышечные лимфатические узлы фиксировали в 10%-ном растворе нейтрального формалина и обрабатывали по стандартной методике для заключения в парафин. Срезы окрашивали гематоксилином и эозином и по ван Гизону. Для иммуногистохимической оценки степени выраженности ангиогенеза использовали моноклональные антитела к CD34-антигену Dako reagents kit. Обработку срезов проводили в соответствии с рекомендациями производителя (Dako, Дания). Окрашенные срезы изучали в световом микроскопе Axioimager M1 (Zeiss, Германия).
Морфометрический анализ структурных компонентов подмышечных лимфатических узлов проводили с использованием объективов х10 (тестовая площадь – 1 400 000 мкм2) и х20 (тестовая площадь – 350 000 мкм2) с использованием программного обеспечения морфологического модуля Axiovision (Zeiss, Германия). На каждом срезе проводили по 5 измерений. Определяли объемную плотность CD34-позитивных структур во всем органе и раздельно в корковом и мозговом веществе, краевом синусе, корковом плато, паракортексе; аналогичным образом оценивали объемную плотность соединительной ткани (при окраске по ван Гизону).
Статистическую обработку результатов проводили с использованием статистической программы MS Excel 7.0 (Microsoft, USA). Вычисляли среднее значение, ошибку среднего, а также коэффициент корреляции по Пирсону (для оценки корреляционных связей между показателями васкуляризации и склеротической трансформации, а также между стадией РМЖ и уровнем развития соединительной ткани или показателями васкуляризации в лимфатических узлах в целом и отдельно в каждой из их структур). Межгрупповые различия определяли по критерию Стьюдента; статистически значимыми считали различия при p
Ультразвуковая оценка васкуляризации узловых образований щитовидной железы
ФГБУ «Федеральный медицинский биофизический центр им. А.И. Бурназяна» ФМБА России
E-mail:
РЕФЕРАТ: В статье проанализирован опыт комплексного ультразвукового исследования объемных образований щитовидной железы у 249 пациентов, подвергшихся оперативному вмешательству.
По распространенности в популяции узловые образования доминируют в структуре тиреоидной патологии, особенно в эндемичных районах, составляя 40-50% всех заболеваний щитовидной железы. Клиническая значимость узловой патологии щитовидной железы определяется высокой распространенностью рака щитовидной железы, который встречается в 5-10% выявленных узлов 3.
Среди методов лучевой диагностики ведущие позиции занимает ультразвуковое исследование, достоинства которого – простота, неинвазивность, доступность, относительно низкие экономические затраты – сочетаются с высокой информативностью. В большинстве случаев ультразвуковое исследование, дополненное тонкоигольной аспирационной биопсией патологических очагов, является основным методом диагностики узловых образований щитовидной железы 8. Совершенствование ультразвуковых технологий и внедрение в практику методик допплеровского картирования позволили выполнять ультразвуковую ангиографию щитовидной железы, качественно и количественно оценивать особенности ее васкуляризации [7, 10-14]. Вместе с тем, данные литературы относительно взаимосвязи выраженности васкуляризации узла и его злокачественности по-прежнему весьма разнообразны.
Материалы и методы
Диагностические возможности ультразвукового исследования (УЗИ) в выявлении и дифференциальной диагностике узловой патологии щитовидной железы (ЩЖ) проанализированы на основании обследования 249 больных. Результаты УЗИ сопоставлены с интраоперационными данными и верифицированы результатами гистологического исследования удаленной ЩЖ.
Всем пациентам было проведено традиционное клиническое и лабораторное обследование, а также инструментальная диагностика.
Комплексное ультразвуковое исследование щитовидной железы выполнялось по общепринятой методике на ультразвуковых диагностических аппаратах HDI 5000 (ATL, США), Acuson «Sequoia» – 512 (Siemens, Германия), Vivid-7 (GE, США), Voluson-730 Pro (GE, США), мультичастотными датчиками 5-12 МГц с использованием различных режимов сканирования.
В процессе исследования при полипозиционном сканировании в В-режиме оценивались положение, форма, контуры железы, ее эхогенность и эхо-структура, наличие дополнительных образований и локальных участков ткани железы с нарушенной акустической структурой, анатомо-топографические соотношения железы с соседними органами.
При наличии дополнительных образований (узлов) оценивали их количество, локализацию, контуры, эхогенность и эхо-структуру, распространение за капсулу ЩЖ. Всем без исключения больным в обязательном порядке по общепринятой методике осматривались зоны регионарного лимфооттока.
Качественный анализ кровотока в паренхиме железы и узловых образованиях проводили с использованием режимов цветового допплеровского кодирования (ЦДК) и энергетического допплера (ЭД). Для оптимизации цветового изображения использовали индивидуальные настройки параметров аппаратуры: мощность сигнала, частота повторения импульсов, фильтры. Однако сравнительную оценку васкуляризации паренхимы и узловых образований у одного и того же пациента в динамике или у различных пациентов проводили при стандартных настройках ультразвуковых приборов в программах «Thyroid». Качественный анализ кровоснабжения паренхимы щитовидной железы проводили в режиме ЦДК и ЭД, выделяя различную выраженность васкуляризации паренхимы (скудную, обычную, повышенную).
Ангиоархитектонику узловых образований определяли согласно градациям, используемым отечественными и зарубежными авторами [3, 106, 152, 198], и дифференцировали узловые образования с 4 типами сосудистого рисунка.
При изучении интенсивности кровоснабжения, как и в ряде исследований [8, 13, 15], выделяли узлы с интранодулярной гиперваскуляризацией (при наличии выраженной внутриузловой сосудистой сети) и интранодулярной гиповаскуляризацией (с наличием единичных сосудов внутри узла).
При оценке внутриузловой ангиоархитектоники отмечали такие качественные характеристики, как ход сосуда, протяженность, характер сосудистого рисунка, равномерность диаметра сосудов, внутриузловую «насыщенность» сосудами и т.д.
В ряде случаев исследование ангиоархитектоники узловых образований щитовидной железы дополняли трехмерной реконструкцией сосудистого рисунка в режиме энергетического допплера (3D-ангио).
Сравнение выборок, не подчиняющихся нормальному распределению, проводили с использованием методов непараметрической статистики. Такие данные в тексте, таблицах и рисунках представляли в виде Ме (медианы), минимальных и максимальных значений. При сопоставлении двух независимых выборок пользовались критерием Манна-Уитни (T). Для сравнения относительных показателей при анализе качественных переменных использовались критерии z и критерий χ 2 (хи-квадрат) с поправкой Йетса на непрерывность. Критический уровень значимости при проверке статистических гипотез принимался равным 0,05.
Используя принцип решающей матрицы, оценивали показатели диагностических тестов (истинно отрицательные результаты (ИО), истинно положительные результаты (ИП), ложно отрицательные результаты (ЛО), ложно положительные результаты (ЛП)) и информативность данных признаков (чувствительность, специфичность, точность, прогностическая ценность положительного результата, прогностическая ценность отрицательного результата). Указанные статистические показатели рассчитывали по формулам:
Результаты исследования и обсуждение результатов
Среди 249 оперированных пациентов у 49 человек (19,7%) установлен рак ЩЖ, который в 3 случаях сочетался с аденомой, у 41 (16,5%) – аденомы ЩЖ, у 151 (60,6%) – узловой коллоидный пролиферирующий зоб, в том числе в 16 случаях рецидивный, и у 5 (2,0%) – узловая форма аутоиммунного тиреоидита (АИТ). В 1 наблюдении (0,4%) пациенту удалена невринома шеи, в 1 (0,4%) случае – аденома паращитовидной железы и еще у 1 пациентки (0,4%) – аберрантная ЩЖ. В 24,5% наблюдений узловая патология ЩЖ сочеталась с диффузным или диффузно-узловым аутоиммунным тиреоидитом.
Результаты наших исследований, свидетельствующие о наличии узловых образований в ЩЖ, совпали с интраоперационными и морфологическими данными у 239 больных. В 157 (65,7%) наблюдениях обнаружено многоузловое поражение ЩЖ, с наличием от 2 до 9 узлов в каждой доле, и в 82 (34,3%) – одиночные узлы ЩЖ. Пятеро пациентов оперированы по поводу диффузно-узловой формы АИТ, ни при УЗИ, ни на операции других узловых образований у них выявлено не было. Результативность УЗИ в выявлении узловых образований ЩЖ составила: чувствительность – 98,8%, специфичность – 87,5%, точность – 98,4%, прогностическая ценность положительного результата – 99,6%, прогностическая ценность отрицательного результата – 70,0%.
В 5 наблюдениях (2,0%) результаты УЗИ были ошибочны: в одном случае за крупный узел нижнего полюса правой доли ЩЖ принята невринома надключичной области (рис. 1), в другом за гиперплазированные паратрахеальные лимфоузлы – аденома паращитовидной железы (рис. 2). У 3 оперированных больных не распознаны узлы ЩЖ, сформировавшиеся на фоне диффузного зоба или АИТ.
Рисунок 1. Эхограмма невриномы (двусторонняя стрелка) шеи.
Сканирование в режиме ЦДК.
Рисунок 2. Аденома паращитовидной железы (стрелки).
В общей сложности у 239 пациентов проанализированы и сопоставлены с результатами гистологического исследования эхографические характеристики 528 узловых образований ЩЖ. При этом изучались серошкальное изображение узлов и их ангиоархитектоника в режимах ЦДК и ЭД, а при необходимости – в режиме трехмерной реконструкции сосудистого рисунка (3D-ангио). Из 528 узлов 56 (10,6%) соответствовали различным формам рака ЩЖ, 45 (8,5%) – доброкачественным опухолям (фолликулярным аденомам) ЩЖ и остальные 427 (80,9%) – узловому в разной степени пролиферирующему зобу. Результаты сопоставления ультразвукового изображения узловых образований с их морфологическим строением и статистическая значимость полученных данных представлены в таблицах 1-3.
Таблица 1. Размеры узловых образований щитовидной железы
различной морфологической структуры
| Размеры узлов | Морфологическое строение узлов | |||||||
|---|---|---|---|---|---|---|---|---|
| Рак | Аденома | Коллоидные узлы | Итого | |||||
| Кол-во | % | Кол-во | % | Кол-во | % | Кол-во | % | |
| До 10 мм | 16 | 28,6 | 5 | 11,1 | 195 | 45,6 | 216 | 40,9 |
| 11-20 мм | 17 | 30,4 | 15 | 33,3 | 102 | 23,9 | 134 | 25,4 |
| 21-30 мм | 13 | 23,2 | 16 | 35,6 | 66 | 15,5 | 95 | 18,0 |
| 31-40 мм | 5 | 8,9 | 5 | 11,1 | 32 | 7,5 | 42 | 8,0 |
| > 40 мм | 5 | 8,9 | 4 | 14,9 | 32 | 7,5 | 41 | 7,8 |
| Всего | 56 | 100,0 | 45 | 100,0 | 427 | 100,0 | 528 | 100,0 |
Таблица 2. Локализация узловых образований щитовидной железы
различной морфологической структуры
| Размеры узлов | Морфологическое строение узлов | |||||||
|---|---|---|---|---|---|---|---|---|
| Рак | Аденома | Коллоидные узлы | Итого | |||||
| Кол-во | % | Кол-во | % | Кол-во | % | Кол-во | % | |
| Верхний полюс | 14 | 25,0 | 2 | 4,4 | 104 | 24,4 | 120 | 22,3 |
| Средняя треть | 24 | 42,9 | 20 | 44,4 | 141 | 33,0 | 185 | 35,0 |
| Нижний полюс | 10 | 17,9 | 20 | 44,4 | 147 | 34,4 | 177 | 34,0 |
| Перешеек | 8 | 14,3 | 3 | 6,8 | 35 | 8,2 | 46 | 8,7 |
| Всего | 56 | 100,0 | 45 | 100,0 | 427 | 100,0 | 528 | 100,0 |
В структуре опухолевых заболеваний ЩЖ обращает внимание присутствие мелких очагов, размерами менее 10 мм (до 28,6% среди раков и до 11,1 % среди аденом) (табл. 1). Это затрудняло их дифференциацию при полинодозном поражении ЩЖ и обнаружение среди мелких пролиферирующих коллоидных узелков и инциденталом. До 17,8% раковых узлов были представлены крупными очаговыми образованиями, размерами более 30 мм в диаметре, что также было характерно и для узлового пролиферирующего зоба. Зависимости частоты встречаемости рака от размеров узла нами не выявлено (χ 2 =3,70, р=0,448).
Малигнизированные узлы чаще локализировались в средней трети доли, тогда как аденомы преимущественно располагались как в нижнем полюсе, так и в средней трети доли (табл. 2). Эхографические характеристики узловых образований различной морфологической структуры отличались большим разнообразием ультразвуковых признаков, что также затрудняло диагностику злокачественной патологии с помощью УЗИ (табл. 3).
Таблица 3. Ультразвуковые признаки узловых образований щитовидной железы
в сопоставлении с результатами морфологического исследования
| Признаки | Морфологическое строение узлов | Статистическая значимость | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Рак | Аденома | Узловой кол. зоб | |||||||
| Кол-во узлов | % | Кол-во узлов | % | Кол-во узлов | % | χ 2 | р | ||
| Эхогенность | Гипоэхогенность | 40 | 71,4 | 18 | 40,0 | 164 | 38,4 | 7,711 | 0,021 |
| Изоэхогенность | 13 | 23,2 | 19 | 42,2 | 172 | 40,3 | 3,116 | 0,211 | |
| Гиперэхогенность | 2 | 3,6 | 2 | 4,4 | 33 | 7,7 | 1,069 | 0,447 | |
| Смешанная | 1 | 1,8 | 6 | 13,3 | 58 | 13,6 | 5,479 | 0,065 | |
| Итого: | 56 | 100 | 45 | 100 | 427 | 100 | |||
| Границы | Ровные | 24 | 42,9 | 42 | 93,3 | 366 | 85,7 | 8,077 | 0,018 |
| Неровные | 32 | 57,1 | 3 | 6,7 | 61 | 14,3 | 35,948 | 0,0001 | |
| Итого: | 56 | 100 | 45 | 100 | 427 | 100 | |||
| Контур | Четкий | 24 | 42,9 | 43 | 95,6 | 394 | 92,3 | 9,677 | 0,008 |
| Нечеткий | 32 | 57,1 | 2 | 4,4 | 33 | 7,7 | 63,644 | 0,0001 | |
| Итого: | 56 | 42,9 | 45 | 100 | 427 | 100 | |||
| Ободок | Ободок Halo | 6 | 10,7 | 14 | 31,1 | 45 | 10,5 | 10,944 | 0,004 |
| Нет | 50 | 89,3 | 31 | 68,9 | 382 | 89,5 | 1,163 | 0,559 | |
| Итого: | 56 | 100 | 45 | 100 | 427 | 100 | |||
| Структура | Однородная | 14 | 25,0 | 10 | 22,2 | 153 | 35,8 | 2,873 | 0,238 |
| Неоднородная | 42 | 75,0 | 35 | 77,8 | 284 | 66,5 | 18,376 | 0,0001 | |
| Итого: | 56 | 100 | 45 | 100 | 427 | 102,3 | |||
| Кальцинаты | Кальцинаты | 23 | 41,1 | 14 | 31,1 | 27 | 6,3 | 48,497 | 0,0001 |
| Нет | 33 | 58,9 | 31 | 68,9 | 400 | 93,7 | 5,297 | 0,071 | |
| Итого: | 56 | 100 | 45 | 100 | 427 | 100 | |||
| Жидкость | Жидкостные участки | 12 | 21,4 | 9 | 20,0 | 123 | 28,8 | 1,59 | 0,451 |
| Нет | 44 | 78,6 | 36 | 80,0 | 304 | 71,2 | 0,41 | 0,815 | |
| Итого: | 56 | 100 | 45 | 100 | 427 | 100 | |||
| Капсула ЩЖ | Нарушение капсулы ЩЖ | 7 | 12,5 | 0 | 0,0 | 0 | 0,0 | 53,14 | 0,0001 |
| Нет | 49 | 87,5 | 45 | 100 | 427 | 100 | 0,21 | 0,9 | |
| Итого: | 56 | 100 | 45 | 100 | 427 | 100 | |||
| I | 2 | 3,6 | 0 | 0,0 | 22 | 7,5 | 4,124 | 0,125 | |
| II | 3 | 5,4 | 2 | 4,4 | 76 | 25,8 | 14,533 | 0,0001 | |
| III с внутриузловой гиперваскуляри-зацией | 12 | 21,4 | 21 | 46,7 | 77 | 26,1 | 4,847 | 0,089 | |
| III с внутриузловой гиповаскуляри-зацией | 32 | 57,1 | 19 | 42,2 | 108 | 36,6 | 3,271 | 0,195 | |
| IV | 7 | 12,5 | 3 | 6,7 | 12 | 4,1 | 5,544 | 0,063 | |
| Итого: | 56 | 100 | 45 | 100 | 295 | 100 | |||
В процессе ультразвукового обследования пациентов с узловыми образованиями ЩЖ решали несколько диагностических задач, которые определяли дальнейшую хирургическую тактику, в том числе выбор объема операции. Главная из них – определение морфологической структуры обнаруженных очагов тиреоидной паренхимы. При обнаружении злокачественной патологии не менее важно было оценить стадийность заболевания, то есть распространение процесса за пределы ЩЖ. И наконец, в-третьих – выявление всех узловых образований в тиреоидной паренхиме, определение их размеров, пространственного расположения, дифференциация участков неизмененной паренхимы, подлежащих сохранению.
При обнаружении узловых образований в тиреоидной паренхиме в первую очередь дифференцировали их злокачественную или доброкачественную природу.
Ретроспективный анализ показал, что в наших наблюдениях рак ЩЖ чаще встречался при множественном узловом поражении ЩЖ (в 62,5% случаев) и присутствовал в одном или нескольких узлах при многоузловом зобе. Одиночные раковые узлы выявлены в 21 случае (37,5%). Вместе с тем частота встречаемости рака ЩЖ в общей структуре моно- и полинодозного поражения ЩЖ практически не различалась и составляла соответственно 28,6%, и 19,9% (различия статистически не значимы, критерий χ 2 =0,912, р=0,340).
Одновременно несколько раковых очагов в одной или обеих долях гистологически верифицированы у 7 (14,3%) пациентов (у 2 в одной доле и у 5 в обеих долях (рис. 3)), причем в 2 случаях в виде микрофокусов до 3-5 мм в диаметре. В этих 2 наблюдениях (4,1% больных) микрофокусы злокачественных новообразований были предположены при УЗИ и определялись в виде гипоэхогенных участков неправильной формы с неровными контурами, размерами 4-5 мм в диаметре, расположенных в непосредственной близости с «основным» раковым узлом (рис. 4). В остальных 5 наблюдениях дополнительные злокачественные новообразования в тиреоидной паренхиме при УЗИ найдены не были.
Рисунок 3. Узлы папиллярного рака (белые стрелки) в правой доле и левой доле ЩЖ.
Рисунок 4. Узел папиллярного рака (двусторонняя стрелка)
и микрофокус рака (белая стрелка и пунктирные маркеры).
По морфологическому строению преобладали высокодифференцированные раки: 58,9% узлов соответствовали папиллярной карциноме, 26,8% – фолликулярной карциноме. Солидный (папиллярный и фолликулярный) рак встретился в 7,1% узлов, медуллярный – в 5,4% и недифференцированный – в единичном наблюдении (1,8%). В 10 наблюдениях (20,4%, 10/49) раку ЩЖ сопутствовал аутоиммунный тиреоидит с выраженными диффузно-псевдоузловыми изменениями паренхимы ЩЖ, а у 3 (6,1%, 3/49) больных рак ЩЖ сочетался с фолликулярными аденомами.
Стадия Т1-2 верифицирована у 33 (67,3%) больных, Т3 – у 7 (14,3%), Т4 – у 9 (18,4%). Лимфогенное метастазирование на стороне поражения обнаружено у 10,2% пациентов. Отдаленные метастазы в кости скелета были выявлены у одного больного (2,0%).
Раковые узлы несколько чаще локализовались в средней трети долей (42,9% узлов), реже в верхнем полюсе (25,0%), в нижней трети (17,9%) и в перешейке (14,2%) (критерий χ 2 =8,220, р=0,0540). И, как уже отмечалось, практически 1/3 узлов (28,6%) составили очаги менее 10 мм в диаметре (табл. 1, 2).
По сравнению с доброкачественными образованиями для раковых узлов были характерны следующие эхографические признаки: гипоэхогенность узла (71,4%), неоднородность структуры (75,0%), нечеткие неровные контуры (51,7%), более высокая встречаемость микрокальцинатов (41,1%) (таблица 3, рис. 5) Такие признаки были выявлены у 67,9% злокачественных очагов. При узлах менее 20 мм в диаметре «типичное» ультразвуковое изображение рака ЩЖ встретилось в 78,8% наблюдений, а при более крупных узлах (свыше 20 мм в диаметре) – лишь в 36,4%.
Рисунок 5. Узел папиллярного рака (двусторонняя стрелка).
«Типичное» ультразвуковое изображение злокачественного узла ЩЖ.
В 32,1% случаев определялось иное ультразвуковое изображение ракового узла, больше соответствующее коллоидному зобу (рис. 6) или аденоме (рис. 7). Такое «нетипичное» ультразвуковое изображение рака ЩЖ чаще выявлялось среди узловых образований размерами свыше 20 мм в диаметре (52,4%), а также среди фолликулярных аденокарцином, при солидных раках и в случае низкодифференцированного рака ЩЖ. Установлению правильного диагноза в этих случая на дооперационном этапе особенно помогала тонкоигольная аспирационная биопсия.
Рисунок 6. Узел папиллярного рака ЩЖ (двусторонняя стрелка). «Нетипичное»
ультразвуковое изображение злокачественного узла ЩЖ. Панорамное сканирование.
Рисунок 7. Узел папиллярного рака ЩЖ (двусторонняя стрелка). «Нетипичное»
ультразвуковое изображение злокачественного узла в перешейке ЩЖ.
Изучение сосудистого рисунка узловых образований тиреоидной паренхимы не способствовало значимому повышению результативности УЗИ в дифференциальной диагностике рака среди других узловых образований ЩЖ (табл. 4).
Таблица 4. Сравнение информативности серошкального УЗИ
и УЗИ с использованием цветокодирующих методик
| Показатели | Серошкальное УЗИ | Серошкальное УЗИ + цветокодирующие методики | Значения критерия z |
|---|---|---|---|
| Чувствительность | 62,5% | 64,3% | 0.002, р=0.942 |
| Специфичность | 84,5% | 87,7% | 1.327, р=0.185 |
| Точность | 82,2% | 85,2% | 1.336, p=0.216 |
| Прогностическая ценность положительного результата | 32,4% | 38,3% | 0.817, р=0.414 |
| Прогностическая ценность положительного результата | 95,0% | 95,4% | 0.248, р=0.808 |
Для большинства (78,5%) раковых узлов была характерна смешанная перинодулярная и внутриузловая ангиоархитектоника с преобладанием внутриузловой гиповаскуляризации, что не отличало их от трети коллоидных узлов и половины аденом (табл. 3, рис. 8). Рассчитанный критерий χ 2 для частоты встречаемости III типа сосудистого рисунка среди раков, аденом и узловых коллоидных узлов составил χ 2 =2,790, р=0,248.
Рисунок 8. Узел папиллярного рака ЩЖ (двусторонняя стрелка).
Сосудистый рисунок узла в режиме ЦДК (слева) и ЭД (справа).
Отсутствие васкуляризации в раковых узлах встретилось лишь в 2 наблюдениях (3,6%) при узлах менее 10 мм в диаметре. Невозможность визуализации их ангиоархитектоники объяснялась наличием кальцинатов, которые частично (рис. 9) или практически полностью выполняли очаги.
Рисунок 9. Аваскулярный узел папиллярного рака (стрелка)
с кальцинатами в структуре. Сканирование в режиме ЭД.
Аваскулярные узловые образования нередко встречались среди коллоидных пролиферирующих узлов (в 7,5% случаев), но это, как правило, были мелкие узелки диаметром не более 6-7 мм. Несмотря на отсутствие значимых различий, среди злокачественных новообразований чаще, чем среди коллоидных узлов и аденом, выявлялись очаги с отсутствием перинодулярной васкуляризации (IV тип сосудистого рисунка). В таких узлах в режимах ЦДК (ЭД) регистрировался внутриузловой, как правило, малоинтенсивный кровоток с отдельными внутриузловыми «обрубленными» и хаотично расположенными сосудами (рис. 10). В этих случаях применение 3-мерной реконструкции сосудистого рисунка (режим 3D-ангио) способствовало уточнению ангиоархитектоники узла, наличия, хода, выраженности и взаиморасположения узловых сосудов (рис. 11).
Рисунок 10. Скудная внутриузловая васкуляризация узла папиллярного рака
(двусторонняя стрелка) (IV тип сосудистого рисунка). Сканирование в режиме ЭД.
Рисунок 11. Сосудистый рисунок узла папиллярного рака (двусторонние стрелки)
в режиме ЭД (слева) и в режиме 3D-ангио.
Несмотря на отсутствие значимого повышения информативности УЗИ с использованием доплеровских методик в дифференциальной диагностике узловых образований различного морфологического строения, результаты ЦДК, ЭД, 3-мерной реконструкции сосудистого рисунка (режим 3D-ангио) следует учитывать при интерпретации ультразвукового изображения любого внутрипаренхиматозного очага. В случае выявления узлового образования только с внутриузловой васкуляризацией (IV тип сосудистого рисунка) и хаотичным дезорганизованным ходом сосудов с большой долей вероятности можно предполагать злокачественную природу узла, особенно при наличии «серошкальных ультразвуковых признаков злокачественности». При получении сосудистого рисунка с перинодулярной и внутриузловой васкуляризацией (III тип) дифференцировать рак, аденому и коллоидный узел при сходной серошкальной картине сложно. Вместе с тем, перинодулярная и внутриузловая гиперваскуляризация с правильным равномерным «спицеобразным» ходом сосудов чаще (в наших наблюдениях в половине случаев) соответствует аденоме (рис. 12). Таким образом, несмотря на то, что цветовое картирование существенно не повышает информативности ультразвуковой диагностики узловых образований щитовидной железы, это исследование является, на наш взгляд, необходимым не только для полноты характеристики обнаруженных образований, но и для корректного проведения обязательной пункционной биопсии.
Рисунок 12. Сосудистый рисунок аденомы ЩЖ в режиме 3D-ангио.
Анализируя сосудистый рисунок выявленных узловых образований, мы обратили внимание, что степень васкуляризации узлов в большей степени определялась размером узла, а не его морфологической структурой (табл. 5).
Таблица 5. Зависимость васкуляризации узловых образований от размеров узлов
| Тип сосудистого рисунка | Размеры узловых образований в мм | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ≤ 10 | от 11 до 20 | от 21 до 30 | от 31 до 40 | > 40 | Всего | |||||||
| Кол-во | % | Кол-во | % | Кол-во | % | Кол-во | % | Кол-во | % | Кол-во | % | |
| I | 23 | 18,1 | 1 | 0,9 | 0 | 0,0 | 0 | 0,0 | 0 | 0,0 | 24 | 6,1 |
| II | 48 | 37,8 | 22 | 20,6 | 7 | 8,4 | 2 | 4,9 | 2 | 5,3 | 81 | 20,5 |
| III с внутриузловой гиперваскуляризацией | 15 | 11,8 | 42 | 39,3 | 30 | 36,1 | 12 | 29,3 | 11 | 28,9 | 110 | 27,8 |
| III с внутриузловой гиповаскуляризацией | 31 | 24,4 | 35 | 32,7 | 45 | 54,2 | 25 | 61,0 | 23 | 60,5 | 159 | 40,2 |
| IV | 10 | 7,9 | 7 | 6,5 | 1 | 1,2 | 2 | 4,9 | 2 | 5,3 | 22 | 5,6 |
| Итого | 127 | 100 | 107 | 100 | 83 | 100 | 41 | 100 | 38 | 100 | 396 | 100 |
| значения χ 2 значения р | 28,241 0,0001 | 49,128 0,0001 | 75,567 0,0001 | 39,884 0,0001 | 36,059 0,0001 | |||||||
Так, среди мелких узлов (менее 10 мм в диаметре) преобладали (63,8%) узлы со скудной васкуляризацией (II или IV типа) или аваскулярные очаги. С увеличением размеров узлов уменьшалась частота встречаемости скудно васкуляризированных образований (с 36,2% при размерах менее 10 мм до 9,8% и 10,6% при размерах очагов свыше 30 и 40 мм). Кроме того, среди образований мелкого и среднего калибра (до 20 мм) с III типом сосудистого рисунка в наших наблюдениях встречались преимущественно узлы с внутриузловой гиперваскуляризацией, а среди более крупных (свыше 20 см и особенно свыше 40 мм в диаметре) – с интранодулярной гиповаскуляризацией.
В общей сложности на дооперационном этапе обследования информативность УЗИ в диагностике злокачественных опухолей ЩЖ составила: чувствительность – 63,4%, специфичность – 87,7%, точность – 85,2%, прогностическая ценность положительного результата – 38,3%, прогностическая ценность отрицательного результата – 95,4%. Информативность УЗИ во многом зависела от размеров опухоли, акустической структуры опухолевого узла, распространенности процесса, количества узлов, наличия синхронных поражений ЩЖ. Так, чувствительность УЗИ при выявлении рака при одиночном и многоузловом поражении составляла соответственно 85,7% против 51,4% (различия статистически значимы, z=2,305, р=0,021). Преобладание в наших наблюдениях пациентов с множественными узловыми образованиями ЩЖ (62,5% против 37,5%), высокая встречаемость «нетипичного» ультразвукового изображения ракового узла (32,1%), большое количество (41,0%) крупных узлов диаметром свыше 2 см объясняли недостаточно высокую чувствительность УЗИ в дифференциации злокачественной патологии ЩЖ. Существенному повышению результативности диагностики рака ЩЖ способствовали тонкоигольные аспирационные биопсии (ТАБ) подозрительных узлов с цитологическим исследованием пунктата. При сочетании УЗИ и ТАБ чувствительность метода возросла до 83,9%, специфичность – до 90,9%, точность – до 89,8%, прогностическая ценность положительного результата – до 62,7%, прогностическая ценность отрицательного результата – до 96,9%.
В случае обнаружения подозрительного в плане злокачественности очага в паренхиме ЩЖ возможностями УЗИ определяли распространенность опухолевого процесса, обращая внимание на нарушение целостности капсулы ЩЖ, наличие измененных лимфоузлов. Дополнительно проводили ультразвуковое обследование других органов и систем (печень, почки), учитывая возможность отдаленного метастазирования.
При исследовании всех образований, а особенно с прикапсульной локализацией и подозрительных на малигнизацию, в обязательном порядке изучали целостность капсулы ЩЖ. Среди заподозренных при УЗИ раках ЩЖ нарушения целостности капсулы в виде неровности, «смазанности» и прерывистости ее контура выявлено у 7 больных с раком ЩЖ (рис. 13).
Рисунок 13. Нарушение целостности капсулы ЩЖ (стрелки)
с инвазией опухоли (двусторонняя стрелка) в прилежащие мышцы.
Измененные лимфоузлы в зонах регионарного лимфооттока найдены при УЗИ у 19 пациентов с раковыми узлами в тиреоидной паренхиме. В 3 наблюдениях ультразвуковое изображение пораженных лимфоузлов очень походило на эхографическую картину ракового узла в ЩЖ. Лимфоузлы были гипоэхогенные, с ровным или неровным четким контуром, ближе к округлой форме, с соотношением длины к ширине Вверх