вариантная анатомия цмб что это
Вариантная анатомия цмб что это
Актуальность. Своевременное выявление индивидуальных изменений в области непарных висцеральных ветвей брюшной аорты позволит диагностировать вариативность ветвления чревного ствола и определить наиболее эффективные пути оперативного вмешательства.
Цель исследования. Целью исследования послужило изучение вариантов анатомии чревного ствола (ЧС) у детей.
Введение. Вариантная анатомия сосудистой системы, изучение особенностей артериального русла в детском возрасте представляет в современной медицине актуальную анатомическую и хирургическую проблему.
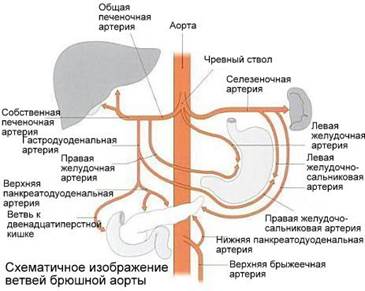
Анатомически строение чревного ствола выглядит следующим образом (рисунок).
Анатомическое строение чревного ствола [1]
— левую желудочную артерия (лат. a. gastrica sinistra) (ЛЖА): она отходит к малой кривизне желудка;
— общую печеночную артерию (лат. a. hepatica communis) (ОПА), которая отходит к двенадцатиперстной кишке, далее в печеночно-двенадцатиперстной связке в общий желчный проток; в желудочно-двенадцатиперстной артерии берут начало две ветви: верхняя поджелудочно-двенадцатиперстная (лат. a. pancreatoduodenalis superior), направляющаяся к большой кривизне желудка, и правая желудочно-сальниковая артерия (лат. a. gastroepiploica dextra) в форме группы небольших стволов разветвляется в поджелудочной железе и в двенадцатиперстной кишке;
— селезеночную артерию (лат. a. lienalis) (СА): она отходит к селезенке, имея две ветки к поджелудочной железе; у ворот селезенки от нее отделяется левая желудочно-сальниковая артерия (лат. a. gastroepiploica sinistra).
По опыту исследований А.F. Aburahma, F.G. Bech, G.L. Moneta, в клинической практике диагноз «синдром компрессии чревного ствола» является редкостью. Согласно A.J. Holland, E.G. Ibach, выявление новых случаев способствует углублению знаний посредством полного обследования больных и более длительных сроков наблюдения до и после операции.
Патофизиологические механизмы компрессии ЧС, которые могли бы объяснить происхождение его клинических симптомов, до сих пор в полной мере не раскрыты и являются предметом обсуждения. При этом наибольшее значение авторами А.В. Покровским, S.A. Marable уделено гемодинамическому и нейрогенному факторам, поскольку возникновение компрессии ЧС связано со сдавлением ЧС срединной дугообразной связкой диафрагмы и нейрофиброзной тканью чревного сплетения.
В исследованиях L. Arcari, М. Karla, C.S. China отмечается, что симптомокомплекс в каждом конкретном случае отличается неоднозначностью, поэтому проследить истинную взаимосвязь нарушений ЧС с ишемией органов пищеварения является проблематичным. А. Марстон, R.A. Baum указывают на необходимость дополнительного обследования артериального давления (АД) и кровотока в ЧС для более детального изучения особенностей нарушений ЧС.
Особое внимание уделяется средствам диагностики нарушений ЧС. По мнению L. Arcari, дуплексное сканирование представляется недостаточным в определении причины стеноза ЧС. Вместе с тем С.О. Ромашин считает, что данных, полученных в ходе дуплексного сканирования, вполне достаточно для диагностики экстравазальной компрессии ЧС.
По мнению G.L. Moneta, установление показаний для операции у больных с синдромом ЧС при наличии сопутствующих заболеваний вызывает определенные трудности.
По мнению А. Марстона, R.A. Baum, ангиография и ультразвуковое сканирование являются только средствами для выявления нарушений непарных висцеральных артерий. Авторы едины во мнении, что причины возникновения нарушений ЧС можно выявить в рамках обследования посредством ангиографии.
Таким образом, согласно проведенному теоретическому исследованию, наблюдаются расхождения во взглядах на нарушения ЧС ввиду неопределенности в изучении причин нарушения ЧС, отсутствия четких показаний к операционному вмешательству, а также из-за противоречивых результатов, что свидетельствует о необходимости дальнейшего и углубленного его изучения.
В детском возрасте причины и симптомокомплекс нарушений ЧС и его причин у детей изучали Л.А. Звенигородская, А.И. Канаев, И.А. Комиссаров, Г.И. Кунцевич, А.В. Покровский, L. Arcari, G.L. Moneta, T. Scholbach и др.
А.В. Покровский указывал на необходимость изучения не только симптомов, причин нарушений в работе ЧС, но и на необходимость анатомического изучения особенностей строения ветвей ЧС [4].
По мнению Г.И. Кунцевича, работа ЧС связана с вариативностью скоростных показателей кровотока [5].
S. Scovell, A. Hamdan в своих исследованиях предположили, что симптомы у пациентов с нарушениями ЧС могут быть связаны не с кровотоком, а скорее всего с вовлечением нервного сплетения, которое лежит в той же области, что и диафрагмальные волокна [2].
Л.А. Звенигородская исследовала пациентов детского возраста с нарушениями ЧС. По результатам исследований, внутрисосудистое поражение непарных висцеральных ветвей брюшного отдела аорты вызвано экстравазальной компрессией ЧС под воздействием серповидной связки диафрагмы.
Исследования И.А. Комиссарова показали, что боли в животе свидетельствуют о нарушениях в работе ЧС, причинами которых являются экстравазальное воздействие дугообразной связки диафрагмы, внутренних ее ножек, а также сдавление нейрофиброзной тканью чревного сплетения [6].
Исследования А.И. Канаева подтверждают, что у пациентов с гемодинамическими нарушениями в чревном стволе выявлены заболевания желудка, двенадцатиперстной кишки, поджелудочной железы. Автор выявил, что нарушения кровотока в чревном стволе обусловлены гемодинамическими факторами, которые влияют на возникновение: а) изолированного стеноза ЧС; б) изолированного стеноза ЧС и нарушения кровотока в ВБА; а также патогенетическими факторами, имеющими в своей основе механическое раздражение срединной дугообразной связкой диафрагмы и пульсовую волну чревного сплетения [7].
Исследования Jansen H., Willenborg основаны на генетико-эпидемиологическом анализе ЧС. Авторы выявили взаимосвязь между нарушением кровотока в ЧС и ишемической болезнью сердца [8].
Sun Z., Fritz D., Turner S. рассматривали клинические случаи возникновения абдоминальной ишемической болезни. Согласно результатам исследования нарушения в работе ЧС сопровождаются хронической болью в животе, потерей веса и ведут к поражению брюшной аорты и чревного ствола, верхней и нижней брыжеечных артерий [9].
Таким образом, неоднозначные результаты проведенных исследований позволяют сделать вывод о необходимости изучения анатомии вариантов ветвления ЧС еще в детском возрасте.
Материалы и методы исследования. Исследование проходило на базе БУ «Республиканская детская клиническая больница» МЗ ЧР с 2016 по 2018 год. За этот период на обследовании находилось 128 детей в возрасте от 5 до 13 лет, обратившихся за медицинской помощью с болями в животе. В 87 случаях абдоминальный синдром был хронический и носил приступообразный характер. В 63 случаях боли локализовались в эпигастральной области. Кроме болевого синдрома наблюдались и нейровегетативные расстройства в виде астении, головной боли, головокружения и парестезии верхних конечностей. В клинике всем детям было проведено комплексное обследование.
Диагностика осуществлялась посредством сбора данных анамнеза, жалоб пациентов, определен характер и локализация болей. Далее проводилось ультразвуковое исследование в режиме импульсно-волнового доплера.
Обследование проходило посредством МСКТ–ангиографии: использование 16–срезового спирального компьютерного томографа с внутривенным контрастированием ЧС позволило изучить варианты ветвления ЧС. В ходе ангиографии пациентам выполнялась катетеризация верхней брыжеечной артерии (ВБА) посредством введения пробного контрастного вещества с целью определения наличия дополнительных артерий. Далее проводилось контрастирование ЧС и выполнялась серия снимков.
На основании полученных данных были определены варианты ветвления ЧС, наличие дополнительных артерий.
Результаты исследования и их обсуждение. При анализе теоретических источников по данной проблеме авторами выделяются следующие варианты ветвления чревного ствола:
— классический вариант ветвления ЧС: отхождение селезеночной артерии (СА), левой желудочной артерии (ЛЖА), общей печеночной артерии (ОПА) (25-92%) [5];
— ЧС имеет 2 ветви: СА и ОПА (2%), при этом ЛЖА отходит от аорты [2];
— ЧС имеет 2 ветви: СА и ЛЖА (2,5-5%), при этом ОПА отходит от ВБА [4];
— ЧС отсутствует, все ветви отходят от брюшной аорты (0,43-32%) [3];
— ЧС состоит из 4 ветвей: дополнительная правая печеночная артерия или дополнительная левая печеночная артерия отходит от ЧС (0,2-5%) [4].
У исследуемой группы детей поводом для обращения за медицинской помощью послужила боль в животе, которая является основным симптомом экстравазальной компрессии чревного ствола. В ходе диагностики были собраны данные анамнеза, описание жалоб, а также результаты УЗИ (импульсно-волновой доплер), МСКТ-ангиографии с внутривенным контрастированием ЧС.
Локализация боли у данной группы детей оказалась различной: в эпигастральной, в подреберье, внизу живота, в подвздошной области. Характер также отличался: от постоянной тупой, ноющей до острой приступообразной боли.
У исследуемых пациентов обнаруживались следующие симптомы: боль внизу живота (100%) с различной локализацией: эпигастральная (28%), внизу живота (31%), в подвздошной области (41%).
В ходе сбора анамнеза установлено, что болевые ощущения у детей усиливались после приема пищи (100% пациентов), при занятиях спортом (40% пациентов) или в состоянии стресса (20% пациентов).
После приема пищи боль возникала спустя 20-25 мин. (42% пациентов), ее появление находилось в прямой зависимости от количества и качества съеденного: больные зачастую начало приступа отмечали после употребления в пищу острой, сладкой, слишком холодной пищи (48% пациентов) или ее больших объемов (10% пациентов).
При описании жалоб было установлено, что не менее часто вызывают приступы боли и физические усилия (62% пациентов), особенно при длительном неудобном положении (13% пациентов), а также при продолжительных спортивных нагрузках (25% пациентов). Совместно эти два фактора увеличивают риск развития болевого синдрома, особенно при наличии психоэмоционального стресса.
Тенденция к длительной потере веса сохранялась у 40% пациентов детского возраста.
Всем пациентам был поставлен диагноз «стеноз ЧС».
Заключение. В ходе исследования был выявлен классический вариант ветвления чревного ствола у 21% пациентов.
Классический вариант ветвления характеризуется отхождением от передней поверхности абдоминальной аорты и делением на 3 ветви (ЛЖА, СА и ОПА). ЛЖА идет к малой кривизне желудка, ОПА – к воротам печени, распадаясь на 2 ветки (левую и правую). СА идет влево к селезенке.
Вариантная анатомия цмб что это
Изучение вариантной анатомии человека является актуальным направлением современной морфологии. В настоящее время вмешательства на артериях широко осуществляются в диагностических и в лечебных целях. Увеличение числа оперативных вмешательств, в том числе эндоскопических, на органах малого таза и нижних конечностях предъявляет повышенные требования к знанию вариантов строения ветвей внутренней подвздошной артерии и ее коллатералей.
Внутренняя подвздошная артерия поставляет большую часть крови для внутренних органов таза, а именно, прямой кишки, мочевого пузыря, предстательной железы и семенных пузырьков у мужчин, матки у женщин, костно-мышечной части таза. Также она отдает ветви в ягодичную область, медиальную область бедра и промежность [4]. Изучение анатомии внутренней подвздошной артерии важно не только для анатомов, но и для хирургов, акушеров-гинекологов, урологов, сосудистых хирургов и радиологов. Двусторонняя перевязка внутренней подвздошной артерии является наиболее эффективным способом остановки маточного кровотечения, позволяющим избежать гистерэктомии. Трудноразрешимые кровотечения при трансуретральной резекции простаты можно контролировать с помощью перевязки внутренней подвздошной артерии, когда невозможно определить кровоточащий сосуд. Эндоваскулярная артериальная эмболизация опухолей таза является эффективным методом остановки кровотечения, получившим на сегодняшний день широкое применение, так как является минимально инвазивной техникой.
Тяжелым и часто летальным осложнением при травмах таза является артериальное кровотечение из ветвей внутренней подвздошной артерии, а именно: латеральных крестцовых, подвздошно-поясничной, запирательной, артерии мочевого пузыря и нижней ягодичной артерии [3]. Хирурги должны быть готовы к неожиданному кровотечению, источником которого является аберрантная запирательная артерия, во время операций по поводу паховых или бедренной грыж и принять соответствующие меры предосторожности, чтобы избежать повреждения этих сосудов.
В специализированных литературных источниках приводятся противоречивые данные о вариантах отхождения магистральных сосудов из бассейна внутренней подвздошной артерии [2]. Отсутствие точных сведений о вариантной анатомии артерий таза затрудняет поиск последних во время оперативных вмешательств с целью их перевязки для остановки кровотечений, возникающих при ранениях и травмах различной этиологии, при восстановительных, органосохраняющих операциях, а также при пересадке почки. Следует отметить, что в литературе описание большинства внутритазовых артериальных анастомозов ограничивается только констатацией наличия того или иного соустья, например, «корона смерти» – анастомоз между запирательной артерией и нижней надчревной артерией [5, 12]. При этом не указывается частота, с которой встречаются эти анастомозы, и не предоставляются их морфометрические характеристики. Среди тех, кто занимался изучением внутренней подвздошной артерии, следует отметить таких исследователей, как Quain, 1908, Kosinski, 1929, Testut,1948, Adachi, 1928, Roberts и Krishinger, 1967. В своих работах они изучали как морфометрию, так и типы ветвления внутренней подвздошной артерии.
Целью данной работы является расширить знания об особенностях строения ветвей внутренней подвздошной артерии, их топографии, вариантной и возрастной анатомии с позиций виртуальных технологий в медицине, тем самым способствовать улучшению результатов оперативных вмешательств на органах малого таза.
Материалы и методы исследования
Изучение вариантной и клинической анатомии ветвей внутренних подвздошных артерий включало в себя три раздела: морфологический, клинический и метод математического моделирования и виртуализации.
Морфологические методы исследования
Морфологические методы исследования проводились в несколько этапов: анатомическая препаровка, полимерное бальзамирование и морфометрия анатомического материала ветвей внутренних подвздошных артерий.
Основным назначением данного этапа являлось:
Методика анатомической препаровки
Исследовали 50 трупов людей. Магистральные артерии и их анастомозы выделяли справа и слева, что составляло 100 случаев. Трупов мужчин было 32, женщин – 18. Возраст умерших варьировался от 30 до 75 лет. Исследования проводили на базе кафедры оперативной хирургии и клинической анатомии с курсом инновационных технологий и Самарского областного бюро судебно-медицинской экспертизы. Во всех случаях изучались протоколы патолого-анатомического исследования трупа для отбора материала по причинам смерти, не оказывающим прямого воздействия на сосудистое русло бассейна внутренней подвздошной артерии.
Полимерная бальзамация анатомического препарата
Для изучения архитектоники ветвей внутренней подвздошной артерии на базе Научно-образовательного центра «Полимерное бальзамирование в медицине» СамГМУ изготавливали препараты с помощью полимерного бальзамирования по методике, разработанной И.В. Гайворонским, С.П. Григоряном (2000 г.). Данная методика заключается в замещении воды и липидов из биологических тканей силиконовым полимером, придающим органам уникальные свойства, а именно, сохранение естественной формы, размеров и топографо-анатомических взаимоотношений сосудисто-нервных структур.
Морфометрия анатомического препарата с использованием инъекционного метода
Методика морфометрии анатомического препарата включала в себя непосредственное измерение длины и диаметра сосудов бассейна внутренней подвздошной артерии во время анатомической препаровки, а также инъекция артериального русла окрашенной двухкомпонентной отвердевающей силиконовой массой для последующего препарирования. Готовая инъекционная смесь вводилась с помощью шприца в катетеризованную внутреннюю подвздошную артерию. Для улучшения полимеризации силиконовой смеси в кровеносном русле препарат помещался на 12 часов в воду, температура которой была 40–50 °С. После застывания силиконовой композиции осуществлялось препарирование сосудов малого таза.
Морфометрические исследования, проведенные на препаратах, инъецированных силиконовой смесью, не давали усадки. При этом полученные морфометрические данные соответствовали внутреннему диаметру артерий.
Клинические методы исследования
Клиническое исследование основывалось на анализе результатов различных видов исследований сосудов, таких как рентгеноконтрастная ангиография, ультразвуковое дуплексное сканирование с цветным картированием и мультиспиральная компьютерная томография.
Для исследования отбирались пациенты в возрасте от 20 до 50 лет без патологий, оказывающих прямое воздействие на сосудистое русло бассейна внутренней подвздошной артерии. Больные исследовались на базе Клиник Самарского государственного медицинского университета и Самарской областной клинической больницы.
Метод математического моделирования и виртуализации
Для математического моделирования и создания трехмерной модели сосудистого русла бассейна внутренней подвздошной артерии применялось сканирование отпрепарированных тазовых областей 3D-сканером Solutionix Regscan III с последующей обработкой отсканированных объектов с помощью 3D-редакторов Autodesk 3dsMax и Autodesk Maya.
3D-сканер Solutionix Rexcan III – это оптическая 3D измерительная система с высоким разрешением (до 5 Мп) и точностью (0,007 мм), с низкими показателями зашумления. Rexcan III использует двойные камеры и технику фазового сдвига, широко применяемую в высокотехнологичных сканерах класса high-end, для получения результата лучшего качества на более высокой скорости [9].
На отпрепарированный биологический материал и область вокруг него устанавливались метки совмещения, регистрируя которые 3D-сканер формирует единую систему координат и таким образом может производить оцифровку объекта. Фиксированное расположение маркеров, создающих единую систему координат, позволяет оператору перемещать сканер во время процедуры регистрации поверхности сложной формы, что дает возможность получения полных трехмерных копий без дополнительной сборки-сшивки отдельных элементов.
При сканировании однородных поверхностей данный прибор дает хорошее качество сетки трехмерной модели. Настройка производится в программном обеспечении устройства за счет изменения объема виртуального куба, в котором происходит регистрация трехмерных координат поверхности объекта. Точность лазерного сканера составляет 100 микрон. С целью получения точных электронных копий отпрепарированных сосудов бассейна внутренней подвздошной артерии мы воспользовались общим алгоритмом работы с бесконтактным оптическим 3D-сканером и разработали методику сборки и обработки данных 3D-сканирования сосудов человека. Производилась регистрация маркеров 3D-сканером, после чего задавались в программном обеспечении величины разрешения сканирования в соответствии с характеристиками сканируемой поверхности сосудов.
Затем проводился процесс непосредственного сканирования поверхностей сосудов, в результате чего было получено необходимое количество сканов. В дальнейшем элементы сессии сканирования были экспортированы в программу для ЭВМ ezScan 7, что позволило перейти к обработке полученного материала.
Для того чтобы получить единые электронные копии объектов сложной формы (в данном случае, сосудистое русло бассейна внутренней подвздошной артерии), была необходима и проводилась сборка «сырого» материала, т.е. совмещались воедино набранные количества сканов ветвей внутренней подвздошной артерии в программном обеспечении ezScan7 с последующей обработкой моделей в редакторах Autodesk 3ds Max и Autodesk Maya.
В области компьютерной графики одной из наиболее важных задач является получение реалистичного и правдоподобного конечного изображения. Основным критерием фотореалистичности и правдоподобности трехмерного изображения является точное отображение освещения, теней, отражающих и поглощающих свойств материалов объектов. Визуализация является заключительным этапом работы над моделируемой сценой. На этом этапе компьютер превращает математическую модель сцены в форму, доступную для визуального восприятия.
Результаты исследования и их обсуждение
Первая попытка сгруппировать варианты отхождения пристеночных ветвей внутренней подвздошной артерии в определенные типы была предпринята Jastschinski (1891). Он обнаружил, что только сосуды одной группы отличаются достаточно регулярным ветвлением, чтобы объединить их в типы, которых он выделял четыре.
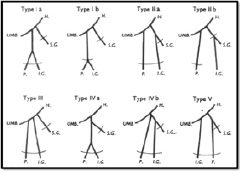
Adachi (1928) внес некоторые изменения в данный метод, добавив пятый тип и определенные подтипы, изучая внутреннюю подвздошную артерию и ее ветви у японцев. Его схема выглядит следующим образом (рис. 1).
Рис. 1. Типы Adachi. Н – внутренняя подвздошная артерия, I.G. – нижняя ягодичная артерия, P – внутренняя половая артерия, S.G. – верхняя ягодичная артерия, UMB – пупочная артерия
Тип I: Верхняя ягодичная артерия отходит отдельно от внутренней подвздошной артерии и отходящих общим стволом нижней ягодичной и внутренней половой артерий.
Тип III: Три ветви возникают отдельно от внутренней подвздошной артерии.
Тип IV: Три артерии возникают общим стволом. Книзу верхняя ягодичная и внутренняя половая артерии отделяются от общего ствола. В типе Iva первой отходит верхняя ягодичная артерия, а затем выделяют бифуркацию нижней ягодичной и внутренней половой артерий. В типе IVb внутренняя половая артерия является первым сосудом, отходящим от общего ствола, который затем делится на верхнюю и нижнюю ягодичные артерии.
Тип V: Внутренняя половая и верхняя ягодичная артерии отходят общим стволом, а нижняя ягодичная отдельно.
В данном исследовании мы ориентировались на классификацию Adachi. В результате исследований распределение типов было следующим: тип I – 42 %, тип II – 10 %, тип III – 38 %, тип IV – 8 %, тип V – 2 %.
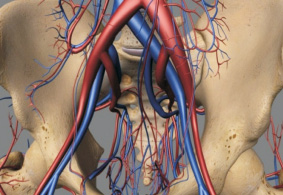
Были построены виртуальные модели наиболее часто встречаемых типов ветвления внутренней подвздошной артерии (рис. 2, 3).
Рис. 2. Виртуальное моделирование бассейна внутренней подвздошной артерии
Рис. 3. Виртуальная модель внутренней подвздошной артерии
Трехмерные модели позволят оценить клиническое и хирургическое значение выявленных закономерностей в вариантной анатомии ветвей внутренней подвздошной артерии [11].
Данная работа легла в основу принципов компьютерного моделирования органных структур при реализации проекта «Создание аппаратно-программного комплекса «Виртуальный хирург» для 3D моделирования операционного процесса и учебно-методических модулей для системного обучения врача-хирурга методикам открытой хирургии с небольшим размером операционного поля, методикам эндоваскулярной хирургии и эндоскопической хирургии на этапах додипломного и последипломного образования», проект реализуется при финансовой поддержке Министерства образования и науки Российской Федерации.
Знание анатомии, топографии, ориентации и синтопии ветвей внутренней подвздошной артерии могут помочь в остановке кровотечения, а также избежать таких серьезных осложнений, как пересечение подвздошных вен и лигирование наружной подвздошной артерии (Naveen N.S. и соавт., 2011). Эти исследования помогут в практической работе хирургам общего профиля, сосудистым хирургам, а также радиологам при эндоваскулярной катетеризации для внутриартериальной химиотерапии и эмболизации опухолей малого таза.
Рецензенты:
Суворова Г.Н., д.б.н., профессор, заведующая кафедрой анатомии человека, ГБОУ ВПО «Самарский государственный медицинский университет Минздрава России», г. Самара;
Волова Л.Т., д.м.н., профессор, директор НИИ «Институт экспериментальной медицины и биотехнологий», ГБОУ ВПО «Самарский государственный медицинский университет Минздрава России», г. Самара.