вакцина на основе аденовируса человека что это
Время первых: как аденоассоциированные вирусы стали лучшими в доставке генов in vivo
Очевидные преимущества AAV: эффективность, безопасность и разнообразие терапевтических применений. Но есть и недостатки: ограниченная емкость (большие гены в него просто не влезут), иммуногенность (нейтрализуются антителами), ограниченный природный тропизм (могут доставлять гены не во все типы клеток).
Автор
Редакторы
Генная терапия стремительно врывается в нашу жизнь, а ведь еще вчера она казалась будто сошедшей со страниц научной фантастики. Сегодня же упоминание вирусных векторов для доставки генов стало обыденным: они вовсю используются создателями вакцин от COVID-19, а профилактическая вакцинация такими препаратами совсем скоро должна стать повсеместной.
Однако занятно другое: на переднем крае создания генных продуктов оказался один маленький вирус, который и полноценным патогеном-то назвать сложно: самостоятельно размножаться он не умеет. Речь об аденоассоциированном вирусе (AAV), векторы на основе которого стали ныне популярным средством доставки лечебных генов в клетку.
О необычайной судьбе этих обладающих уникальными свойствами частиц, прошедших путь от «неизвестной примеси» до ключевого элемента передовой науки, и хотелось бы рассказать в этой статье.
Генная и клеточная терапии
Спецпроект о генной и клеточной терапиях, тернистом пути их развития, первых успехах и надеждах, а также о сложностях регулирования, производства и изучения этих новейших методов лечения.
Партнер спецпроекта — Департамент разработки генотерапевтических препаратов одной из крупнейших российских биотехнологических компаний — BIOCAD. BIOCAD заслужил серьезные позиции на мировом фармацевтическом рынке благодаря выпуску лекарственных препаратов на основе антител.
Когда в 1960-х годах AAV обнаружили впервые, его наблюдали в виде небольших ДНК-содержащих частиц, загрязняющих препараты клеток почек макак-резусов, инфицированных обезьяньим аденовирусом типа 15.
Поскольку AAV шли как бы в «нагрузку» с аденовирусами, они и получили свое название — «аденоассоциированные вирусы» [1]. Более полувека изучения этих частиц сделали очевидной их высокую ценность для современной медицины, что во многом связано с уникальностью молекулярной организации. Эволюция будто нарочно «проектировала» их под нужды человека, заметно облегчив все же необходимую для доставки генов модификацию. Судите сами: удивительная особенность вирусов, во многом обеспечившая им выдающуюся «живучесть» и плодовитость, ─ полная зависимость от клеток пораженного организма-хозяина, лишь внутри которых и могут они размножаться. Ну а наши сегодняшние герои еще менее «самостоятельны», — для удвоения генетического материала нуждаются в присутствии «вируса-помощника» (часто аденовируса или вируса простого герпеса), без которого их репродукция мало осуществима. Казалось бы, вряд ли такая «неполноценность» сделает эти вирусы сколько-нибудь полезными, но как выяснилось, все это оборачивается только к лучшему, и далее мы поймем почему.
AAV: знакомимся ближе
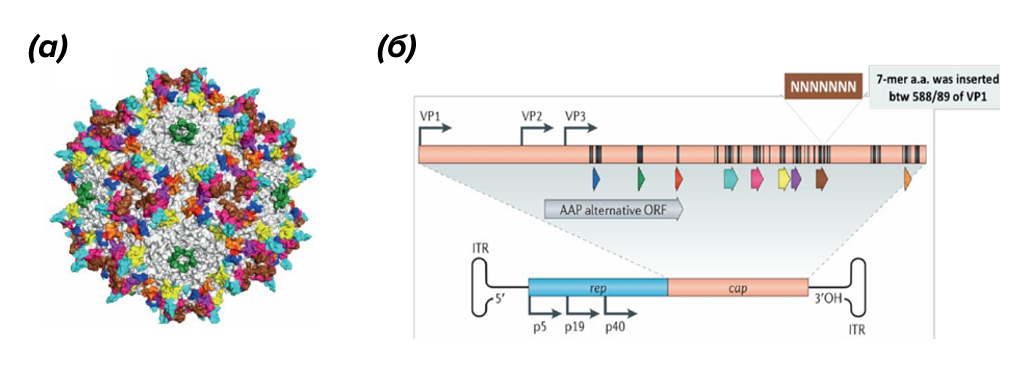
AAV относятся к роду Dependoparvovirus из семейства парвовирусов (Parvoviridae). Их вирионы небольшие — с геномом около 4,7 тысяч пар нуклеотидов (т.п.н.) в одноцепочечной ДНК, «упакованной» в капсид размером ≈20–25 нм (рис. 1) [2], [3].
Рисунок 1. Структура AAV.
(а): модель кристаллической структуры капсида AAV;
(б): карта генома AAV.
Из-за потребности во вспомогательном вирусе для репликации AAV практически непатогенны, а потому намного безопаснее других вирусов, так что при необходимости доставки лечебного гена к клеткам-мишеням внутри организма пациента (терапия in vivo) почти всегда применяют именно их (точнее, векторы на их основе).
А поскольку каких-либо заболеваний у человека они не вызывают, то и иммуногенный профиль у них достаточно мягкий: как будто иммунная система «не привыкла» воспринимать их как опасные, и сильно «паниковать» при встрече с ними особо нечего [4].
Это, конечно, все очень упрощенно, но если хочется узнать поподробнее, как именно иммунная система распознает патогены, что способствует ее активации и как все это помогает организму справляться с заражением, рекомендуем ознакомиться со статьей «Биомолекулы»: «Иммунитет: борьба с чужими и… своими» [5].
Впрочем, сильно обольщаться тоже не стоит ─ пока можно сказать, что AAV слабо иммуногенен по сравнению с другими вирусами (например, аденовирусом), но если рассматривать его отдельно, ─ все не так просто [6]. В публикациях последних лет все чаще встречаются упоминания о клеточном ответе на него и что такие реакции могут вносить вклад в снижение эффективности наших вирусных «курьеров» [7], [8]. И это не говоря о нейтрализующих антителах (neutralizing antibodies ─ nAbs) против AAV, имеющихся у большинства людей, которые могут настолько снизить эффективность терапии, что порою из клинических исследований (а значит в будущем и из возможностей лечения одобренными препаратами) приходится исключать до 50% пациентов [8].
Но не будем сильно забегать вперед: к этой фундаментальной проблеме мы еще вернемся.
AAV и другие звери
Сегодня доставка нужных генов может осуществляться с использованием и других вирусных векторов, а также «невирусными» методами, однако даже в исследовательских целях чаще применяют именно вирусы, ведь они превосходят по своим характеристикам другие решения [9]. Если же говорить о клиническом применении, то тут проверку пока прошли векторы на основе пяти основных классов вирусов: ретровирусов (RV), аденовирусов (AD), AAV, лентивирусов (LV) и вирусов простого герпеса (HSV). Эти векторы можно дополнительно разделить на две группы в зависимости от того, интегрируются ли они в хромосомы клеток (RV и LV) или в основном присутствуют в ядре клетки в виде внехромосомных эписом (AAV, AD и HSV) [9], [10]. Данная характеристика — одна из важнейших в решении о клиническом использовании, и здесь векторы AAV имеют преимущество: они меньше других интегрируются в геном, обеспечивая лучший профиль безопасности для терапии in vivo. Причем даже если такая интеграция случается, она не приводит к сдвигу рамки считывания, а это значит — риск потенциального онкогенеза невелик [2].
Более подробно о различиях разных типов вирусных векторов, о том, как такие различия могут идти «в плюс» или «в минус» — в зависимости применения в конкретном виде терапии, об одобренных лекарствах, использующих вирусные векторы, а также многом другом из мира генной терапии, читайте в статье «Генная терапия: познакомьтесь с лекарствами будущего» [9]. Надо заметить, что в 2019 году компания Merck&Co зарегистрировала вакцину от Эболы на основе вируса везикулярного стоматита, а в клинических исследованиях находятся векторы для генной терапии редких кожных заболеваний на основе вируса герпеса. Так что арсенал вирусных векторов расширяется.
Кроме того, AAV способны инфицировать не только активно делящиеся, но и покоящиеся клетки, такие как нейроны и клетки сетчатки, ─ а ведь при использовании других способов доставки генов эти клетки трансдуцировать не так-то просто [2].
Поэтому выходит, что эти носители несколько превосходят другие решения: чего стоит только наличие множества различных серотипов AAV ─ вариаций, отличающихся молекулярными структурами на поверхности капсидов, влияющих на тропизм (или тканевую специфичность) — способность инфицировать клетки строго определенных тканей. Это свойство помогает создателям генного лечения направлять воздействие с применением AAV, реализуя его там, где и требуется эффект: например, в клетках нервной ткани, печени или мышц.
Аденовирусы и аденоассоциированные вирусы: не одно и то же!
Внедрение в терапевтическую практику AAV стало будто логическим продолжением раннего использования носителей на основе аденовирусов (Adenoviridae — AD), ─ из препаратов которых, как уже было сказано, и были выделены первые аденоассоциированные вирусы.
При этом векторы AD (рис. 2) в генной терапии применяют практически с самого ее зарождения, ─ а ведь эта область стартовала уже более 20 лет назад. Так что интересно сравнить эти два типа вирусных векторов для доставки генов, сопоставить их преимущества и недостатки для клинических применений.
Рисунок 2. Модель аденовируса.
Помимо схожих названий, эти рекомбинантные вирусные системы объединяют еще некоторые общие свойства: например, они могут инфицировать широкий круг разных клеток (включая делящиеся и неделящиеся), почти совсем не интегрируясь в их геном. Однако есть между ними и несколько важных отличий, в том числе: разная емкость, разное время, уровни и продолжительность экспрессии целевого гена, а также иммунный ответ (табл. 1). Это и не удивительно, ведь аденовирусы и аденоассоциированные вирусы относятся к разным «весовым категориям»: первые содержат двухцепочечную ДНК, а вторые — одноцепочечную.
| Свойство | АD | AAV |
|---|---|---|
| Тропизм | Делящиеся и неделящиеся клетки | Делящиеся и неделящиеся клетки |
| Интеграция в геном | Нет | Нет |
| Емкость вектора | ||
| Экспрессия гена / продукция целевого белка | Высокая | Низкая |
| Длительность экспрессии гена | Недолговременная | Потенциально длительная |
| Иммунный ответ | Высокий | Очень низкий |
| Время начала экспрессии | 16–24 часа | 2–7 дней (in vitro) 3–21 день (in vivo) |
| Уровень биобезопасности | BSL-2 | BSL-1 |
Как видно из таблицы, AD имеют почти в два раза большую емкость в сравнении с AAV (что позволяет помещать в них гены большего размера), более высокий уровень биосинтеза целевых белковых продуктов и более раннюю экспрессию (уже через 16–24 часа после инфицирования). В тоже время, провоцируемый AD сильный иммунный ответ ─ основное ограничение для их применения (он же стал главной причиной ранних клинических неудач при использовании таких векторов на заре генной терапии).
Однако AD по-прежнему широко используют в исследованиях из-за их высокоэффективной трансдукции большинства тканей, а иммуногенные свойства этих векторов нашли применение в вакцинации ─ создании (и применении) рекомбинантных вакцин на основе этой платформы.
В частности, нашумевший «Спутник V» ( «Биомолекула» не раз о нем писала) как раз и является примером такой вакцины против коронавируса: два ее компонента представляют собой рекомбинантные векторы на основе разных серотипов аденовируса человека: Ad26 и Ad5 [11], [12]. В оба этих вектора внедрен ген, кодирующий белковый «шип» вируса SARS-CoV-2 ─ так называемый белок S. После введения вакцины векторы проникают в клетки пациента и «заставляют» их вырабатывать белок S. Иммунная система вырабатывает защиту от этого чужеродного белка и впоследствии может «дать отпор» реальной коронавирусной инфекции. К другим аденовирусным векторным вакцинам относятся: AstraZeneca / Оксфордского университета на основе аденовируса шимпанзе (ChAdOx), вакцина компании Johnson & Johnson на основе Ad26 (аналогичная первому компоненту «Спутника V»), а также китайская CanSino на основе Ad5 (аналогичная второму компоненту «Спутника V»).
И пока о безопасности и эффективности вакцин не утихают жаркие дискуссии, мы можем констатировать лишь одно: прецедент появления вакцин такого типа уникален как по срокам вывода на рынок, так и по подтверждаемой исследованиями эффективности против совсем новой инфекции. И это еще одна демонстрация завораживающей (и где-то даже пугающей) стремительности прогресса в естественных науках (а именно — в биотехнологиях), невероятный скачок в которых происходит прямо на наших глазах.
Серотипы AAV: первое приближение — природное разнообразие
Различные серотипы AAV были выявлены после открытия данного вируса, и самым изученным из них вскоре стал AAV2: в течение первых 20 лет после его идентификации были описаны цикл репликации и способность этого серотипа оставаться в латентном состоянии внутри клетки [3]. А уже к началу 1980-х годов секвенировали геном AAV2, что облегчило создание первых векторов на его основе [1].
К настоящему времени открыто в общей сложности 12 основных серотипов AAV, встречающихся как у человека, так и у нечеловекообразных приматов [1]. Помимо этого, у различных видов животных было выявлено ещё более 100 изолятов AAV, пока что изученных недостаточно, чтобы можно было с полной уверенностью отнести их к отдельным серотипам (такие разновидности называют еще «вариантами») [13].
Ранее новый серотип определяли как AAV, который не нейтрализуется сывороткой, нейтрализующей известные серотипы (отсюда и название: от serum — «сыворотка»). Сейчас серотипы определяются по генетической гомологии и делятся на клады.
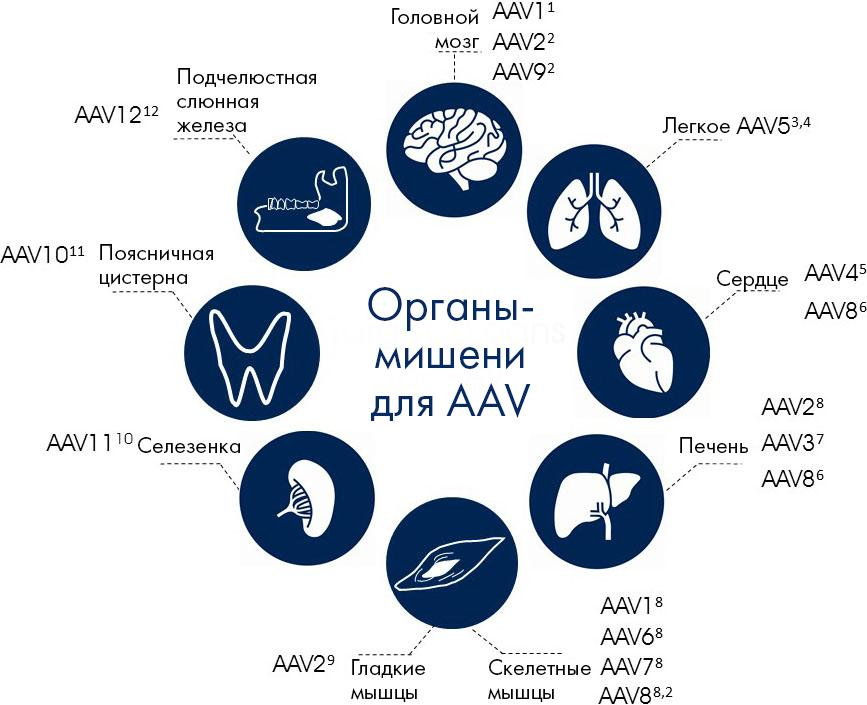
Во многих экспериментах обнаружены четкие отличия в тканевом тропизме и эффективности трансдукции серотипов AAV (рис. 3), что дает широкие (и во многом пока нереализованные) возможности селективного применения этих векторов. Например, серотип AAV1 демонстрирует высокую эффективность трансдукции мышц, нейронов, клеток сердца и пигментного эпителия сетчатки, а для AAV2 выявили специфичность ко многим типам опухолевых клеток, к нейронам, а также к клеткам почек, пигментного эпителия сетчатки и фоторецепторным клеткам. При этом AAV2 ─ единственный серотип, способный к доставке терапевтического гена в почки [14].
Рисунок 3а. Органы-мишени для серотипов AAV 2–12.
Рисунок 3б. Органы-мишени для серотипов AAV 1–8.
AAV8 и AAV9 показали успешное инфицирование злокачественных клеток ─ лимфомы и опухолей, вызываемых вирусом папилломы человека (HPV), соответственно. В то же время, AAV8 ─ пока единственный серотип, способный поражать поджелудочную железу, а в клинических испытаниях он широко используется для экспрессии фактора свертывания крови IX в печени с целью лечения гемофилии B [14].
Об испытаниях с применением вектора AAV8 «Биомолекула» уже писала в статье «Сводка с генотерапевтических фронтов. Новая стратегия нейтрализации гемофилии» [15]. К слову, об этих самых сводках: лечение гемофилии B, описанное в материале «АМТ-061 — генная терапия, способная на революцию в лечении гемофилии» [16], использующее для доставки гена вектор AAV5, казалось на момент написания статьи одним из самых перспективных, однако что-то пошло не так. У одного из пациентов, получавших такое лечение, развилась гепатоцеллюлярная карцинома, после чего FDA приостановило клинические испытания для расследования данного инцидента.
При этом, как сообщает компания-разработчик, у пациента с раком было сразу несколько факторов риска этой болезни, включая гепатиты C и B, возможную неалкогольную жировую болезнь печени и пожилой возраст, и потому, скорее всего, развитие злокачественной опухоли не было связано с генным лечением. В то же время, учитывая печально известную историю проблем с безопасностью генной терапии (что изначально было во многом связано с использованием не самых удачных векторов, ─ мы рассказывали об этом в статье «Три поколения лекарств» [17]), опасения регуляторов понять несложно. С другой стороны, в программе исследования генной терапии гемофилии задействовано на сегодняшний день более 100 пациентов, и никаких других случаев рака обнаружено не было, — так что FDA здесь, наверное, больше перестраховывается: как говорится, «обжегшись на молоке, дуют на воду»… В конце марта 2021 года компания сообщила о том, что расследование пришло к выводу о низкой вероятности связи лечения и этого случая рака, и, наконец, 26 апреля 2021 года, пока мы редактировали эту статью, исследование разрешили продолжить.
Разница в тропизмах основных серотипов потенциально может позволить реализовать самые разные исследовательские и терапевтические цели, а более трудные задачи можно попробовать решить, используя выделенные в последние годы «дополнительные» изоляты AAV. Ведь некоторые из них имеют преимущества по сравнению с более широко известными и применяемыми на сегодня серотипами [2], [18]. Кроме того, ведется работа по получению искусственных вариантов вируса (см. ниже).
Например, для изолята AAVrh10 (выделенного из клеток макак-резусов) в исследованиях на многочисленных моделях животных было показано, что он способен эффективно проникать в ЦНС — это значит, что возможно применение вектора на его основе для доставки генов в мозг с целью лечения нейропатологий.
Другой выявленный изолят ─ AAVrh32.33 ─ может быть использован при разработке вакцин, так как, по сравнению с другими серотипами AAV, он вызывает значительно более сильный Т-клеточный ответ, позволяя активизировать иммунную систему [2].
Все это, вкупе с рядом других «улучшающих» стратегий, может помочь расширить возможности применения AAV в медицине и преодолеть ограничения, которые, несмотря на все преимущества, у данного типа вирусных векторов все же имеются.
Серотипы AAV: второе приближение — модификация природных вариантов
Есть несколько препятствий, ограничивающих использование векторов на основе природных серотипов. В частности, несмотря на достаточно мягкий профиль иммуногенности AAV (так принято считать ─ все же относительно иммуногенности этих частиц пока много вопросов), активация Т-клеточных реакций была выявлена в нескольких исследованиях. Причем это приводило к разрушению трансдуцированных клеток с соответствующим снижением экспрессии трансгена. Здесь наблюдали и некоторую количественную зависимость: при низких дозах вектора вероятность слабой и более контролируемой иммунной реакции была выше, и это не приводило в итоге к полной потере экспрессии.
О том, что такое убиквитинилирование и какую роль этот процесс выполняет в клетке, подробно рассказывают статьи «Биомолекулы»: «Вездесущий убиквитин» и «Вездесущий убиквитин возвращается» [20], [21].
Кстати, одна из рабочих гипотез, объясняющих появление T-клеточных ответов на AAV, основана на наблюдении, что после разрушения таких частиц протеасомами пептидные фрагменты белков вируса могут перемещаться посредством активного транспорта к молекулам MHC-I, и, связываясь с ними, попадать на поверхность клетки, где их презентация делает трансдуцированные клетки очень «заметными» для иммунного надзора. А это и приводит в итоге к их разрушению цитотоксическими T-клетками [8], [22].
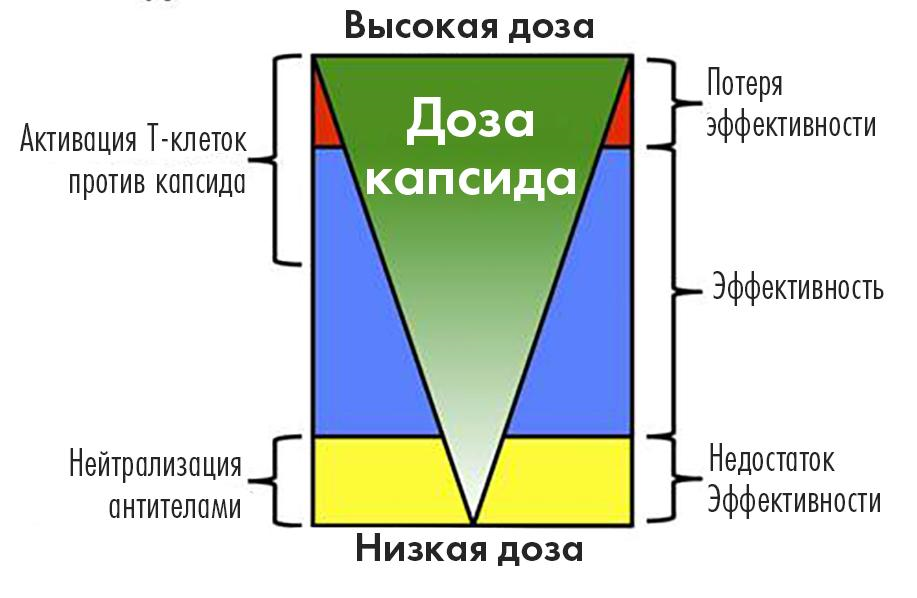
Так или иначе, тут своего рода дилемма: для эффективной системной доставки генов нужны высокие дозы векторов, но это же приводит в итоге к разрушению таких носителей иммунной системой, снижая (а может, и сводя на нет) успешность такой доставки. Одно из решений ─ попасть в «окно» дозирования, когда доставляемого вектора уже достаточно для преодоления гуморального иммунитета, но еще не столь много, чтобы успел подключиться клеточный иммунитет (рис. 4).
Рисунок 4. Модель взаимосвязи между дозами капсидов AAV и результатом переноса гена после системной доставки вектора. Низкие дозы капсидов с большей вероятностью нейтрализуются анти-AAV антителами, причем даже низкими титрами nAbs. Это приводит к снижению эффективности доставки генов. Более высокие дозы капсидов преодолевают это ограничение, обеспечивая терапевтическую эффективность. Однако капсид-специфическая активация Т-клеток постепенно детектируется по мере увеличения общей введенной дозы AAV. Это не влияет на эффективность до тех пор, пока не будет превышен критический порог, выше которого иммуноопосредованный клиренс трансдуцированных клеток-мишеней приведет к потере эффективности.
В целом же все перечисленное только усугубляет проблему иммуногенности, которая и становится основным препятствием эффективного использования этих вирусных частиц в качестве векторов для терапевтических приложений генной терапии (вероятно, она является основной причиной провалов клинических исследований таких лекарств).
Перспективное направление в преодолении существующих ограничений — модификация имеющихся вариантов AAV для создания совершенно новых вирусных векторов — в природе не встречающихся, что может улучшить характеристики: расширить ограниченный природой тропизм, усилить экспрессию, увеличить эффективность трансдукции и т.д. При этом для инжиниринга AAV используют несколько отличающихся стратегий, имеющих как плюсы, так и минусы.
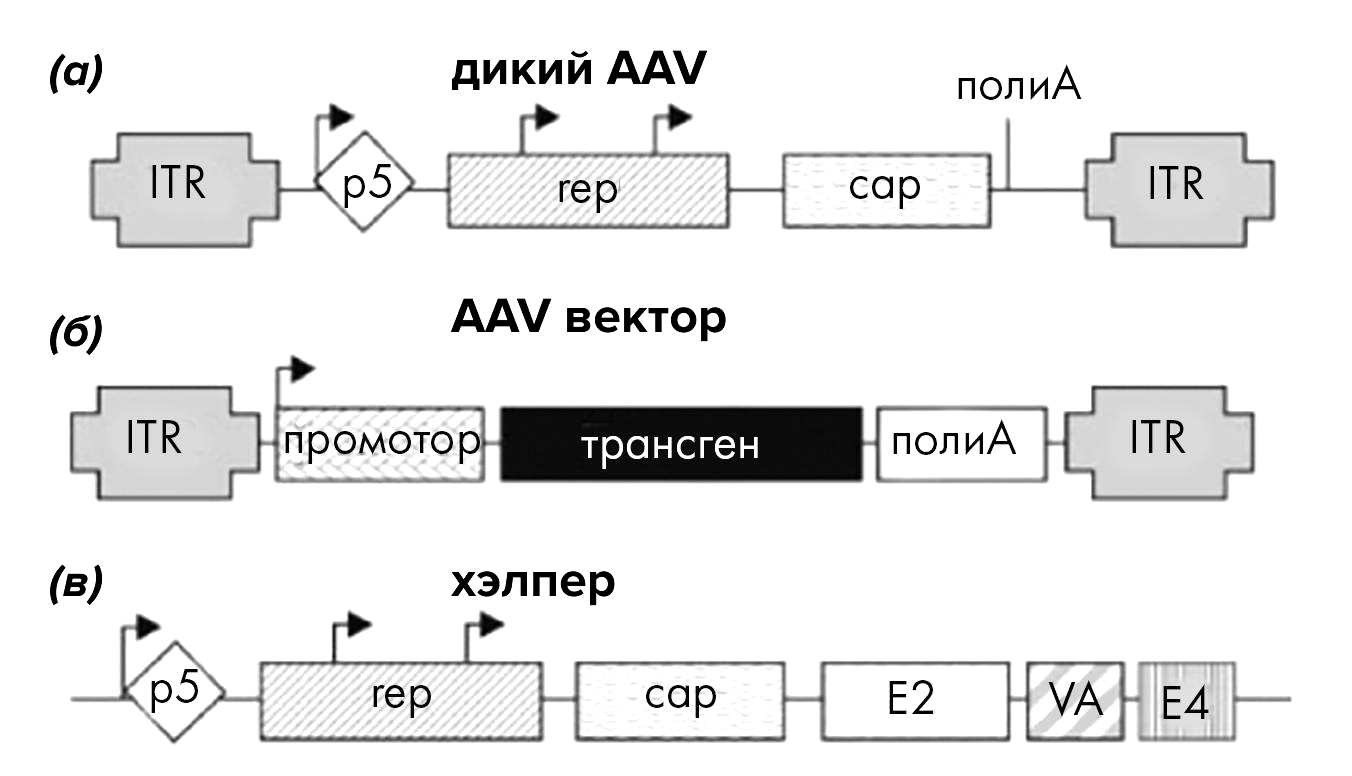
Прежде чем с головой окунуться в захватывающую область инжиниринга AAV, позволяющую значительно расширять терапевтический потенциал этих частиц, коснемся немного того, как в принципе создаются рекомбинантные векторы для исследований и клинического применения на основе AAV дикого типа (wild-type AAV ─ wtAAV).
Чтобы создать рекомбинантный вектор, исследователи удаляют из wtAAV весь «ненужный» генетический материал: гены, ответственные за репликацию (Rep) и образование капсида (Cap), заменяются промотором, управляющим экспрессией целевого гена (рис. 5) [23].
Более развернуто тема создания и производства рекомбинантных AAV раскрывается в статье «Биомолекулы»: «Крохотные курьеры: как аденоассоциированные вирусы спасают жизни», в которой также несколько подробнее рассказано о биологии этих вирусов, в частности описывается процесс проникновения AAV в клетку [24]. Этот материал ─ хорошее дополнение к нашей статье.
Рисунок 5. Сравнение генетических последовательностей AAV дикого типа (а) и соответствующего рекомбинантного вектора (б). Видно, что в векторе от wild AAV остаются только ITR: генетический материал между ними удаляют, заменяя на кассету трансгена, включающую собственно трансген, его промотор, а также сигнальную последовательность полиаденилирования (polyA termination sequence), обозначающую конец считывания целевого транскрипта (терминацию).
Модулирование тропизма и улучшение трансдукции
Первые рекомбинантные AAV, как уже упоминалось, были созданы на основе природного серотипа 2, и, благодаря широкому тропизму, их удалось опробовать в клинических испытаниях для самых разных терапевтических применений. Однако, как вскоре выяснилось, их существенное достоинство (специфичность сразу ко многим типам клеток) может быть и недостатком, когда требуется адресно доставить целевой ген в строго определенный орган или ткань, да и к тому же некоторые очень «желательные» мишени (например, стволовые клетки) невосприимчивы к векторам на основе AAV2 [25].
Поэтому усилия исследователей сосредоточились на стратегиях модификации белков капсидов AAV для изменения природного тропизма и повышения эффективности трансдукции [25].
Транскапсидирование
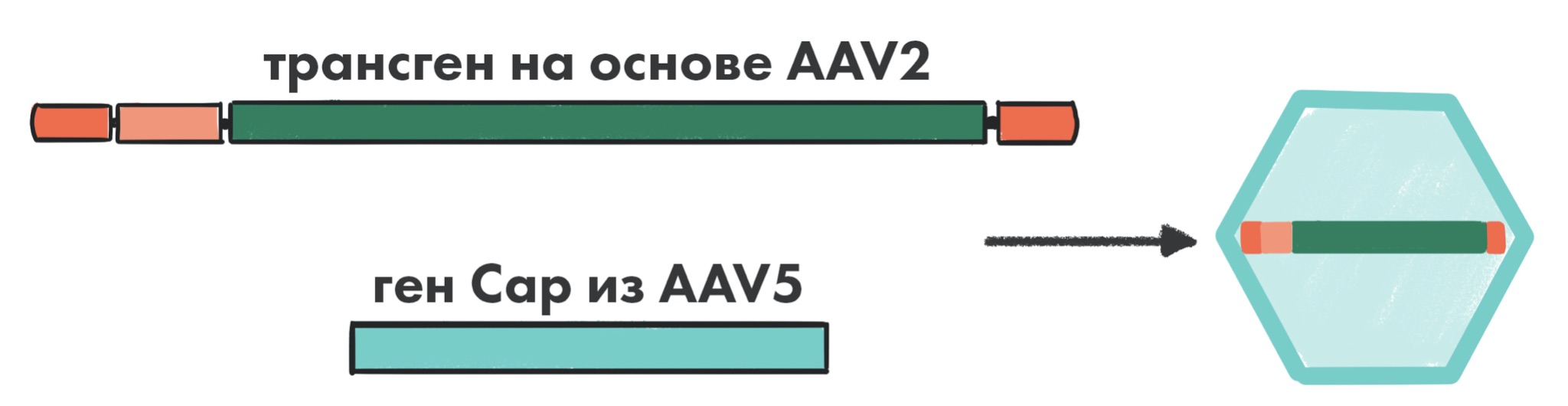
Упаковка генома AAV одного серотипа в капсид другого серотипа (то есть транскапсидирование) может позволить получить вектор с желаемым геномом (например, тот же AAV2), но с измененным тропизмом.
В исследованиях этот способ продемонстрировал определенную эффективность в плане ухода от нейтрализации антителами [2]. Тканевый тропизм, проявляемый гибридным вектором, соответствует специфичности наружной белковой оболочки (капсиду AAV5), что позволяет «нацеливаться» на нужные типы клеток (рис. 6).
Рисунок 6. Пример транскапсидированной частицы AAV.
Мозаичные капсиды
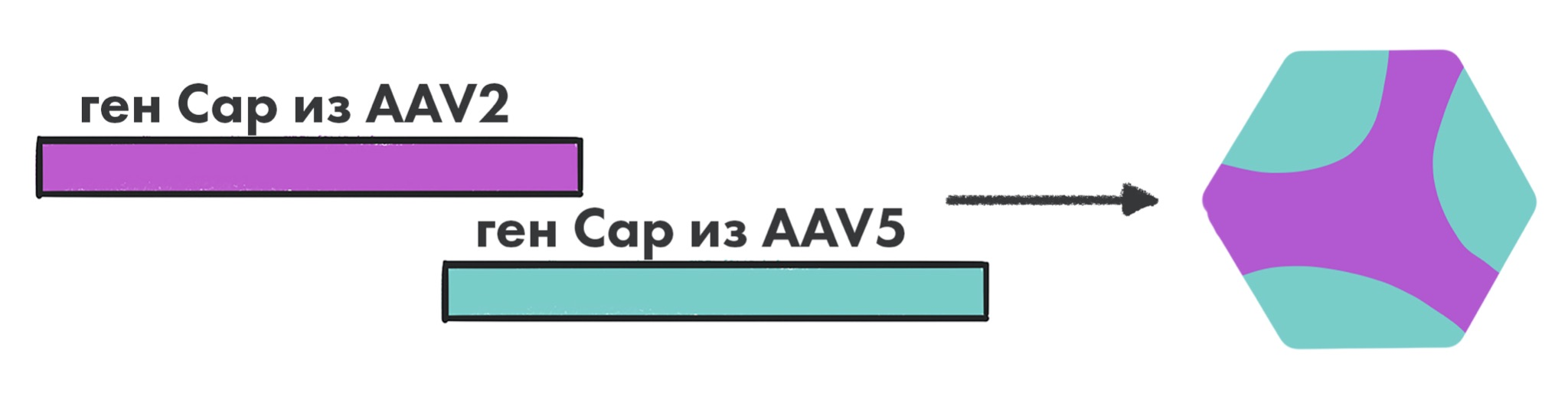
Мозаичные вирионы, капсиды которых представляют собой гибридные структуры, состоящие из смеси субъединиц, «позаимствованных» от разных серотипов AAV, ─ альтернативный подход к модификации свойств таких векторов, что позволяет сочетать полезные качества разных серотипов [25]. Например, некоторые мозаичные векторы показали в 100 раз усиленную трансдукцию клеток, а также расширенный тропизм на более широкий диапазон типов клеток (рис. 7) [25].
Рисунок 7. Пример мозаичной частицы AAV. Такая частица будет иметь тропизм по отношению к ткани-мишени как AAV2, так и AAV5.
Это перспективный подход, но он имеет два потенциальных недостатка. Во-первых, соотношения между двумя серотипами при производстве могут не воспроизводиться от цикла к циклу, потому что невозможно точно предсказать, каким будет соотношение капсидных белков разных серотипов в мозаичной частице (хотя теоретически оно должно составлять примерно 50:50) [25].
Во-вторых, мозаичный капсид потенциально может быть инактивирован nAbs, направленными против любого из исходных серотипов [25].
Перенацеливание первое: химическая инженерия капсидов
Известно, что AAV2 связываются с полисахаридом HSPG, ─ рецептором, присутствующим во многих тканях и типах клеток, что во многом и определяет широкий тропизм этих векторов [25]. Чтобы повысить специфичность и нацелить вектор более точечно на нужные исследователям клетки, пробовали конъюгировать с поверхностью AAV определенные лиганды, увеличивающие «точность наведения» (рис. 8).
Рисунок 8. Модификация поверхности капсида молекулой белка ─ использование специфичных к капсиду AAV первичных антител, связанных с вторичными антителами, распознающими рецепторы на клетках-мишенях. Такие модификации продемонстрировали в исследованиях успешное изменение тропизма векторов по отношению к определенным типам клеток.
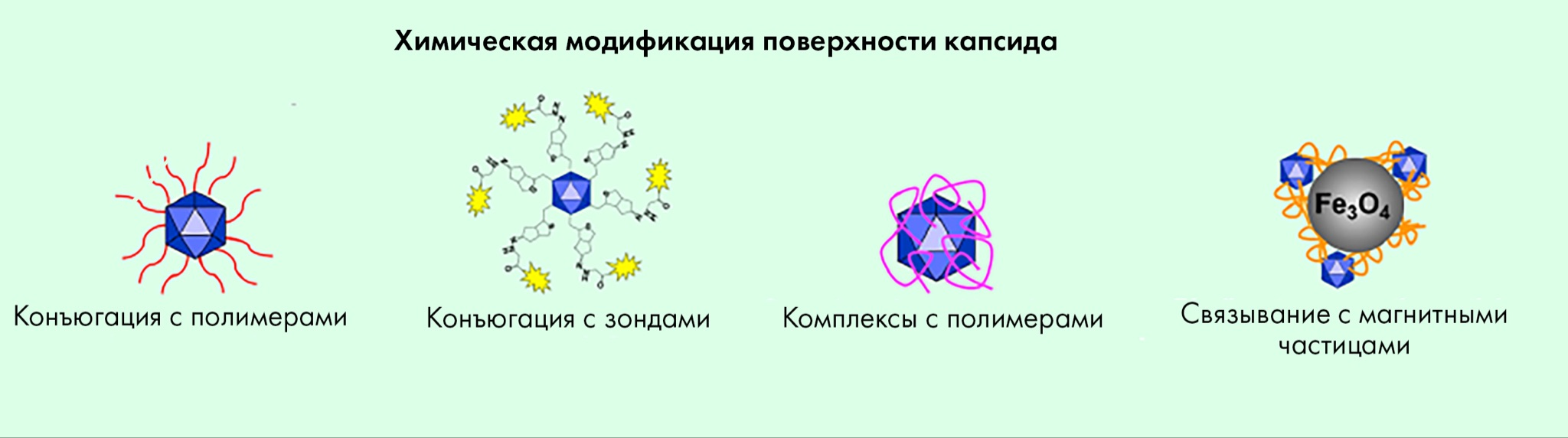
Помимо модификации белками, на поверхность можно «сажать» специальные частицы-зонды, укрывать поверхность полимерами, а также связывать с наночастицами (рис. 9) [2]. Такие стратегии могут также «замаскировать» векторы от нейтрализующих антител и задать тропизм к таким клеткам, которые не распознает ни один из известных серотипов [2].
Рисунок 9. Стратегии химической модификации поверхности капсидов AAV.
Перенацеливание второе: генетическая инженерия капсидов
AAV2 можно изменить и методами генной инженерии: встроить в белок оболочки вируса чужеродный пептид, и в итоге вектор будет «одет» в химерный капсид (рис. 10). Цели создания химер те же: расширение возможностей трансфицирования различных типов клеток, повышение эффективности трансдукции и снижение иммуногенности. У «химерного» подхода неплохой потенциал для «тюнинга» AAV, но минус встраивания слишком больших полипептидов в капсидный белок ─ ухудшение его свойств: например, неправильное сворачивание [26].
Рисунок 10. Химерный капсид. Такие белковые оболочки могут содержать чужеродный пептид в своей структуре, потому что его кодирующая последовательность была вставлена в открытую рамку считывания генома вирусной частицы. Этот способ позволяет менять специфичность вектора для связывания с рецепторами нужных клеток-мишеней.
Направленная эволюция
Успехи векторов, модифицированных перечисленными выше способами, неплохие, однако потенциал их небезграничен, так как используют они в основном уже существующие в природе молекулярные структуры [25].
Развитие технологий молекулярного клонирования позволило исследователям создавать библиотеки мутантных вариантов AAV, а достижения в разработке разнообразных высокопроизводительных методов скрининга/отбора ─ выбирать из множества модифицированных векторов наиболее приемлемые по нужным показателям. Использование этих библиотек позволяет конструировать и выбирать рекомбинантные AAV, которые устойчивы к нейтрализующим антителам, обладают повышенным (или более специфичным) тканевым тропизмом, а также находить варианты, позволяющие снизить дозу вектора без потери эффективности [3].
Такой подход, в какой-то мере повторяющий созданные природой алгоритмы естественного отбора (только многократно ускоряющий их), теоретически может позволить создавать AAV почти с любыми нужными исследователям свойствами, однако его существенный минус ─ эволюция носит случайный характер, и направить ее так, чтобы получить точно заданный результат, может быть затруднительно.
В области направленной эволюции также существуют различные подходы и способы получения желаемого результата, однако тема эта сложная и объемная, и потому ее подробный разбор мы оставим за скобками нашего повествования (ведь все охватить невозможно).
Другие модификации
Самокомплементарный AAV (scAAV ─ Self-complementary AAV). Одним из недостатков AAV является его геном, ведь он представлен одноцепочечной ДНК. Поскольку функциональность вируса как производителя целевого белка зависит от аппарата репликации ДНК клетки (он нужен для синтеза комплементарной цепи), экспрессия трансгена может «задерживаться». Мы уже видели (см. врезку выше), насколько быстрее в сравнении с AAV аденовирусы (имеющие как раз двухцепочечный геном) могут экспрессировать свои гены. А ведь чем раньше начнется биосинтез целевых продуктов, тем скорее пациент начнет получать лечебный эффект.
Чтобы преодолеть это ограничение скорости, разработали scAAV, содержащий комплементарные последовательности ДНК, образующие «обычную» двойную спираль при инфицировании. Это устраняет необходимость ждать достройки второй цепочки ДНК и ускоряет экспрессию.
К сожалению, при создании scAAV возникает дополнительное ограничение ─ и без того малая емкость упаковки AAV снижается до 2,4 тысяч пар оснований.
Способы увеличения емкости. При всех плюсах AAV, небольшой размер этих векторов не позволяет упаковывать в них многие важные гены, доставка которых по месту назначения могла бы помочь в лечении многих серьезных болезней, так что увеличение емкости таких носителей ─ проблема весьма актуальная.
Для этого ученым приходится прибегать к самым разным ухищрениям, которые, правда, пока что опробованы только в доклинических и ранних клинических исследованиях. Однако некоторые из этих способов «вместить невместимое» довольно занятны (и могут стать основой для создания новых лекарств), так что стоит присмотреться к ним повнимательней.
Для доставки крупных генов с использованием AAV были разработаны две основные стратегии. Одна из них основана на «принудительной» упаковке генов большего, чем емкость частицы, размера (то есть более 5 т.п.н.) в один вектор AAV. Другая базируется на «разделении» генетического материала между двумя векторами AAV (разные части гена помещаются в разные векторы) [27]. В каком-то смысле вторая стратегия является просто усовершенствованием первой, ведь изначально исследователи пробовали решить проблему, просто упаковав «негабаритный» ген (
9 т.п.н.) в AAV, после чего с удивлением обнаружили успешную трансдукцию и экспрессию полноразмерного трансгена.
Однако при воспроизведении результатов в повторных исследованиях ученых ожидал новый сюрприз: оказалось, что даже когда в векторы упаковывались бо́льшие гены, физический размер геномов частиц-носителей не менялся (по-прежнему составляя
4,7 т.п.н.). Но как же тогда они «умудрялись» приводить к биосинтезу полноценных белков?!
Ученые предположили, что в процессе упаковки «негабаритных» генов в небольшие AAV внедренные генетические последовательности фрагментируются или усекаются, а их кусочки распределяются по разным векторам, но после трансдукции эти частицы способны дополнять друг друга, что и дает на выходе требуемые продукты экспрессии. Естественная способность AAV восстанавливать фрагментированные геномы и стала основой для нескольких подходов с «расщеплением» целевых последовательностей (и помещением их в разные векторы) с целью доставки «негабаритных» генов в клетки. Такой подход использовали, например, для восстановления нормального биосинтеза дистрофина при исследовании генной терапии мышечной дистрофии Дюшенна [28], [29].
Помимо этого, ученые пытались, и небезуспешно (по крайней мере, в опытах на животных), применять и другие способы упаковки «негабаритных» генов в маленькие AAV. В частности, вместо полноразмерных генов интегрировали их «усеченные» варианты; при этом кодирующую последовательность «обрезали» так, чтобы продукт ее экспрессии не терял своей функциональности. Такой подход пробовали, например, при разработке лечения гемофилии А (использовали усеченный вариант гена, кодирующего фактор VIII, а также при попытках генной терапии муковисцидоза (уменьшенный ген, кодирующий CFTR) [30], [31]. Ну и в вышеупомянутом исследовании мышечной дистрофии Дюшенна (помимо распределения генетического материала в разные векторы) использовали также «усеченный» ген, кодирующий высокофункциональный, но «обрезанный» белок ─ «минидистрофин».
Кстати говоря, внедрение последовательностей, кодирующих функциональный дистрофин, ─ не единственный возможный вариант корректировки такой патологии. Достаточно интересными и перспективными можно считать попытки редактирования генома в уже имеющихся (но дефектных) генах, кодирующих этот белок. Тут также были сделаны определенные успехи: в опытах на мышах удалось достигнуть экспрессии полноценного белка на уровне 8% от нормы (при том, что для улучшения мышечной функции достаточно всего 4%).
При этом для доставки системы редактирования CRISPR/Cas применили элегантное решение: целевой генетический материал не просто распределили по двум разным векторам AAV (один вектор — с кассетой экспрессии Cas9, второй ─ с двумя направляющими РНК); для эффективной упаковки применили и еще одну хитрость. Дело в том, что часто используемая нуклеаза Cas9 из бактерии Streptococcus pyogenes в данном случае не подходила: она слишком велика для упаковки в AAV. Поэтому исследователи заменили ее на Cas9 золотистого стафилококка, как раз подходящую по размеру (3,2 т.п.н.).
Эти ухищрения помогли отредактировать ген дистрофина: удалить несущий мутацию дефектный экзон, после чего естественный механизм негомологичной репарации способствовал «сшиванию» образовавшегося разрыва, что и привело в итоге к образованию укороченной, но функциональной версии гена [29], [32].
Способы преодоления гуморального иммунитета к AAV
Многие из перечисленных выше стратегий инжиниринга AAV помогают в той или иной степени уклоняться от иммунных ответов (что было продемонстрировано в исследованиях такого лечения), однако воздействие nAbs по-прежнему остается серьезнейшей проблемой. А ведь ее решение могло бы значительно продвинуть вперед генную терапию, расширив возможности применения таких препаратов.
Происходит так потому, что для лечения выбирают только пациентов без антител к AAV, ну а кому не посчастливилось ─ не получит лекарства [22]. А ведь это далеко не лучший вариант, и не только потому, что таких «неудачников» может быть до 96%, но и потому, что у получающих терапию антитела ведь тоже начнут вырабатываться. А значит, повторное введение вектора (если его действие уже прекратилось) может стать невозможным из-за нейтрализации новых доз AAV уже выработанными антителами.
И вот, помимо различных «танцев с бубнами» вокруг использования модифицированных векторов, ученые разрабатывают также стратегии нейтрализации «анти-AAV» антител, и здесь тоже есть определенный прогресс.
Использование пустых капсидов для адсорбции антител против AAV
Интеграция генетической последовательности в капсид рекомбинантного вектора не всегда достаточно эффективна, что зачастую приводит к значительному количеству пустых вирусных векторов при производстве. Эти пустые векторы могут составлять до 90% промышленной серии, и в рамках контроля качества, конечно, должны быть удалены.
В то же время, на данный момент до конца не ясно, будут ли такие «пустышки» примесью, повышающей иммуногенность, или скорее послужат своего рода приманкой, отвлекающей «внимание» иммунной системы от «заряженных» и активных векторов.
Так или иначе, ученые рассматривают возможность намеренного введения пустых капсидов пациентам, чтобы связывание с ними антител снижало титр последних и в итоге смягчало нейтрализующее действие гуморального иммунитета, улучшая таким образом эффективность терапии. В исследованиях на приматах было показано, что это может быть эффективной стратегией (введение капсидов-ловушек увеличивало экспрессию трансгена), однако есть вопросы о целесообразности применения такого подхода.
Во-первых, производство подобных капсидов-ловушек будет дорогостоящим, трудоемким и потребует строгого контроля качества для проверки того, что они действительно пусты. Во-вторых, пустые капсиды могут увеличивать антигенную нагрузку и потенциально активизировать Т-клеточный иммунитет, что приведет к разрушению уже трансдуцированных клеток.
Терапевтический плазмаферез
Для удаления антител из крови может быть использован терапевтический плазмаферез ─ процедура, при которой кровь забирают от пациента, затем плазму отделяют от клеток крови, фильтруют (удаляя таким образом антитела) и после этого вводят обратно пациенту.
Этот метод оказался успешным в снижении титра нейтрализующих антител (при этом он еще относительно безопасен и неинвазивен), и потому его применение видится достаточно перспективным. Однако есть и недостатки: для значительного снижения антител зачастую требуется проведение нескольких циклов плазмафереза, при этом при высоких титрах антител полностью они все же не устраняются, а ведь даже низкие титры все еще могут значительно снизить эффективность генной трансдукции [22].
Ингибирование активации B-клеток
Активация B-клеток иммунитета после введения векторов AAV приводит к тому, что они созревают и начинают продуцировать nAbs, которые и нейтрализуют частицы-носители генов. Этот процесс реализуется через серию скоординированных этапов, в процессе которых антигены AAV сначала захватываются антигенпрезентирующими клетками, после чего последние начинают через MHC-II «предъявлять» их CD4 + Т-клеткам, которые, в свою очередь вырабатывают стимулирующие цитокины, запускающие превращение B-клеток в плазматические клетки ─ фабрики для производства антител против AAV.
Нарушение этого процесса снизило бы количество «анти-AAV» антител, обеспечив долгосрочную экспрессию трансгена и позволив вводить вектор повторно, если потребуется. Этого и попробовали достичь ученые, заблокировав как T-, так и B-клетки, при помощи ритуксимаба ─ химерного моноклонального антитела, нацеленного на белок CD20 В-клеток, ─ в комбинации с иммунодепрессантом циклоспорином или рапамицином.
Такой подход может предотвратить развитие иммунного ответа на AAV, однако он требует массу времени — долго длится как сам курс, так и последующее восстановление: иммунитету требуется в среднем 6–12 месяцев, чтобы восстановиться после приема ритуксимаба. Кроме того, не может не беспокоить и возможность развития нежелательных явлений при приеме столь серьезных лекарств, ведь иммунодепрессанты делают пациентов уязвимыми для инфекций.
Прямое нацеливание на nAbs
Доклинические исследования показали, что введение агента, способного разрушать иммуноглобулины, тоже может быть эффективным. Препарат имфилидаза (Imfilidase) используется для снижения иммунных ответов у пациентов с трансплантированными органами. В исследованиях на животных этот препарат показал себя неплохо: снижал уровни nAbs против AAV, позволяя эффективно трансдуцировать клетки. Такой же эффект показали и для плазмы крови человека в условиях in vitro.
В будущем эта стратегия (отдельно или в комбинации с другими), вероятно, будет применяться в случае необходимости повторного применения AAV или при лечении пациентов с уже имеющимися «анти-AAV» антителами.
Будущие перспективы
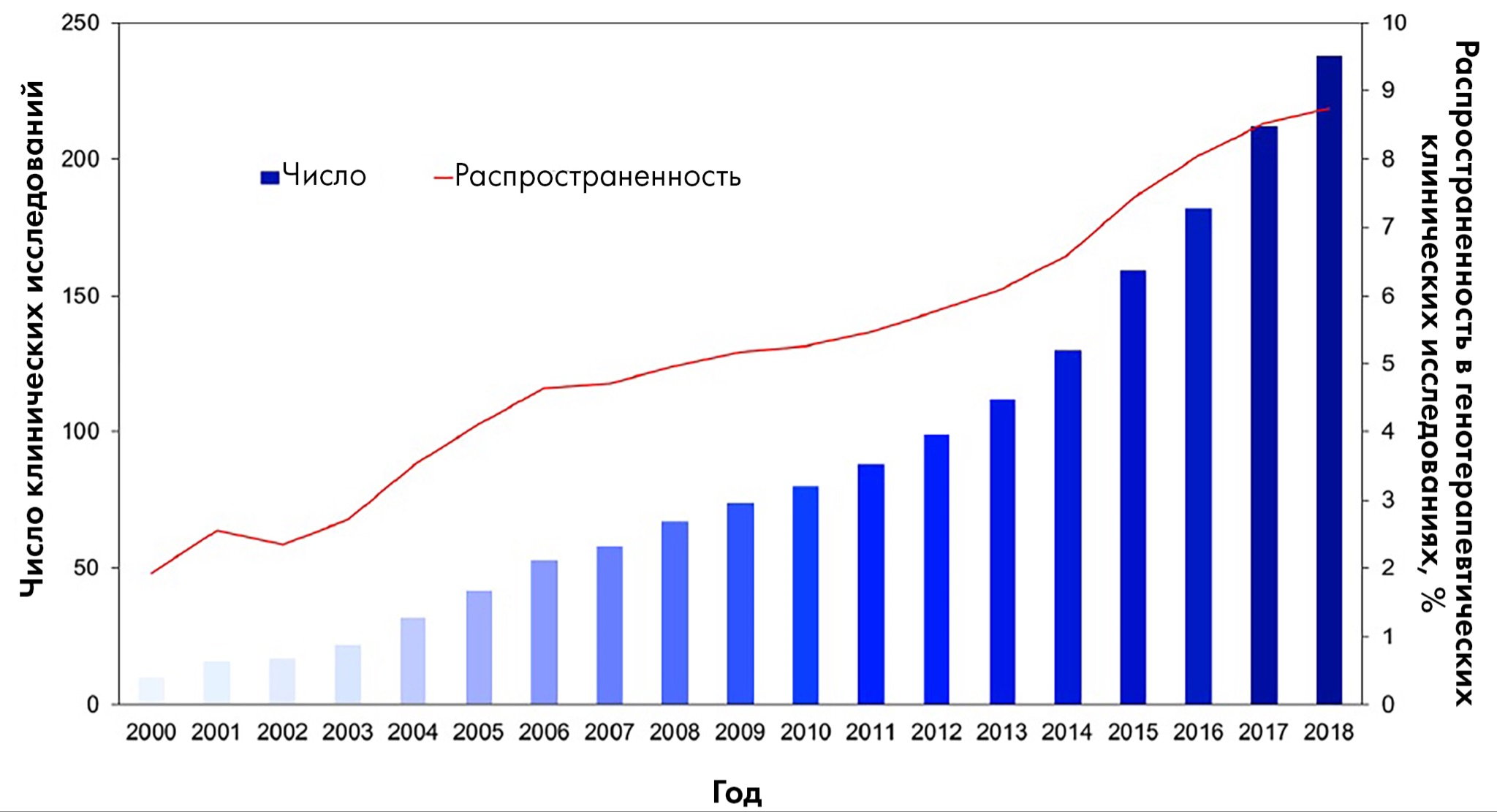
Пока одобрено лишь несколько лекарств на основе векторов AAV. Самые известные — это Zolgensma, Luxturna и Glybera, причем последний был даже снят с производства из-за нерентабельности и сейчас на рынке отсутствует [9], [17], [33]. Однако множество таких препаратов проходят клинические исследования ─ среди них лекарства для лечения муковисцидоза, гемофилии, сердечной недостаточности, дефицита липопротеинлипазы и болезни Паркинсона. Всего на апрель 2021 года зарегистрировано уже 245 таких исследований, и растет не только их число, но и доля среди всех разрабатываемых лекарств (рис. 11), что говорит о стремительном взлете генно-инженерных препаратов на основе AAV. Ожидается, что взлетная динамика всего рынка генной терапии продлится минимум до 2030 года, а размер его к 2027 году достигнет 6,6 млрд долларов, увеличиваясь на 16,6% ежегодно. При этом превалирующий уже сейчас сегмент AAV (доля рынка за 2020 год — более 43%) будет также расти в геометрической прогрессии в среднем на 43,4% в год.
Рисунок 11. Стремительный взлет как числа, так и доли клинических исследований генноинженерных лекарств, основанных на AAV. На апрель 2021 года их уже 245.
Одним из серьезных ограничений к широкому внедрению технологий на основе AAV пока что остается масштабирование производства. Стоимость реагентов для трансфекции и плазмид, сложность получения векторов в большом объеме, очистка и контроль качества — все это еще не до конца решенные проблемы. Эти сложности «Биомолекула» описывала в статье «Генные и клеточные лекарства: сложное регулирование для сложных продуктов» [34].
Как показал проведенный недавно анализ клинических исследований генной терапии на основе AAV, включивший данные 3000 пациентов на протяжении 20 лет [35], в целом они достаточно эффективны и безопасны. Однако остаются и преграды: из-за того, что большая часть AAV при внутривенном введении распределяется в печень, в основном исследуются заболевания, связанные с этим органом, а также ЦНС, мышцами и глазами благодаря возможности местного введения. Кроме того, преимущественное распределение в печень капсидов в высоких дозах способно вызвать токсичность. Есть надежда, что инженерия капсидов и использование тканеспецифичных промоторов позволят создавать генные терапии и для таких важных органов, как сердце, почки и легкие.
Конечно, пока еще препараты на основе AAV несовершенны, но все говорит о том, что дальнейшее развитие технологии может позволить им совсем скоро стать одной из важных модальностей рынка фармакотерапии. Благо для улучшений лекарств на основе таких векторов, как мы могли видеть, существуют самые разные стратегии, а значит, приведенные прогнозы экспертов вполне могут оправдаться.
Biotechclub: AAV и другие биотехнологии
BiotechClub — это площадка для диалога Life Science ообщества, которая охватывает различные быстро развивающиеся области биотехнологий: разработку вакцин, методы лечения аутоиммунных и онкологических заболеваний, генную терапию (см. видео), machine-learning в биотехнологиях и другие. Конференция объединяет в дискуссии академические круги, правительство и бизнес. В этом году конференция пройдет в Санкт-Петербурге 26 и 27 октября и будет состоять из пяти треков: онкозаболевания, аутоиммунные заболевания, орфанные заболевания, COVID-19 и НЕмедицинские биотехнологии.
Доклад про перспективы применения векторов на основе аденоассоциированного вируса в генотерапии прозвучал в ходе IV научной конференции BiotechClub в 2020 году. Павел Гершович, директор департамента разработки генотерапевтических препаратов BIOCAD, рассказал об этом эффективном средстве доставки, с которым непосредственно связаны технологическая часть и направления развития генотерапевтического подхода.
Материал предоставлен партнёром — Департаментом разработки генотерапевтических препаратов компании BIOCAD