вакантная орбиталь что это
Атомы и электроны
Атомно-молекулярное учение
Описываемая модель атома называется «планетарной» и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20) в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.
Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило: порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим электроны занимают различные энергетические уровни.
Состоит из s-подуровня: одной «s» ячейки (2s 2 ) и p-подуровня: трех «p» ячеек (2p 6 ), на которых помещается 6 электронов
Состоит из s-подуровня: одной «s» ячейки (3s 2 ), p-подуровня: трех «p» ячеек (3p 6 ) и d-подуровня: пяти «d» ячеек (3d 10 ), в которых помещается 10 электронов
Состоит из s-подуровня: одной «s» ячейки (4s 2 ), p-подуровня: трех «p» ячеек (4p 6 ), d-подуровня: пяти «d» ячеек (4d 10 ) и f-подуровня: семи «f» ячеек (4f 14 ), на которых помещается 14 электронов
Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: «s», «p» и «d», которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или атомным орбиталям, движутся электроны, создавая определенный «рисунок».
Правила заполнения электронных орбиталей и примеры
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.
Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил. А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся одним электроном дополнили первую ячейку.
Внешний уровень и валентные электроны
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных электронов. Ниже будет дано наглядное объяснение этой задаче.
Большая Энциклопедия Нефти и Газа
Наличие вакантных орбиталей в подуровнях одного и того же уровня указывает на возможность перехода атома из невозбужденного состояния в возбужденное с формированием соответствующего количества неспаренных электронов. [1]
Наличие вакантных орбиталей в подуровнях одного и того же уровня указывает на возможность перехода атома из невозбужденного состояния в возбужденное с формированием соответствующего числа неспаренных электронов. [2]
Для образования я-дативной связи требуется наличие вакантных орбиталей у ионогенных групп полимера и подходящих по энергии и симметрии заполненных орбиталей у иона металла. Образование л-дативных связей увеличивает стабильность полимерного комплекса. [4]
Увеличение заряда центрального атома, уменьшение его размеров, наличие вакантных орбиталей способствуют проявлению элементами комплексообразу-ющих свойств. [6]
Проанализировать, как влияют на свойства атомов элементов следующие факторы: общее число электронов; форма электронных облаков; степень заселенности атомных орбиталей; степень замкнутости внешнего слоя; размеры и протяженность орбиталей; число неспаренных электронов на внешних орбиталях; наличие вакантных орбиталей и их энергия; структура предпоследнего электронного слоя. [8]
За счет донорно-акцепторного механизма увеличиваются валентные возможности атомов. В соединениях NH3 и BF3 азот и бор трехвалентны, в соединении H3NBF3 азот и бор четырехвалентны. Таким образом, валентность атомов зависит не только от количества неспаренных электронов, но и от наличия вакантных орбиталей и неподеленных электронных пар. Из общего количества электронных пар в образовании связи обычно участвует не больше одной. [10]
ОРБИТАЛЬ
ОРБИТАЛЬ – область наиболее вероятного местонахождения электрона в атоме (атомная орбиталь) или в молекуле (молекулярная орбиталь).
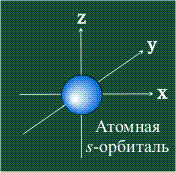
Электрон движется в атоме вокруг ядра не по фиксированной линии-орбите, а занимает некоторую область пространства. Например, электрон в атоме водорода может с определенной вероятностью оказаться либо весьма близко к ядру, либо на значительном удалении, однако существует определенная область, где его появление наиболее вероятно. Графически орбиталь изображают в виде поверхности, очерчивающей область, где вероятность появления электрона наибольшая, иначе говоря, электронная плотность максимальна. У атома водорода орбиталь электрона имеет сферическую (шаровую) форму:
К настоящему моменту описано пять типов орбиталей: s, p, d, f и g. Названия первых трех сложились исторически, далее был выбран алфавитный принцип. Формы орбиталей вычислены методами квантовой химии.
Орбитали существуют независимо от того, находится на них электрон (занятые орбитали), или отсутствует (вакантные орбитали). Атом каждого элемента, начиная с водорода и заканчивая последним полученным на сегодня элементом, имеет полный набор всех орбиталей на всех электронных уровнях. Их заполнение электронами происходит по мере увеличения порядкового номера, то есть, заряда ядра.
s-Орбитали, как было показано выше, имеют сферическую форму и, следовательно, одинаковую электронную плотность в направлении каждой оси трехмерных координат:
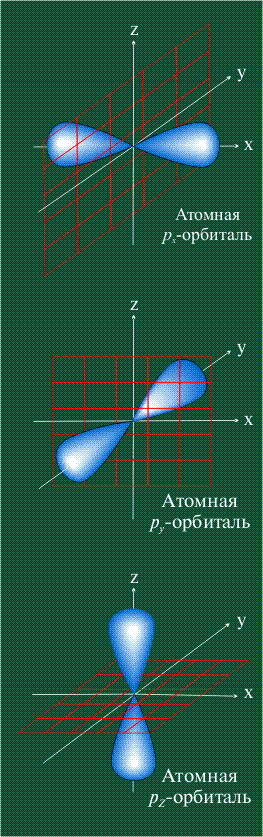
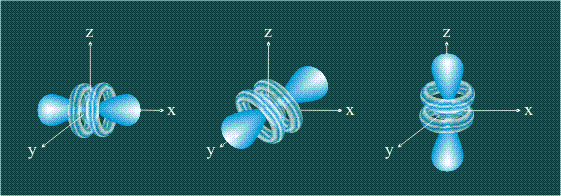
На первом электронном уровне каждого атома находится только одна s-орбиталь. Начиная со второго электронного уровня помимо s-орбитали появляются также три р-орбитали. Они имеют форму объемных восьмерок, именно так выглядит область наиболее вероятного местонахождения р-электрона в районе атомного ядра. Каждая р-орбиталь расположена вдоль одной из трех взаимоперпендикулярных осей, в соответствии с этим в названии р-орбитали указывают с помощью соответствующего индекса ту ось, вдоль которой располагается ее максимальная электронная плотность:
В современной химии орбиталь – определяющее понятие, позволяющее рассматривать процессы образования химических связей и анализировать их свойства, при этом внимание сосредотачивают на орбиталях тех электронов, которые участвуют в образовании химических связей, то есть, валентных электронов, обычно это электроны последнего уровня.
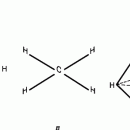
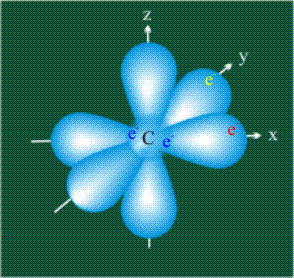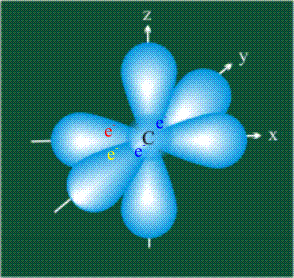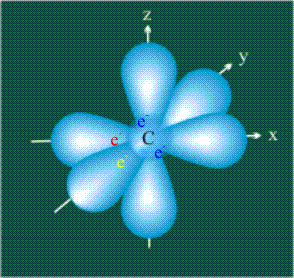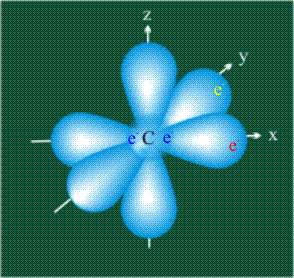
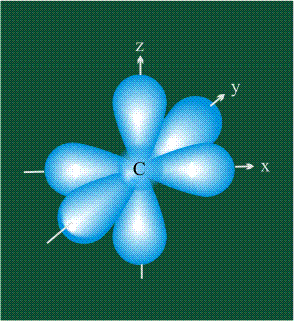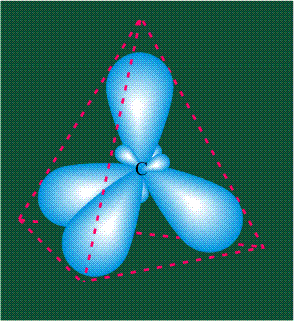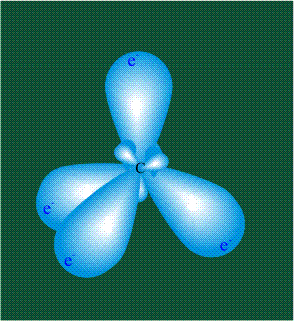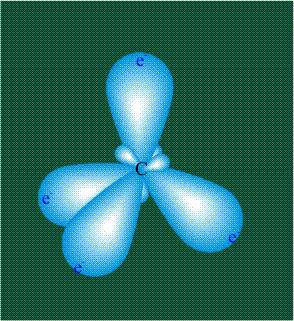
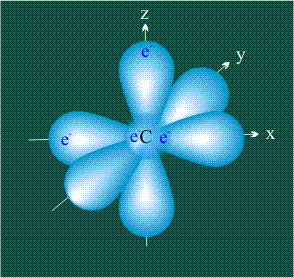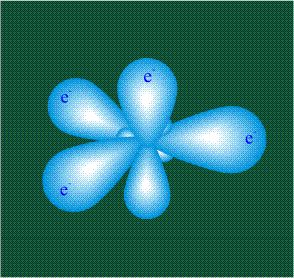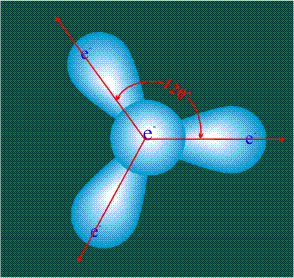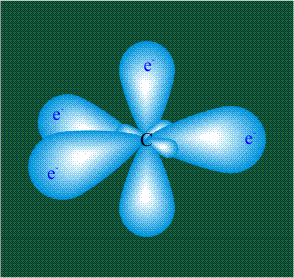
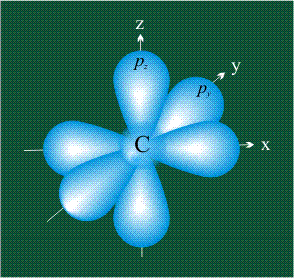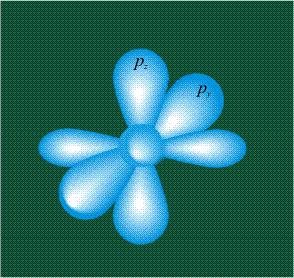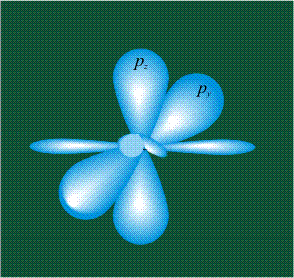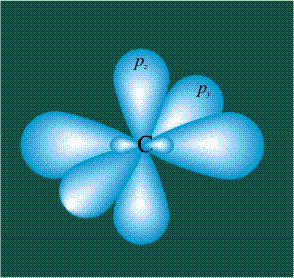
У атома углерода в исходном состоянии на втором (последнем) электронном уровне находится два электрона на s-орбитали (отмечены синим цветом) и по одному электрону на двух р-орбиталях (отмечены красным и желтым цветом), третья орбиталь – рz-вакантная:
Гибридизация.
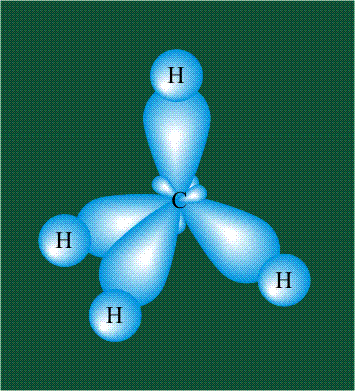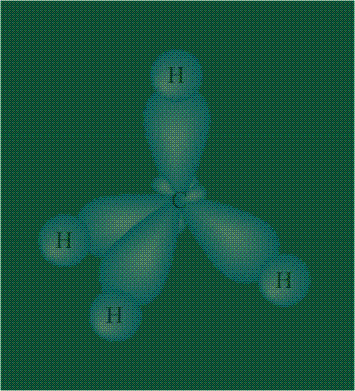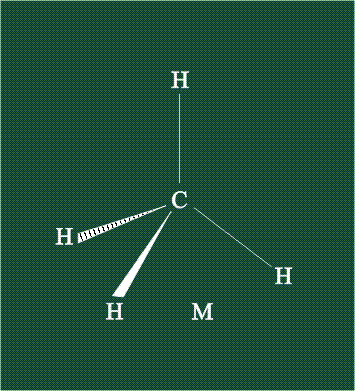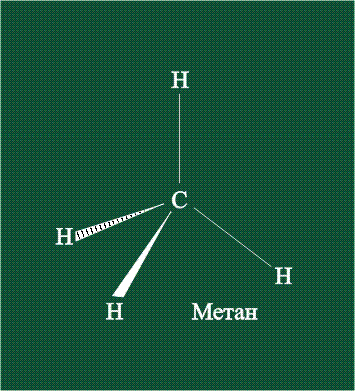
В том случае, когда атом углерода участвует в образовании насыщенных соединений (не содержащих кратных связей), одна s-орбиталь и три р-орбитали объединяются, образуя новые орбитали, представляющие собой гибриды исходных орбиталей (процесс называют гибридизацией). Количество гибридных орбиталей всегда равно количеству исходных, в данном случае, четыре. Получившиеся орбитали-гибриды одинаковы по форме и внешне напоминают асимметричные объемные восьмерки:
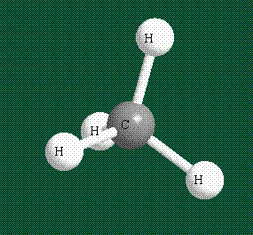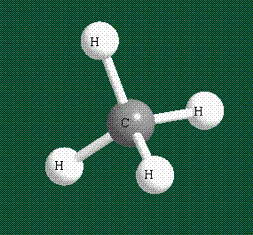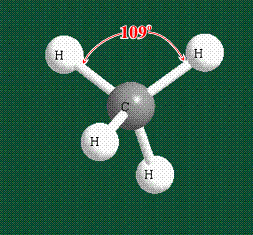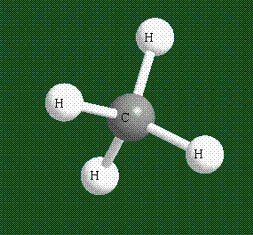
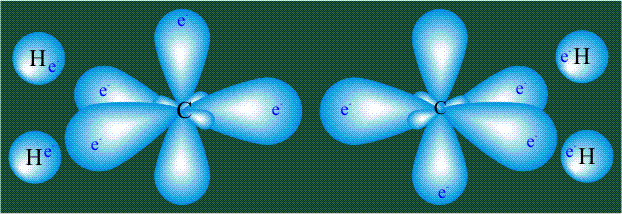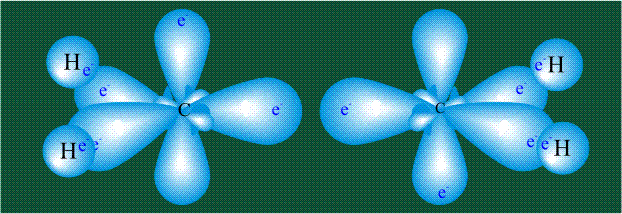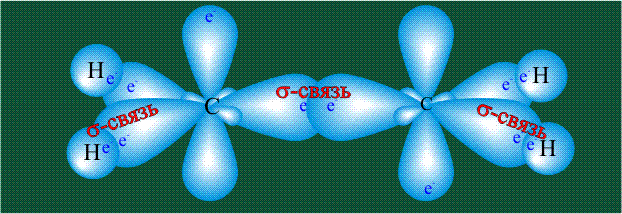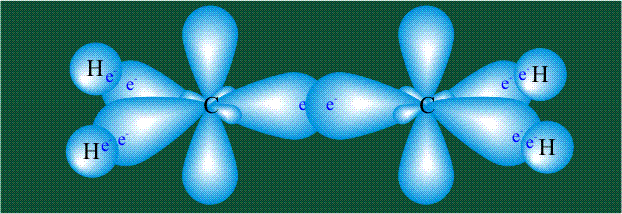
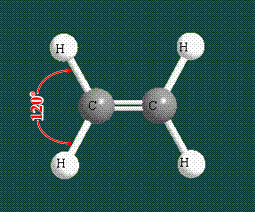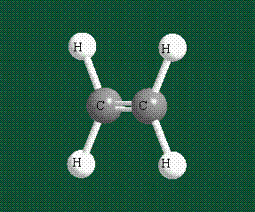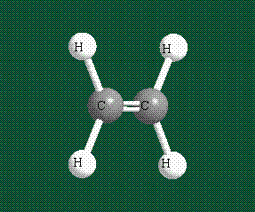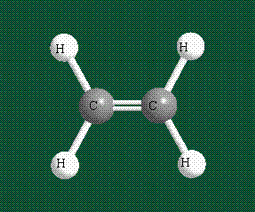
Вся конструкция оказывается как бы вписанной в правильный тетраэдр – призма, собранная из правильных треугольников. При этом орбитали-гибриды располагаются вдоль осей такого тетраэдра, угол между любыми двумя осями – 109°. Четыре валентных электрона углерода располагаются на этих гибридных орбиталях:
Участие орбиталей в образовании простых химических связей.
Свойства электронов, разместившихся на четырех одинаковых орбиталях, эквивалентны, соответственно, будут эквивалентны химические связи, образованные с участием этих электронов при взаимодействии с атомами одного типа.
Взаимодействие атома углерода с четырьмя атомами водорода сопровождается взаимоперекрыванием вытянутых гибридных орбиталей углерода со сферическими орбиталями водородов. На каждой орбитали находится по одному электрону, в результате перекрывания каждая пара электронов начинает перемещаться по объединенной – молекулярной орбитали.
В традиционном написании структуры образовавшегося метана вместо перекрывающихся орбиталей используют символ валентной черты. Для объемного изображения структуры валентность, направленную от плоскости чертежа к зрителю показывают в виде сплошной клиновидной линии, а валентность, уходящую за плоскость рисунка – в виде штриховой клиновидной линии:
Таким образом, структура молекулы метана определяется геометрией гибридных орбиталей углерода:
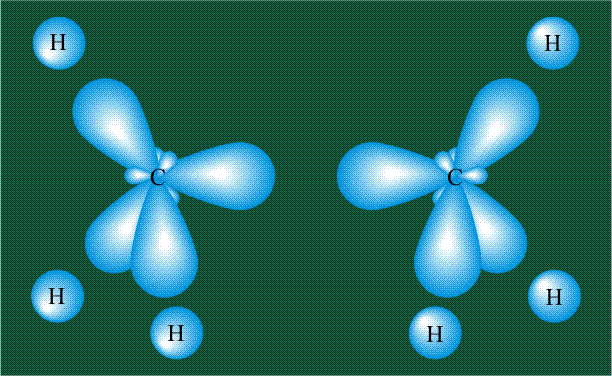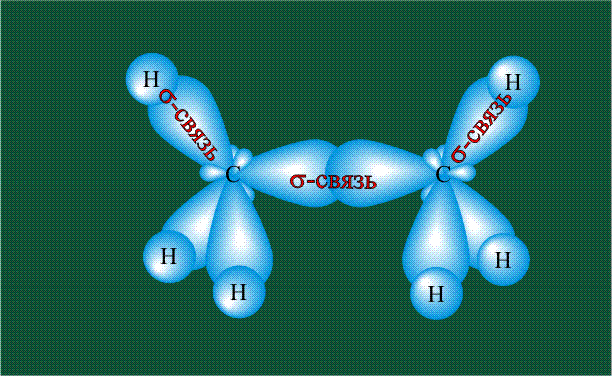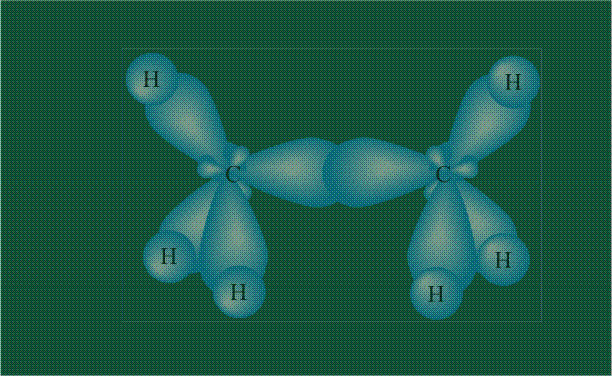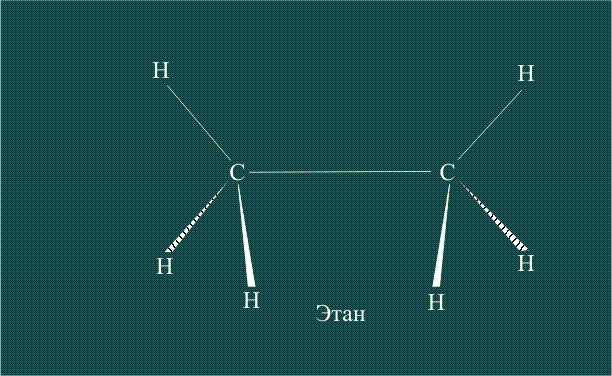
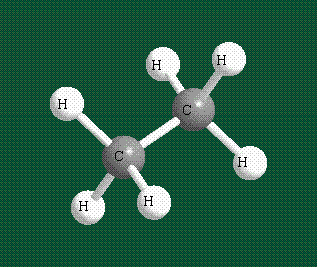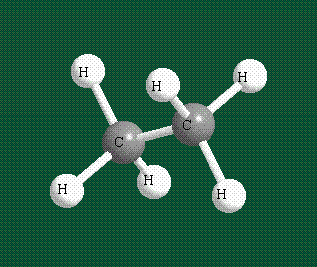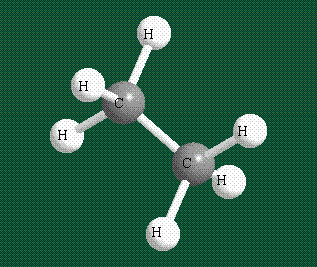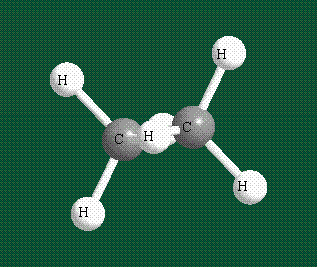
Образование молекулы этана аналогично показанному выше процессу, отличие состоит в том, что при взаимоперекрывании гибридных орбиталей двух атомов углерода происходит образование С-С – связи:
Участие орбиталей в образовании кратных химических связей.
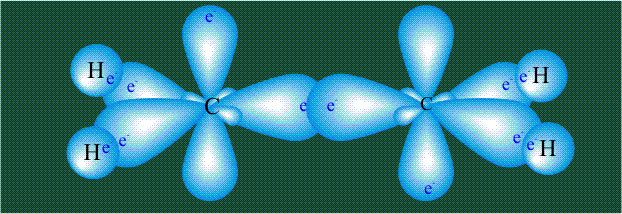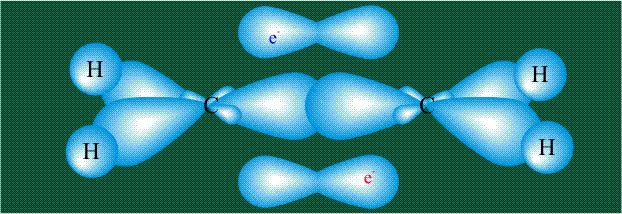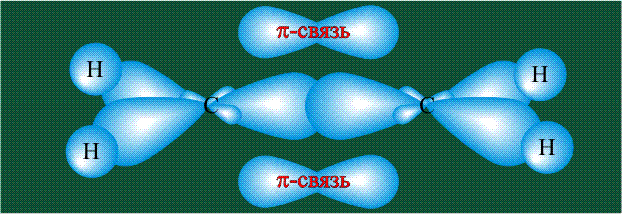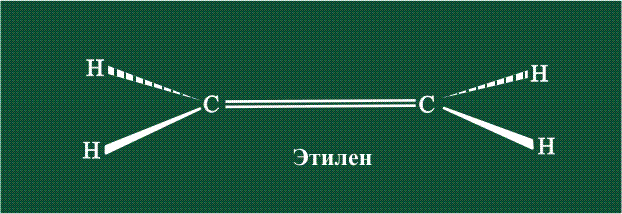
Молекула этилена образована также с участием орбиталей-гибридов, однако в гибридизации участвуют одна s-орбиталь и только две р-орбитали (рх и ру), третья орбиталь – pz, направленная вдоль оси z, в образовании гибридов не участвует. Из исходных трех орбиталей возникают три гибридных орбитали, которые располагаются в одной плоскости, образуя трехлучевую звезду, углы между осями – 120°:
Вторая валентная черта в обозначении двойной связи, широко используемая для изображения ненасыщенных соединений уже не одно столетие, в современном понимании подразумевает наличие двух областей с повышенной электронной плотностью, расположенных по разные стороны линии связи С-С.
Структура молекулы этилена задана геометрией гибридных орбиталей, валентный угол Н-С-Н – 120°:
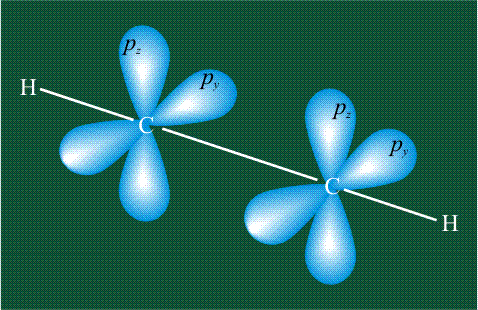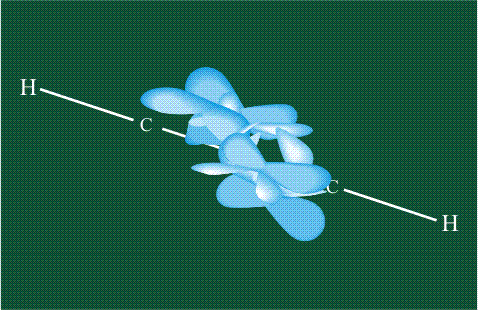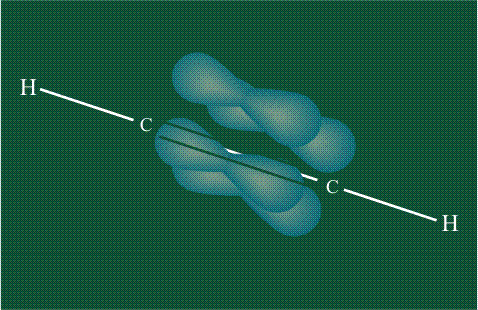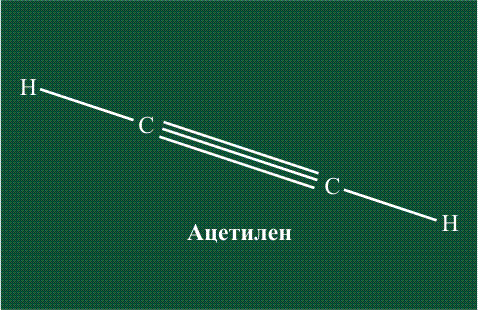
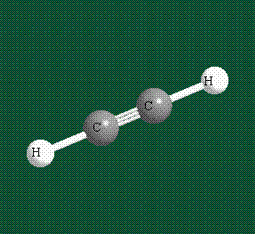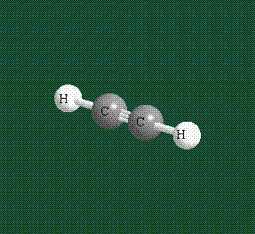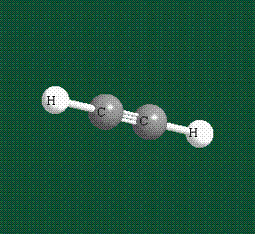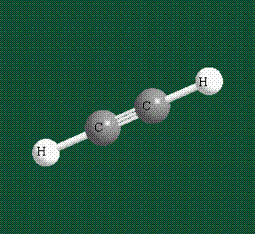
При образовании ацетилена в гибридизации участвует одна одна s-орбиталь и одна рx-орбиталь (орбитали pyи pz, в образовании гибридов не участвуют). Две образовавшиеся гибридные орбитали располагаются на одной линии, вдоль оси х:
В итоге молекула ацетилена имеет палочкообразную форму:
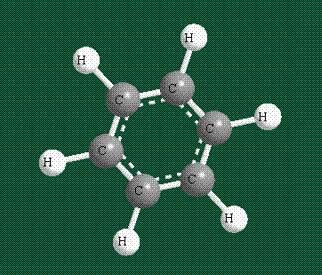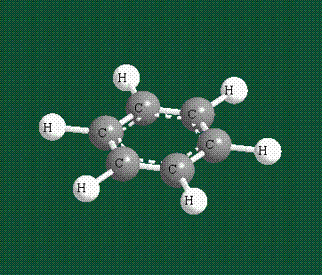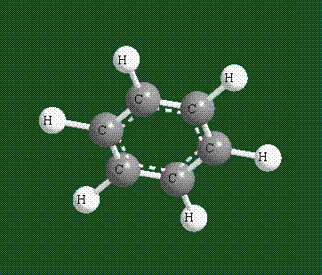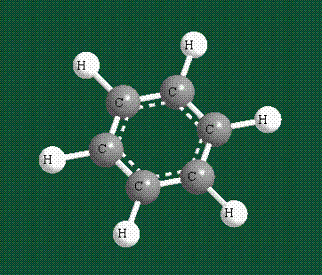
У бензола остов молекулы собран из атомов углерода, имеющих гибридные орбитали, составленные из одной s— и двух р-орбиталей, расположенные в форме трехлучевой звезды (как у этилена), р-орбитали, не участвующие в гибридизации, показаны полупрозрачными:
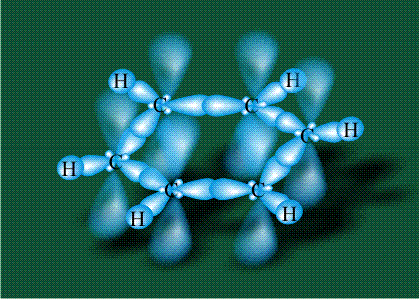
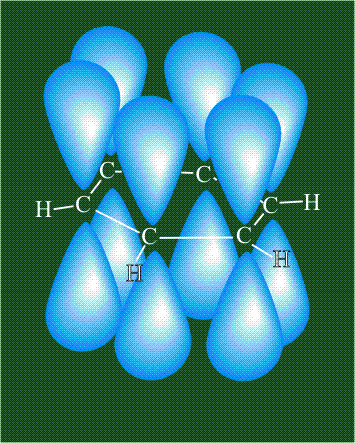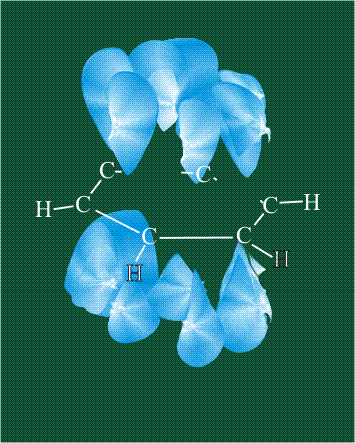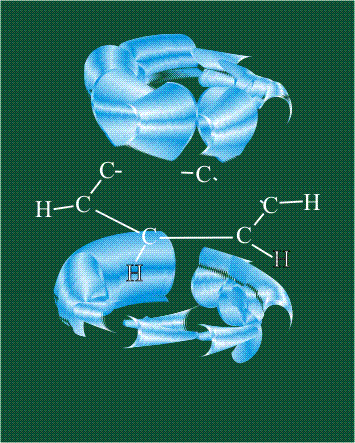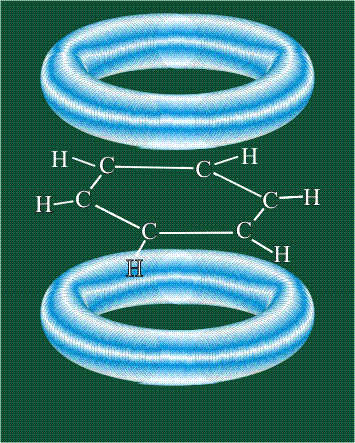
Шесть оставшихся р-орбиталей взаимоперекрываются, образуя молекулярную орбиталь в виде двух кольцевых областей, над и под плоскостью бензольного цикла:
Возникает единая замкнутая электронная система (см. также АРОМАТИЧНОСТЬ).
Молекула бензола плоская, что задано плоской конфигурацией «трехлучевых звезд», из которых она собрана. Молекулярную орбиталь, образованную перекрыванием шести атомных р-орбиталей обозначают в виде кольцевого символа внутри бензольного цикла:
В образовании химических связей могут также участвовать вакантные, то есть, не содержащие электронов орбитали (см. также ТРЕХЦЕНТРОВЫЕ СВЯЗИ).
Орбитали высоких уровней.
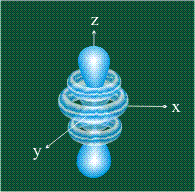
Начиная с четвертого электронного уровня, у атомов появляются пять d-орбиталей, их заполнение электронами происходит у переходных элементов, начиная со скандия. Четыре d-орбитали имеют форму объемных четырехлистников, называемых иногда «клеверным листом», они отличаются лишь ориентацией в пространстве, пятая d-орбиталь представляет собой объемную восьмерку, продетую в кольцо:
d-Орбитали могут образовывать гибриды с s- и p-орбиталями. Параметры d-орбиталей обычно используют при анализе строения и спектральных свойств в комплексах переходных металлов.
Начиная с шестого электронного уровня, у атомов появляются семь f-орбиталей, их заполнение электронами происходит в атомах лантаноидов и актиноидов. f-Орбитали имеют довольно сложную конфигурацию, ниже на рисунке показана форма трех из семи таких орбиталей, имеющих одинаковую форму и ориентированных в пространстве различным образом:
f-Орбитали весьма редко используют при обсуждении свойств различных соединений, поскольку расположенные на них электроны практически не принимают участия в химических превращениях..
Перспективы.
На восьмом электронном уровне находится девять g-орбиталей. Элементы, содержащие электроны на этих орбиталях, должны появится в восьмом периоде, пока они недоступны (в ближайшее время ожидается получение элемента № 118, последнего элемента седьмого периода Периодической системы, его синтез проводят в Объединенном институте ядерных исследований в Дубне).
Форма g-орбиталей, вычисленная методами квантовой химии, еще более сложная, чем у f-орбиталей, область наиболее вероятного местонахождения электрона в данном случае выглядит весьма причудливо. Ниже показан внешний вид одной из девяти таких орбиталей:
В современной химии представления об атомных и молекулярных орбиталях широко используют при описании строения и реакционных свойств соединений, также при анализе спектров различных молекул, в некоторых случаях – для прогнозирования возможности протекания реакций.
Вакантная орбиталь что это
Если l=0, то независимо от n, волновые функции s – электронов имеют шаровую форму.
Если l=1, то конфигурация гантели.
Магнитное квантовое число m определяет квантовый характер взаимодействия электронов атома с внешним магнитным полем. m определяет число орбиталей на каждом подуровне и задает взаимное расположение электронных облаков на данном подуровне.
m принимает целочисленные отрицательные и положительные значения от –l до +l включая ноль, т.е. каждому значению l соответствует свой набор магнитных квантовых чисел m, состоящей из 2е+1 таких чисел.
Для s – подуровня l=0 и m=0
Т. е., на s – подуровне всегда существует одна s – орбиталь.
Для p – подуровня l = 1 и m=-1; 0; +1, т.е. p – подуровень всегда имеет три орбитали.
Спиновое квантовое число
Спин – это собственный момент количества движения электрона. Спин характеризует направление вращения и, следовательно, при двух возможных направлениях механического вращения должно существовать два разных спина электрона.
Решение систем уравнений Шрёдингера, потенциальной энергии и граничных условий описывает полные энергии Е и волновые функции ψ всех возможных орбиталей атома, но не дает ответа на следующие вопросы:
Сколько электронов может находиться на одной орбитали, одном подуровне, одном уровне?
В какой последовательности заполняются орбитали, подуровни, уровни?
Чтобы ответить на эти вопросы рассмотрим принцип Паули, принцип минимума энергии, правило Хунда.
Принцип Паули В. (1925г.):
В атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел.
Принцип Паули определяет максимальную емкость по электронам одной орбитали.
— вакантная орбиталь (электронная ячейка)
— полузаселенная орбиталь (орбиталь, занятая неспаренным электроном)
— полностью заселенная орбиталь (орбиталь, занятая электронной парой)
Принцип Паули также определяет электронную емкость подуровней и уровней.
Ne =2(2l+1) для подуровня
Максимальная емкость уровня по электронам суммируется из величин Nе подуровней этого уровня.
Nn =2n 2 для уровня.
Принцип минимума энергии
Наиболее устойчивыми состояниями любой системы (атома, молекулы) являются состояния с минимальным запасом энергии.
Для атома этот принцип означает, что электроны в атоме заполняют уровни с наименьшими значениями главного квантового числа n, а в пределах уровня сначала заполняются подуровни с наименьшими значениями орбитального квантового числа l.
Правило Хунда. (1927г.)
Орбитали, принадлежащие к одному подуровню, заполняются каждая в начале одним электроном, а затем происходит их заполнение векторными электронами. (электроны, по одиночке заполняющие орбитали одного и того же подуровня, имеют защищающие орбитали одного и того же подуровня, имеют одинаковые спины). Например
Учитывая взаимное расположение орбиталей в пространстве,
правило Хунда приобретает простой физический смысл:
электроны одного подуровня, отталкиваясь друг от друга, стремятся
занять по возможности удаленные друг от друга, т.е.
разные орбитали подуровня.
правильное изображение: 2p
неправильное изображение 2p
неправильное изображение 2p
Электронные формулы – фиксируют занятые электронами подуровни и число электронов на них.
Цифрами обозначают номер уровня
Буквами – номер подуровня.
N 1s 2 2s 2 2p 3 2+2+3=7 электронов
— изображают атом элемента в виде совокупности орбиталей, которые также называются квантовыми ячейками.
Следует отметить, что в электронно – структурных формулах в отличие от электронных изображают не только заполненные, но и вакантные орбитали валентных подуровней, что позволяет предсказать изменение валентности элемента в результате перехода в возбужденное состояние обозначают символом соответственного элемента со звездочкой.
P основное состояние В=3
p* возбужденное состояние В=5
Энергия подуровней возрастает в следующем порядке:
1s последовательность подуровней описывается правилом Клечковского:
1) Уровни и подуровни атомов заполняются электронами в порядке возрастания суммы главного и орбитального квантовых чисел (n+l)
Порядковый номер элемента
Впервые физический смысл порядкового номера раскрыл Ван – де – Брук. Он теоретически доказал, что порядковый номер элемента равен заряду ядер его атомов. Эта гипотеза была экспериментально подтверждена Мозли при изучении спектров рентгеновского излучения, испускаемого простыми веществами при их бомбардировке электронным пучком высокой энергии.
Работы Ван – де – Брука и Мозли дали возможность установить правильность расположения элементов в периодической таблице, определить общее число элементов в каждом периоде и оказали, что порядковый номер, а не атомная масса, является важнейшим свойством элемент, определяющим электронную структуру атомов.
Периодическая система Д.И.Менделеева
В 1869 году русский ученый Д.И.Менделеев составил таблицу, включающую большинство известных элементов, в которой элементы были сгруппированы в нескольких горизонтальных рядах так, что вертикальные столбцы включали элементы, сходные по химическим свойствам. Эта таблица, которую Менделеев называл системой элементов.
Кроме того, был открыт и сформулирован закон периодичности, основанный на закономерности изменений свойств элементов при увеличении масс атомов: « Свойства простых тел, также формы и свойства соединений элементов, находятся в периодической зависимости от величины атомных весов элементов».
Ко времени открытия Д.И.Менделеевым периодического закона строение атома было неизвестно.
Современная формулировка ПЗ:
«Свойства химических элементов и образуемых ими простых и сложных соединений находятся в периодической зависимости от заряда ядра их атомов».
Структура ПС элементов определяется строением электронных уровней и подуровней атомов. Основной структурной единицей системы элементов является период.
Периодом с номером n называется совокупность химических элементов, начинающаяся s-элементами и заканчивающаяся p-элементами.
Исключение составляет первый период, в котором нет p-элементов, т.к. на первом энергетическом уровне (n=1) существует только 1s-подуровень, в нем содержится всего два элемента: Н и Не. Водород вследствие специфичности свойств помещают либо в первую группу, либо в седьмую, либо в обе одновременно, заключая в одной из групп символ в скобки. Эти способы расположения водорода основаны на том, что он имеет некоторые формальные черты сходства как со щелочными металлами, так и с галогенами.
P-элементы – достраивается p подуровень
D-элементы – достраивается d подуровень
F-элементы – достраивается f подуровень
Второй и третий периоды содержат по восемь элементов (по два s, по шесть p), четвертый и пятый периоды включают, кроме того, по 10 d-элементов, а шестой и седьмой периоды имеют в составе еще и по 14 f-элементов.
В периодах происходит повторение строения валентных электронных оболочек. Элементы с одинаковыми конфигурациями электронных оболочек образуют вертикально расположенные в ПС подгруппы и группы.
Свойства химических элементов закономерно изменяются в периодах при переходе от щелочных металлов к благородным газам, а также в группах при переходе от элементов с малыми номерами периодов к элементам с большими номерами периодов (от Li к Cs, от F к I).
Широкое распространение получили коротко и длиннопериодный вариант ПС.
Длиннопериодный вариант является более наглядным, но менее компактным.
Особенности данного варианта:
в пределах групп соблюдается подобие элементов;
3. периоды сильно различаются по числу входящих в них элементов;
4. неметаллы образуют компактный «треугольник», состоящий из 1s и части p-элементов.
Элементы B, Si, As, Te, At, находящиеся на диагональной границе треугольника, иногда называют полуметаллами из-за их двойственных свойств.
Короткопериодный вариант таблицы получен механическим выносом f-элементов в отдельную таблицу и совмещением d-элементов с s-элементами, их внесением в группы с тем же числом внешних электронов.
s и p-элементы разделены секцией d-элементов (в 6 и 7 периоде еще и секцией f-элементов), поэтому d-элементы ещё называются переходными элементами.
3. группы элементов раздваиваются, появляется понятие «подгруппа».
В подгруппах содержатся элементы, схожие по химическим свойствам. В большинстве групп элементы главной и побочной подгрупп обнаруживают определенное химическое сходство, преимущественно в высших степенях окисления.
Для атомов элементов главных подгрупп валентными являются электроны застраивающихся s и p-подуровней, для атомов элементов побочных групп – электроны s и d-подуровней, к которым у атомов лантаноидов и актиноидов добавляются электроны f-подуровня.
Именно между этими валентными подуровнями происходит «перескок» электронов, который вызывает отклонение электронных конфигураций от последовательности заполнения. Однако большого влияния на химические свойства элементов такие переходы как у хрома (3d 4 4s → 3d 5 4s 1 ) или меди (3d 9 4s 2 → 3d 10 4s 1 ) существенного влияния не оказывают, т.к. эти электроны все равно останутся валентными.
4. восьмая группа включает четыре подгруппы: подгруппу благородных газов и подгруппы железа, кобальта и никеля.
Чаще используют короткопериодный вариант, ввиду его компактности.
Свойства атомов элементов и периодичность их изменения.
К важнейшим свойствам атомов относятся потенциал ионизации, сродство к электрону, электроотрицательность, радиус.
Потенциал ионизации I – это энергия, которую необходимо затратить для удаления одного электрона с валентной орбитали свободного (изолированного) атома в основном состоянии.
Различают 1-ый, 2-ой и т.д. потенциалы ионизации, т.е. потенциалы, отвечающие удалению 1-го, 2-го и т.д. электронов.
Удаление 1-го электрона с орбитали можно описать уравнением:
В группах, сверху вниз, значение I 1 уменьшаются. Это уменьшение сильнее всего выражено в подгруппе благородных газов и слабо – в подгруппе щелочных металлов.
Величина потенциала ионизации может служить мерой «металичности» элемента: чем меньше потенциал ионизации, тем легче оторвать электрон от атома, тем сильнее должны быть выражены металлические свойства элемента.
Кроме экранирования проявляется значительное взаимное отталкивание электронов, если они занимают одну и туже орбиталь.
Сродство к электрону.
Сродство к электрону – это энергия, которая выделяется в результате присоединения электрона нейтральным атомом и превращения его в анион:
В целом с ростом порядкового номера элемента в периоде Е растет, а в группе уменьшается.
Сродство к электрону атомов металлов близко к нулю или отрицательно, т.е. для атомов большинства металлов присоединение электронов энергетически невыгодно.
Электроотрицательность.
Электроотрицательность – это мера способности атома элемента к приобретению отрицательного заряда при образовании химической связи. Для практической оценки этой способности широко распространена шкала электроотрицательностей, основанная на термохимических данных, предложенная Полингом. По такой шкале наиболее электроотрицательным элементом является фтор, а наимение электроотрицательным – франций.
С ростом порядкового номера элемента электроотрицательность увеличивается по периоду и уменьшается внутри группы.
Атомы электроотрицательных элементов обладают высоким сродством к электрону. Атомы таких элементов очень просто удерживают собственные электроны и имеют свойство принимать дополнительные электроны в химических реакциях.
F – является самым электроотрицательным элементом.
Радиус атома.
Радиус атома в зависимости от заряда ядра изменяется периодически. По периоду с увеличением заряда ядра радиус уменьшается, что связано с увеличивающимся притяжением электронов наружного слоя к ядру по мере возрастания его заряда. При переходе к следующему периоду, атомные радиусы увеличиваются.
В пределах подгруппы с ростом заряда ядра радиусы атомов элементов увеличиваются, т.к. с ростом номера элемента в подгруппе всегда увеличивается число экранирующих подуровней.
При отдаче атомом электронов уменьшается его эффективный размер, а присоединение электронов вызывает его увеличение. Отсюда радиус катиона всегда меньше, а радиус аниона всегда больше радиуса соответствующего электронейтрального атома. В пределах одной подгруппы радиусы ионов одинакового заряда возрастают с увеличением заряда ядра. Это можно объяснить увеличением числа энергетических уровней и растущим удалением внешних электронов от ядра.
Общие химические свойства элементов.
— металличность и неметалличность элемента;
— кислотно-основные свойства элемента;
— окислительно-восстановительные свойства элементов.
Металличность и неметалличность
Количественно металличность и неметалличность определяются электроотрицательностью элемента. Чем ниже электроотрицательность, тем больше электроположительность, т.е. сильнее выражены металлические свойства. Чем больше электроотрицательность, тем сильнее неметаллические свойства.
По периодам металличность уменьшается, неметалличность увеличивается. По группам металлические свойства возрастают. Самым ярко выраженным металлом является цезий, неметаллом – фтор.
Кислотно-основные свойства
Электроположительные металлы (щелочные) образуют самые сильные основания. Электроотрицательные элементы образуют сильные кислородсодержащие кислоты.
NaOH – сильное основание (щелочь)
Al(OH)3 – амфотерное соединение
HClO4 – оч. сильная кислота
По периодам способность к образованию оснований уменьшается и увеличивается способность к образованию кислот.
В группах электроотрицательных элементов нарастает сила бескислородных кислот: H2O, H2S, H2Te.
Окислительно-восстановительные свойства.
Наиболее электроотрицательные элементы являются сильными окислителями, а электроположительные элементы, щелочные металлы являются восстановителями.
По периодам восстановительные свойства ослабевают и возрастают окислительные свойства элементов.
III период: в последовательности Na, Mg, Al, Si, P восстановительная способность уменьшается, окислительная способность растет в последовательности P, S, Cl.
Окислительные свойства элементов зависят от числа проявляемых им степеней окисления. По периоду это число возрастает (Na – 0, +1, a Cl – шесть).
По группам увеличивается восстановительная и уменьшается окислительная способности:
II группа – Be, Mg, Ca, Sr, Ba Самый сильный восстановитель – барий
ТЕМА. Химическая связь
Химическая Связь – взаимодействие атомов, обусловленное перекрыванием их электронных облаков и сопровождающееся уменьшением энергии системы.
В зависимости от характера распределения электронной плотности между ковалентную, ионную и металлическую.
Основные параметры Х.С.- длина связи, прочность, валентные углы.
Валентный угол (угол связи) – это угол между воображаемыми прямыми, проходящими через ядра химически связанных атомов.
Прочность связи определяется энергией связи. Количественно она оценивается энергией разрыва такой связи
Энергия связи Еон= 464 кДж/ моль
Ковалентная связь
Ковалентная связь(К.С.)- тип химической связи между двумя атомами, возникающей при обобществлении электронов, которые принадлежат этим атомам.
Первую гипотезу о природе ковалентной связи выдвинул Льюис (1916). Рассмотрим образование молекулы Н2 из отдельных атомов. Изолированные атомы, имеющие электроны с противоположно направленными спинами, при сближении притягиваются друг к другу. При этом их электронные облака (АО) перекрываются с образованием общего молекулярного облака (молекулярной орбитали МО), максимальная плотность которого расположена в межъядерном пространстве.-
Н · ·Н Н : Н Обычно обобществлённая пара электронов заменяется черточками Н-Н.
Для более сложных молекул, чем Н2, точное решение уравнения Шредингера получить невозможно. Поэтому на практике используются приближенные методы квантомеханического расчета таких систем. Это метод валентных связей (МВС) и метод молекулярных орбиталей(ММО).
Основные положения МВС:
1) ковалентная связь образуется двумя атомами за счет двух электронов с антипараллельными спинами, т.е. химическая связь локализована между двумя атомами;
2) связь располагается в том направлении, в котором возможность перекрывания электронных облаков наибольшая;
3) ковалентная связь является тем более прочной, чем более полно перекрываются электронные облака.
Способы образования ковалентной связи. Валентность.
Так как нахождение 2 электронов в поле действия двух ядер энергетически выгоднее, чем пребывание каждого электрона в поле своего ядра, то в образовании К.С. принимают участие все одноэлектронные орбитали внешнего энергетического уровня.