в результате гликолиза образуется что
Гликолиз
Гликолиз (от греческого glykys — сладкий и …лиз), путь Эмбдена — Мейергофа — Парнаса, ферментативный анаэробный процесс негидролитического распада углеводов (главным образом глюкозы) до молочной кислоты.
Значение гликолиза в физиологии живых организмов
Филогенетически гликолиз наиболее древний путь расщепления глюкозы, широко распространён в природе и играет важную роль в обмене веществ живых организмов. Обеспечивает клетку энергией в условиях недостаточного снабжения кислородом (у облигатных анаэробов гликолиз — единственный процесс, поставляющий энергию), а в аэробных условиях гликолиз является стадией, предшествующей дыханию — окислительному распаду углеводов до CO2 и H2O.
У высших животных, в том числе млекопитающих, гликолиз интенсивно происходит в скелетных мышцах, печени, сердце, эритроцитах, сперматозоидах, эмбриональных и других растущих (в т. ч. опухолевых) тканях. Ферменты гликолиза локализованы в растворимой части цитоплазмы клеток. Многим микроорганизмам свойствен идентичный гликолизу процесс гомоферментативного молочнокислого брожения. Большинство других типов сбраживания углеводов являются вариантами гликолиза.
Гликолиз – ход реакции

В процессе последующего превращения 3-фосфоглицериновой кислоты в пировиноградную кислоту через стадию образования фосфоенолпирувата (реакции 8–10 ) образуется ещё одна молекула АТФ.
При восстановлении пировиноградной кислоты за счёт восстановленного НАД возникает конечный продукт гликолиза — молочная кислота (реакция 11 ).
Таким образом, при распаде одной молекулы глюкозы по гликолитическому пути образуется:
Гликолиз энергетически менее выгоден, чем дыхание, так как поставляет около 5% энергии, которая может быть получена при полном окислении глюкозы до CO2 и H2O. Кроме глюкозы в гликолиз могут вовлекаться другие гексозы (манноза, галактоза, фруктоза), пентозы и глицерин.
Субстратом гликолиза у животных может также служить гликоген (в этом случае процесс называется гликогенолизом), а у растений — крахмал, глюкозные единицы которых вовлекаются в гликолиз благодаря действию гликоген фосфорилазы (реакция 12 ) или фосфорилазы крахмала и фосфоглюкомутазы (реакция 13 ).
В процессе гликогенолиза (наиболее интенсивно протекает в мышцах) при распаде одной глюкозной единицы запасается три молекулы АТФ.
Ключевой стадией, лимитирующей скорость гликолиза, является реакция, катализируемая аллостерическим ферментом фосфофруктокиназой, активность которого стимулируется АМФ и АДФ и подавляется АТФ и лимонной кислотой. Важную роль в регуляции играют также другие ферменты гликолиза. В присутствии кислорода скорость гликолиза снижается в связи с началом дыхания (эффект Пастера), это обеспечивает более эффективный механизм образования богатых энергией связей. В опухолевых клетках, безъядерных эритроцитах, эмбриональных и некоторых других тканях обнаружен активный гликолиз в присутствии O2 (т. н. аэробный гликолиз).
Параграфы 32 и 34 Гликолиз. Аэробный обмен углевод
Автор текста – Анисимова Е.С.
Продавать текст нельзя. Авторские права защищены.
Для замечаний:
https://vk.com/bch_5
Параграфы 32 и 34.
Реакции, формулы и ферменты см. в файле «32 ФОРМУЛЫ ГЛИКОЛИЗа».
ПАРАГРАФ 32:
«Гликолиз».
Параграф 34:
«Аэробный обмен углеводов».
Гликолиз – это процесс превращения глюкозы в пируват (10 реакций).
Считается вторым этапом катаболизма (второй называется унификацией) в обмене углеводов – см. п.20.
Локализация процесса – гликолиз протекает во всех клетках организма, в гиалоплазме.
Глюкоза для гликолиза и других процессов поступает в клетки из крови, для чего в крови должна поддерживаться достаточная концентрация глюкозы (от 3 ммоль/л – см. п.37).
Транспорт глюкозы через мембраны клеток осуществляется специальными белками-переносчиками глюкозы. Транспорт глюкозы в клетки многих тканей (например, жировой и мышечной тканей, но не нейронов и эритроцитов) стимулируется инсулином (см. п.102, 103); и поэтому при снижении количества инсулина в крови или снижении действия инсулина (при диабете) транспорт глюкозы в клетки названных тканей снижен, что приводит к дефициту глюкозы в клетках и к избытку глюкозы в крови – см. п.37.
Кроме того, при расщеплении гликогена в мышцах (гликогенолизе – см.п.31) образуется метаболит гликолиза – глюкозо-6-фосфат, который сразу вступает во вторую реакцию гликолиза.
32.2. Конечные метаболиты гликолиза, значение и тканевые особенности
(то есть в каких клетках и тканях какие варианты бывают).
Центральным конечным метаболитом гликолиза является ПИРУВАТ (2 молекулы пирувата образуются из одной молекулы глюкозы).
Дальнейшие превращения пирувата зависят от условий, в которых протекает гликолиз – или в лактат, или в ацетилКоА, или в оксалоацетат (см. далее).
32.2.1. Превращения пирувата В АЭРОБНЫХ УСЛОВИЯХ
(АЭРОБНЫЙ ОБМЕН УГЛЕВОДОВ:
это гликолиз до пирувата и дальнейшие превращения пирувата, о которых тут сказано):
При наличии кислорода и возможности его использования (то есть в аэробных условиях в митохондриях во всех клетках, кроме эритроцитов)
1 – пируват может превратиться в АЦЕТИЛ-КоА под действием ПДГ (см. п.20, 21, «32 формулы гликолиз»), что даёт по 2,5 АТФ от каждой молекулы пирувата.
Пируват ; ацетилКоА + 2,5 АТФ
2.1 – АцетилКоА может поступить в ЦТК, что может привести к выработке 10 молекул АТФ от каждой молекулы ацетилКоА. И превращению ацетилКоА в углекислый газ для выдоха. Что завершает распад углеводородного скелета молекулы глюкозы.
ацетилКоА ; 2СО2 + 10 АТФ (при поступлении в ЦТК и ДЦ)
2.2 – В печени ацетилКоА может использоваться для синтеза жирных кислот (при сытости, см. п.46),кетоновых тел (при голоде и стрессе, см. п.47) и холестерина (см. п.49), а также (через реакции ЦТК) – аминокислот глутамата, глутамина и т.д. (см. п.67).
ацетилКоА ; жирные кислоты, кетоновые тела, холестерин, аминокислоты (с оксалоацетатом)
3 – Из пирувата может образоваться аминокислота АЛАНИН (см. п.64, 67 и 33) и кетокислота ОКСАЛОАЦЕТАТ (см. п.33), которая может 1) использоваться в ЦТК (см.п. 21) и 2) для синтеза аминокислоты аспартата для синтеза аспарагина, белков, для обезвреживания аммиака в синтезе мочевины (см.п.66) и для синтеза нуклеотидов (а затем РНК и ДНК).
4 – из метаболита гликолиза 3-фосфоглицерата (см. п.67) может синтезироваться аминокислота СЕРИН, из которой могут синтезироваться глицин, цистеин, липоиды (см. п.52).
Пируват ; аланин или оксалоацетат (; аспартат ; мочевина или нуклеотиды ; ДНК и РНК)
ОКСАЛОАЦЕТАТ для ЦТК или ; аспартат ; мочевина или нуклеотиды ; ДНК и РНК)
; (биотин!)
Аланин ; ПИРУВАТ ; (ПДГ) АЦЕТИЛ-КоА (+ 2,5 АТФ) ; (в ЦТК) 2СО2 + 10 АТФ (всего 12,5 АТФ)
; (под действием ПДГ, витамины – В1, В2, РР, пантотенат, липоевая)
ацетилКоА ; жирные кислоты (для жира и липоидов), кетоновые тела, холестерин
ЗНАЧЕНИЕ ГЛИКОЛИЗА в аэробных условиях – в получении всех перечисленных веществ, в том числе для синтезов (можно сказать, что это анаболическая роль гликолиза по аналогии с анаэробной ролью ЦТК). Участие гликолиза в выработке АТФ – это энергетическая роль гликолиза. Участие гликолиза в катаболизме глюкозы (превращение 6-тиуглеродной молекулы глюкозы в две трёхуглеродных молекулы пирувата) и поставка метаболитов для ЦТК (ацетилКоА и оксалоацетата) – катаболическая. Это достоинства гликолиза в аэробных условиях.
Недостатком аэробного обмена глюкозы является то, что его реакции протекают только в аэробных условиях и не протекают в анаэробных.
32.2.2. Превращения пирувата В АНАЭРОБНЫХ УСЛОВИЯХ.
При отсутствии кислорода или невозможности его использования в дыхательной цепи (см. п.22), то есть в анаэробных условиях пируват превращается в ЛАКТАТ (под действием фермента ЛДГ),
поскольку в анаэробных условиях пируват не может превратиться в ацетилКоА, так как не работает ПДГ (из-за избытка НАДН и дефицита НАД).
Причиной сниженной активности ПДГ и образования лактата может быть и дефицит витаминов ПДГ, особенно В1.
Лактат – это анион молочной кислоты, которая при клеточном рН (около 7) диссоциирует на лактат и протон; повышение концентрации протонов (Н+) называется ацидозом («закислением»), поскольку именно наличие протонов создаёт кислую среду, кислую реакцию, снижает рН.
Использовать кислород в дыхательной цепи не могут ЭРИТРОЦИТЫ из-за отсутствия в них митохондрий и дыхательной цепи,
а также любые клетки, если в них не работает дыхательная цепь (см.п.22) из-за попадания в них ингибиторов дыхательной цепи.
Дефицит кислорода (гипоксия) возникает во всех клетках при нарушении доставки кислорода:
1) из-за нарушения кровотока (из-за тромбов, жгута, сдавливания, падения артериального давления, большой кровопотери, сердечной недостаточности и т.д.),
2) из-за нарушения работы эритроцитов (см. п.121),
3) из-за нарушения поступления кислорода в лёгкие (при эмфиземе лёгких у курильщиков, при бронхоспазме и т.д.).
Превращение глюкозы в лактат в анаэробных условиях могут называть анаэробным гликолизом.
Лактат опасен, поскольку его накопление приводит к АЦИДОЗУ, который называется лактацидозом (в отличие от кетоацидоза при накоплении кетоновых тел – см. п. 47). Лактацидоз и кетоацидоз относятся к метаболическим ацидозам, то есть к ацидозам, обусловленным накоплением метаболитов (кислот) и нарушением метаболизма. Есть ещё респираторный ацидоз – то есть связанный с нарушением дыхания (задержкой дыхания). При всех ацидозах портится самочувствие, нарушается работа белков (так как оптимум для большинства белков – рН около 7), возникает чувство тошноты. Сильный ацидоз может привести к коме, но для здоровых людей это не характерно.
32.3. ОБМЕН ЛАКТАТА.
Это процессы образования и использования лактата.
32.3.1. ОБРАЗОВАНИЕ лактата.
Как сказано выше, образуется лактат при анаэробном гликолизе в эритроцитах, мышцах и других клетках в анаэробных условиях. Из клеток он может поступать в кровь, что при избытке лактата приводит к ацидозу.
Ткани-клетки-источники лактата:
В покое основное количество лактата поступает в кровь из эритроцитов, а при наряжённой работе мышц – из мышц.
Кроме этого, лактат поступает в кровь из любых клеток, которым не хватает кислорода или в которых не работают дыхательная цепь, ЦТК и ПДГ. Причиной сниженной работы ЦТК бывает дефицит витаминов ЦТК, особенно В1. См. 32.2.2.
32.3.2. Использование и УТИЛИЗАЦИЯ ЛАКТАТА.
Из крови большая часть лактата поступает в клетки печени, где утилизируется. Это снижает ацидоз. Поэтому нарушение работы печени (печёночная недостаточность) может стать причиной избытка лактата в крови (из-за сниженного использования лактата клетками печени).
Пути метаболизма лактата – 25% и 75%.
25% лактата подвергаются так называемому ОКИСЛЕНИЮ ЛАКТАТА.
При этом:
1) лактат превращается в пируват под действием фермента ЛДГ, что даёт 2,5 АТФ благодаря образованию НАДН и его использованию в дыхательной цепи,
2) затем пируват превращается в ацетилКоА под действием ПДГ, что даёт ещё 2,5 АТФ благодаря образованию НАДН и его использованию в дыхательной цепи,
3) затем ацетилКоА вступает в ЦТК, что даёт ещё 10 АТФ.
В сумме окисление одной молекулы лактата даёт 15 молекул АТФ.
Реакции окисления лактата идут только в аэробных условиях.
75% лактата используются для синтеза глюкозы, который называется глюконеогенезом (ГНГ) и протекает в основном в печени.
Поэтому снижение ГНГ может стать причиной избытка лактата и ацидоза.
При превращении лактата в глюкозу:
1) сначала лактат превращается в пируват под действием ЛДГ, как и при окислении лактата,
2) затем пируват превращается в ОКСАЛОАЦЕТАТ (см. п.33 и п.21), что требует витамина БИОТИН – без биотина реакция не идёт (причиной дефицита биотина, нарушения этой реакции, ГНГ и избытка лактата бывает избыточное употребление сырых яиц, так как в них содержится вещество, препятствующее усвоению биотина),
3) оксалоацетат превращается в глюкозу в ходе реакций глюконеогенеза.
32.3.3. Избыток лактата.
Между процессами образования лактата и его использования должно быть равновесие, благодаря которому концентрация лактата в клетках и крови не превышала бы нормальную.
Повышение концентрации лактата в клетках приводит к снижению рН в клетках, нарушению работы белков клеток, повреждению клеток. Например, мышцы при избыточной концентрации лактата теряют способность сокращаться.
Повышение концентрации лактата в крови называется гиперЛАКТАТемией и приводит к ацидозу.
К избытку лактата приводит или повышение образования лактата, или снижение утилизация лактата.
Причины повышенного образования лактата (см. выше 32.2.3. и 32.3) –
1) дефицит кислорода (гипоксия при анемии, сердечной или лёгочной недостаточности и т.д.) или снижение его использования,
2) снижение превращения пирувата в ацетилКоА из-за нарушения работы ПДГ при дефиците В1 или других витаминов ПДГ,
3) повышенная концентрация НАДН, которая бывает не только при дефиците кислорода, но и при употреблении алкоголя.
Причины сниженного использования лактата и пирувата:
1) дефицит витаминов ПДГ и биотина, без которых не протекают реакции использования и пирувата,
2) нарушение работы печени, в котором должен протекать ГНГ.
Для коррекции ацидоза, обусловленного избытком лактата, нужно убрать причины избытка лактата – восстановить кровоток, принимать витамины, не употреблять алкоголь и т.д.
32.4. Выработка АТФ при анаэробном гликолизе
(энергетический баланс анаэробного гликолиза).
В анаэробных условиях гликолиз (при котором глюкоза превращается в лактат) позволяет синтезировать 2 молекулы АТФ способом субстратного фосфорилирования (см. файл «32 формулы гликолиз» реакции № 7 и 10, а также п.23) в расчёте на использование одной молекулы глюкозы (превращение одной глюкозы в 2 молекулы лактата).
1. Этого количества хватает только эритроцитам (у них и нет других источников АТФ).
Остальным клеткам этого (2 молекул АТФ от одной молекулы глюкозы) мало, но без анаэробного гликолиза клетки не имели бы и этого в анаэробных условиях.
2. При наложении жгута и в других ситуациях нарушения кровотока ткани конечностей не подвергаются в течение часа некрозу именно благодаря тому, что есть небольшое количество АТФ, которое вырабатывается при гликолизе в анаэробных условиях. А после часа времени возникает риск некроза именно потому, что АТФ от анаэробного гликолиза мало.
3. Клеткам головного мозга недостаточно того количества АТФ, который может им дать анаэробный гликолиз, поэтому они не способны, в отличие от тканей конечностей, выдержать гипоксию в течение часа.
4. При интенсивной работе мышц (например, при беге на сто метров или при подъёме штанги) в них возникают анаэробные условия. Наличие в них АТФ для работы поддерживается именно благодаря 2 АТФ анаэробного гликолиза, который быстро «включается» при работе мышц.
Ранее анаэробного гликолиза АТФ образуется благодаря запасам креатин/фосфата – см. п.68. Более длительная работа мышц требует получения АТФ при аэробных процессах – аэробном обмене глюкозы и при ;-окислении жирных кислот.
32.5. Достоинства и недостатки анаэробного гликолиза.
Таким образом, то, что анаэробный гликолиз даёт хоть немного АТФ без кислорода – это его ДОСТОИНСТВО.
А то, что этого количества АТФ МАЛО (хватает только эритроцитам, тканям конечностей при гипоксии и скелетным мышцам при короткой напряжённой работе, но не хватает другим тканям вообще, а тканям конечностей не хватает более чем на час, не хватает мышцам для длительной работы – это НЕДОСТАТОК анаэробного гликолиза).
Ещё один недостаток анаэробного гликолиза – то, что избыток его конечного метаболита (лактата) приводит к ацидозу.
Гликолиз является единственным процессом, за счёт которого может образоваться АТФ при отсутствии (или неиспользовании) кислорода. Именно гликолиз обеспечивает молекулами АТФ эритроциты, в которых нет других источников АТФ из-за отсутствия митохондрий и дыхательной цепи см. п.23.
32.6. Выработка АТФ при аэробном обмене глюкозы.
См. «32 формулы гликолиз» и 32.2.
В аэробных условиях глюкоза превращается в 6 молекул СО2, что сопровождается синтезом 32 молекул АТФ.
При гликолизе глюкоза превращается в 2 молекулы пирувата, что сопровождается образованием 2 молекул АТФ способом субстратного фосфорилирования и двух молекул НАДН (см. реакцию гликолиза № 6).
Каждая из этих 2 молекул НАДН даёт по 2,5 АТФ, то есть всего 5 (с помощью ДЦ).
Каждая из двух молекул пирувата даёт по 12,5 молекул АТФ, то есть всего – 25.
В сумме глюкоза может дать 32 молекулы АТФ. (2 + 2,5*2 + 12,5*2).
В головном мозге из-за особенностей обмена глюкоза даёт не 32, а 30 молекул АТФ.
32.7. РЕГУЛЯЦИЯ ГЛИКОЛИЗА. См. п.6 и 7, 33, 37, 102.
Смысл регуляции любого процесса в том, чтобы его скорость соответствовала потребностям организма и отдельных клеток.
Изменение скорости процесса осуществляется через изменение активности или концентрации ферментов процесса под влиянием метаболитов и гормонов.
Активность повышается активаторами и снижается ингибиторами.
Концентрация ферментов повышается в результате усиления синтеза ферментов под влиянием индукторов и снижается в результате снижения синтеза под влиянием репрессоров.
Регулировать все ферменты 10 реакций гликолиза не обязательно. Достаточно регулировать активность некоторых ферментов. Эти регулируемые ферменты называются КЛЮЧЕВЫМИ – см. п.7.
В гликолизе ключевыми ферментами являются три – ферменты первой реакции, последней и третьей – гексокиназа, фосфофруктокиназа и пируваткиназа.
Фермент первой реакции последовательности реакций часто является ключевым. Фермент третьей реакции гликолиза является самым медленным – это тоже типично (что фермент самой медленной реакции метаболического пути является ключевым).
32.7.1. Регуляция гликолиза гормонами.
Гликолиз стимулируется инсулином (за счёт индукции ключевых ферментов) и подавляется глюкокортикостероидами (ГКС; за счёт репрессии ключевых ферментов). См. п.85.
Катехоламины адреналин и норадреналин усиливают гликолиз в мышцах и подавляют в печени.
Благодаря стимуляции инсулином гликолиза (а также стимуляции инсулином транспорта глюкозы во многие клетки) расход глюкозы тканями увеличивается, что приводит
1) к удовлетворению потребностей клеток в глюкозе и
2) к снижению концентрации глюкозы в крови –
это снижение концентрации глюкозы в крови называется гипогликемическим эффектом,
а инсулин, который обусловливает снижение концентрации глюкозы в крови, является гипогликемическим гормоном.
32.7.2. Регуляция гликолиза метаболитами.
Обычно активаторами процесса являются его субстраты, а ингибиторами – продуктами. Механизм – аллостерический (см. п.6).
Активатором гликолиза является АДФ (в качестве субстрата – чтобы превратиться в АТФ), а ингибиторами – продукты гликолиза АТФ, ацетилКоА и цитрат (отдалённо это продукты гликолиза, так как цитрат образуется из ацетилКоА и оксалоацетата, образующихся из пирувата).
Эффекты АДФ противоположны эффектам АТФ, так как АДФ образуется при расщеплении АТФ, и [АДФ] становится тем больше, чем меньше [АТФ].
Ещё один активатор гликолиза – метаболит фруктозо-2,6- бисфосфат, который активирует фосфофруктокиназу.
Сравните регуляцию гликолиза с регуляцией ГНГ – эти два процесса регулируются одними и теми же регуляторами, но действие регуляторов на эти два противоположных процесса прямо противоположно. Это помогает рассказать регуляцию ГНГ, зная регуляцию гликолиза.
Р е г у л я ц и я г о р м о н а м и процессов углеводного обмена.
Усиление процесса
способствует (гипер/гликемии) или не способствует? Г о р м о н ы
Ин ГГ КА ГКС
; [Г] Гипергликемические
Гликолиз (глюкоза в пируват) Нет, ведёт к гипогликемии ; ; в печени см. *
Глюконеогенез (синтез глюкозы) Да, ведёт к гипергликемии ; ; в печени
* В мышцах КА (в т.ч. адреналин) не снижают гликолиз, а усиливают – так как КА должны обеспечить мышцы энергией за счет выработки в мышцах АТФ. Гликолиз – это единственный процесс, который может дать АТФ при дефиците кислорода (дефицит кислорода обязательно возникает в работающих скелетных мышцах, как бы ни старались легкие и сердце обеспечить мышцы кислородом; но чем лучше человек тренирован, тем лучше организм справляется с нагрузками).
Р е г у л я ц и я гликолиза и ГНГ метаболитами. (Аллостерическая).
(Действие регуляторов на гликолиз и на ГНГ противоположно.)
ацетилКоА Цитрат А Т Ф А Д Ф Фруктозо-2,6-бисфосфат
гликолиз Продукт продукт Продукт Субстрат
Ингибиторы гликолиза Активаторы гликолиза
ГНГ: синтез
глюкозы Субстрат продукт
Активаторы ГНГ Ингибиторы ГНГ
12
В чем д о с т о и н с т в а
(см. выше) 1) только он дает АТФ в ЭЦ,
2) только он дает АТФ без О2, хоть и мало (всего 2),
3) быстро включается, что ценно при короткой напряженной работе 1) дает много АТФ,
2) дает метаболиты ЦТК
(ОА и ацетилКоА из П,
а затем в ЦТК образуются остальные, в т.ч. для аминокислот и белков)
В чем н е д о с т а т к и
(см. выше) 1) образует лактат, что приводит к ацидозу,
2) мало АТФ (из-за чего жгут нельзя долго держать) не протекает
без кислорода
(при гипоксии)
14 Каким
тканям или клеткам
дает достаточное количество энергии Эритроцитам, скелетным мышцам при короткой работе, а при жгуте – час Всем, в которых протекает
(в эритроцитах не протекает)
1. Как называется увеличение [Л] в крови Гипер / лактат / емия
2. Чем о п а с н а высокая [ лактата ]
(молочная кислота ; лактат + Н+ ) Накоплением протонов (Н+), т.е. АЦИДОЗОМ, который приводит к
тошноте, усталости и (при очень сильном ацидозе) к коме
3. Какой ПРОЦЕСС образует лактат Анаэробный гликолиз (при дефиците кислорода и в ЭЦ)
4. Какие ТКАНИ являются источником лактата (поступающего в кровь) В покое – эритроциты. При работе скелетных мышц – мышцы.
При патологии – любая ткань при гипоксии и без В1.
5. Какие ПРОЦЕССЫ используют лактат ГНГ (в печени) и окисление лактата (ЛДГ, ПДГ, ЦТК)
6. Какой ОРГАН «берёт» лактат из крови Печень (для превращения лактата в глюкозу в ГНГ)
Гликолиз
Содержание
Гликолиз [ править | править код ]
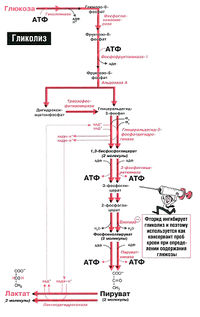
Гликолиз – процесс распада одной молекулы глюкозы с выделением энергии, достаточной для «зарядки» двух молекул АТФ, протекает в саркоплазме под воздействием 10 специальных ферментов.
Гликолиз может протекать без потребления кислорода (такие процессы называются анаэробными) и с потреблением кислорода (аэробный гликолиз) способен быстро восстанавливать запасы АТФ в мышце.
При занятиях бодибилдингом и высокоинтенсивных упражнениях происходит анаэробный гликолиз, с образованием молочной кислоты.
Во время динамических нагрузок, таких как бег, плавание и т.п., происходит аэробный гликолиз.
Аэробный гликолиз происходит в митохондриях под воздействием специальных ферментов и требует затрат кислорода, а соответственно и времени на его доставку. Окисление происходит в несколько этапов, сначала идет гликолиз, но образовавшиеся в ходе промежуточного этапа этой реакции две молекулы пирувата не преобразуются в молекулы молочной кислоты, а проникают в митохондрии, где окисляются в цикле Кребса до углекислого газа СО2 и воды Н2О и дают энергию для производства еще 38 молекул АТФ. Суммарное уравнение реакции окисления глюкозы выглядит так:
Распад глюкозы по аэробному пути (аэробный гликолиз) дает энергию для восстановления 38 молекул АТФ. Аэробное окисление в 19 раз эффективнее анаэробного гликолиза.

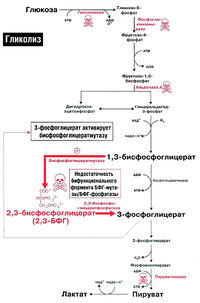
Анаэробный гликолиз глюкозы в эритроцитах, 2,3-БФГ и эффект Бора [ править | править код ]
Эритроциты транспортируют большое количество кислорода, которым снабжают все органы человека. По иронии судьбы сами они не могут использовать этот кислород. Источником энергии для эритроцитов служит глюкоза, при окислении которой в ходе анаэробного гликолиза в эритроцитах образуется АТФ (рис. 18.1). Аэробное окисление глюкозы в эритроцитах невозможно, так как в них отсутствуют митохондрии и вместе с ними все ферменты цикла Кребса. Кроме того, в них отсутствуют также ферменты, необходимые для окисления жирных кислот и использования кетоновых тел.
Функция эритроцитов — транспорт кислорода ко всем органам и тканям организма. Гемоглобин эритроцитов прочно связывается с кислородом, образуя оксигемоглобин. Однако в периферических тканях эритроциты должны отдать этот кислород другим клеткам. Это осуществляется благодаря явлению, известному под названием эффекта Бора. Эффект Бора создается благодаря двум факторам: протонам и 2,3-бисфосфоглицерату (рис. 18.2).
Работающим мышцам необходим АТФ, и поэтому в них интенсивно функционирует цикл Кребса. В цикле Кребса образуется диоксид углерода, который проникает в эритроциты и реагирует с водой, образуя угольную кислоту (эту реакцию катализирует карбоангидраза). Угольная кислота самопроизвольно диссоциирует, образуя бикарбонат и протон, что приводит к местному возрастанию концентрации протонов (Н+), т.е. понижению pH. Протоны высвобождают кислород из гемоглобина, и кислород диффундирует из эритроцитов в периферические ткани. Здесь он связывается с миоглобином и переносит кислород в дыхательную цепь, где он используется для синтеза АТФ путем окислительного фосфорилирования.
2,3-БФГ-шунта (шунт Рапопорта-Люберинга) (рис. 18.2). В периферических тканях молекула 2,3-БФГ связывается с дезоксигемоглобином и стабилизирует его структуру, не позволяя ему захватывать кислород от соседней молекулы оксигемоглобина.
2.3- БФГ в норме и при патологии [ править | править код ]
Эмбриональный гемоглобин имеет низкое сродство к 2,3-БФГ [ править | править код ]
Гемоглобин — тетрамер. состоящий из двух альфа-цепей и двух бета-цепей. Фетальный гемоглобин имеет иное строение: он состоит из двух а-цепей и двух у-цепей. По сравнению с нормальным гемоглобином взрослого человека, фетальный гемоглобин имеет более низкое сродство к 2,3-БФГ. Это значит, что сродство к кислороду у фетального гемоглобина выше, чем у гемоглобина материнского организма. Благодаря этому происходит транспорт кислорода от материнского организма к азолу.
2.3- БФГ и высотная адаптация [ править | править код ]
Предположим, что некий житель низин решил провести отпуск в горах. В первые дни отпуска даже незначительные физические нагрузки вызовут у него усталость и одышку. Но за несколько дней произойдет адаптация к высокогорью — в эритроцитах повысится концентрация 2,3-БФГ. Благодаря этому ткани станут получать кислород в достаточном количестве. несмотря на то что его концентрация в разреженном горном воздухе невысока. Повышение концентрации 2,3-БФГ — ответная реакция организма на недостаток кислорода
У курящих лиц концентрация 2,3-БФГ в эритроцитах выше, чем у некурящих. Так организм компенсирует сниженное вследствие постоянного воздействия угарного газа обеспечение тканей кислородом. Компенсаторное повышение уровня 2.3- БФГ также часто наблюдается у больных хроническими анемиями, обструктивной болезнью легких, при врожденных пороках сердца и муковисцидозе.
Энзимопатии гликолитического пути в эритроцитах [ править | править код ]
В редких случаях из-за врожденной недостаточности гликолитических ферментов в эритроцитах развивается наследственная несфероцитарная гемолитическая анемия. Это заболевание может быть весьма тяжелым, поскольку в эритроцитах гликолиз — единственный путь синтеза и АТФ и 2.3-БФГ.
Нарушения гликолитического ферментативного аппарата могут по-разному сказываться на метаболизме 2.3-БФГ (рис. 18.2). Если нарушение расположено проксимально по отношению к 2.3-БФГ-шунту (например, при недостаточности гексокиназы, фосфоглюкоизомеразы или альдолазы А), уровень 2,3-БФГ будет снижен, так как будет снижена интенсивность синтеза его предшественников. Если же нарушение расположено после 2.3-БФГ-шунта (например, недостаточность пируваткиназы). концентрация 2.3-БФГ в эритроцитах будет повышена.
Кроме того, у ряда больных была обнаружена недостаточность бифункционального фермента шунта — БФГ-мутазы/2,3-БФГ-фосфагазы. У таких больных концентрация 2.3- БФГ была низкой.
Номенклатура альдолаз [ править | править код ]
Чтобы учащийся не путал разные термины, необходимо разобраться в номенклатуре альдолаз. Альдолаза (полное название — фруктозо-1,6-бисфосфат-атьдолаза) по официальной номенклатуре называется D-глицеральдегид-З-фосфатлиазой (КФ 4.1.2.13). Она выполняет три функции:
У животных обнаружены три формы альдолазы.
Альдолаза А. Содержится в эритроцитах и мышцах. При наследственной гемолитической анемии в крови содержится дефектная форма альдолазы А.
Альдолаза В. Недостаточность альдолазы В приводит к наследственной непереносимости фруктозы. Альдолаза В присутствует в печени, почках и тонком кишечнике.
Альдолаза С. Содержится в головном мозге.
Взаимосвязь гликолиза и аэробных реакций [ править | править код ]
Два способа оценки аэробных возможностей организма (прямая оценка показателя максимального устойчивого состояния по лактату и косвенная оценка аэробно-анаэробного перехода) основаны на классической теории активации гликолиза, предложенной А. Хиллом. В основу этой теории легла гипотеза о том, что активация гликолиза в мышечном волокне запускается при снижении аэробного ресинтеза АТФ. Основной причиной снижения аэробного ресинтеза АТФ должно быть неадекватное снабжение клетки кислородом, т.е. фактически снижение внутриклеточного парциального давления кислорода до критического уровня (0,1—0,5 мм рт. ст.), ниже которого нормальное функционирование митохондрий невозможно. Прямо проверить данное предположение оказалось методически достаточно сложно.
Относительно недавно появились исследования, в которых in situ было измерено внутримышечное парциальное давление кислорода, связанного с миоглобином, во время максимального теста с возрастающей нагрузкой в т. gracilis у собаки методом криомикроспектроскопии. Среднее парциальное давление кислорода, связанного с миоглобином, при работе на уровне МПК значительно выше критического и составляет 5,5 мм рт. ст., при этом не удается обнаружить связь между ПК мышцей или средним парциальным давлением кислорода в волокне и концентрацией лактата в мышце или суммарным выходом лактата из мышцы.
Сходные результаты получены при измерении внутримышечного парциального давления кислорода во время максимального теста с повышающейся нагрузкой (50-100% от пикового ПК) у тренированных велосипедистов в условиях in vivo при разгибании ноги в коленном суставе. Исследователи получили достаточно неожиданный результат. Оказалось, что парциальное давление кислорода в миоглобине не изменяется на протяжении всего теста с возрастающей нагрузкой (50—100% от пикового ПК) вплоть до отказа от работы. Среднее парциальное давление кислорода, связанного с миоглобином, составляет 3,1 мм рт. ст. Любопытно, при работе в гипоксических условиях (F,02—0,12) парциальное давление кислорода, связанного с миоглобином, оказывается достоверно ниже, чем в нормоксии и составляет 2,1 мм рт. ст. Оно также не изменяется во всем диапазоне нагрузок (50
100% от пикового ПК). При этом потребление кислорода тканями рабочей ноги, измеренное с помощью прямого метода (по Фику), линейно растет вплоть до отказа от работы, как в гипоксических, так и в нормоксических условиях.
Таким образом, даже при гипоксии во время максимальной нагрузки парциальное давление кислорода в миоглобине не падает ниже критического уровня. Однако при этом наблюдается увеличение скорости суммарного выхода лактата из рабочей мышцы, измеренное с помощью прямого метода. Причем работа в условиях гипоксии приводила к значительно более интенсивному выходу лактата (относительно нормированной мощности работы), чем работа в нормоксических условиях. На основании этих данных можно сделать вывод о том, что парциальное напряжение кислорода в активной мышечной клетке не является ключевым фактором, активирующим гликолиз. В то же время опыты с гипоксией дают основание полагать, что парциальное давление кислорода в цитоплазме может модулировать активность гликолиза. Увеличение суммарного выхода лактата из мышцы, как в условиях нормоксии, так и в условиях гипоксии, регулируется, главным образом, активацией симпато-адреналовой системы. Это подтверждается сходной динамикой концентрации адреналина в артериальной крови и суммарного выхода лактата из рабочей мышцы. Влияние симпато-адреналовой системы на гликолиз подтверждается и рядом других работ, в которых исследовали изменения концентрации катехоламинов во время нагрузки, а также опытами с применением бета-блокаторов.
Среди других возможных кандидатов на роль активаторов гликолиза выделяют: АДФ, АМФ, неорганический фосфат, отношение креатин/фосфокреатин и цитоплазматический окислительно-востановительный потенциал (НАДН+/НАД+).
Суммируя результаты описанных исследований, можно сказать, что парциальное давление кислорода в цитоплазме мышечной клетки не опускается до критичного уровня даже при работе максимальной аэробной мощности. Это означает, что активность гликолиза в мышечном волокне во время работы не зависит от скорости аэробного ресинтеза АТФ или, по крайней мере, зависит не только от нее.