в планетарной модели атома принимается что число в ядре
Презентация была опубликована 6 лет назад пользователемРоман Грузинский
Похожие презентации
Презентация на тему: » В планетарной модели атома принимается, что 1)число электронов на орбитах равно числу протонов в ядре 2)число протонов равно числу нейтронов в ядре 3)число.» — Транскрипт:
1 В планетарной модели атома принимается, что 1)число электронов на орбитах равно числу протонов в ядре 2)число протонов равно числу нейтронов в ядре 3)число электронов на орбитах равно сумме чисел протонов и нейтронов в ядре 4)число нейтронов в ядре равно сумме чисел электронов на орбитах и протонов в ядре
2 Планетарная модель атома обоснована опытами по 1)растворению и плавлению твердых тел 2)ионизации газа 3)химическому получению новых веществ 4)рассеянию α-частиц
3 При изучении строения атома в рамках модели Резерфорда моделью ядра служит 1)электрически нейтральный шар 2)положительно заряженный шар с вкраплениями электронов 3)отрицательно заряженное тело малых по сравнению с атомом размеров 4)положительно заряженное тело малых по сравнению с атомом размеров
4 Энергия фотона, поглощаемого атомом при переходе из основного состояния с энергией E 0 в возбужденное состояние с энергией Е 1 равна (h постоянная Планка) 1)E 1 – E 0 2) 3) 4) E 1 + E 0
5 Согласно постулатам Бора частота электромагнитного излучения, возникающего при переходе атома из возбужденного состояния с энергией Е 1, в основное состояние с энергией Е 0, вычисляется по формуле (с скорость света, h постоянная Планка) 1) 2) 3) 4)
6 Сколько фотонов различной частоты могут испускать атомы водорода, находившиеся во втором возбужденном состоянии Е 2, согласно постулатам Бора? 1) 1 2) 2 3) 3 4) 4
7 Предположим, что энергия атомов газа может принимать только те значения, которые указаны на схеме. Атомы находятся в состоянии с энергией Е (3) Фотоны какой энергии может поглощать данный газ? 1)любой в пределах от 2· Дж до 8· Дж 2)любой, но меньшей 2· Дж 3)только 2· Дж 4)большей или равной 2· Дж
9 На рисунке приведены возможные значения энергии атомов газа. Атомы газа находятся в состоянии с энергией E 1. На газ падает луч лазера. Атомы ионизируются, если энергия фотонов в лазерном луче не меньше 1) Дж. 2) Дж. 3) Дж. 4) Дж.
10 На рисунке 2 приведены возможные значения энергии атомов газа. Атомы находятся в состоянии с энергией Е 2. Какое из следующих утверждений правильно? 1)Атомы данного газа могут поглотить фотон с энергией Дж, но не могут испустить такой фотон. 2)Атомы данного газа могут как поглотить, так и испустить фотон с энергией Дж. 3)Атомы данного газа могут испустить фотон с энергией Дж, но не могут поглотить такой фотон. 4)Атомы данного газа не могут ни поглотить, ни испустить фотон с энергией Дж.
11 На рисунке представлена диаграмма энергетических уровней атома. Какой из отмеченных стрелками переходов между энергетическими уровнями сопровождается поглощением кванта минимальной частоты? 1)с уровня 1 на уровень 4 2)с уровня 1 на уровень 2 3)с уровня 4 на уровень 1 4)с уровня 2 на уровень 1
12 При поглощении света атомом вещества 1)энергия атома меняется постепенно 2) энергия атома может меняться постепенно или скачком в зависимости от состояния атома 3)энергия атома может меняться скачком или постепенно в зависимости от частоты падающего света 4)энергия атома меняется только скачками
13 На рисунке приведены фотографии спектра поглощения неизвестного газа и спектров поглощения известных веществ. По анализу спектров можно утверждать, что неизвестный газ содержит в заметном количестве 1)водород (Н), гелий (Не) и натрий (Na) 2)только натрий (Na) и водород (Н) 3)только натрий (Na) и гелий (Не) 4)только водород (Н) и гелий (Не)
14 На рисунках А, Б, В приведены спектры излучения паров стронция, неизвестного образца и кальция. Можно утверждать, что в образце 1)не содержится ни стронция, ни кальция 2)содержится кальций, но нет стронция 3)содержатся и стронций, и кальций 4)содержится стронций, но нет кальция
15 На рисунке приведен спектр поглощения неизвестного газа, а также спектры поглощения атомов магния и лития. Что можно сказать о химическом составе газа? 1)Газ состоит только из атомов магния. 2)Газ состоит только из атомов лития. 3)Газ состоит из атомов магния и лития. 4)Газ состоит из атомов магния, лития и еще какого-то другого вещества.
Планетарная модель атома.
Планетарная модель атома, или модель Резерфорда — это историческая модель строения атома, предложенная Эрнестом Резерфордом как результат эксперимента с рассеиванием альфа-частиц.
Для вычисления распределения «+» заряда в атоме, английский ученый Э. Резерфорд провел исследование рассеяния α-частиц фольгой из разных веществ. Большинство α-частиц беспрепятственно, практически не отклоняясь, проходило сквозь фольгу, и лишь 1 из 2000 частиц отклонялась на углы, большие 90°. Результатом этих экспериментов в 1911 г. стало предложение Резерфордом следующей модели строения атома.
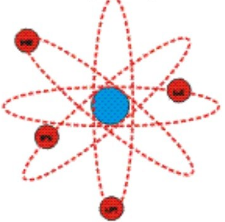
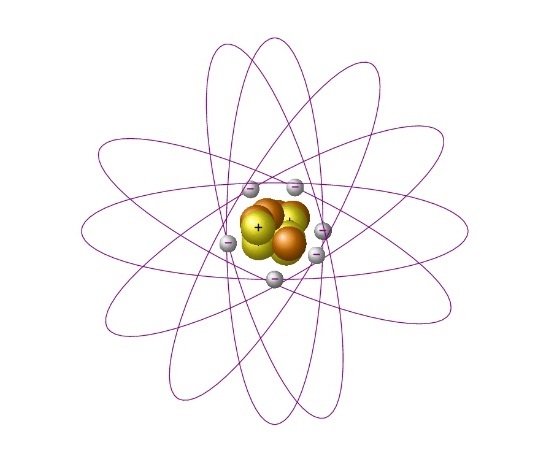
Атом состоит из положительно заряженного ядра, вокруг него обращаются электроны, каждый по своей орбите, как планеты Солнечной системы, обращающиеся вокруг Солнца. Именно поэтому модель назвали планетарной.
Положительный заряд ядра qядра связан с числом электронов Z в атоме при помощи соотношения:

Заряд ядра и число электронов в атоме, соответственно, совпадает с порядковым номером элемента в таблице Д. И. Менделеева.
В целом атом является электронейтральным. Электрон, отрываясь или присоединяясь к атому (как результат столкновения, например, либо при разных химических процессах) может образовывать положительно либо отрицательно заряженные ионы.
Простая и наглядная модель атома Резерфорда отлично объясняла результаты этих опытов. Но основываясь на этой модели строения атома нельзя объяснить факт существования атома и его устойчивость.
Это несоответствие опыта выводам теории связано с попыткой применения законов классической физики к внутриатомным явлениям (которые, как выяснилось, подчиняются законам квантовой механики).
Выход из образовавшейся в теории атома ситуации нашел датский физик Нильсом Бором.
Планетарная модель атома
теория по физике 🧲 квантовая физика
Одним из самых важных открытий в области современной физики стало открытие сложного строения атома. В процессе изучения этого строения были открыты новые законы, которые применимы только для описания движения микрочастиц. Такие законы называют законами квантовой механики.
Строение атома по Томсону
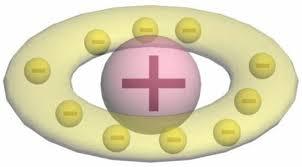
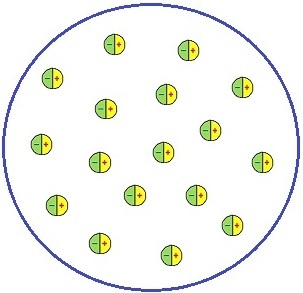
Правильное представление о строении атома сложилось не сразу. Первую модель строения частицы вещества предложил английский физик Дж. Дж. Томсона, которому принадлежит открытие электронов. Сравнить эту модель можно с кексом. Положительный заряд атома, играющий роль теста, занимает весь атомарный объем. Причем его плотность одинакова во всех точках. Электроны, словно изюминки в тесте, равномерно распределяются в объеме, занятом положительным зарядом.
Так, согласно представлениям Томсона, атом водорода представляет собой небольшой положительно заряженный шарик радиусом в 10 –10 м. И внутри него расположен один электрон. У более сложных атомов электронов больше.
Опыты Резерфорда
Модель Томсона подверглась критике уже тогда, поскольку она абсолютно противоречила уже открытым к тому времени свойствам атома. Одно из главных свойств — устойчивость.
Известно, что масса электронов в несколько тысяч раз меньше массы атомов. Но в целом атом является нейтральным. Значит, основная масса приходится на его положительно заряженную часть. Для экспериментального исследования распределения положительного заряда, а значит, и массы внутри атома Эрнест Резерфорд предложил в 1906 г. применить зондирование атома с помощью α-частиц. Такие частицы образуются при распаде радия и некоторых других химических элементов. Их масса примерно в 8000 раз больше массы электрона, а положительный заряд равен по модулю удвоенному заряду электрона. По сути, α-частицы — это лишенные электронов атомы гелия. Двигаются они со скоростью, равной 1/15 скорости света.
Такими частицами Резерфорд в своих экспериментах бомбардировал атомы тяжелых элементов. Известно, что электроны неспособны изменить траекторию движения α-частиц, потому что они слишком мало весят. Ведь небольшой камешек, врезавшийся в автомобиль, не может существенно повлиять на его скорость.
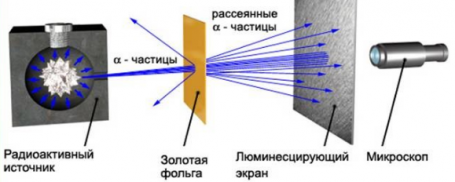
Изменить направление движения α-частиц может только положительный заряд атома. Так, если бомбардировать этими частицами атом, то по их рассеянию можно узнать, каким образом распределяется положительный заряд внутри него. Схема опыта резерфорда выглядит так:
Резерфорд поместил в цилиндр радиоактивное вещество. Вдоль цилиндра ученый высверлил узкий канал, из начал исходить пучок α-частиц. Этот поток попадал на тонкую золотую фольгу. Пройдя ее, частицы попадали на полупрозрачный экран, покрытый сульфидом цинка. За экраном стоял
Если провести опыт без фольги, то глядя в микроскоп, можно было наблюдать следующую картину: на экране формировался кружок, образованный сцинтилляциями от удара α-частиц об экран.
Но если на пути потока этих частиц поставить тонкую фольгу из золота, то картина меняется. Кружок, состоящий из сцинтилляций, становится больше.
Такой результат эксперимента нельзя было предсказать, если считать, что атом действительно имеет такое строение, какое предположил Томсон. Ведь при распределении по всем объему атома положительный заряд не может создать сильное электрическое поле. Поэтому он не смог бы отклонить траекторию движения α-частиц кардинально. Максимальная сила отталкивания в этом случае может быть рассчитана путем применения закона Кулона:
q a — заряд α-частицы, q — положительный заряд атома, R — радиус атома, а k — коэффициент пропорциональности. Напряженность электрического поля равномерно заряженного шара максимальна на поверхности шара и убывает до нуля по мере приближения к центру. Поэтому чем меньше радиус R, тем больше сила, отталкивающая α-частицы.
Определение размеров атомного ядра
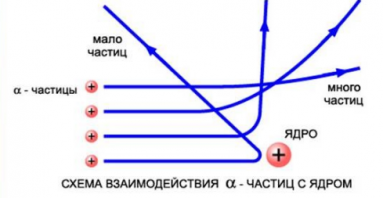
Резерфорд сделал вывод о том, что α-частица могла быть отброшена назад только случае, если положительный заряд атома и его масса сконцентрированы в небольшом пространстве. Так ученый пришел к мысли о существовании атомного
На рисунке выше изображены траектории α-частиц, пролетающих на различных расстояниях от ядра. Подсчитывая количество α-частиц, рассеянных на различные углы, Резерфорд дал оценку размерам ядра. Выяснилось, что его диаметр равен примерно 10 –12 –10 –13 см. Такой разброс связан с тем, что размеры ядер атомов разных веществ различны. Размер же самого атома равен 10 –8 см. Это в 10–100 тыс. раз больше размера атомного ядра.
Планетарная модель атома
Основываясь на результатах опыта, Резерфорд создал планетарную модель атома. Согласно ей, в центре атома расположено положительно заряженное
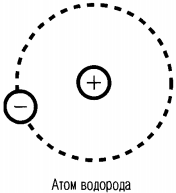
Так, в атоме водорода вокруг ядра вращается только лишь один электрон. Его ядро имеет положительный заряд, равный по модулю заряду электрона. Причем его масса примерно в 1836,1 раза больше массы электрона. Это ядро было названо протоном и стало рассматриваться как элементарная частица. Размер атома водорода определяется радиусом орбиты его электрона.
Простая и наглядная планетарная модель атома имеет прямое экспериментальное обоснование. Она кажется совершенно необходимой для объяснения опытов по рассеиванию α-частиц. Но даже это модель не объяснить факт существования атома, его устойчивость. Ведь движение электронов по орбитам происходит с ускорением, и оно очень велико. Ускоренно движущийся заряд по законам электродинамики Максвелла должен излучать электромагнитные волны с частотой, равной частоте его обращения вокруг ядра. Излучение сопровождается энергетическими потерями. Теряя энергию, электроны должны приближаться к ядру так, как спутник приближается к Земле при торможении о верхние слои атмосферы. По расчетам, электрон должен упасть на ядро за 10 –8 с. Но этого не происходит. Атомы устойчивы и в невозбужденном состоянии могут существовать бесконечно. При этом они не излучают электромагнитные волны.
Опыты Э. Резерфорда по рассеянию α-частиц показали, что
А. почти вся масса атома сосредоточена в ядре.
Б. ядро имеет положительный заряд.
Какое(-ие) из утверждений правильно(-ы)?
Алгоритм решения
Решение
Резерфорд направил пучок радиоактивного излучения на золотую фольгу. Альфа-частицы, проходя сквозь нее, попадали на экран и оставляли след. Если без фольги след представлял собой более менее четко ограниченный круг, то в случае с фольгой, четких границ круга не было. Когда Резерфорд окружил установку фольгой, он обнаружил, что часть альфа-частиц изменила траекторию движения после столкновения с фольгой в обратном направлении. Но это было бы невозможно, если бы заряд был распределен в атомах равномерно по всему объему. Наблюдать такую картинку возможно только при условии, что заряд атома концентрируется в небольшом пространстве — ядре. Причем этот заряд положительный, поскольку он не притягивает, а отталкивает альфа-частицы. Поэтому оба утверждения являются верными.
pазбирался: Алиса Никитина | обсудить разбор | оценить
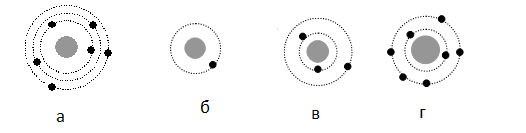
На рисунке изображены схемы четырёх атомов, соответствующие модели атома Резерфорда. Чёрными точками обозначены электроны. Атому 63 Li соответствует схема:
Алгоритм решения
Решение
Планетарная модель атома подразумевает наличие положительно заряженного ядра, вокруг которого вращаются по орбитам электроны. Причем количество протонов равно количеству электронов. Зарядовое число у лития равно 3. Следовательно, на орбитах вокруг ядра должно вращаться 3 электрона — как на рисунке «в».
pазбирался: Алиса Никитина | обсудить разбор | оценить
Ядро атома содержит 3 нейтрона и 4 протона, вокруг ядра обращаются 2 электрона. Эта система частиц является
а) нейтральным атомом углерода 9 6C б) ионом бериллия 7 4Be в) ионом лития 9 3Li г) нейтральным атомом бериллия 7 4B
Алгоритм решения
Решение
Согласно условию, содержится 4 протона и всего 2 электрона. Это значит, что речь будет идти о положительно заряженном ионе. Массовое число будет равно 7 (4 протона + 3 нейтрона), а зарядовое число — 4 (4 протона). Этому соответствует ион бериллия.
pазбирался: Алиса Никитина | обсудить разбор | оценить
Просто о химии. От установления делимости атома к планетарной модели Бора-Резерфорда.
Эксперименты по установлению делимости атома.
Основной экспериментальной предпосылкой установления делимости атома стали исследования электрического тока, проводимые физиками на протяжении всего XIX века. В 1874 г. ирландский физик Джордж Джонстон Стоуни высказал идею о том, что электричество состоит из элементарных зарядов, связанных с атомами, и вычислил величину этого элементарного заряда; в 1891 г. Стоуни предложил для него термин электрон.
Исследования электрических разрядов в разреженных газах и вакууме, которые начал в 1859 г. немецкий физик Юлиус Плюккер, привели к тому, что Вильгельм Гитторф и Уильям Крукс открыли в 1869-1875 гг. невидимые катодные лучи, распространяющиеся в вакууме от катода к аноду. Природа катодных лучей, которые распространяются прямолинейно и вызывают флюоресценцию (свечение) стекла вокруг анода, долгое время оставалась неизвестной; немецкие физики предполагали волновую, английские – корпускулярную природу катодных лучей. В 1886 г. немецкий физик Эуген Гольдштейн, экспериментируя с решетчатым катодом, открыл каналовые лучи, распространяющиеся противоположно катодным; была высказана гипотеза о том, что каналовые лучи состоят из положительно заряженных частиц.
Изучение катодных лучей привело и к другому важному открытию. Вильгельм Конрад Рёнтген обнаружил в 1895 г., что при падении катодных лучей на антикатод возникает новый вид излучения – X-лучи (рентгеновские лучи), которые обладают высокой проникающей способностью и вызывают флюоресценцию различных веществ.
Природа рентгеновских лучей также поначалу истолковывалась по-разному – помимо мнения, что X-лучи сходны с ультрафиолетом, высказывались и предположения об их корпускулярной природе. Окончательно волновая природа X-лучей была доказана лишь в 1913 г., когда Макс Теодор Феликс фон Лауэ обнаружил их дифракцию при прохождении через кристаллы.
Пытаясь проверить высказанное французским математиком Анри Пуанкаре предположение о том, что X-лучи не связаны с катодными лучами, Антуан Анри Беккерель начал изучение флюоресценции солей урана.
В 1897-1898 гг. французские учёные Пьер Кюри и Мария Склодовская-Кюри установили, что испускание уранового излучения является свойством атома урана. Результатом их работы стало открытие двух новых радиоактивных элементов – полония и радия,а так же введение нового термина – радиоактивность.
В 1899 г. английский физик Эрнест Резерфорд обнаружил неоднородность уранового излучения: в магнитном поле лучи разделяются таким образом, что можно выделить две составляющих, соответствующих потокам частиц с положительными и отрицательными зарядами.
Поль Виллар в 1900 г. выделил ещё один тип: лучи, не отклоняющиеся магнитным полем. Резерфорд предложил обозначать эти излучения первыми буквами греческого алфавита: альфа-, бета- и гамма-лучи.
Исследования радиоактивности в корне изменили классическое понятие атома; стало очевидным, что атом надлежит понимать как сложную систему, в образовании которой участвуют некие более простые частицы.
Модели строения атомов.
Первые модели строения атомов появились в начале 20 века.
В 1901 году Жан Перьен предложил планетарную модель атома. Подобную модель предложил в 1904 году японский химик Ханатаро Нагаока. В модели Нагаока атом был похож на планету Сатурн – ядро атома было планетой, а вращающие электроны его кольцами.
Однако более широкое представление о строении атома получила модель Томсона. В 1902 году Ульям Томсон предположил, что атом это сгусток положительно заряженной материи, внутри которой равномерно распределены электроны.
Такая модель атома напоминала кекс с изюмом (или пудинг), откуда произошло название модели – кексовая (пудинговая) модель строения атома.
Простейший атом – атом водорода – представлял собой, по мнению У. Томсона, положительно заряженный шар, в центре которого находится электрон. Детально данную модель разработал Дж. Дж. Томсон, считавший, что электроны внутри положительно заряженного шара расположены в одной плоскости и образуют концентрические кольца.
Немецкий физик Филипп фон Ленард попытался создать модель, не предполагающую раздельного существования в атоме противоположных зарядов. Атом, согласно модели Ленарда, состоит из нейтральных частиц (т.н. динамид), каждая из которых является электрическим дуплетом.
Выполненные Ленардом расчёты показали, что эти частицы должны иметь крайне малые размеры, и, следовательно, большая часть объёма атома представляет собой пустоту. Сосредоточение массы атома в небольшой части его объёма отчасти подтверждалось и проведёнными Ленардом в 1903 г. опытами, в которых пучок быстрых электронов легко проходил через тонкую металлическую фольгу.
Указанные модели атома Томсона-Томсона, Перьена-Нагаоки и Ленарда являлись сугубо гипотетическими и исключительно качественными.
В 1906-1909 гг. Ганс Гейгер, Эрнст Марсден и Эрнест Резерфорд, пытаясь найти экспериментальные подтверждения модели Томсона, провели свои знаменитые опыты по рассеиванию α-частиц на золотой фольге. Они использовали α-частицы вместо электронов, т.к. благодаря своей большей массе (в 7350 раз больше массы электрона) α-частицы не претерпевают заметного отклонения при столкновении с электронами, что позволяет регистрировать только столкновения с положительной частью атома. В качестве источника α-частиц ими был взят радий, а частицы, претерпевавшие рассеяние в тонкой золотой фольге, регистрировались по сцинтилляционным вспышкам на экране из сульфида цинка, находящемся в затемненной комнате.
Результат опытов оказался совершенно противоположным ожидаемому. Большинство α-частиц проходило через золотую фольгу по прямым или почти прямым траекториям, но в то же время некоторые α-частицы отклонялись на очень большие углы, что свидетельствовало о наличии в атоме чрезвычайно плотного положительно заряженного образования. Основываясь на этих экспериментальных фактах, Резерфорд в 1911 г. предложил свою ядерную модель атома: в центре атома находится положительно заряженное ядро, объём которого ничтожно мал по сравнению с размерами атома; вокруг ядра вращаются электроны, число которых приблизительно равно половине атомной массы элемента.
Модель атома Резерфорда при несомненных достоинствах содержала важное противоречие: в соответствии с законами классической электродинамики вращающийся вокруг ядра электрон должен был непрерывно испускать электромагнитное излучение, теряя энергию. Вследствие этого радиус орбиты электрона должен был быстро уменьшаться, и рассчитанное из этих представлений время жизни атома оказывалось ничтожно малым. Тем не менее, модель Резерфорда послужила основой для создания принципиально новой теории, которую разработал в 1913 г. датский физик Нильс Хенрик Давид Бор.
Модель Бора опиралась на квантовую гипотезу, которую выдвинул в 1900 г. немецкий физик Макс Карл Эрнст Людвиг Планк. Планк постулировал, что вещество может испускать энергию излучения только конечными порциями, пропорциональными частоте этого излучения. Применив квантовую гипотезу для объяснения фотоэффекта, Альберт Эйнштейнв 1905 г. предложил фотонную теорию света.
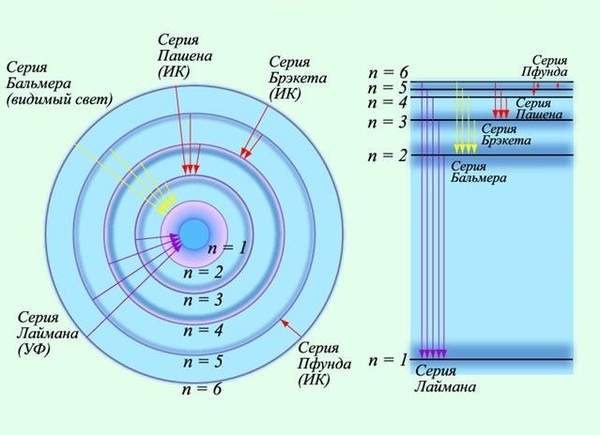
Ещё одной предпосылкой для боровской модели атома стали серии спектральных линий водорода, которые обнаружили в 1885 г. швейцарский ученый Иоганн Якоб Бальмер, в 1906 г. американский физик Теодор Лайман и в 1909 г. немецкий физик Фридрих Пашен. Эти серии (в видимой, ультрафиолетовой и инфракрасной областях спектра) подчинялись очень простой закономерности: частоты были пропорциональны разности обратных квадратов целых чисел.
Бор объяснил устойчивость планетарной модели атома и одновременно эти спектральные данные с позиций квантовой теории, сформулировав ряд постулатов, накладывающих на модель атома квантовые ограничения. Согласно постулатам Бора, электрон может вращаться вокруг ядра лишь по некоторым дозволенным («стационарным») орбитам, находясь на которых, он не излучает энергию. Ближайшая к ядру орбита соответствует «нормальному» (наиболее устойчивому) состоянию атома. При сообщении атому кванта энергии электрон переходит на более удалённую орбиту. Обратный переход из «возбуждённого» в «нормальное» состояние сопровождается испусканием кванта излучения.
Для атома водорода расчёты спектров на основе модели Бора дали хорошее согласие с экспериментом, но для других элементов получалось существенное расхождение с опытными данными. В 1916 г. немецкий физик Арнольд Иоганн Вильгельм Зоммерфельд уточнил модель Бора. Зоммерфельд высказал предположение, что кроме круговых, электрон может двигаться и по эллиптическим орбитам.
В первой половине 1920-х гг. в модель атома были добавлены ещё два квантовых числа. Немецкий физик Альфред Ланде ввёл для описания движения электрона в атоме магнитное квантовое число, а молодые физики Джордж Юджин Уленбек и Сэмюэл Абрахам Гаудсмит в 1925 г. ввели в атомную физику представление о спине электрона, Следует отметить, что американский физик Артур Холли Комптон, основываясь на атомных спектрах высокого разрешения, ещё в 1921 г. высказывал предположение о квантованном вращении электрона, а в следующем году Отто Штерн и Вальдер Герлах экспериментально наблюдали разделение пучка атомов серебра в магнитном поле на две части, соответствующие ориентации электронных спинов.
В 1925 г. Вольфганг Паули опубликовал свою работу, содержащую формулировку принципа запрета, носящего его имя: в данном квантовом состоянии может находиться только один электрон. Паули указал, что для характеристики состояния электрона необходимо четыре квантовых числа: главное квантовое число n, азимутальное квантовое число l и два магнитных числа m1 и m2.
В 1927 г. немецкий физик Фридрих Хунд сформулировал эмпирические правила заполнения электронных оболочек. С применением запрета Паули и принципа насыщения уровней к 1927 г. была в целом построена электронная структура всех известных к тому времени 92 элементов.