в планетарной модели атома принимается что число электронов на орбитах
Планетарная модель атома.
Планетарная модель атома, или модель Резерфорда — это историческая модель строения атома, предложенная Эрнестом Резерфордом как результат эксперимента с рассеиванием альфа-частиц.
Для вычисления распределения «+» заряда в атоме, английский ученый Э. Резерфорд провел исследование рассеяния α-частиц фольгой из разных веществ. Большинство α-частиц беспрепятственно, практически не отклоняясь, проходило сквозь фольгу, и лишь 1 из 2000 частиц отклонялась на углы, большие 90°. Результатом этих экспериментов в 1911 г. стало предложение Резерфордом следующей модели строения атома.
Атом состоит из положительно заряженного ядра, вокруг него обращаются электроны, каждый по своей орбите, как планеты Солнечной системы, обращающиеся вокруг Солнца. Именно поэтому модель назвали планетарной.
Положительный заряд ядра qядра связан с числом электронов Z в атоме при помощи соотношения:

Заряд ядра и число электронов в атоме, соответственно, совпадает с порядковым номером элемента в таблице Д. И. Менделеева.
В целом атом является электронейтральным. Электрон, отрываясь или присоединяясь к атому (как результат столкновения, например, либо при разных химических процессах) может образовывать положительно либо отрицательно заряженные ионы.
Простая и наглядная модель атома Резерфорда отлично объясняла результаты этих опытов. Но основываясь на этой модели строения атома нельзя объяснить факт существования атома и его устойчивость.
Это несоответствие опыта выводам теории связано с попыткой применения законов классической физики к внутриатомным явлениям (которые, как выяснилось, подчиняются законам квантовой механики).
Выход из образовавшейся в теории атома ситуации нашел датский физик Нильсом Бором.
Презентация была опубликована 6 лет назад пользователемРоман Грузинский
Похожие презентации
Презентация на тему: » В планетарной модели атома принимается, что 1)число электронов на орбитах равно числу протонов в ядре 2)число протонов равно числу нейтронов в ядре 3)число.» — Транскрипт:
1 В планетарной модели атома принимается, что 1)число электронов на орбитах равно числу протонов в ядре 2)число протонов равно числу нейтронов в ядре 3)число электронов на орбитах равно сумме чисел протонов и нейтронов в ядре 4)число нейтронов в ядре равно сумме чисел электронов на орбитах и протонов в ядре
2 Планетарная модель атома обоснована опытами по 1)растворению и плавлению твердых тел 2)ионизации газа 3)химическому получению новых веществ 4)рассеянию α-частиц
3 При изучении строения атома в рамках модели Резерфорда моделью ядра служит 1)электрически нейтральный шар 2)положительно заряженный шар с вкраплениями электронов 3)отрицательно заряженное тело малых по сравнению с атомом размеров 4)положительно заряженное тело малых по сравнению с атомом размеров
4 Энергия фотона, поглощаемого атомом при переходе из основного состояния с энергией E 0 в возбужденное состояние с энергией Е 1 равна (h постоянная Планка) 1)E 1 – E 0 2) 3) 4) E 1 + E 0
5 Согласно постулатам Бора частота электромагнитного излучения, возникающего при переходе атома из возбужденного состояния с энергией Е 1, в основное состояние с энергией Е 0, вычисляется по формуле (с скорость света, h постоянная Планка) 1) 2) 3) 4)
6 Сколько фотонов различной частоты могут испускать атомы водорода, находившиеся во втором возбужденном состоянии Е 2, согласно постулатам Бора? 1) 1 2) 2 3) 3 4) 4
7 Предположим, что энергия атомов газа может принимать только те значения, которые указаны на схеме. Атомы находятся в состоянии с энергией Е (3) Фотоны какой энергии может поглощать данный газ? 1)любой в пределах от 2· Дж до 8· Дж 2)любой, но меньшей 2· Дж 3)только 2· Дж 4)большей или равной 2· Дж
9 На рисунке приведены возможные значения энергии атомов газа. Атомы газа находятся в состоянии с энергией E 1. На газ падает луч лазера. Атомы ионизируются, если энергия фотонов в лазерном луче не меньше 1) Дж. 2) Дж. 3) Дж. 4) Дж.
10 На рисунке 2 приведены возможные значения энергии атомов газа. Атомы находятся в состоянии с энергией Е 2. Какое из следующих утверждений правильно? 1)Атомы данного газа могут поглотить фотон с энергией Дж, но не могут испустить такой фотон. 2)Атомы данного газа могут как поглотить, так и испустить фотон с энергией Дж. 3)Атомы данного газа могут испустить фотон с энергией Дж, но не могут поглотить такой фотон. 4)Атомы данного газа не могут ни поглотить, ни испустить фотон с энергией Дж.
11 На рисунке представлена диаграмма энергетических уровней атома. Какой из отмеченных стрелками переходов между энергетическими уровнями сопровождается поглощением кванта минимальной частоты? 1)с уровня 1 на уровень 4 2)с уровня 1 на уровень 2 3)с уровня 4 на уровень 1 4)с уровня 2 на уровень 1
12 При поглощении света атомом вещества 1)энергия атома меняется постепенно 2) энергия атома может меняться постепенно или скачком в зависимости от состояния атома 3)энергия атома может меняться скачком или постепенно в зависимости от частоты падающего света 4)энергия атома меняется только скачками
13 На рисунке приведены фотографии спектра поглощения неизвестного газа и спектров поглощения известных веществ. По анализу спектров можно утверждать, что неизвестный газ содержит в заметном количестве 1)водород (Н), гелий (Не) и натрий (Na) 2)только натрий (Na) и водород (Н) 3)только натрий (Na) и гелий (Не) 4)только водород (Н) и гелий (Не)
14 На рисунках А, Б, В приведены спектры излучения паров стронция, неизвестного образца и кальция. Можно утверждать, что в образце 1)не содержится ни стронция, ни кальция 2)содержится кальций, но нет стронция 3)содержатся и стронций, и кальций 4)содержится стронций, но нет кальция
15 На рисунке приведен спектр поглощения неизвестного газа, а также спектры поглощения атомов магния и лития. Что можно сказать о химическом составе газа? 1)Газ состоит только из атомов магния. 2)Газ состоит только из атомов лития. 3)Газ состоит из атомов магния и лития. 4)Газ состоит из атомов магния, лития и еще какого-то другого вещества.
Планетарная модель атома
теория по физике 🧲 квантовая физика
Одним из самых важных открытий в области современной физики стало открытие сложного строения атома. В процессе изучения этого строения были открыты новые законы, которые применимы только для описания движения микрочастиц. Такие законы называют законами квантовой механики.
Строение атома по Томсону
Правильное представление о строении атома сложилось не сразу. Первую модель строения частицы вещества предложил английский физик Дж. Дж. Томсона, которому принадлежит открытие электронов. Сравнить эту модель можно с кексом. Положительный заряд атома, играющий роль теста, занимает весь атомарный объем. Причем его плотность одинакова во всех точках. Электроны, словно изюминки в тесте, равномерно распределяются в объеме, занятом положительным зарядом.
Так, согласно представлениям Томсона, атом водорода представляет собой небольшой положительно заряженный шарик радиусом в 10 –10 м. И внутри него расположен один электрон. У более сложных атомов электронов больше.
Опыты Резерфорда
Модель Томсона подверглась критике уже тогда, поскольку она абсолютно противоречила уже открытым к тому времени свойствам атома. Одно из главных свойств — устойчивость.
Известно, что масса электронов в несколько тысяч раз меньше массы атомов. Но в целом атом является нейтральным. Значит, основная масса приходится на его положительно заряженную часть. Для экспериментального исследования распределения положительного заряда, а значит, и массы внутри атома Эрнест Резерфорд предложил в 1906 г. применить зондирование атома с помощью α-частиц. Такие частицы образуются при распаде радия и некоторых других химических элементов. Их масса примерно в 8000 раз больше массы электрона, а положительный заряд равен по модулю удвоенному заряду электрона. По сути, α-частицы — это лишенные электронов атомы гелия. Двигаются они со скоростью, равной 1/15 скорости света.
Такими частицами Резерфорд в своих экспериментах бомбардировал атомы тяжелых элементов. Известно, что электроны неспособны изменить траекторию движения α-частиц, потому что они слишком мало весят. Ведь небольшой камешек, врезавшийся в автомобиль, не может существенно повлиять на его скорость.
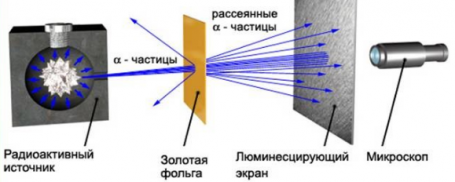
Изменить направление движения α-частиц может только положительный заряд атома. Так, если бомбардировать этими частицами атом, то по их рассеянию можно узнать, каким образом распределяется положительный заряд внутри него. Схема опыта резерфорда выглядит так:
Резерфорд поместил в цилиндр радиоактивное вещество. Вдоль цилиндра ученый высверлил узкий канал, из начал исходить пучок α-частиц. Этот поток попадал на тонкую золотую фольгу. Пройдя ее, частицы попадали на полупрозрачный экран, покрытый сульфидом цинка. За экраном стоял
Если провести опыт без фольги, то глядя в микроскоп, можно было наблюдать следующую картину: на экране формировался кружок, образованный сцинтилляциями от удара α-частиц об экран.
Но если на пути потока этих частиц поставить тонкую фольгу из золота, то картина меняется. Кружок, состоящий из сцинтилляций, становится больше.
Такой результат эксперимента нельзя было предсказать, если считать, что атом действительно имеет такое строение, какое предположил Томсон. Ведь при распределении по всем объему атома положительный заряд не может создать сильное электрическое поле. Поэтому он не смог бы отклонить траекторию движения α-частиц кардинально. Максимальная сила отталкивания в этом случае может быть рассчитана путем применения закона Кулона:
q a — заряд α-частицы, q — положительный заряд атома, R — радиус атома, а k — коэффициент пропорциональности. Напряженность электрического поля равномерно заряженного шара максимальна на поверхности шара и убывает до нуля по мере приближения к центру. Поэтому чем меньше радиус R, тем больше сила, отталкивающая α-частицы.
Определение размеров атомного ядра
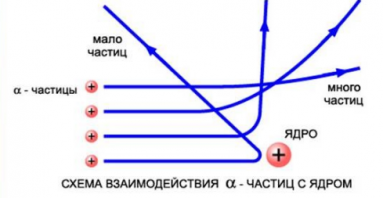
Резерфорд сделал вывод о том, что α-частица могла быть отброшена назад только случае, если положительный заряд атома и его масса сконцентрированы в небольшом пространстве. Так ученый пришел к мысли о существовании атомного
На рисунке выше изображены траектории α-частиц, пролетающих на различных расстояниях от ядра. Подсчитывая количество α-частиц, рассеянных на различные углы, Резерфорд дал оценку размерам ядра. Выяснилось, что его диаметр равен примерно 10 –12 –10 –13 см. Такой разброс связан с тем, что размеры ядер атомов разных веществ различны. Размер же самого атома равен 10 –8 см. Это в 10–100 тыс. раз больше размера атомного ядра.
Планетарная модель атома
Основываясь на результатах опыта, Резерфорд создал планетарную модель атома. Согласно ей, в центре атома расположено положительно заряженное
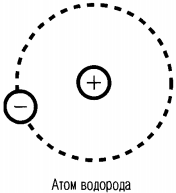
Так, в атоме водорода вокруг ядра вращается только лишь один электрон. Его ядро имеет положительный заряд, равный по модулю заряду электрона. Причем его масса примерно в 1836,1 раза больше массы электрона. Это ядро было названо протоном и стало рассматриваться как элементарная частица. Размер атома водорода определяется радиусом орбиты его электрона.
Простая и наглядная планетарная модель атома имеет прямое экспериментальное обоснование. Она кажется совершенно необходимой для объяснения опытов по рассеиванию α-частиц. Но даже это модель не объяснить факт существования атома, его устойчивость. Ведь движение электронов по орбитам происходит с ускорением, и оно очень велико. Ускоренно движущийся заряд по законам электродинамики Максвелла должен излучать электромагнитные волны с частотой, равной частоте его обращения вокруг ядра. Излучение сопровождается энергетическими потерями. Теряя энергию, электроны должны приближаться к ядру так, как спутник приближается к Земле при торможении о верхние слои атмосферы. По расчетам, электрон должен упасть на ядро за 10 –8 с. Но этого не происходит. Атомы устойчивы и в невозбужденном состоянии могут существовать бесконечно. При этом они не излучают электромагнитные волны.
Опыты Э. Резерфорда по рассеянию α-частиц показали, что
А. почти вся масса атома сосредоточена в ядре.
Б. ядро имеет положительный заряд.
Какое(-ие) из утверждений правильно(-ы)?
Алгоритм решения
Решение
Резерфорд направил пучок радиоактивного излучения на золотую фольгу. Альфа-частицы, проходя сквозь нее, попадали на экран и оставляли след. Если без фольги след представлял собой более менее четко ограниченный круг, то в случае с фольгой, четких границ круга не было. Когда Резерфорд окружил установку фольгой, он обнаружил, что часть альфа-частиц изменила траекторию движения после столкновения с фольгой в обратном направлении. Но это было бы невозможно, если бы заряд был распределен в атомах равномерно по всему объему. Наблюдать такую картинку возможно только при условии, что заряд атома концентрируется в небольшом пространстве — ядре. Причем этот заряд положительный, поскольку он не притягивает, а отталкивает альфа-частицы. Поэтому оба утверждения являются верными.
pазбирался: Алиса Никитина | обсудить разбор | оценить
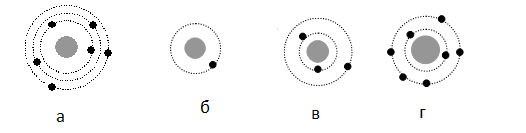
На рисунке изображены схемы четырёх атомов, соответствующие модели атома Резерфорда. Чёрными точками обозначены электроны. Атому 63 Li соответствует схема:
Алгоритм решения
Решение
Планетарная модель атома подразумевает наличие положительно заряженного ядра, вокруг которого вращаются по орбитам электроны. Причем количество протонов равно количеству электронов. Зарядовое число у лития равно 3. Следовательно, на орбитах вокруг ядра должно вращаться 3 электрона — как на рисунке «в».
pазбирался: Алиса Никитина | обсудить разбор | оценить
Ядро атома содержит 3 нейтрона и 4 протона, вокруг ядра обращаются 2 электрона. Эта система частиц является
а) нейтральным атомом углерода 9 6C б) ионом бериллия 7 4Be в) ионом лития 9 3Li г) нейтральным атомом бериллия 7 4B
Алгоритм решения
Решение
Согласно условию, содержится 4 протона и всего 2 электрона. Это значит, что речь будет идти о положительно заряженном ионе. Массовое число будет равно 7 (4 протона + 3 нейтрона), а зарядовое число — 4 (4 протона). Этому соответствует ион бериллия.
pазбирался: Алиса Никитина | обсудить разбор | оценить
В планетарной модели атома принимается что число электронов на орбитах
§2.5. Электронное строение атома.
В этом и в следующем параграфах рассказывается о моделях электронной оболочки атома. Важно понимать, что речь идет именно о моделях. Реальные атомы, конечно, более сложны и мы пока знаем о них далеко не все. Однако современная теоретическая модель электронного строения атома позволяет успешно объяснить и даже предсказать многие свойства химических элементов, поэтому широко используется в естественных науках.
Для начала рассмотрим более подробно «планетарную» модель, которую предложил Н. Бор (рис. 2-3 в).
Рис. 2-3 в. «Планетарная» модель Бора.
Как уже рассказывалось в этой главе, датский физик Н. Бор в 1913 году предложил модель атома, в которой электроны-частицы вращаются вокруг ядра атома примерно так же, как планеты обращаются вокруг Солнца. Бор предположил, что электроны в атоме могут устойчиво существовать только на орбитах, удаленных от ядра на строго определенные расстояния. Эти орбиты он назвал стационарными. Вне стационарных орбит электрон существовать не может. Почему это так, Бор в то время объяснить не мог. Но он показал, что такая модель позволяет объяснить многие экспериментальные факты (подробнее об этом рассказывается в параграфе 2.7).
Электронные орбиты в модели Бора обозначаются целыми числами 1, 2, 3, … n, начиная от ближайшей к ядру. В дальнейшем мы будем называть такие орбиты уровнями. Для описания электронного строения атома водорода достаточно одних только уровней. Но в более сложных атомах, как выяснилось, уровни состоят из близких по энергии подуровней. Например, 2-й уровень состоит из двух подуровней (2s и 2p). Третий уровень состоит из 3-х подуровней (3s, 3p и 3d), как показано на рис. 2-6. Четвертый уровень (он не поместился на рисунке) состоит из подуровней 4s, 4p, 4d, 4f. В параграфе 2.7 мы расскажем, откуда взялись именно такие названия подуровней и о физических опытах, которые позволили «увидеть» электронные уровни и подуровни в атомах.
В электронной оболочке любого атома ровно столько электронов, сколько протонов в его ядре, поэтому атом в целом электронейтрален. Электроны в атоме заселяют ближайшие к ядру уровни и подуровни, потому что в этом случае их энергия меньше, чем если бы они заселяли более удаленные уровни. На каждом уровне и подуровне может помещаться только определенное количество электронов.
В 20-е годы прошлого века на смену модели Бора пришла волновая модель электронной оболочки атома, которую предложил австрийский физик Э. Шредингер. К этому времени было экспериментально установлено, что электрон имеет свойства не только частицы, но и волны. Например, видимый нашими глазами свет представляет собой электромагнитные волны. Ряд свойств таких волн есть и у электрона. Шредингер применил к электрону-волне математические уравнения, описывающие движение волны в трехмерном пространстве. Однако с помощью этих уравнений рассчитывается не траектория движения электрона внутри атома, а вероятность найти электрон-волну в той или иной точке пространства вокруг ядра.
Рис. 2-7. Примерно такую форму в волновой модели атома имеют «области вероятности» существования электронов: s- и p-орбитали (d-орбитали имеют более сложную форму).
В классической механике предполагается, что человек может наблюдать явление, не нарушая его естественного хода. Например, можно наблюдать движение небесных тел в телескоп, и это никак не отразится на их движении. Астроном может произвести измерения и составить точное математическое описание движения объекта. Используя полученные формулы, можно предсказать, куда движется данный объект и где он будет находиться в любой момент времени.
В микромире дело обстоит иначе. Например, исследуя движение электрона с помощью микроскопа (если бы такое было возможно), мы бы наблюдали отраженные от электрона волны света, энергия которых по величине сопоставима с энергией самих исследуемых частиц. Поэтому при выполнении измерений нами неизбежно вносились бы изменения в состояние электрона (местоположение, скорость, направление движения и т.д.). Значит, на основании наших измерений бессмысленно говорить о точном местоположении электрона в каждый момент времени.
Принцип неопределенности говорит о том, что не следует пытаться вычислить точную траекторию электрона вокруг ядра. Можно лишь указать вероятность нахождения электрона в том или ином участке пространства около ядра в любой момент времени. Эта вероятность поддается вычислению с помощью математических методов.
Во всех моделях атома электроны называют s-, p-, d- и f-электронами в зависимости от подуровня, на котором они находятся. Элементы, у которых внешние (то есть наиболее удаленные от ядра) электроны занимают только s-подуровень, принято называть s-элементами. Точно так же существуют p-элементы, d-элементы и f-элементы.
Таблица 2-4. Наибольшее возможное число электронов на первых 4-х электронных уровнях.
Сколько может разместиться электронов на данном уровне (2n 2 )
Эти сведения нам нужны для того, чтобы научиться “расселять” электроны по уровням в атоме любого элемента. А химические свойства элемента, как мы увидим чуть позже, определяются электронами самого последнего (наиболее удаленного от ядра) заселенного уровня.
Физика. 11 класс
Конспект урока
Урок №24. Строение атома. Опыты Резерфорда
На уроке рассматриваются: понятия атомное ядро, опыты Резерфорда, планетарная модель строения атома; сравниваются модели атома Томсона и Резерфорда, даны некоторые сведения о фактах, подтверждающих сложное строение атома, о работах учёных по созданию модели строения атома.
Атомное ядро — тело малых размеров, в котором сконцентрирована почти вся масса и весь положительный заряд атома.
Планетарная модель атома Резерфорда: в целом атом нейтрален, в центре атома расположено положительно заряжённое ядро, в котором сосредоточена почти вся масса атома, электроны движутся по орбитам вокруг ядра, заряд ядра, как и число электронов в атоме, равен порядковому номеру элемента в периодической системе Д.И.Менделеева.
Ядро атома водорода названо протоном и рассматривается как элементарная частица.
Ядро атома водорода имеет положительный заряд, равный по модулю заряду электрона, и массу, примерно в 1836,1 раза больше массы электрона.
Частота излучений атома водорода составляет ряд серий: серия Бальмера, серия Лаймана, серия Пашена и другие, каждая из которых образуется в процессе перехода атома в одно из энергетических состояний.
Обязательная литература по теме урока:
Основное содержание урока
Долгое время, физика накапливала факты о свойстве вещества для полного представления о строении атома. И только в XIX веке изучение атомического строения вещества существенно сдвинулось с точки покоя.
Большую роль в развитии атомистической теории сыграл выдающийся русский химик Дмитрий Иванович Менделеев, разработавший в 1869 году периодическую систему элементов, в которой впервые был поставлен вопрос о единой природе атомов.
Важным свидетельством сложной структуры атомов явились исследования спектров, излучаемые веществом, которые привели к открытию линейчатых спектров атомов. В начале XIX века в излучении атома водорода были открыты спектральные линии в видимой части спектра.
Таким образом, к началу XX века учёные сделали вывод о том, что атомы материи имеют сложную внутреннюю структуру. Они являются электрически нейтральными системами, а носителями отрицательного заряда атомов являются лёгкие электроны, масса которых составляет лишь малую долю массы атомов. Однако модель атома Томсона находилась в полном противоречии с экспериментами по изучению распределения положительных зарядов.
Электрон – наименьшая электроотрицательная заряжённая элементарная частица

Немецкий физик Филипп фон Ленард в 1903 году проводил опыты, в которых пучок быстрых электронов легко проходил через тонкую металлическую фольгу. На основании этого Ленард предположил, что атом состоит из нейтральных частиц или нейтральных дуплетов с совмещённым положительным и отрицательным зарядами, рассредоточенными в атоме, где большая площадь представляет собой пустоту.
В 1904 году японский физик Хентаро Нагаока выдвинул гипотезу о том, что атом состоит из тяжелого положительно заряженного ядра, окруженного кольцами из большого числа электронов, колебания которых и являются причиной испускания атомных спектров, по аналогии с теорией устойчивости колец Сатурна.
Но в физике уже более 200 лет существует главное правило: окончательный выбор между гипотезами может быть сделан только на основе опыта. Эксперименты, проведенные в первый раз Эрнестом Резерфордом, сыграли решающую роль в понимании структуры атома.
30.08.1871 г. – 19.10.1937 г.
Британский физик новозеландского происхождения
Лауреат Нобелевской премии по химии 1908 года
Для экспериментального изучения распределения положительного заряда, а значит, и массы внутри атома Эрнест Резерфорд в 1906 г. предложил применить зондирование атома α-частицами, скорость которых составляет 1/15 скорости света.
Эти частицы возникают при распаде, например, радия и некоторых других радиоактивных элементов. Сами же α-частицы – это ионизированные атомы гелия, положительный заряд гелия в два раза больше заряда электрона +2He. Этими частицами Резерфорд бомбардировал атомы тяжёлых элементов (золото, медь и др.). Если бы электроны были равномерно распределены по всему объёму атома (по модели атома Томсона), электроны не могли бы заметно изменять траекторию α –частиц, так как размеры и масса электронов в 8000 раз меньше массы α-частиц. Точно так же камушек в несколько десятков граммов при столкновении с автомобилем не может изменить его скорость.
Чтобы обнаружить отклонение α-частиц на большие углы Резерфорд окружил фольгу экранами. Сотрудники Резерфорда вели счёт α-частиц, попадающих в регистрирующее устройство при отклонении их на от первоначального направления на определённый угол φ (фи). Данные из серии опытов, за определённый период времени, приведены в таблице: