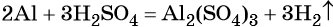в каком случае можно говорить что протекает химическая реакция
ЧАСТЬ 1
2. Образование новых веществ сопровождается появлением новых признаков или свойств, характеризующих эти вещества, что можно зафиксировать с помощью органов чувств, т.е. заметить признаки химических реакций.
3. Заполните таблицу «Признаки химических реакций».
4. Классификация реакций по признаку выделения или поглощения теплоты.
5. Условия течения химических реакций:
— соприкосновение реагирующих веществ;
— первоначальное нагревание для некоторых экзотермических реакций;
— постоянное нагревание для эндотермических реакций.
ЧАСТЬ 2
1. В каком случае можно говорить, что протекает химическая реакция?
1) В пробирку с раствором щёлочи приливают индикатор фенолфталеин.
3) В пробирку с раствором щёлочи приливают индикатор метиловый оранжевый.
Ответ поясните.
Так как в этих случаях наблюдается изменение окраски раствора, в 1 – раствор станет малиновый, во 3 – жёлтый.
2. Прочитайте внимательно стихотворение.
Явил ряд признаков подряд
Нам, разлагаясь, бихромат:
Цвет, звук, огонь и даже газ
Заметить каждый мог из нас.
Чтоб превращенье началось,
Поджечь кристаллы нам пришлось.
Тепло наружу – это экзо,
Горенье – свет,
Тепло вовнутрь – это эндо –
Обратный тепловой эффект!
О каких признаках описанной реакции говорится в стихотворении?
Изменение окраски, образование газа, появление запаха.
Если на уроке вам не демонстрировали эту реакцию, найдите в Интернете видеофрагмент «Разложение бихромата аммония», просмотрите его и сделайте рисунок, навеянный этой замечательной реакцией.
3. Установите соответствие между признаком и химической реакцией.
4. При приготовлении раствора серной кислоты следует:
Выделяется большое количество теплоты, вода может закипеть и выбросить брызги на лицо и руки работающего.
5. Верны ли следующие суждения?
А. Экзотермические реакции, как правило, идут при постоянном нагревании.
Б. Эндометрические реакции могут протекать без нагревания.
4) оба суждения неверны.
6. Чтобы увеличить скорость химической реакции между твёрдыми и газообразными веществами, нужно измельчить твёрдое вещество.
7. Чтобы увеличить скорость химической реакции между твёрдыми растворимыми веществами, нужно измельчить и растворить их в воде.
8. Укажите, что нужно сделать, чтобы ликвидировать возгорание:
1) твёрдых веществ и материалов – закрыть плотным материалом;
2) нефтепродуктов – использовать огнетушитель;
3) электроприборов – обесточить и накрыть плотным материалом.
Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения. Сохранение массы веществ при химических реакциях
Химической реакцией называют взаимодействия, приводящие к изменению химической природы участвующих в них частиц. При этом происходит изменение их состава и (или) строения. В химических реакциях могут участвовать атомы, молекулы, ионы и радикалы.
В ходе химических реакций атомные ядра не затрагиваются и число атомов каждого химического элемента сохраняется.
Химические реакции протекают при определённых условиях (температура, давление, наличие или отсутствие растворителя, катализа, ультрафиолетовое излучение).
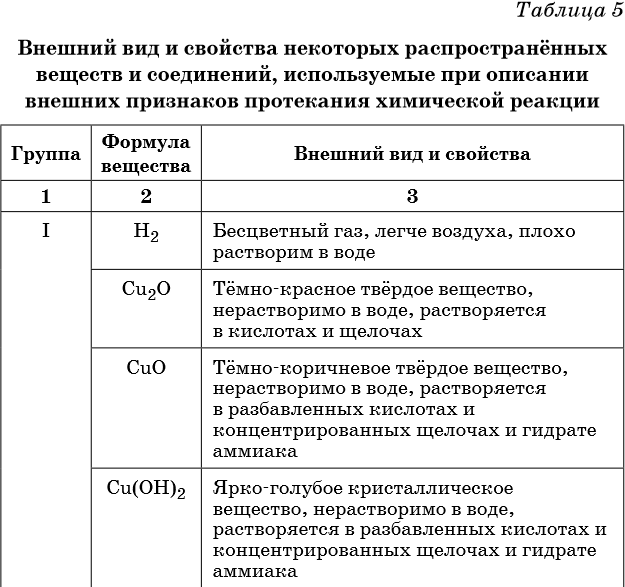
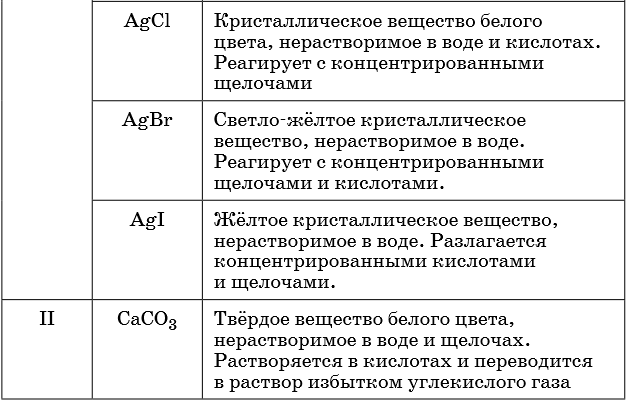
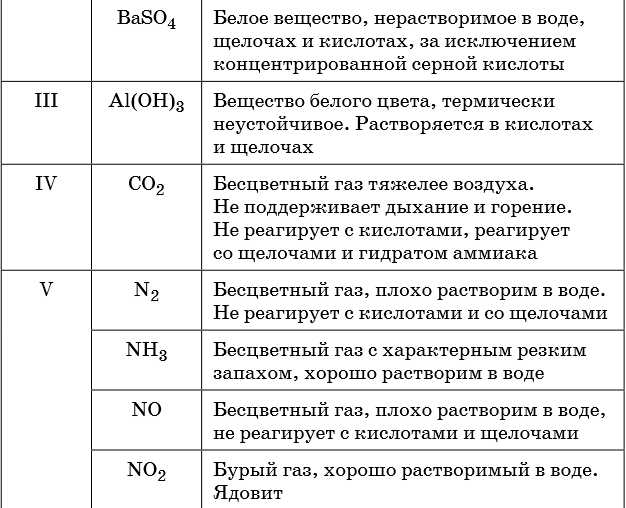
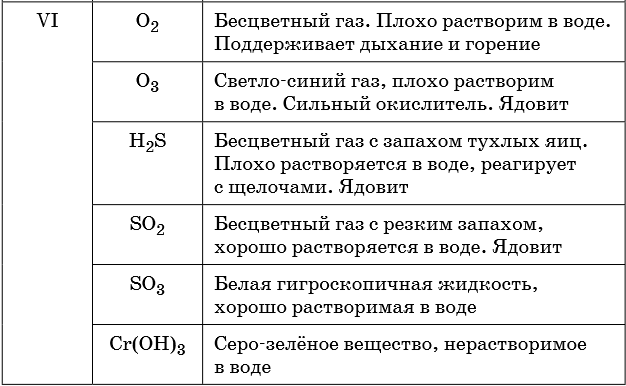
Признаками протекания химических реакций являются выделение или поглощение газа, образование или растворение осадка, изменение цвета, выделение или поглощение теплоты.
Описание качественных реакций, используемых для определения некоторых катионов и анионов, приводится в приложении в конце урока.
В таблице 5 представлены сведения о внешнем виде и свойствах некоторых распространённых веществ и соединений, используемых при описании внешних признаков протекания химической реакции.
Для описания химических реакций используют химические уравнения, в левой части которых указывают исходные вещества, а в правой — продукты реакции. Обе части химического уравнения соединяют стрелкой (в случае необратимых химических превращений), а если химическая реакция является обратимой, то это показывают с помощью прямой и обратной стрелок.
В неорганической химии, если количество атомов химических элементов в левой и правой частях уравнено с помощью стехиометрических коэффициентов, части уравнения часто соединяют знаком равенства.
Стехиометрией называют учение о количественных соотношениях между реагентами и продуктами реакции.
Коэффициенты стехиометрические — действительные натуральные (то есть положительные, как правило, целые) числа, стоящие перед формулой химического вещества в уравнении реакции. Коэффициенты показывают минимальное количество структурных единиц вещества (атомов, молекул, ионов, радикалов), участвующих в данной реакции.
В вышеприведённой реакции два атома алюминия реагируют с тремя молекулами серной кислоты, в результате чего образуется одна молекула сульфата алюминия (коэффициент, равный одному, перед формулой не ставят) и три молекулы водорода.
В соответствии с законом сохранения массы (закон Ломоносова — Лавуазье) масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции.
Этот закон подтверждает, что атомы являются неделимыми и в ходе химических реакций не изменяются. Молекулы при реакциях претерпевают изменения, но общее число атомов каждого вида не изменяется, и поэтому общая масса веществ в процессе реакции сохраняется.
Тренировочные задания
1. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) растворение осадка
2) выделение чёрного осадка
3) отсутствие внешних признаков
4) выделение синего осадка
2. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) растворение осадка
3) выделение белого осадка
4) выделение синего осадка
3. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение жёлто-зелёного газа
3) выделение жёлтого осадка
4) растворение осадка
4. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) появление оранжевой окраски
2) выделение газа с характерным запахом
3) растворение осадка
4) отсутствие внешних признаков
5. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) отсутствие внешних признаков
3) выделение белого осадка
4) выделение чёрного осадка
6. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NaI
Б) Zn и KOH
В) HCl и FeS
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) выделение газа с характерным запахом
3) выделение бесцветного газа
4) выделение чёрного осадка
7. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение газа с характерным запахом
3) выделение белого осадка
4) растворение осадка
8. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
9. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение синего осадка
2) растворение осадка
3) выделение белого осадка
4) выделение бурого осадка
10. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NaI
Б) Al и NaOH
В) HCl и K2SO3
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение жёлтого осадка
11. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) отсутствие внешних признаков
12. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Cu и HNO3 (конц.)
Б) Cu и H2SO4 (конц.)
В) BaCO3 и HCl
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение бесцветного газа
13. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
14. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого осадка
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
15. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа
3) выделение белого осадка
4) выделение чёрного осадка
16. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
17. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение чёрного осадка
18. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа с характерным запахом
3) выделение белого осадка
4) растворение осадка
19. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа с характерным запахом
3) выделение белого осадка
4) выделение студенистого бесцветного осадка
20. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение жёлтого осадка
В каком случае можно говорить что протекает химическая реакция
Тема 26. Химические реакции.
Часть I
2. Образование новых веществ сопровождается появлением новых признаков или свойств, характеризующих эти вещества, что можно зафиксировать с помощью органов чувств, т.е. заметить признаки химических реакций.
3. Заполните таблицу «Признаки химических реакций».
4. Классификация реакций по признаку выделения или поглощения теплоты.
5. Условия течения химических реакций:
— соприкосновение реагирующих веществ;
— первоначальное нагревание для некоторых экзотермических реакций;
— постоянное нагревание для эндотермических реакций.
Часть II
1. В каком случае можно говорить, что протекает химическая реакция?
1) В пробирку с раствором щёлочи приливают индикатор фенолфталеин.
3) В пробирку с раствором щёлочи приливают индикатор метиловый оранжевый.
Ответ поясните.
Так как в этих случаях наблюдается изменение окраски раствора, в 1 – раствор станет малиновый, во 3 – жёлтый.
2. Прочитайте внимательно стихотворение.
Явил ряд признаков подряд
Нам, разлагаясь, бихромат:
Цвет, звук, огонь и даже газ
Заметить каждый мог из нас.
Чтоб превращенье началось,
Поджечь кристаллы нам пришлось.
Тепло наружу – это экзо,
Горенье – свет,
Тепло вовнутрь – это эндо –
Обратный тепловой эффект!
О каких признаках описанной реакции говорится в стихотворении?
Изменение окраски, образование газа, появление запаха.
Если на уроке вам не демонстрировали эту реакцию, найдите в Интернете видеофрагмент «Разложение бихромата аммония», просмотрите его и сделайте рисунок, навеянный этой замечательной реакцией.
3. Установите соответствие между признаком и химической реакцией.
4. При приготовлении раствора серной кислоты следует:
2) серную кислоту приливать к воде.
Ответ поясните.
Выделяется большое количество теплоты, вода может закипеть и выбросить брызги на лицо и руки работающего.
5. Верны ли следующие суждения?
А. Экзотермические реакции, как правило, идут при постоянном нагревании.
Б. Эндометрические реакции могут протекать без нагревания.
4) оба суждения неверны.
6. Чтобы увеличить скорость химической реакции между твёрдыми и газообразными веществами, нужно измельчить твёрдое вещество.
7. Чтобы увеличить скорость химической реакции между твёрдыми растворимыми веществами, нужно измельчить и растворить их в воде.
8. Укажите, что нужно сделать, чтобы ликвидировать возгорание:
1) твёрдых веществ и материалов – закрыть плотным материалом;
2) нефтепродуктов – использовать огнетушитель;
3) электроприборов – обесточить и накрыть плотным материалом.
В каком случае можно говорить что протекает химическая реакция
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Вопрос 3
Заполните таблицу «Признаки химических реакций».
| Взаимодействие щёлочи с фенолфталеином | Фенолфталеин в присутвии щелочей изменяет окраску на малиновый | ||
| Обесцвечивание подкрашенного раствора щёлочи кислотой | Потекает реакция нейтрализации | Выделяется углекислый газ | |
| Взаимодействие растворов щёлочи и медного купороса | Образуется нерастворимый гидроксид меди (II) | Образуется растворимая соль меди (II) |
Вопрос 4
Классификация реакций по признаку выделения или поглощения теплоты.