в честь чего назван химический элемент индий
Индий
И́ндий / Indium (In), 49
[Kr] 4d 10 5s 2 5p 1
И́ндий — элемент главной подгруппы третьей группы пятого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 49. Обозначается символом In (лат. Indium ). Относится к группе лёгких металлов. Простое вещество индий (CAS-номер: 7440-74-6) — ковкий, легкоплавкий, очень мягкий металл серебристо-белого цвета. Сходен по химическим свойствам с алюминием и галлием, по внешнему виду с цинком.
Содержание
История
Происхождение названия
Яркая эмиссионная линия в спектре индия — цвета индиго.
Геохимия и минералогия
Химические свойства
Физические свойства
Термодинамические параметры
Дополнительная информация
Получение
Получают из отходов и промежуточных продуктов производства цинка, свинца и олова. Это сырьё содержит от 0,001 % до 0,1 % индия. Из исходного сырья производят концентрат индия, из концентрата — черновой металл, который затем рафинируют. Исходное сырьё обрабатывают серной кислотой и переводят индий в раствор, из которого гидролитическим осаждением выделяют концентрат. Из концентрата черновой металл извлекают цементацией на цинке и алюминии. Для рафинирования используются различные методы, например зонная плавка.
Стоимость индия в 2006 году составила около 700$ за кг.
Применение
В последние годы мировое потребление индия быстро растёт и в 2005 достигло 850 тонн.
Биологическая роль
Изотопы
Природный индий состоит из двух изотопов — стабильного 113 In (изотопная распространённость 4,29 %) и бета-радиоактивного 115 In (95,71 %; период полураспада 4,41·10 14 лет).
Примечания
Ссылки
Полезное
Смотреть что такое «Индий» в других словарях:
индий — индий, я … Русский орфографический словарь
ИНДИЙ — Металл серебристо белый, не окисляющийся на воздухе; откр. в 1863 г. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ИНДИЙ металл, серого цвета; удельный вес = 7,42. Словарь иностранных слов, вошедших в состав… … Словарь иностранных слов русского языка
ИНДИЙ — (Indium), In, химический элемент III группы периодической системы, атомный номер 49, атомная масса 114,82; металлический индий открыт немецкими учеными Ф. Рейхом и И. Рихтером в 1863 … Современная энциклопедия
Индий — (Indium), In, химический элемент III группы периодической системы, атомный номер 49, атомная масса 114,82; металлический индий открыт немецкими учеными Ф. Рейхом и И. Рихтером в 1863. … Иллюстрированный энциклопедический словарь
ИНДИЙ — хим. элемент, символ In (лат. Indium), ат. н. 49, ат. м. 114,82. Серебристо белый металл, плотность 7362 кг/м3, малопрочен, мягок (намного мягче свинца) и легкоплавок (tпл = 156,2 °С). Индий и его сплавы применяют в полупроводниковой технике, для … Большая политехническая энциклопедия
ИНДИЙ — (символ In), серебристо белый металл III группы периодической таблицы. Побочный продукт, получаемый при очистке цинка. Благодаря ковкости и вязкости используется в некоторых сплавах с низкой температурой плавления, в полупроводниках, в качестве… … Научно-технический энциклопедический словарь
Индий — In (по синей, цвета индиго. линии спектра * a. indium; н. Indium; ф. indium; и. indio), хим. элемент III группы периодич. системы Менделеева, ат. н. 49, ат. м. 114,82. Состоит из стабильного изотопа 113In (4,33%) и изотопа со слабой… … Геологическая энциклопедия
ИНДИЙ — (Indium), In, хим. элемент III группы периодич. системы элементов, ат. номер 49, ат. масса 114,82. В природе представлен двумя изотопами: стабильным 113In (4,28%) и слабо b радиоактивным 116In (95,72%, T1/2=5.1014 лет). Электронная конфигурация… … Физическая энциклопедия
индий — сущ., кол во синонимов: 3 • металл (86) • минерал (5627) • элемент (159) Словарь синонимов ASIS … Словарь синонимов
Индий — (хим.) подобно галлию и некотор. друг. металлам, открыт(1863) с помощью спектрального анализа Рейхом и Рихтером во Фрейберге,при исследовании встречающейся там цинковой обманки. И. в свободном виденикогда не встречается, а в виде, вероятно,… … Энциклопедия Брокгауза и Ефрона
ИНДИЙ
Открытие индия произошло в эпоху бурного развития спектрального анализа – принципиально нового (в те времена) метода исследования, открытого Кирхгоффом и Бунзеном. Французский философ О.Конт писал, что у человечества нет никакой надежды узнать, из чего состоят Солнце и звезды. Прошло несколько лет, и в 1860 спектроскоп Кирхгоффа опроверг это пессимистичное предсказание. Последующие пятьдесят лет были временем наиболее крупных успехов нового метода. После того как было установлено, что у каждого химического элемента есть свой спектр, являющийся столь же характерным для него свойством, как дактилоскопический отпечаток – признаком человека, началась «погоня» за спектрами. Помимо выдающихся исследований Кирхгоффа (едва не приведших его к полной слепоте) элементного состава Солнца, не менее триумфальными были наблюдения спектров земных объектов: в 1861 были открыты цезий, рубидий и таллий.
В 1863 профессор Фрейбергской минералогической школы (Германия) Фердинанд Рейх (1799–1882) и его ассистент Теодор Рихтер (1824–1898) спектроскопически исследовали образцы цинковой обманки (минерала сфалерита, ZnS), чтобы обнаружить в них таллий. Из образца сфалерита действием соляной кислоты Рейх и Рихтер выделили хлорид цинка и поместили его в спектрограф с надеждой зарегистрировать появление ярко-зеленой линии, характерной для таллия. Профессор Ф.Рейх страдал дальтонизмом и не мог различать цвета спектральных линий, поэтому все наблюдения регистрировал его ассистент Рихтер. Обнаружить присутствие таллия в образцах сфалерита не удалось, но каково же было удивление Рейха, когда Рихтер сообщил ему о появлении в спектре ярко-синей линии (4511Å). Было установлено, что линия не принадлежала ни одному из известных до этого элементов и отличалась даже от ярко-синей линии спектра цезия. В силу сходства цвета характеристической полосы в эмиссионном спектре с цветом красителя индиго (латинское «indicum» – индийская краска) открытый элемент был назван индием.
Так как новый элемент был обнаружен в сфалерите, первооткрыватели сочли его аналогом цинка и приписали ему неверную валентность, равную двум. Они определили и атомный вес эквивалента индия, который оказался 37,8. Исходя из валентности 2, был неверно установлен атомный вес элемента (37,8 × 2 = 75,6). Только в 1870 Д.И.Менделеев на основании периодического закона установил, что индий имеет валентность, равную трем, и является, таким образом, аналогом алюминия, а не цинка.
Таким образом, в 1871 индий стал 49-ым элементом периодической системы.
Индий в природе.
По содержанию в земной коре индий относится к типичным редким элементам, а по характеру распространения – к типичным рассеянным элементам. Кларк индия в земной коре равен 1,4·10 –5 %. Сейчас известно около десяти собственных минералов индия: самородный индий (редчайшие экземпляры), сложные сульфиды индит FeIn2S4, рокезит CuInS2, сакуранит (CuZnFe)3InS4 и патрукит (Cu,Fe,Zn)2(Sn,In)S4, интерметаллид йиксуит PtIn, джалиндит In(OH)3. Эти минералы не имеют практического значения вследствие своей исключительной редкости. Близость ионного радиуса индия с размерами ионов более распространенных металлов (Fe, Zn, Mn, Sn, Mg, Pb и др.) приводит к тому, что в природе индий встраивается в кристаллические решетки минералов этих элементов. Однако, несмотря на такое сходство, содержание индия в подавляющем большинстве минералов-носителей невелико и редко когда выходит за пределы нескольких тысячных долей процента. Количество минералов, в которых содержание индия достигает нескольких десятых долей процента (0,05–1%) чрезвычайно мало. Среди них можно отметить цилиндрит Pb3Sn4Sb2S14 (0,1–1% In) и франкеит Pb5Sn3Sb2S14(до 0,1% In), минералы класса сульфостаннанов, цинковую обманку ZnS (0,1–1% In), халькопирит CuFeS2(0,05–0,1% In) и борнит Cu3FeS3 (0,01–0,05% In). Из-за незначительного распространения в природе сульфостаннанов они не имеют значения для промышленных процессов извлечения индия. Концентрация индия в цинковых обманках тем выше, чем больше содержание в них железа и марганца, а из разнообразных по условиям своего образования обманках (марматит, сфалерит, клейофан) богаты индием ранние высокотемпературные, темноокрашенные представители – марматиты. Так, в сфалерите с высоким содержанием железа (темном сфалерите) содержание индия достигает 1%. Однако среднее содержание индия в сфалеритовых месторождениях не превышает и сотой доли процента.
В небольших концентрациях индий обнаружен в золе каменных углей, нефтях некоторых месторождений (до 2,2·10 –6 % In), а также в морской ((0,02–7)·10 –10 % In) и дождевой ((0,002–2)·10 –7 %) воде. Содержание индия во Вселенной оценивается в 3·10 –10 %(масс.) или 3·10 –12 %(ат.).
На сегодняшний день нет достоверных сведений о мировых ресурсах индия, так как его извлечение всегда привязано к переработке цинковых руд. По приблизительным оценкам United States Geological Surveys (по состоянию на июнь 2004) суммарный мировой запас разведанных месторождений индия составляет 2,5·10 3 тонн в пересчете на металл, а объемы резервной базы (с учетом неразведанных ресурсов) – 6·10 3 тонн металла. Мировыми лидерами по запасам индия являются Канада (30% мировых запасов), Китай и США (10% мировых запасов):
| Таблица 1. ПРИБЛИЗИТЕЛЬНОЕ РАСПРЕДЕЛЕНИЕ МИРОВЫХ РЕСУРСОВ ИНДИЯ | ||
| Страна | Ресурсы, тонн | Резервная база, тонн |
| Канада | 700 | 2000 |
| Китай | 280 | 1300 |
| США | 300 | 600 |
| Россия | 200 | 300 |
| Перу | 100 | 150 |
| Япония | 100 | 150 |
| Другие страны | 800 | 1500 |
Промышленное получение и рынок индия.
Основная доля природного индия приходится на свинцово-цинковые месторождения (70–75%) и лишь небольшая его часть на оловянные месторождения (10–15%), поэтому в настоящее время основным источником первичного индия являются цинковые обманки полиметаллических месторождений. Индий получается как побочный продукт переработки свинцово-цинковых, полиметаллических или оловянных руд, а далее цинковых медных или оловянных концентратов. Схемы извлечения индия сложны и многостадийны, так как для индия, в отличие от большинства других редких металлов, нет специфических химических реакций, позволяющих отделять его от нежелательных примесей, а многочисленные методы цементации, экстракции и ионообменного выделения также не вполне селективны.
Основным индиевым сырьем являются возгоны свинцово-цинковых производств пыль. При обогащении свинцово-цинковых руд индий в основном переходит в цинковые и, в небольшой степени, в свинцовые концентраты, часть индия остается с пустой породой. Полученные цинковые концентраты обжигаются, и практически весь индий, вследствие низкой летучести In2O3, остается в огарке. При последующем пирометаллургическом получении цинка индий почти полностью переходит в летучие возгоны. Несмотря на различное происхождение, для всех возгонов характерно обогащение цинком, свинцом, кадмием и многими другими элементами, вследствие чего извлечение индия из них затруднено. Кроме того, содержание индия в таких возгонах редко превышает 0,01%. Основным способом разложения возгонов является сернокислотное выщелачивание. Наиболее полное извлечение индия в раствор достигается обработкой большим избытком серной кислоты или с помощью сульфатизации (действием концентрированной серной кислоты на возгоны при нагревании). В процессе сульфатизации в значительной степени удаляются примеси мышьяка, хлора и фтора, но остаются цинк, медь, кадмий, алюминий и другие элементы. Обработанные кислотой возгоны далее обрабатываются водой, в результате которой получаются разбавленные сернокислотные растворы с концентрацией индия около 0,1 г/л. Самой сложной стадией процесса является извлечение индия из таких растворов, для которого предложено множество методов избирательного осаждения и растворения, экстракции и ионного обмена; все они не являются вполне селективными. На практике применяется последовательное сочетание этих методов для наиболее полного и селективного извлечения элемента.
На первом этапе выделения индия из растворов после выщелачивания могут применяться обработка избытком не очень концентрированного раствора гидроксида натрия (отделение Al, Zn, As, Sb, Sn, Ga, Gе), избытком водного аммиака (отделение Cd, Co, Cu, Ni, Zn) или сероводородом в сильнокислой среде.
На втором этапе используются процессы цементации, амальгамного восстановления, экстракционного и ионообменного извлечений. Цементация – вытеснение индия из раствора цинковой пылью, черновым индием или алюминиевыми листами, которое в значительной степени позволяют избавиться от примесей железа и алюминия. В результате цементации получается пирофорный (самовоспламеняющийся на воздухе) губчатый индий, который выдерживают сутки под слоем воды для пассивации. Амальгамный способ заключается в переведении индия из водного раствора в фазу ртути действием амальгамы цинка или электролизом на ртутном катоде. Разложением амальгамы получают металлический индий. Электролизом на ртутном катоде можно выделить практически весь индий даже из сильно разбавленных растворов. В экстракционных методах в качестве органической фазы часто применяется раствор алкилфосфорных кислот в керосине. Таким способом можно экстрагировать почти нацело весь индий из сернокислотных растворов. Совместно с индием в специально подобранных условиях экстрагируются лишь Sb(III), Sn(IV), Fe(III). После повторной экстракции индий из раствора выделяется цементацией. Ионообменное выделение (наряду с экстракцией и цементацией) применяется для очистки индиевых концентратов.
Металлический индий, полученный из побочных продуктов свинцово-цинковых производств, содержит свинец, мышьяк, олово, ртуть, никель, кадмий, железо и другие элементы в качестве значительных примесей Для более глубокой очистки применяются специальные методы – плавка под слоем щелочи (удаление Zn, Al и некоторых других примесей), плавка под слоем глицеринового раствора иодида калия с добавкой иода (удаление Cd, Tl, Fe). Окончательно индия очищается при помощи кристаллофизических методов – зонной плавки и вытягивания из расплава по Чохральскому. При этом происходит глубокая очистка от примесей серебра, меди, никеля и, если вытягивание воздухе, железа.
В последние годы рынок металлического индия отличается крайней нестабильностью. Данные разных авторов по производству и потреблению индия часто отличаются в несколько раз. В 1987 производство первичного рафинированного индия составляло 53 тонны, в 1988 – 106 тонн, в 1994 – 145 тонн, а в 1995 – 240 тонн, в 2000 было произведено 335 тонн металла, в 2001 – 345 тонн, в 2002 – 335 тонн, а в 2003 выплавлено 305 тонн металла. Крупнейшими производителями первичного индия являются Китай, Япония и Канада. США не производят своего индия (все месторождения индия, как стратегического металла, законсервированы), а лишь занимаются рафинированием (заводы в Нью-Йорке и Род-Айленде) ввозимого из-за рубежа низкосортного (99,97 и 99,99%) индия до 99,9999% содержания металла (ITO-качества).
| Таблица 2. РАСПРЕДЕЛЕНИЕ МОЩНОСТЕЙ ЕЖЕГОДНОГО МИРОВОГО ПРОИЗВОДСТВА (2003) ПЕРВИЧНОГО ИНДИЯ. | ||
| Страна | Производство, тонн/год | Основные производители |
| Канада | Falconbridge Ltd.’s Kidd Creek, Ontario; Teck Cominco’s Trail, British Colombia. | |
| Бельгия | Zhuzhou Smelter Non-ferrous Co., Ltd; Liuzhou Zinc Product Co., Ltd; Huludao Zinc Smelter Co; China Tin Group Co. Ltd. | |
| Франция | Indium Corporation of America; Utica; NY; Umicore Indium Products, Providence, RI (a division of n.v. Umicore, s.a.) | |
В силу ограниченности природных ресурсов индия возникла проблема переработки вторичного сырья (лом от производства ЖК-дисплеев и пр.), с которой сейчас успешно справляется Япония, выплавившая в 2003 160 тонн вторичного индия. Крупнейший потребитель индия – Япония, по некоторым оценкам в 2003 потребление индия в этой стране составило 420 тонн. Внутренние ежегодные потребности США в индии оцениваются в 90–95 тонн, но в 2003 США импортировали 125 тонн металла, экспортировали меньше 10 тонн. Мировое потребление индия в 2003 составило более 500 тонн, и по прогнозам специалистов Roskill к 2008 потребление индия может достигнуть значения 850–870 тонн. В начале 1987 цена на индий составляла 114, а в середине равнялась 250 долларов/кг. В 1995 цена на металл достигла 575 долларов/кг, но в 1999 она снова упала до отметки 200 долларов/кг. К середине 2002 цены на индий достигли рекордно низкого значения 55–60 долларов/кг, но к началу зимы ситуация стала меняться, и стоимость индия перевалила за отметку 100 долларов/кг. К концу 2003 индий стоил 300 долларов/кг, а в 2004 – 400–430 долларов/кг. За последние 14 лет среднемесячная цена на металл составила 250 долларов/кг.
Свойства простого вещества.
В присутствии кислорода медленно корродирует в воде с образованием гидроксида:
Слабо растворяется на холоде в разбавленных кислотах, значительно лучше при нагревании. Легко растворяется в галогеноводородных кислотах (в HF – в присутствии окислителя):
2In + 6HCl = 2InCl3 + 3H2
Реакция индия с концентрированной серной кислотой на холоде протекает с выделением водорода, при нагревании – диоксида серы. В зависимости от добавленного количества кислоты возможно образование нормального сульфата или комплексной кислоты:
2In + 6H2SO4 = In2(SO4)3 + 3SO2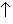
In + 2H2SO4 + 3,5H2O = HIn(SO4)2·3,5H2O Ї + 2H2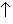
Индий легко растворяется в азотной кислоте различной концентрации с образованием нитрата индия (III):
In + 4HNO3 = In(NO3)3 + NO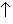
Индий не реагирует с уксусной кислотой, но растворяется в растворе щавелевой:
2In + 6H2C2O4 = 2H3[In(C2O4)3] + 3H2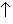
С галогенами при легком нагревании образует тригалогениды:
2In + 3X2 = 2InX3 (X = F, Cl, Br, I).
При взаимодействии индия с сероводородом при 1000° С или при сплавлении стехиометрических количеств индия и серы в атмосфере СО2 можно получить сульфид индия(I):
Индий не реагирует с бором, углеродом и кремнием, не известны также соответствующие борид, карбид, силицид. Водород с индием также не реагирует и очень плохо в нем растворяется (менее 1 см 3 на 100 г In); известны, однако, гидриды индия – (InH3)n и InH. При сплавлении индия с его тригалогенидами можно получить галогениды, в которых индий находится в низших степенях окисления +1 и +2 (наряду с нестехиометрическими галогенидами).
Важнейшие соединения индия.
Индий в своих соединениях может находиться во всех степенях окисления от 0 до +3. Химия одновалентного индия сейчас хорошо изучена, однако практическое значение имеют лишь соединения трехвалентного индия, как наиболее устойчивые и распространенные.
4In(NO3)3 = 2In2O3 + 12NO2
Оксид индия не растворим в воде, не реагирует с растворами щелочей, легко взаимодействует с растворами минеральных кислот с образованием соответствующих солей:
При температурах 700–800° С In2O3 восстанавливается водородом или углеродом до металла:
Оксид индия (III) нелетуч, но при сильном нагревании выше 1200° С частично диссоциирует с образованием черного летучего In2O:
Сейчас оксид индия (III) – наиболее широко применяемое соединение индия, так как он является основой большинства электропроводящих пленок (легированных диоксидом олова) на стекле, слюде или лавсане, используемых при изготовлении жидкокристаллических дисплеев, мониторов портативных компьютеров, электролюминесцентных ламп, электродов фотопроводящих элементов, топливных элементов (в том числе – высокотемпературных) и т.п. Электропроводящие пленки на основе In2O3, будучи нанесенными на автомобильные или авиационные стекла, способны нагревать их до 100° С при пропускании тока и, тем самым, предотвращать их обледенение и запотевание. Стекла с такими пленками способны пропускать до 85% падающего на них света. Кроме того, In2O3 находит некоторое применение в стекольной промышленности, так как добавки его придают стеклу желтый или оранжевый цвет. Для монокристалла индий-оловянного оксида получено одно из максимальных значений эффективности преобразования солнечной энергии (12%). Известно еще множество применений оксида индия в качестве электропроводящего элемента.
Полупроводники на основе пниктогенидов индия.
Пниктогениды – соединения индия с элементами главной подгруппы V группы периодической системы (кроме висмута) обладают полупроводниковыми свойствами. Несмотря на снижающийся в последнее десятилетие удельный вес полупроводниковых материалов в общем потреблении индия, они продолжают играть значительную роль в электротехнике.
С фосфором, мышьяком и сурьмой индий образует по одному стехиометрическому соединению (нестехиометрических не образуется вовсе) – InP, InAs и InSb. Все они кристаллизуются в кубической сингонии (типа сфалерита). Известен и нитрид индия InN, но пока он находит весьма ограниченное применение.
Наиболее просто получается антимонид индия по реакции
Помимо зонной плавки, для получения монокристаллов антимонида индия (особенно легированных) применяют метод вытягивания кристаллов из расплава с температурой, близкой к точке кристаллизации (по Чохральскому). Суть (в отличие от аппаратурного оформления) его довольно проста: в расплав вещества с помощью специального магнитного (или другого) держателя опускается затравка (маленький монокристалл InSb), а после начала наращивания вещества на кристалл держатель медленно поднимается из расплава. Следует отметить, что монокристаллы выращиваются в определенных кристаллографических направлениях и, таким образом, можно получить вытянутый монокристалл антимонида индия довольно больших размеров.
Антимонид индия отличается чрезвычайно высокой подвижностью электронов и благодаря этому InSb используется в изготовлении малоинерционных датчиков Холла, находящих разнообразное применение в приборах для измерения напряженности постоянных и переменных магнитных полей и токов. Другой областью применения антимонида индия является изготовление инфракрасных детекторов, поскольку его электропроводность сильно меняется под действием инфракрасного излучения, которое, в большей или меньшей степени, испускают все окружающие тела в зависимости от степени их нагрева. Именно на регистрации ИК-излучения, испускаемого разными телами с различной интенсивностью, основано действие приборов ночного видения. На основе InSb можно создавать фотоприемники, работающие в дальней ИК-области. Такие приемники, однако, работают при сильном охлаждении (до 2–4 К). Антимонид индия с успехом используется и при изготовлении различного рода преобразователей, термоэлектрических генераторов и некоторых других электротехнических устройств.
Арсенид индия – серые кристаллы с металлическим блеском, температура плавления 943° С. Поскольку мышьяк очень летуч, при синтезе соединение разлагается сразу после образования. Чтобы предотвратить разложение, нужно в объеме реактора поддерживать равновесное давление паров мышьяка. Для наиболее удобного регулирования давления паров мышьяка предложена оригинальная конструкция т.н. двухзонной печи. Такая печь обладает двумя температурными зонами, в одной из которых находится расплавленный индий, а в другой мышьяк. Реакция проходит между расплавом индия и парами мышьяка по уравнению
Температура нагревателя в зоне с мышьяком регулируется таким образом, чтобы поддерживалось равновесное давление паров As (32,7 кПа при 800–900° С) при синтезе арсенида индия.
Монокристаллы InAs получают вытягиванием из расплава по Чохральскому из-под слоя флюса (расплав B2O3). Флюс нужен для предотвращения испарения мышьяка из реакционной зоны (своеобразный гидродинамический затвор), а чтобы пузырьки паров мышьяка не пробулькивали через слой флюса, над ним создается давление инертного газа (обычно аргона), втрое превышающее давление паров мышьяка при синтезе. По своим свойствам арсенид индия похож на антимонид, поэтому и области применения у них почти одинаковы.
Сейчас хорошо отработана технология нанесения из жидкой или газовой фазы полупроводящих пленок InP, InAs и InSb на монокристаллическую подложку, так как этот способ изготовления полупроводников имеет ряд важных преимуществ перед методами выращивания объемных монокристалллов (более низкие температуры кристаллизации, снижение содержания примесей и др.). Такие структуры также находят широкое применение в электронике.
Наибольшее применение в полупроводниковой технике находят не чистые пниктогениды индия, а их твердые растворы или растворы с пниктогенидами галлия, например системы GaP-InSb, InAs-InP, InP-GaSb и многие другие. Изменение состава таких растворов позволяет плавно контролировать важнейшие физико-химические свойства получаемых полупроводников, тем самым расширяя функциональные возможности и повышая рабочие параметры электронных устройств на их основе. Принципы синтеза таких растворов сходны с принципами изготовления полупроводников из индивидуальных веществ.
Другие применения индия.
Основная статья потребления (65%) индия в США и Японии – изготовление тонких электропроводящих пленок и ИК-отражающих пленок на основе оксида индия. Доля применения индия для изготовления полупроводников невелика – всего 10%. Помимо этого есть много других областей применения индия. Прежде всего, благодаря пластическим и антикоррозионным свойствам, низкой летучести и маленькой температуре плавления индий используется для получения различных сплавов и припоев (15% от общего потребления индия), находящих самые разнообразные применения от ювелирного дела и зубоврачебной практики до изготовления космических аппаратов. Индий способен легко (даже при натирании) диффундировать в другие металлы и образовывать твердые износостойкие покрытия, поэтому с конца 1940-х индий успешно применяется в изготовлении высококачественных подшипников для двигателей, срок службы которых в пять раз превосходит срок службы обычных. Предложено множество покрытий для нанесения на трущиеся поверхности подшипников – серебряно-индиевые, серебряно-ториево-индиевые, индий-цинковые, свинцово-индиевые, чистый индий и другие. Многие из таких подшипников способны работать без смазки – покрытия на основе индия придают поверхности хорошие смазывающие свойства. Для увеличения сопротивления износу индием покрывают острия контактов различных выключателей, графитовых щеток и т.д. Широко применяется индий как компонент более чем пятидесяти легкоплавких сплавов с температурами плавления от 10,6° С (62,5% Ga, 21,5% In, 16% Sn) до 314° С (95% Pb, 5% In), с успехом применяющихся для лужения и пайки. Кроме того, они используются в качестве высокотемпературной смазки, материалов высоковакуумных и жидкометаллических затворов, жидкометаллических скользящих электроконтактов и среды для термометров и термостатов. Индий – компонент многих припоев, например припои состава Ag 50–65%, Ga 3–12%, In 6–18%, Cu – остальное; In 12–50%, Sn 10–40%, Ag 0,1–10%, Cu 20–60%. Припои на основе индия используются, например, для сварки металла со стеклом. Индий и олово имеют низкое давление пара, поэтому их сплавы используются для пайки высоковакуумной аппаратуры. В ювелирном деле индий применяется в сплавах с золотом, серебром и платиноидами. Добавление индия к золоту значительно увеличивает твердость и прочность изделий, улучшает их декоративный вид. Разработан ряд сплавов индия для замены золота в ювелирных изделиях. Получены сплавы индия с палладием, имеющие золотой и розово-сиреневый цвета. Например известны «зеленое золото» (75%, Au, 20% Ag, 5% In), сплав платины с индием (60% мол. In и 40% Pt) золотисто-желтого цвета, «белое золото» и многие другие сплавы. Добавка индия к серебру предотвращает потускнение серебряных ювелирных изделий на воздухе. Применение индия в стоматологии известно с 1934. При небольших добавках к материалам зубных пломб и протезов индий повышает их коррозионную стойкость и твердость. Добавка индия к материалу зубных протезов позволяет использовать большие количества меди вместо золота при их изготовлении. Соединения индия являются компонентами зубных цементов, порошков и паст для профилактики кариеса зубов. Индиевые покрытия обладают прекрасной отражающей способностью и применяются в изготовлении высококачественных зеркал, необходимых для астрономических приборов (например, телескопов, регистрирующих слабый свет от далеких звезд), прожекторов, рефлекторов и других устройств с высокой измерительной точностью. Обычные бытовые зеркала не одинаково отражают световые лучи различных спектральных областей – другими словами, цветовая гамма несколько искажается, хотя это и не заметно для человеческого глаза. Это недостаток серебряных, оловянных, и ртутно-висмутовыех зеркал, но не индиевых, одинаково точно отражающих лучи с различными длинами волн.
Биологическая роль индия.
О биологической роли индия почти нет сведений, известно лишь, что индий в следовых количествах есть в зубной ткани, и что в больных зубах (кариозных) его концентрация значительно ниже, чем в здоровых. Сведения о токсикологии индия противоречивы, но, скорее всего, при введении в желудок и внутривенно индий малотоксичен. Пыль индия вредна. ПДК индия в воздухе 0,1 мг/м 3 (США) и 4 мг/м 3 (Россия).



