в чем значение перехватов ранвье нервных волокон
РАНВЬЕ ПЕРЕХВАТ
Смотреть что такое «РАНВЬЕ ПЕРЕХВАТ» в других словарях:
ранвье перехват — (L. A. Ranvier) см. Перехват узла … Большой медицинский словарь
перехват узла — (isthmus nodi, LNH; син. Ранвье перехват) участок истончения оболочки миелинового нервного волокна, соответствующий границе между леммоцитами (шванновскими клетками) … Большой медицинский словарь
Ранвье́ перехва́т — (L.A. Ranvier) см. Перехват узла … Медицинская энциклопедия
Перехват Ранвье (Node Of Ranvier) — сужение миелинового нервного волокна, образующееся на границе между двумя соседними шванновскими клетками. В перехвате отсутствует миелиновая оболочка. Источник: Медицинский словарь … Медицинские термины
ПЕРЕХВАТ РАНВЬЕ — (node of Ranvier) сужение миелинового нервного волокна, образующееся на границе между двумя соседними шванновскими клетками. В перехвате отсутствует миелиновая оболочка … Толковый словарь по медицине
Перехва́т узла́ — (isthmus nodi, LNH; син. Ранвье перехват) участок истончения оболочки миелинового нервного волокна, соответствующий границе между леммоцитами (шванновскими клетками) … Медицинская энциклопедия
МИЕЛИНОВАЯ ОБОЛОЧКА — (от греч. myelos мозг), оболочка, окружающая отростки нервных клеток в мякотных волокнах. М. о. состоит из белого белково липидного комплекса миелина, в периферич. ЦНС образуется вследствие многократного обёртывания отростка шванновской клеткой… … Биологический энциклопедический словарь
Нейрон — (от греч. néuron нерв) неврон, нервная клетка, основная функциональная и структурная единица нервной системы (См. Нервная система); принимает сигналы, поступающие от рецепторов и др. Н., перерабатывает их и в форме нервных импульсов… … Большая советская энциклопедия
НЕЙРОН — (от греч. neuron жила, нерв), нервная клетка, нейроцит, осн. структурная и функциональная единица нервной системы, обладающая специфич. проявлениями возбудимости. Способен принимать сигналы, перерабатывать их в нервные импульсы и проводить к… … Биологический энциклопедический словарь
НЕРВНОЕ ОКОНЧАНИЕ — (terminatio nervi), специализированное образование в концевом разветвлении отростков нейрона, лишённых миелиновой оболочки; служит для приёма или передачи сигналов. Чувствительные, или сенсорные, Н. о,, осуществляющие приём сигналов (рецепцию),… … Биологический энциклопедический словарь
В чем значение перехватов ранвье нервных волокон
А. Накручивание мембраны шванновской клетки на крупный аксон формирует миелиновую оболочку миелинизированного нервного волокна.
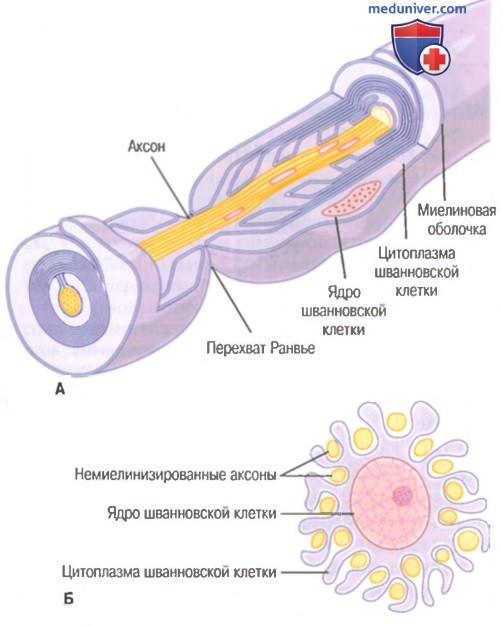
Б. Частичная закрутка мембраны и цитоплазмы шванновской клетки вокруг множества немиелинизированных нервных волокон (показано в поперечном сечении).
На рисунке показано типичное миелинизированное волокно. Центральной его частью является аксон, по мембране которого проводится потенциал действия. Аксон заполнен аксоплазмой — вязкой внутриклеточной жидкостью. Аксон окружен миелиновой оболочкой, которая часто много толще, чем сам аксон. Примерно через каждые 1-3 мм вдоль миелиновой оболочки имеется перехват Ранвье.
Миелиновая оболочка формируется вокруг аксона шванновскими клетками. Мембрана шванновской клетки сначала охватывает аксон, затем шванновская клетка многократно вращается вокруг аксона, образуя многочисленные мембранные слои, содержащие липидное вещество сфингомиелин. Это вещество является отличным изолятором и снижает ионный ток через мембрану аксона примерно в 5000 раз. Между каждыми двумя последовательно расположенными шванновскими клетками по ходу аксона остается маленькая неизолированная область длиной всего 2-3 мкм, где ионы могут свободно переходить через мембрану аксона из внеклеточной жидкости во внутриклеточную и обратно. Эту область называют перехватом Ранвье.
Сальтаторное проведение в миелиновых волокнах от перехвата к перехвату. Ионы практически не могут проходить через толстую миелиновую оболочку мякотных волокон, однако они легко диффундируют через перехваты Ранвье. Следовательно, потенциалы действия возникают только в перехватах и проводятся от перехвата к перехвату; это называют салътаторным (скачкообразным) проведением. В этом случае электрический ток течет через внеклеточную жидкость снаружи от миелиновой оболочки, а также через аксоплазму внутри аксона от перехвата к перехвату, последовательно возбуждая один перехват за другим. Таким образом, нервный импульс как будто прыгает по волокну, на основании этого и появился термин «салътаторное проведение».
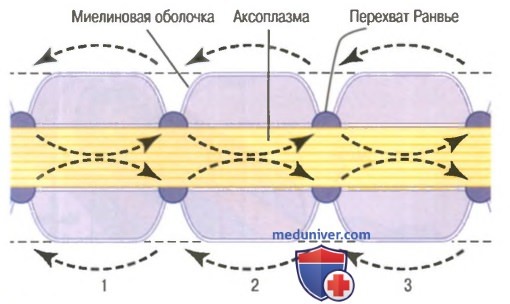
Сальтаторное проведение имеет два преимущества. Во-первых, заставляя процесс деполяризации «прыгать» через большие промежутки вдоль аксона, этот механизм повышает скорость проведения в миелинизированных волокнах в 5-50 раз. Во-вторых, сальтаторное проведение сохраняет энергию для аксона, поскольку деполяризуются только перехваты, что позволяет приблизительно в 100 раз снизить потерю ионов по сравнению с возможными потерями в других условиях. В связи с этим снижаются траты энергии, необходимые для восстановления трансмембранной разности концентраций ионов натрия и калия после серии нервных импульсов.
Существует другая особенность сальтаторного проведения в крупных миелинизированных волокнах: отличная изоляция, обеспечиваемая миелиновой оболочкой, и 50-кратное снижение мембранной емкости позволяют осуществлять реполяризацию путем перемещения очень незначительного числа ионов.
Скорость проведения в нервных волокнах. Скорость проведения в нервных волокнах колеблется от 0,25 м/сек в очень тонких немиелинизирован-ных волокнах до 100 м (длина футбольного поля) в 1 сек в очень толстых миелинизированных волокнах.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Перехваты Ранвье
Перехваты Ранвье — периодические разрывы в изолирующих миелиновых оболочках миелинизированных аксонов в местах аксональных мембран, подвергаемых воздействию внеклеточного пространства. Перехваты Ранвье не изолированы и очень богаты ионными каналами, что позволяет им принимать участие в обмене ионов, необходимых для восстановления потенциала действия. Нервная проводимость в миелинизированных аксонах называется сальтаторным проведением (от лат. saltare — прыгать, скакать) из-за того, что потенциал действия «перескакивает» от одного узла к другому по всей длине аксона.
Содержание
Общая информация
Многие аксоны позвоночных окружены миелиновой оболочкой, способствующей быстрому и эффективному сальтаторному («скачкообразному») распространению потенциалов действия. Контакты между нейронами и нейроглиями проявляют очень высокий уровень пространственной и временной организации в миелинизированных волокнах. Миелинизирующие клетки нейроглий; олигодендроциты в центральной нервной системе (ЦНС) и Шванновские клетки в периферической нервной системе (ПНС), обернуты вокруг аксона, оставляя аксолемму относительно незакрытой на равномерно расположенных перехватах Ранвье. Эти междуузловые глиальные мембраны сливаются для образования компактного миелина, в то время как заполненные цитоплазмой параузловые петли миелинизирующих клеток спирально закручены вокруг аксона на обеих сторонах узлов. Такой способ организации требует жесткого контроля развития и формирования различных специализированных зон контакта между различными областями мембраны миелинизирующих клеток. Каждый узел Ранвье окружён межузловыми областями, в то время как скрученные глиальные петли прикреплены к мембране аксонов с помощью разделённых перегородками соединений.
Отрезок между перехватами Ранвье называют междоузлием, а его внешнюю часть, контактирующую с параузлами, называют областью соприкосновения параузлов. Узлы инкапсулируются микроворсинками, растущими из внешней стороны мембраны Шванновской клетки в ПНС, либо периузловыми расширениями астроцитов в ЦНС.
История
Его совершенные гистологические техники и исследования как на поврежденных, так и на нормальных нервных волокнах стали всемирно известными. Его наблюдения за узлами волокон, а также дегенерацией и регенерацией срезанных волокон, оказали большое влияние на неврологов в Сальпетриере. Вскоре после этого он обнаружил разрывы в оболочках нервных волокон, которые впоследствии были названы перехватами Ранвье. Это открытие позже привело Ранвье к тщательному гистологическому исследованию миелиновых оболочек и шванновских клеток. [3]
Структурный и молекулярный состав
Структура
Междоузлия, то есть сегменты миелина и промежутки между ними, называют узлами. Размер междоузлий и расстояние между ними изменяется в зависимости от диаметра волокна в нелинейной зависимости, оптимальной для максимальной скорости передачи. [4] Узлы имеют размер от 1-2 мкм, в то время как размер междоузлий может достигать (а иногда даже превышать) длину в 1,5 миллиметра, в зависимости от диаметра аксона и типа волокна.
Структура узла и окружающие параузловые области отличаются от междоузлий, находящихся под оболочкой из компактного миелина, но сходны в ЦНС и ПНС. Аксон подвергается воздействию внеклеточной среды в узле и сжимается в диаметре. Уменьшение размера аксона отражает более высокую плотность упаковки нейрофиламентов в этой области, которые менее фосфорилируются и транспортируются медленнее. [4] Везикулы и другие органеллы также увеличиваются в узлах, что предполагает, что существует узкое место аксонального транспорта в обоих направлениях, а также местной аксоно-глиальной передаче сигналов.
Когда продольный разрез в узле производится через миелинизируемую шванновскую клетку, можно заметить три отдельных сегмента: стереотипное междоузлие, параузловая область, а так же сам узел. В межузловой области Шванновская клетка имеет внешний воротник из цитоплазмы, оболочку из компактного миелина, внутренний воротник из цитоплазмы и аксолемму. В параузловых областях витки параузловой цитоплазмы касаются утолщений аксолеммы с образованием разделённых перегородками соединений. Непосредственно в узле аксолемма соприкасается с несколькими микроворсинками Шванновских клеток и содержит плотный цитоскелетный подслой.
Структурные различия перехватов ЦНС и ПНС
Хотя исследования разрушения замораживанием показали, что узловая аксолемма как в ЦНС, так и в ПНС богаче внутримембранными частицами (ВМЧ), по сравнению с междоузлиями, есть некоторые структурные различия, касающиеся их клеточных составляющих. [4] В ПНС специализированные микроворсинки выступают из наружной манжеты Шванновских клеток и очень близко подходят к узловой аксолемме крупных волокон. Проекции Шванновских клеток расположены перпендикулярно узлу и расходятся из центральных аксонов. В ЦНС же один или более выростов в астроцитах исходят в непосредственной близости от узлов. Исследователи заявляют, что эти выросты исходят из многофункциональных астроцитов, а не от совокупности астроцитов, направленных на контактирование с узлом. С другой стороны, в ПНС базальная пластинка, которая окружает шванновские клетки, непрерывна по всему узлу.
Состав
Было обнаружено, что анкирин связан с βIV-спектринами — изоформами спектрина, в больших количествах содержащимися в узлах Ранвье и начальных сегментах аксонов.
Молекулярная структура
Молекулярное строение узлов основывается на их функции в распространении импульса. Количество натриевых каналов в узле по отношению к междоузлию предполагает, что количество ИМБ соответствует количеству натриевых каналов. Калиевые каналы, по сути, отсутствуют в узловой аксолемме, в то время как они имеют высокую концентрацию в параузловой аксолемме и мембранах Шванновских клеток узла. [4] Точная функция калиевых каналов не совсем выявлена, но известно, что они могут способствовать быстрой реполяризации потенциалов действия или играть жизненно важную роль в буферизацию ионов калия в узлах. Это очень неравномерное распределение потенциалозависимых натриевых и калиевых каналов поразительно контрастирует с их диффузным распределением в немиелинизированных волокнах. [4] [6]
Филаментная сеть, прилегающая к узловой мембране, содержит белки цитоскелета, называемые спектрин и аникрин. Высокая плотность анкирина в узлах может быть функционально значимой, так как некоторые из белков, находящихся в узлах, имеют способность связываться с анкирином с чрезвычайно высоким сродством. Все эти белки, включая анкирин, в больших количествах содержатся в начальном сегменте аксона, что предполагает функциональную связь. Взаимосвязь этих молекулярных компонентов к скоплениям натриевых каналов в узлах до сих пор неизвестна. Впрочем, некоторые молекулы клеточной адгезии, как сообщается, размещены в узлах бессистемно, в то время как множество других молекул сосредоточено в глиальных мембранах параузловых областей, где они вносят вклад в его организацию и структурную целостность.
Развитие
Миелинизация нервных волокон
Сложные изменения, которые претерпевает шванновская клетка в процессе миелинизации периферических нервных волокон, были обнаружены и изучены многими учеными. Начальное развитие аксона происходит без перерыва вдоль всей протяженности шванновской клетки. Этот процесс секвенируют клубящейся поверхности Шванновских клеток таким образом, что на сложенной поверхности клеток из противоположных граней образуется двойная мембрана. Эта мембрана растягивается и спирально закручивается снова и снова по мере продолжения сворачивания поверхности клеток. В результате легко убедиться в увеличении толщины расширения миелиновой оболочки и ее диаметра поперечного сечения. Также очевидно, что каждый из последовательных витков спирали увеличивается в размерах по длине аксона по мере увеличения числа витков. Тем не менее, не ясно, является ли увеличение длины миелиновой оболочки может являться результатом исключительно увеличения протяженности аксона, охватываемой каждым последующим витком спирали, как описано выше. На стыке двух шванновских клеток вдоль аксона, направления пластинчатых навесов миелиновых окончаний имеют другой смысл. [7] Это соединение, прилегающее к шванновским клеткам, представляет собой область, именуемую узлом Ранвье.
В чем значение перехватов ранвье нервных волокон
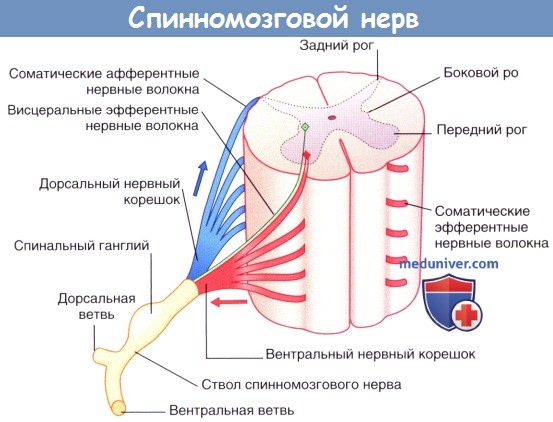
К периферическим нервам относят черепные и спинномозговые нервы, соединяющие центральную нервную систему (ЦНС) с периферическими органами и тканями. Спинномозговые нервы формируются при слиянии вентральных (передних) и дорсальных (задних) нервных корешков в месте их выхода из позвоночного канала. Задние нервные корешки образуют утолщения — спинальные ганглии (или задние корешковые ганглии). Спинномозговые нервы относительно короткие — их длина составляет менее 1 см. Проходя через межпозвоночное отверстие, спинномозговые нервы делятся на вентральную (переднюю) и дорсальную (заднюю) ветви.
Задняя ветвь обеспечивает иннервацию мышц, выпрямляющих позвоночник, а также кожи туловища в этой области. Передняя ветвь иннервирует мышцы и кожу передней части туловища; кроме того, от нее отходят чувствительные волокна к париетальной плевре и париетальной брюшине.
Передняя ветвь также дает начало ветвям шейного, плечевого и пояснично-крестцового нервных сплетений. Таким образом, значение понятия «ветвь» может изменяться в зависимости от контекста. (Подробное описание нервных сплетений представлено в главах, посвященных анатомии.)
Стрелками указано направление проведения импульса. Зеленым цветом обозначено симпатическое нервное волокно.
Периферические нейроны частично расположены в ЦНС. Двигательные (эфферентные) нервные волокна, иннервирующие скелетную мускулатуру, начинаются от мультиполярных а- и у-нейронов, расположенных в переднем роге серого вещества. Строение этих нейронов соответствует общим принципам, характерным для мотонейронов. Более подробная информация представлена в отдельной статье на сайте. Задние нервные корешки берут начало от униполярных нейронов, тела которых расположены в спинальных ганглиях, а чувствительные (афферентные) центральные отростки входят в задний рог серого вещества спинного мозга.
В состав спинномозгового нерва входят соматические эфферентные нервные волокна, направляющиеся к скелетной мускулатуре туловища и конечностей, и соматические афферентные нервные волокна, проводящие возбуждение от кожи, мышц и суставов. Кроме того, в спинномозговом нерве расположены висцеральные эфферентные и, в некоторых случаях, афферентные вегетативные нервные волокна.
Общие принципы внутреннего строения периферических нервов схематично изображены на рисунке ниже. Только лишь по строению нервных волокон невозможно определить, являются они двигательными или чувствительными.
Периферические нервы окружены эпиневрием — внешним слоем, состоящим из плотной неравномерной соединительной ткани и располагающимся вокруг пучков нервных волокон и сосудов, кровоснабжающих нерв. Нервные волокна периферических нервов могут переходить из одного пучка в другой.
Каждый пучок нервных волокон покрыт периневрием, представленным несколькими отчетливо различимыми эпителиальными слоями, связанными плотными щелевидными соединениями. Отдельные шванновские клетки окружены эндоневрием, образованным ретикулярными коллагеновыми волокнами.
Менее половины нервных волокон покрыто миелиновой оболочкой. Немиелинизированные нервные волокна расположены в глубоких складках шванновских клеток.
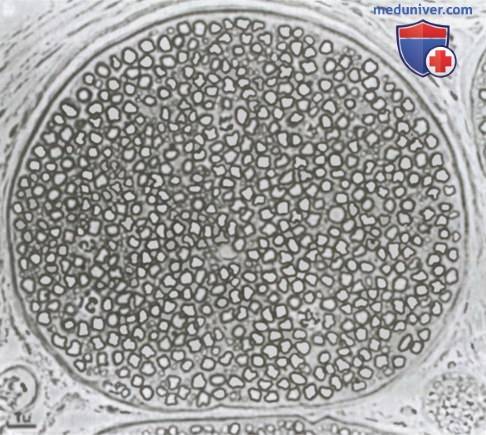
Понятие «нервное волокно», как правило, применяют при описании проведения нервного импульса; в этом контексте оно заменяет термин «аксон». Миелинизированные нервные волокна представляют собой аксоны, окруженные концентрически расположенными слоями (пластинками) миелина, образованными плазматическими мембранами шванновских клеток. Немиелинизированные нервные волокна окружены отдельными немиелинизируюгцими шванновскими клетками; плазматическая мембрана этих клеток — нейролемма — одновременно покрывает несколько немиелинизированных нервных волокон (аксонов). Структура, образованная таким аксоном и шванновской клеткой, получила название «ганглий Ремака».
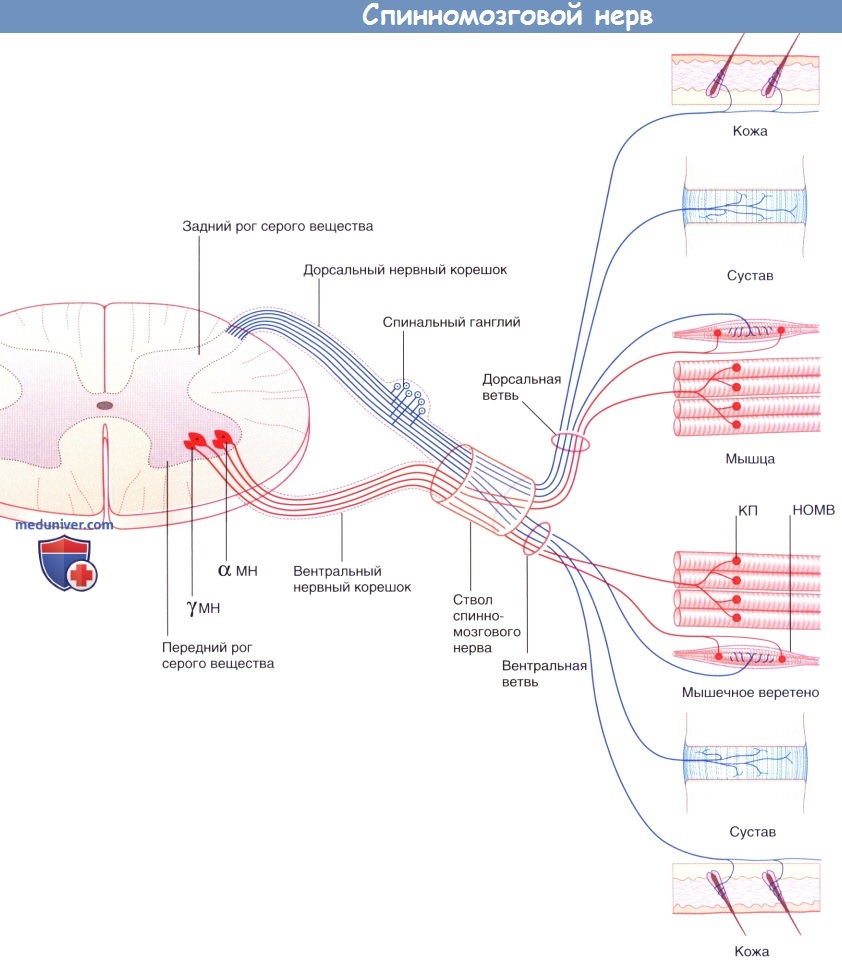
КП — концевая пластинка двигательного нерва на мышце; НОМВ — нервное окончание мышечного веретена; МН — мультиполярный нейрон.
а) Образование миелина. Шванновские клетки (леммоциты) — представители нейроглиальных клеток периферической нервной системы. Эти клетки образуют непрерывную цепочку вдоль периферических нервных волокон. Каждая шванновская клетка миелинизирует участок нервного волокна длиной от 0,3 до 1 мм. Видоизменяясь, шванновские клетки образуют в спинальных и вегетативных ганглиях сателлитные глиоциты, а в области нервно-мышечных соединений — клетки телоглии.
В процессе миелинизации аксона одновременно участвуют все окружающие его шванновские клетки. Каждая шванновская клетка оборачивается вокруг аксона, образуя «дупликатуру» плазматической мембраны,—мезаксон. Мезаксон поступательно смещается, накручиваясь на аксон. Последовательно формирующиеся слои плазматической мембраны располагаются друг напротив друга и, «вытесняя» цитоплазму, образуют главную (крупную) и межпромежуточную (мелкую) плотные линии миелиновой оболочки.
В области конечных участков миелинизированных сегментов аксона по обеим сторонам от перехватов Ранвье (промежутков между конечными участками соседних шванновских клеток) расположены паранодальные карманы.
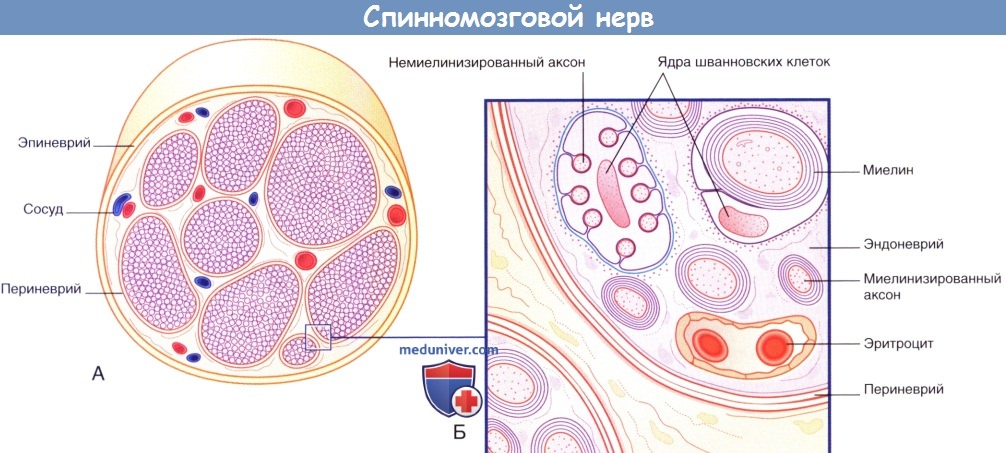
(А) Световая микроскопия. (Б) Электронная микроскопия. 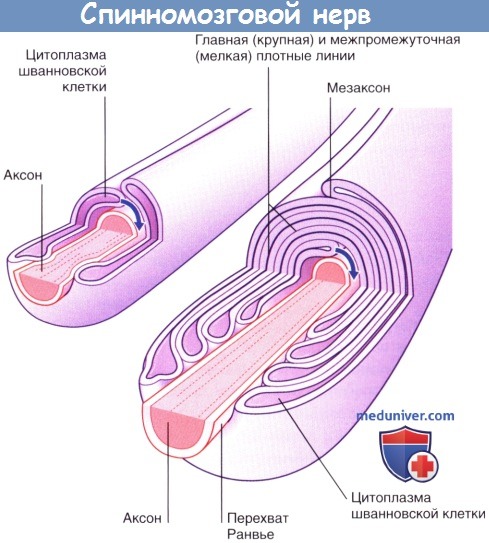
Стрелками указано направление накручивания цитоплазмы шванновской клетки.
1. Миелин ускоряет проведение импульсов. По аксонам немиелинизированных нервных волокон проведение импульса осуществляется непрерывно со скоростью около 2 м/с. Поскольку миелин выполняет функцию электроизолятора, возбудимая мембрана миелинизированных нервных волокон ограничена перехватами Ранвье. В связи с этим возбуждение распространяется от одного перехвата к другому сальтаторно — «скачкообразно», обеспечивая значительно большую скорость проведения нервного импульса, достигающую значений 120 м/с. Количество импульсов, проводимых за секунду, значительно выше у миелинизированных нервных волокон по сравнению с немиелинизированными.
Следует отметить, что чем крупнее миелинизированное нервное волокно, тем длиннее его межузловые сегменты, в связи с чем нервные импульсы, «делая большие шаги», распространяются с большей скоростью. Для описания зависимости между размером нервного волокна и скоростью проведения импульсов можно использовать «правило шести»: скорость распространения нервных импульсов по волокну, диаметр которого составляет 10 нм (включая толщину миелинового слоя), составляет 60 м/с, а по волокну диаметром 15 нм — 90 м/с и т. д.
С точки зрения физиологии периферические нервные волокна классифицируют по скорости проведения нервных импульсов, а также по другим критериям. Двигательные нервные волокна разделяют на типы А, В и С в соответствии с уменьшением скорости проведения импульсов. Чувствительные нервные волокна разделяют на группы I—IV по такому же принципу. Однако на практике эти классификации взаимозаменяемы: так, например, немиелинизированные чувствительные нервные волокна относят не к типу С, а к группе IV.
Подробная информация о диаметрах и местах локализации периферических нервных волокон представлена в таблицах ниже.
На электронно-микроскопическом изображении показаны миелинизированное периферическое нервное волокно и окружающая его шванновская клетка. На рисунках ниже представлена группа немиелинизированных нервных волокон, погруженных в цитоплазму шванновской клетки и продемонстрирован участок перехвата Ранвье аксона ЦНС.
б) Область перехода центральной нервной системы в периферическую нервную систему. В области моста мозга и спинного мозга периферические нервы входят в переходную зону между центральной и периферической нервной системой. Отростки астроцитов из ЦНС погружаются в эпиневрий корешков периферических нейронов и «переплетаются» со шванновскими клетками. Астроциты немиелинизированных волокон погружаются в пространство между аксонами и шванновскими клетками. Перехваты Ранвье миелинизированных нервных волокон в периферической части окружаются миелином шванновских клеток (демонстрируя некоторые переходные свойства), а в центральной части — миелином олигодендроцитов.
в) Резюме. Стволы спинномозговых нервов проходят в межпозвоночных отверстиях. Эти структуры образуются при соединении вентральных (двигательных) и дорсальных (чувствительных) нервных корешков и разделяются на смешанные вентральные и дорсальные ветви. Нервные сплетения конечностей представлены вентральными ветвями.
Периферические нервы покрыты эпиневральной соединительной тканью, пучковидной периневральной оболочкой и эндоневрием, образованным коллагеновыми волокнами и содержащим шванновские клетки. Миелинизированное нервное волокно включает аксон, миелиновую оболочку и цитоплазму шванновской клетки — нейролемму. Миелиновые оболочки формируются шванновскими клетками и обеспечивают сальтаторное проведение импульсов со скоростью, прямо пропорциональной диаметру нервного волокна.
Редактор: Искандер Милевски. Дата публикации: 12.11.2018
Молекулярная специфика в перехватах Ранвье
| Эволюционная необходимость быстрой и эффективной проводимости потенциалов действия в нейронах позвоночных привела к образованию миелиновой оболочки. Миелин – многослойная оболочка, сформированная в центральной нервной системе олигодендроцитами, а в периферической нервной системе Шванновскими клетками – обертывает сегменты аксона, разделенные узловыми перехватами Ранвье (РИС.1а). Миелиновая оболочка ослабляет прохождение current flow через мембрану аксона посредством снижения ее емкости (capacitance) и увеличения ее transverse resistance, давая, таким образом, возможность быстрому сальтаторному продвижению нервного импульса от перехвата к перехвату. В результате большое число аксонов с высокой скоростью проводимости может быть заключено в ограниченное пространство. И этот признак дает возможность для развития более сложной нервной системы. Кроме того, сальтаторная проводимость устраняет необходимость восстановления потенциала действия в каждой точке мембраны аксона. Следовательно, снижаются метаболические требования для активности нейронов. |
Organization and function of the nodal environs
Скоординированная дифференцировка аксона и его миелинизирующих клеток требует тесной взаимосвязи между нейронами и глией на самых ранних стадиях развития. Сигналы, передаваемые аксоном, регулируют пролиферацию, выживаемость и дифференцировку олигодендроцитов и Шванновских клеток и участвуют в детерминации толщины миелина. Реципрокные глиальные сигналы влияют на цитоскелет аксонов и аксонный транспорт и необходимы для выживаемости аксонов. В результате таких реципрокных связей миелинизированные волокна приобретают структурные признаки, позволяющие им максимизировать скорость проведения импульса. Одним из таких признаков является разделение мембраны аксона на отдельные молекулярные, структурные и функциональные домены. Такие домены включают перехваты Ранвье, paranodal junction (околоузловое соединение), juxtaparanodes (участок, расположенный за paranodal junction ) и internodal (межперехватный участок (РИС.1b и 2). Авторы сфокусировали внимание на молекулярных механизмах, лежащих в основе образования и поддержания этих уникальных доменов аксона, необходимых для нормального функционирования нервной системы.
The node of Ranvier
Узловые перехваты Ранвье представляют собой небольшие по длине, равномерно расположенные разрывы миелиновой оболочки. Интервал между перехватами Ранвье имеет длину примерно в 100 раз большую диаметра нервного волокна. Имеются некоторые различия в структурных характеристиках перехватов между центральной и периферической нервными системами. В периферических нервах весь миелинизированный участок аксона покрыт базальной оболочкой (базальным слоем) (basal lamina), а внешний слой (outer collar) шванновской клетки имеет микроворсинки, покрывающие узловые перехваты (РИС. 1b). Околоузловое пространство (т.е. пространство между аксолеммой и базальным слоем), содержащее микроворсинки, также заполнено волокнистым матриксом. В ЦНС нет basal lamina и контакт перехватов осуществляется через околоузловые астроциты (perinodal astrocyte=перинодальные астроциты), которые недавно были названы синантоцитами (synantocytes) [Butt, A. M., Kiff, J., Hubbard, P. & Berry, M. Synantocytes: new functions for novel NG2 expressing glia. J. Neurocytol. 31, 551-565. 2002].
Cytoskeletal proteins.Перехваты и начальный сегмент аксона обогащены ankyrin G – мембранно-цитоскелетным адаптером, связывающим интегральные мембранные белки с spectrin cytoskeleton. Ankyrin G взаимодействует с Na+ каналами – с их α- и β-субъединицами, а также с Nf 186, Nrcam и Kv3.1. β-субъединица «вербует» ankyrin G для плазменной мембраны и такое взаимодействие регулируется tyrosine phosphorylation. Связывание ankyrin G с α-субъединицей осуществляется через последовательность девяти аминокислот, присутствующих во всех известных voltage-gated Na+ каналах. Такой девяти-аминокислотный лейтмотив необходим для аккумуляции α-субъединицы в начальном сегменте аксона. Более того, такой ankyrin-binding сайт локализован в пределах короткой последовательности, которой достаточно, чтобы таргетировать белки для начального сегмента аксона. Остается определить, нужна ли эта короткая последовательность для таргетирования перехватов Ранвье. Связывание ankyrin G с двумя перехватными Ig-CAMs, Nf186 и Nrcam опосредуется группой из двенадцати аминокислот, найденной в их цитоплазматических доменах. Ankyrin G связывается с этими группами только тогда, когда он дефосфорилирован, указывая на то, что неидентифицируемые тирозин киназы и фосфатазы могут регулировать такое взаимодействие. Tyrosine-phosphorylated neurofascin локализован в глиальных параузлах (paranodes), а не в перехватах, свидетельствуя в пользу гипотезы, согласно которой перехватный neurofascin тесно связан с ankyrin G. Ankyrin G также связывает spectrin βIV – spectrin изоформу, присутствующую в изобилии в перехватах Ранвье и начальных сегментах аксонов – связывая в дальнейшем узловые Na + каналы и Ig-CAMs с цитоскелетом аксона.
The nodal gap, extracellular matrix and the glial membrane В ПНС узловой пробел (перехват) заполнен микроворсинками Шванновских клеток, происходящими из наружной оболочки клетки (РИС.1b). В проксимальной области микроворсинок мембраны двух соседних Шванновских клеток соединены tight junctions (плотным соединением), но эти соединения не изолируют узелковый пробел. Было обнаружено, что они проницаемы для пероксидазы хрена, прикладываемой снаружи нервного волокна. Три белка – erzin, radixin и moesin, так же как и erzin-связывающий белок EBP50 и Rho-AGTPasa локализованы в микроворсинках. Потенциально эти белки могут связывать актин-обогащенные микроворсинки с интегральными мембранными белками (integral membrane proteins). Кроме того, несколько белков внеклеточного матрикса (extracellular matrix (ECM) proteins) найдено в узловых пробелах под базальной оболочкой, включая hyaluronan-binding proteoglycan versican, tenascin-C и NG2 proteoglycan. Недавно было показано, что dystroglycan в избытке экспрессирующийся на abaxonal поверхности миелинизирующих Шванновских клеток также локализуется в перехватах. Специфическое удаление dystroglycan в Шванновских клетках приводит к дезорганизации микроворсинок, заметной редукции узловых Na+ каналов и к последующему нарушению проводимости нервного волокна.
В отличие от ПНС, в ЦНС отростки перинодальных астроцитов (perinodal astrocytes) (РИС.1b) контактируют с большинством узловых перехватов. Было показано, что узловой пробел в ЦНС включает несколько протеогликанов, в том числе tenascin и phosphacan. Узловые пробелы ЦНС также содержат versican-binding protein Bral1, продуцируемый нейронами. Функции этих белков пока неясны, однако предполагают, что благодаря высокому содержанию в них acidic disaccharides, они могут обеспечивать негативную среду, служащую в качестве внеклеточного резервуара Na+ в перинодальном пространстве. И tenascin-C, и tenascin-R связываются с Na+ каналами и изменяют их электрофизиологические свойства. Генетическое удаление tenascin-R ведет к снижению нервной проводимости, но не оказывает никакого эффекта на распределение Na+ каналов в узловых перехватах, указывая на то, что такое взаимодействие может стабилизировать узловые комплексы или регулировать активность каналов, но не требуется для первичной кластеризации этих каналов. Сообщалось также, что Na+ каналы связывают цитоплазматический конец (tail) и внеклеточный домен Rptpβ – рецепторную тирозин фосфатазу, о локализации которой в узловой аксолемме (nodal axolemma) пока не сообщалось. Более того, значимость этих взаимодействий для нормальной физиологии миелинизированных нервов пока неясна, т.к. распределение узловых Na+ каналов и скорость проводимости миелинизированных аксонов в ЦНС нормальны у Rptpβ-дефицитных мышей. Стоит отметить, что и tenascin-R, и Rptpβ также взаимодействуют с contactin и Nrcam, присутствующими в узловых перехватах ЦНС, указывая на возможное присутствие крупных макромолекулярных комплексов в перинодальном пространстве.
The axoglial paranodal junction
Morphology and molecular composition. C обеих сторон перехватов Ранвье компактная миелиновая оболочка раскрывается и формирует заполненные цитоплазмой глиальные петли (glial loops), которые спирально наматываются вокруг аксона (РИС.1b). Такие паранодальные петли соединены с аксолеммой серией перемычек (поперечных полосок – transverse bands), которые напоминают septate junctions (перегородчатые соединения) у беспозвоночных (BOX1). Аксоглиальные соединения появляются относительно поздно во время миелинизации – сначала они образуются ближе к перехватам наиболее отдаленной паранодальной петлей и постепенно распространяются по мере того, как дополнительные петли прикрепляются к аксону. В итоге, они состоят из множества колец, каждое из которых представляет собой виток миелиновой оболочки.
Мембрана аксона в месте аксоглиального соединения содержит комплекс из двух cell-recognition молекул — contactin-associated protein (Caspr, также известные как paranodin) и contactin (РИС.2b). Caspr является трансмембранным белком типа I, принадлежащим к отдельной подгруппе neurexins – полиморфного белкового семейства, участвующего в клеточной адгезии и межклеточных связях. У человека известно 5 генов семейства Caspr – CASPR1–CASPR5 (Spiegel, I., Salomon, D., Erne,et. al. Caspr3 and caspr4, two novel members of the caspr family are expressed in the nervous system and interact with PDZ domains. Mol. Cell. Neurosci. 20, 283-297. 2002). У дрозофилы известно 2 гена – nrxIV и axo и у Caenorhabditis elegans также 2 гена – itx-1 и nlr-1 [L. Haklai-Topper and E.P., unpublished observations]. Эти белки связывают некоторые CAMs и, следовательно, могут рассматриваться как CAM-ассоциированные белки. Их внеклеточная область состоит из нескольких доменов, участвующих в межбелковых взаимодействиях, включая discoidin и fibrinogen-like domain, epidermal growth factor (EGF) motifs, и несколько областей гомологичных G домену laminin A (BOX 1). Caspr, но не другие члены семейства Caspr, формирует комплекс с contactin только в cis. Взаимодействие между Caspr и contactin необходимо для эффективного экспорта Caspr из эндоплазматического ретикулума к плазменной мембране, оно регулирует glycosylation и транспорт contactin. Caspr и contactin связаны в эндоплазматическом ретикулуме и могут быть транспортированы через Гольджи-независимый путь (Golgi-independent pathway) к клеточной поверхности. Так же как и при исследовании in vitro, у contactin-дефицитных мышей Caspr сохраняется в теле нейрона и не достигает аксона (Boyle, M. E. et al.2001), но Caspr необходим для поддержания contactin в paranodes (Gollan, L. et al. Retention of a cell adhesion complex at the paranodal junction requires the cytoplasmic region of Caspr. J. Cell Biol. 157, 1247-1256 (2002). Shows that the stabilization of the Caspr/contactin complex at the cell membrane requires the intracellular region, which includes the protein 4.1B-binding domain).
И Caspr, и contactin важны для образования axoglial junction (аксоно-глиального соединения) и их отсутствие ведет к исчезновению септ (перемычек) и расширению пространства между аксоном и паранодальными петлями. Результаты указывают, что Caspr и contactin могут быть частью paranodal adhesion complex, который необходим для плотного соединения двух оболочек. Фенотип contactin-дефицитных мышей сходен с фенотипами двух других паранодальных мутантов – galactolipids-дефицитными мышами, у которых отсутствует UDP-galactose ceramide galactosyltransferase (Cgt) и не синтезируются galactocerebroside (GalC) и sulfatide и cerebroside sulfotransferase ( Cst)-null мышами, у которых отсутствует синтез только sulfatide. У всех этих мутантов Caspr и contactin отсутствуют в paranodes. Путь, при котором отсутствие GalC и sulfatide вызывает паранодальные аномалии, неясен, но можно предположить, что это результат прямого связывания sulfatide с Caspr/contactin комплексом. И, напротив, говоря о роли galactolipids в формировании LIPLD RAFTS (липидных плотиков) и организации миелина, можно предположить, что их отсутствие может привести к превращению junctional glial компонентов в не-компактный миелин. Последнее предположение подтверждается недавними находками, показавшими, что генетическое удаление миелинового и лимфоцитарного (myelin and lymphocyte – MAL) белка, – raft-ассоциированной молекулы, участвующей во внутриклеточном трафике, – ведет к паранодальным аномалиям (N. Schaeren-Wiemers and U. Suter, personal communication).
Внутриклеточные области Caspr и Caspr2 содержат juxtamembrane последовательность, которая связывает protein 4.1B, присутствующий в paranodes и juxtaparanodes. Как и другие 4.1 белки, 4.1В белок содержит консервативный actin–spectrin-binding домен и, следовательно, может связывать Caspr (и следовательно contactin) с цитоскелетом. В соответствии с этой гипотезой, protein 4.1B аномально распределяется вдоль периферических миелинизорованных аксонов у мышей с отсутствием либо contactin, либо galactolipids, у которых отсутствуют паранодальные Caspr. У этих мутантов местоположение белка 4.1В коррелирует с положением Caspr и Caspr2, указывая на то, что они могут определять его локализацию. Более того, цитоплазматический конец Caspr нужен для стабилизации Caspr/contactin комплекса в paranodes, т.к. у Caspr мутантов с отсутствием этого домена не сохраняется axoglial junction. Поэтому, вероятно, что Caspr является трансмембранным скаффолдом, который стабилизирует Caspr/contactin adhesion complex в septate-подобных соединениях связывая комплекс с аксонным цитоскелетом через белок 4.1В. Этот механизм напоминает функцию neurexin IV Drosophila, который захватывает Coracle (гомолог белка 4.1) для septate junctions (BOX 1). Кроме того, цитоплазматический Caspr также связывает FERM domain (four-point-one, ezrin–radixin–moesin)-содержащий белок Schwanomin/merlin. Однако значение такого взаимодействия не совсем ясно, поскольку Schwanomin не концентрируется в области паранодального соединения.
Распределение Caspr и contactin вдоль internodes (межперехватов) (см. далее в тексте), их накопление в paranodes (как число колец, представляющих витки миелиновой обертки во время развития), аномальное распределение Caspr при рассеянном склерозе и у некоторых «миелиновых» мутантов указывают на то, что миелиновая оболочка определяет локализацию Caspr и contactin в аксолемме. Более того, добавление растворимого Rptpβ, связывающего contactin с myelinating co-cultures, нарушает паранодальное накопление Caspr, указывая на то, что локализация Caspr/contactin complex в этом участке может быть опосредована его взаимодействием с глиальным лигандом. Наиболее подходящим кандидатом глиального лиганда для Caspr/contactin complex является Nf155 – глиальная изоформа CAM neurofascin, который локализован вместе с Caspr и contactin в месте аксоглиального соединения (axoglial junction) и не локализуется в этом участке в отсутствии Caspr. В подтверждение этой гипотезы недавно появилось сообщение, что soluble Nf155-Fc chimaera связывается с клетками, экспрессирующими Caspr и contactin, а преципитация этих белков из лизатов мозга крыс указывает на то, что Nf155 может служить в качестве рецептора для Caspr/contactin complex. Однако последние сообщения подвергли сомнению данную модель, так как было показано, что когда Nf155 связывается непосредственно с contactin, то Caspr подавляет такое взаимодействие. Это указывает на возможное существование других рецепторов для Caspr/contactin complex в миелинизирующей глии. Это наблюдение согласуется с предыдущими сообщениями, показавшими, что Nf155 в paranodes появляется намного позже, чем Caspr.
Function of the paranodal junction. Предполагают, что paranodal junction присоединяет миелиновую оболочку к аксону, чтобы отделить электрическую активность в перехватах Ранвье от межперехватного участка (internodal region), находящегося под компактной миелиновой оболочкой, и служит в качестве преграды (fence), которая ограничивает латеральную диффузию белков аксолеммы. Недавние исследования с использованием 4-х паранодальных мутантных мышей – мышей с отсутствием Caspr, contactin, Cgt и Cst, (все с отсутствием характерной перегородки (septa) в аксоглиальном соединении) – позволили прекратить проверку этих оригинальных идей. В ЦНС этих мутантов паранодальные петли (paranodal loops) дезорганизованы, имеется множество перекрывающихся и инвертированных петель, обращенных в сторону от аксона. В ПНС этих мутантов морфологические изменения менее выражены, возможно, благодаря присутствию базального слоя (basal lamina). Параузлы (paranodes) хорошо организованы, однако увеличено пространство между глиальной оболочкой и аксоном. Но даже в отсутствие перегородки (septa) паранональные петли (loops) все еще тесно прикреплены к аксону во многих участках ЦНС и ПНС, указывая на присутствие до сих пор не идентифицированных паранодальных компонентов, которые опосредуют аксо-глиальный контакт в этом участке. Вместе с электронно-микроскопическими данными, показавшими, что поперечные соединения (transverse bands) образуются позже во время миелинизации, эти исследования указывают на возможную роль перегородки (septa) в сохранении паранодальных петель (колец) для аксона в аксоглиальном соединении. В соответствии с этими наблюдениями, постепенное, зависимое от возраста открепление паранодальных колец от аксона наблюдали в ЦНС Caspr-null мышей (Rios, J. C. et al. Paranodal interactions regulate expression of sodium channel subtypes and provide a diffusion barrier for the node of Ranvier. J. Neurosci. 23, 7001-7011. 2003).
Отсутствие паранодальной перегородки (paranodal septa) у четырех паранодальных мутантов ведет к реорганизации мембраны аксона (РИС.3). У этих мутантов shaker-type К+ каналы, в норме присутствующие в juxtaparanodal области неправильно локализованы по отношению к паранодальной мембране аксона. Поэтому, возможно, что паранодальное перегородчатое соединение (paranodal septate junction) функционирует как барьер, который ограничивает передвижение К+ каналов из-под компактного миелина, отделяя их от Na+ каналов в узловых перехватах. В противоположность juxtaparanodal К+ каналам, нарушение паранодальной перегородки минимально влияет на распределение узловых Na+ каналов. Существует небольшое увеличение длины перехватов, сопровождаемое уменьшением мембранных частиц (particles) в узловой аксолемме, определяемое при FREEZE –FRACTURE электронной микроскопии. Это указывает на то, что paranodal septate junction не является необходимым для появления перехватов. Однако глиальное прикрепление в области paranodes в ЦНС необходимо для сохранения Na+ кластеризации в аксолемме.перехвата Ранвье
Juxtaparanode локализуется в короткой области сразу за paranodal junction (РИС.1b). При freeze-fracture электронной микроскопии эта область представляет собой нерегулярно расположенные частицы, которые в большей степени сконцентрированы вблизи paranodes и более диффузны по мере приближения к межперехватам (internodes). Эти частицы соответствуют скорее всего гетеромультимерам delayed rectifier K+ каналов семейства Shaker – Kv1.1, Kv1.2 и Kvβ2. В juxtaparanodal аксолемме эти каналы колокализуются и образуют комплекс с Caspr2, вторым членом Caspr семейства. Кроме того, в этом участке присутствует Kv1.6, преимущественно в небольших аксонах. Два других белка, обнаруженных в juxtaparanodes, представляют собой транзиторный аксональный glycoprotein-1 (Tag1) – GPI-связанный CAM, родственный contactin, и connexin 29 (Cx29), обнаруженый в глиальной мембране. Связь Caspr2 с К+ каналами опосредуется их карбокси-терминальной областью, вероятнее всего через неидентифицируемый PDZ DOMAIN-содержащий белок. И хотя один такой белок Psd95 локализован в juxtaparanodes и ассоциируется с К+ каналами, он, как оказалось, не участвует во взаимодействии этих каналов с Caspr2 или их накоплении в этой области. Два последних исследования показали, что Caspr2 и Tag1 формируют juxtaparanodal complex, состоящий из глиальной Tag1 молекулы и аксонального Caspr2/Tag1 гетеродимера (РИС.2с) [Poliak, S. et al. Juxtaparanodal clustering of Shaker-like K+ channels in myelinated axons depends on Caspr2 and TAG-1. J. Cell Biol. 162, 1149-1160 (2003)]. Этот комплекс необходим для аккумуляции К+ каналов в juxtaparanodes, поскольку прицельное нарушение Caspr2 или Tag1 приводит к значительному снижению juxtaparanodal аккумуляции этих каналов в аксонах как ЦНС, так и ПНС (РИС.3). Эти результаты указывают, что Caspr2 и Tag1 могут формировать скаффолды, способные позиционировать ионные каналы в специфических участках плазменной мембраны, и это напоминает механизм, работающий во время формирования синапсов.
Role of K+ channels under the myelin sheath. Предполагали, что juxtaparanodal К+ каналы работают как активные «заслонки» (damper) для возвратного возбуждения (re-entrant excitation) и способствуют сохранению межперехватного потенциала покоя (internodal resting potential). И хотя теоретически этих каналов, разбросанных в межперехватах, достаточно для поддержания потенциала покоя, для предупреждения re-entrant excitation требуется повышенная пространственная кластеризация К+ каналов около перехвата. Несмотря на значительное устранение в juxtaparanodal кластере Kv1.1/Kv1.2 у Caspr2- и Tag1-нокаутных мышей, никаких изменений в возбудимости миелинизированных нервов у них не выявлено. То, что общее количество этих каналов остается постоянным у обоих мутантов может указывать на то, что главная роль этих покрытых миелином К+ каналов заключается в поддержании межперехватного потенциала покоя. Кроме того, компьютерное моделирование, при котором учитывались вариации распределения К+ каналов и проводимости аксоглиального соединения (axoglial junctional conductance) показало, что кластеризация К+ каналов в juxtaparanode может обеспечивать защитную функцию в аксонах, которые могут подвергаться слабой демиелинизации (РИС.4). В соответствии с этой моделью Caspr2 иTag1 могут обеспечивать стабильность в аксонах, аксоглиальные соединения которых подвержены определенному риску.
Другой функцией juxtaparanodal К+ каналов может быть их посредническая роль в аксоглиальном процессе передачи информации. В ПНС эти каналы локализованы across from Cx29 гемиканалов (hemichannels), которые присутствуют в adaxonal мембране миелинизирующих Шванновских клеток и наиболее вероятно соответствуют розеточным частицам, видимым при freeze-fracture электронной микроскопии в этом участке. Такие гемиканалы могут обеспечивать прямой путь для ионов К+ из аксона в глию. Это, в свою очередь, могло бы генерировать зависимый от активности сигнал в Шванновскую клетку, что напоминает электрические синапсы сформированные gap junctions. В поддержку этой гипотезы предположили, что Ca2+ transients, записываемые в Шванновских клетках до электрической стимуляции аксона, генерировались К+ efflux (утечкой) из аксона, что деполяризует глиальную мембрану. Обмен информацией через такой «аксоглиальный синапс» в juxtaparanodes может обеспечивать дополнительный механизм для axon–gliacommunication. Интересно то, что паранодальное аксоглиальное соединение (paranodal axoglial junction) также может быть ремоделировано активностью нейронов. Этот эффект может быть отчасти опосредован контролем экспрессии contactin на поверхности аксона.
Хотя никакой специфики соединений не наблюдали между глией и аксоном в области межперехватов, при freeze-fracture электронной микроскопии было обнаружено, что межперехватная аксолемма в ПНС содержит продольные нити (longitudinal strands) внутримембранных частиц, напоминающих нити, найденные в paranodes и в juxtaparanodal областях. Как показано на РИС. 1с и 1d, Caspr и contactin локализуются по всей межперехватной области в полосе, фланкированной К+ каналами и Caspr2, которая соединяет внутренний мезаксон (inner mesaxon) миелиновой оболочки и формирует периферическое кольцо ниже внутренней стороны SCHMIDT-LANTERMAN INCISURES. Эта линия, названная juxtamesaxonal и juxta-incisural (Scherer, S. S. & Arroyo, E. J. Recent progress on the molecular organization of myelinated axons. J. Peripher. Nerv. Syst. 7, 1-12. 2002), является прямым продолжением paranodes/juxtaparanodes. Следовательно, Nf155, Cx29 и Tag1 ограничены в дополнительном распространении на adaxonal мембране миелинизирующих Шванновских клеток. Эти находки указывают, что локализация аксонных белков в межперехватах диктуется миелиновой оболочкой, вероятно, посредством механизма, сходного с тем, который работает в paranode/juxtaparanode. Однако недавний анализ Caspr2-null мышей показал, что разные механизмы могут контролировать локализацию К+ каналов в juxtaparanodes и в juxtamesaxon. Молекулярная организация межперехватной области не изучена в миелинизированных нервах ЦНС.
Formation of the nodal environ
The role of myelinating glia. Во время развития миелинизации нервов в ПНС разные узловые домены формируются постепенно. Na+ каналы сначала кластеризуются в перехватах, затем появляется паранодальное соединение и позже происходит группировка К+ каналов в области juxtaparanode. И в ЦНС, и в ПНС Na+ каналы кластеризуются сначала в участках, прилегающих к границам отростков олигодендроцитов и миелинизирующих Шванновских клеток. Дальнейший продольный рост этих отростков вызывает смещение кластеров до тех пор, пока два соседних кластера не сольются, формируя новый перехват Ранвье. Эти результаты свидетельствуют о том, что Na+ кластеры позиционируются посредством прямого глиального контакта. Следовательно, распространение Na+ каналов является диффузным в ретинальных ганглиозных клетках (retinal ganglion cells), но они правильно кластеризуются в перехватах, после того как аксоны пересекут lamina cribrosa и станут миелинизированными. Эти каналы не группируются после удаления олигодендроцитов или Шванновских клеток и рассеиваются во время демиелинизации. Более того, перехватные Na+ каналы связаны с краями миелинизирующих Шванновских клеток в нервах с более короткими межперехватами, что является результатом ремиелинизации (remyelination) или генетической мутации, как, например, у мутантных мышей CLAW PAW. Однако исследование с использованием ганглиозных клеток ретины показало, что Na+ кластеризация может быть индуцирована in vitro растворимыми факторами, секретируемыми культивируемыми олигодендроцитами. И хотя Шванновские клетки не проявляют такой кластеризирующей активности, некоторая кластеризация Na+ каналов определялась в отсутствии миелинизирующих Шванновских клеток у дистрофичных мышей. Недавний анализ dysmyelinating или paranodal мутантов, а также моделей демиелинизации показал, что присутствие интактных миелинизирующих олигодендроцитов необходимо для включения во время развития изоформы Na+ канала в перехватах. И, напротив, Nav1.6 обнаружена в перехватах у двух миелиновых мутаций, которые ассоциируются с гибелью олигодендроцитов и отсутствием нормального паранодального соединения. – у MYELIN DEFICIENT (MD) крыс и у JIMPY мутантных мышей. Эти наблюдения указывают, что «включение» может происходить в отсутствие нормального паранодального контакта или миелина. Следует отметить, что недавний анализ SHIVERER мутантов показал, что в то время как аксоглиальный контакт необходим для экспрессии Nav1.6 в перехватах, он не нужен для таргетирования этой подгруппы в начальном сегменте аксона, что свидетельствует о существовании множественных адресных механизмов при миелинизации аксонов.
Molecular assembly. Во время миелинизации нервов в ПНС, Nrcam и Nf186 первыми определяются в перехватах, после чего появляются ankyrin G и Na+ каналы. Однако в ЦНС ankyrin G определяется в перехватах до кластеризации Nf186 и Na+ каналов. Эти результаты указывают, что Nrcam, Nf186 или неидентифицируемый ankyrin G-binding белок связывают ankyrin G, который, в свою очередь, «рекрутирует» Na+ каналы. В поддержку этой модели свидетельствует тот факт, что добавление растворимого Nrcam в культуру myelinating dorsal root ganglia подавляет кластеризацию Na+ каналов. Более того, появление ankyrin G и Na+ каналов в перехватах отсрочено у Nrcam-null мышей, что свидетельствует об участии этой адгезивной молекулы в кластеризации. Формирование перехватов у этих животных можно объяснить присутствием Nf186, который содержит сходный ankyrin G-binding сайт и, следовательно, может компенсировать отсутствие Nrcam. Значимость взаимодействия между ankyrin G и такими компонентами перехвата была показана у мышей с отсутствием мозжечковой изоформы ankyrin G, у которых Na+ каналы, Ig-CAMs и spectrin βIV не группируются в начальном сегменте аксонов клеток Пуркинье. Похожую картину наблюдали у спонтанной мутации по spectrin βIV – QUIVERING мышей (или у мышей с прицельным нарушением этого гена), у которых найдены аномалии перехватов и измененное распределение каналов. Однако ankyrin G также присутствует в параузлах (paranodes) во время ранней миелинизации аксонов, что говорит не о его прямом участии в первичном таргетировании Na+ каналов, а скорее о его важности для их стабилизации. Кроме того, ankyrin G в норме локализован в перехватах у dystroglycan-null мышей, у которых показана значительная редукция кластеров перехватных Na+ каналов. После первичной кластеризации компонентов перехватов в волокнах ПНС, Nf155 и Caspr/Contactin комплекс аккумулируются в paranodal junction. После этого появляются Caspr2 и К+ каналы в juxtaparanodal области. Caspr2, К+ каналы и TAG-1 первыми определяются в параузлах (paranodes) и позже они перемещаются в juxtaparanodes как формы паранодального соединения (paranodal junction forms). В отсутствии такого соединения К+ каналы не перемещаются в juxtaparanodes и остаются рядом с перехватами (РИС.4; ТАБЛ.1 и 2). Дальнейшее поддержание К+ каналов в juxtaparanodal области требует Caspr2 и Tag1, поскольку в их отсутствии эти каналы перераспределяются по межперехватам.
Molecular sieves, pickets and fences. Сегрегация белков на отдельные домены в нейронах достигается через специфические сортировочные механизмы, за которыми следует закрепление и кластеризация этих белков в плазменной мембране. Формирование окружения перехвата Ранвье может включать несколько различных молекулярных механизмов (РИС.5). Удаление Na+ каналов с границ миелинизирующей глии во время развития может быть осуществлено с помощью селективной молекулярной фильтрации или «сита», обнаруженной в paranodes (РИС.5с). Предполагали, что такое «сито» не пропускает крупные белковые комплексы, включая Na+ каналы и Ig-CAMs, соединенные с ankyrin G, и пропускает мелкие мембранные частицы – соответствующие К+ каналам. Такой процесс требует аксоглиального контакта, но он не опосредуется Caspr/contactin комплексом, т.к. его отсутствие не препятствует кластеризации Na+ каналов в перехватах. Поэтому, появление зрелых, септ-содержащих (septa-containing) паранодальных соединений может быть необязательным для эффективной кластеризации Na+ каналов. Это мнение подтверждается данными freeze-fracture электронной микроскопии, при которой была показана ранняя дифференцировка перехватов еще до появления paranodal septa (паранодальной перегородки). Следовательно, накопление Caspr в параузлах и кластеризация Na+ каналов в перехватах происходит перед появлением septa (перегородки). Следует заметить, что постепенное открепление паранодальных петель (paranodal loops) в ЦНС у паранодальных мутантов сопровождается расширением пробела перехвата и рассеиванием Na+ каналов. Это указывает на то, что хотя septa и не является необходимым компонентом для первичной сборки Na+ каналов в перехватах, стабилизированные глиальные контакты (зависимые от septa) в paranodes могут быть необходимым компонентом для поддержания этих кластеров. Интересно, что кластеризация Na+ каналов в зрительном нерве Caspr-null мышей, у которых отсутствует paranodal septa, ассоциируется с кластерами соседних К+ каналов и это увеличивает вероятность того, что Caspr2 и Tag1 компенсируют в этих участках отсутствие Caspr и contactin.
В отличие от кластеризации Na+ каналов в перехватах, формирование septa- содержащих аксоглиальных соединений важно для изоляции К+ каналов в juxtaparanodes. Эти наблюдения указывают, что, будучи однажды сформированными, аксоглиальные septate соединения функционируют как барьер, ограничивающий движение этих каналов и других молекул из-под миелиновой оболочки к перехватам. Предполагается также, что молекулярное «сито», функционирующее в paranodes во время формирования перехватов, могло бы изменить эти свойства после того как paranodal loops уже обеспечат безопасность аксона посредством septate junction. Появление такого барьера может быть опосредовано прикреплением Caspr/contactin комплекса к цитоскелету аксона, связывающегося с глиальным лигандом, и сборкой специфических липидных микродоменов. И хотя вклад липидного состава мембраны в появление доменов аксона пока не изучен, интересно то, что contactin, Caspr и Tag1 ассоциируются с липидными плотиками (rafts).
Кроме paranodal junction возможно также существование мембранного барьера в перехватах. И хотя Caspr2/K+ канальный комплекс и Tag1 неправильно локализованы в паранодальной области в отсутствие paranodal junction, эти белки не проникают в перехваты, указывая на присутствие дополнительного барьера в этом участке. Такой барьер в области перехвата может быть сходен с диффузным барьером (или мембранным барьером), обнаруженным в начальном сегменте аксона, который можно рассматривать как первый перехват в большинстве миелинизированных аксонов. В начальном сегменте аксона этот барьер сформирован высоко концентрированными локальными трансмембранными белками, которые прикреплены к актиновому цитоскелету и которые служат в качестве «пикетов», способных блокировать диффузию мембранных белков и фосфолипидов. Интересно то, что интактный актиновый цитоскелет в аксонах ганглиев сетчатки также необходим для кластеризации Na+ каналов при воздействии растворимого фактора, секретируемого олигодендроцитами.
Рассматриваются два других молекулярных механизма, участвующих в формировании перехватов. В ПНС кластеризация перехватных Na+ каналов во время развития может быть опосредована контактирующими глиальными отростками, которые «тянут» Na+ каналы и Ig-CAMs по направлению к их окончательной позиции на аксолемме (РИС.5b). Это может быть осуществлено с помощью связывания Na+ каналов с микроворсинками Шванновских клеток, либо непосредственно через их β-субъединицы, либо косвенно через Nrcam и Nf186. Во время развития ERM-позитивные ворсинки Шванновских клеток осуществляют ранний контакт с перехватами во время их образования. Эти участки контактов (названные «caps») содержат phosphorylated adaptor EBP50 и face across axonal ankyrin G. Разрушение микроворсинок у мышей без dystroglycan в Шванновских клетках ведет к значительному снижению кластеризации Na+ каналов в узловых перехватах. Остается выяснить, связывает ли dystroglycan какие либо узелковые белки, опосредуя, таким образом, такое аксоглиальное взаимодействие.
Микроворсинки содержат также другие кандидатные белки, включая L1 и neurofascin, способные связывать Ig-CAMs, присутствующие в аксолемме. Наконец, возможно, что кластеризация Na+ каналов в перехватах Ранвье осуществляется с помощью downregulation этих каналов из нижних (from beneath) межперехватов и посредством селективной инсерции вновь синтезированных или рециклированных молекул в формирующийся узловой пробел (РИС.5d). Маловероятно, но во время развития может работать механизм «доставки». На это указывают такие наблюдения как перемещение изоформ Na+ каналов после формирования перехватов, присутствие высокой концентрации везикул в перехватах и тесная связь Na+ каналов с микротрубочками. Сходный механизм также может работать при формировании juxtaparanodes в ЦНС, где К+ каналы первыми определяются во время развития.

