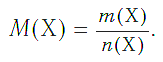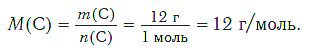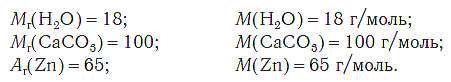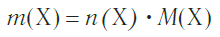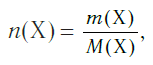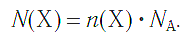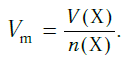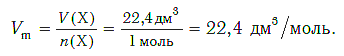в чем выражается молярный объем
Урок 9. Молярная масса и молярный объем
В уроке 9 «Молярная масса и молярный объем» из курса «Химия для чайников» выясним, что подразумевается под молярной массой и молярным объемом; приведем формулы для их вычисления. Напоминаю, что в прошлом уроке «Химическое количество вещества и моль» мы выяснили, что такое химическое количество вещества; рассмотрели моль в качестве единицы количества вещества, а также познакомились с постоянной Авогадро.
Молярная масса
Вы знаете, что одинаковое химическое количество любых веществ содержит одно и то же число структурных единиц. Но у каждого вещества его структурная единица имеет собственную массу. Поэтому и массы одинаковых химических количеств различных веществ тоже будут различны.
Молярная масса — это масса порции вещества химическим количеством 1 моль.
В Международной системе единиц молярная масса выражается в кг/моль. В химии чаще используется дольная единица — г/моль.
Определим молярную массу углерода. Масса углерода химическим количеством 1 моль равна 0,012 кг, или 12 г. Отсюда:
Молярная масса любого вещества, если она выражена в г/моль, численно равна его относительной молекулярной (формульной) массе.
На рисунке 47 показаны образцы веществ (H2O, CaCO3, Zn), химическое количество которых одно и то же — 1 моль. Как видите, массы разных веществ химическим количеством 1 моль различны.
Молярная масса является важной характеристикой каждого отдельного вещества. Она отражает зависимость между массой и химическим количеством вещества. Зная одну из этих величин, можно определить вторую — массу по химическому количеству:
и, наоборот, химическое количество по массе:
а также число структурных единиц:
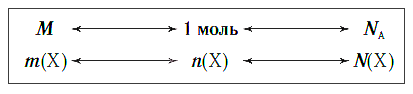
Взаимосвязь между этими тремя характеристиками вещества в любом его агрегатном состоянии можно выразить простой схемой:
Молярный объем
Подобно молярной массе, молярный объем газа равен отношению объема данного газообразного вещества V(Х) к его химическому количеству n(Х) :
Так как объем газа зависит от температуры и давления, то при проведении различных расчетов берутся обычно объемы газов при нормальных условиях (сокращенно — н. у.). За нормальные условия принимаются температура 0 °С и давление 101,325 кПа.
Установлено, что при нормальных условиях отношение объема любой порции газа к химическому количеству газа есть величина постоянная и равная 22,4 дм 3 /моль. Другими словами, молярный объем любого газа при нормальных условиях:
Пример 1. Вычислите химическое количество SiO2, масса которого равна 240 г.
Пример 2. Определите массу серной кислоты H2SO4, химическое количество которой 2,5 моль.
Пример 3. Сколько молекул CO2 и сколько атомов кислорода содержится в углекислом газе массой 110 г?
Пример 4. Какой объем занимает кислород химическим количеством 5 моль при нормальных условиях?
Краткие выводы урока:
Надеюсь урок 9 «Молярная масса и молярный объем» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Данный урок был заключительным в главе «Основные химические понятия».
Урок №40. Закон Авогадро. Молярный объем газов
итальянский учёный-химик, первооткрыватель фундаментального физико-химического закона, названного его именем.
Закон Авогадро : в равных объёмах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул. (1811 г, итальянский учёный Амедео Авогадро)
Cледствия из закона Авогадро :
1 следствие:
Одинаковое число молекул различных газов при одинаковых условиях занимает одинаковый объём.
Так, 6,02 ∙ 10 23 молекул (1 моль) любого газа и любой смеси газов при (н.у.) занимает объём равный 22,4 л.
Такой объём называется молярным объёмом и обозначается V m
Молярный объём V m – это постоянная величина для веществ – газов при нормальных условиях (н.у.) V m = 22,4 л/моль
Нормальными условиями (н.у.) для газов считаются:
P 0 = 1 атм. = 101325 Па = 760 мм. рт. ст.
Взаимосвязь молярной массы, молярного объёма, числа Авогадро и количества вещества:
ν = V/V m = N/N a = m/M
M = ρ‧V m
Молярный объём
Молярный объём.
Молярный объём Vm – отношение объёма вещества к его количеству при определенной температуре и давлении.
Молярный объём:
Молярный объём – отношение объёма вещества к его количеству при определенной температуре и давлении.
Молярный объём имеет обозначение Vm.
Молярный объём численно равен объёму одного моля вещества.
Молярный объём в Международной системе единиц (СИ) измеряется в кубических метрах на моль, русское обозначение: м 3 /моль; международное: m 3 /mol.
Термин «молярный объём» может быть применён к простым веществам, химическим соединениям и смесям.
Молярный объём зависит от температуры, давления и агрегатного состояния вещества.
Молярный объём вещества вычисляется по формуле:
n – количество вещества,
ρ – плотность вещества.
Молярный объём идеального газа:
Молярный объём идеального газа вычисляется по формуле:
R – универсальная газовая постоянная,
Данное уравнение выводится из уравнения состояния идеального газа (называемого также уравнение Менделеева – Клапейрона).
Согласно закону Авогадро одинаковые количества газов при одинаковых условиях занимают одинаковый объём.
Молярный объем при данной температуре и давлении одинаков для всех идеальных газов и составляет:
– при температуре 0 °C и давлении 1 атмосфера (101 325 Па) – 0,022413969545014… м 3 /моль,
– при температуре 25 °C и давлении 1 атмосфера (101 325 Па) – 0,024465403697038… м 3 /моль,
– при температуре 0 °C и давлении 100 кПа – 0,022710954641485… м 3 /моль,
– при температуре 25 °C и давлении 100 кПа – 0,024789570296023… м 3 /моль.
Молярные объёмы реальных газов в той или иной степени отличаются от молярного объёма идеального газа, однако во многих случаях для практических вычислений отклонениями от идеальности пренебрегают.
Определение молярного объема при химических реакциях
Молярный объем — что это такое в химии
Молярный объем V m — является отношением объема вещества к его количеству, численно равен объему одного моля вещества.
Термин «молярный объем» применим по отношению к простым веществам, химическим соединениям и смесям. Величина зависит от следующих факторов:
Молярный объем вычисляют по формуле:
Молярный объем является характеристикой плотности упаковки молекул в рассматриваемом веществе. В случае простых веществ в некоторых ситуациях допустимо использовать понятие атомного объема.
Исходя из того, что объем газа определяется температурой и давлением, в процессе расчетов принято использовать объемы газов при нормальных условиях (сокращенно — н. у.). За нормальные условия принимают:
Молярный объем какого-либо газа при нормальных условиях:
Молярный объем смеси
Молярный объем смеси:
Молярный объем газов
Закон Авогадро: одинаковые количества газов при одинаковых условиях занимают одинаковый объем.
Молярный объем идеального газа вычисляют с помощью формулы, которая является выводом из уравнения состояния идеального газа.
Молярный объем идеального газа:
где T — является термодинамической температурой;
R — универсальная газовая постоянная.
Молярный объем кристаллов
Объем V я элементарной ячейки кристалла вычисляют с помощью характеристик кристаллической структуры, которые определяют на основании результатов рентгеноструктурного анализа.
Зависимость между объемом ячейки и молярным объемом:
где Z — определяет, сколько формульных единиц в элементарной ячейке.
Значения молярного объема химических элементов
Вычисление химического количества газа по его объему
Объем газа можно рассчитать по его химическому количеству. В этом случае необходимо преобразовать формулу молярного объема путем выражения из нее V :
Таким образом, объем газа равен произведению его химического количества на молярный объем. Продемонстрировать данное утверждение можно на примере. Допустим, что необходимо определить объем (н. у.) метана с химическим количеством 1,5 моль. Используя уравнение, записанное ранее, проведем вычисления:
При известном объеме газообразного вещества можно определить химическое количество рассматриваемого газа. В этом случае следует выразить из уравнения молярного объема n:
Определение объема веществ при химических реакциях
Перед тем, как приступить к расчетам объема веществ, следует ввести понятие плотности. Данный показатель определяется отношением массы вещества к его объему. Плотность измеряют в к г / м 3 (или г/л, г/мл). В случае газообразных веществ плотность принимает очень маленькие значения. Упростить расчеты химических реакций можно, если рассматривать отношение плотностей газов.
Относительной плотностью газа В по газу А называют величину, равную отношению плотностей рассматриваемых веществ или отношению молярных масс этих газов.
Данный параметр обозначают D A ( B ) и определяют по формуле:
В связи с тем, что в расчете относительной плотности используют величины одинаковой размерности, данный параметр является безразмерной величиной. Определить относительную плотность газообразных веществ по некому газу можно с помощью отношения молярных масс этих газов. Например, относительная плотность кислорода по водороду составляет:
Согласно закону Авогадро, в равных объемах различных газов, которые существуют при одинаковых температурах и давлениях, содержится одно и то же количество молекул. Данная гипотеза была представлена в 1811 году в Турине профессором физики Амедео Авогадро.
Подтверждение теория нашла во множестве экспериментальных опытах. Закон получил название закона Авогадро и стал в дальнейшем количественной основой современной химии. Закон Авогадро в точности реализуем в случае идеального газа. С увеличением разреженности газообразного вещества повышается точность расчетов по этому закону применительно к данному реальному газу.
Первое следствие из закона Авогадро: один моль (одинаковое количество молей) любого газа при одинаковых условиях занимает одинаковый объем.
Исходя из закона Авогадро, одинаковое число молекул какого-либо газа занимает при одинаковых условиях один и тот же объем. Наряду с тем, 1 моль какого-то вещества включает в себя (согласно определению) одинаковое количество частиц (к примеру, молекул). Таким образом, при определенных температуре и давлении 1 моль любого вещества в газообразном состоянии занимает один и тот же объем.
Если условия соответствуют нормальным, то есть температура равна 0 °C (273,15 К), и давление составляет 101,325 кПа, объем 1 моль газа соответствует 22,413 962(13) л. Данная физическая константа является молярным объемом идеального газа и обозначается Vm.
Вычислить молярный объем при температуре и давлении, отличных от нормальных условий, можно с помощью уравнения Клапейрона:
Второе следствие из закона Авогадро: молярная масса первого газа равна произведению молярной массы второго газа на относительную плотность первого газа ко второму.
Как найти объемные отношения газов в смеси
В процессе вычисления объемных отношений газов, участвующих в химических реакциях, используют закон Гей-Люссака (химический закон объемных отношений). В англоязычной литературе данный закон можно встретить под названием закона Шарля.
Закон Гей-Люссака — закон, демонстрирующий пропорциональную зависимость между объемом газообразного вещества и абсолютной температурой при постоянном давлении (то есть в изобарном процессе).
Закон получил название в честь французского физика и химика Жозефа Луи Гей-Люссака.
Математическое выражение закона Гей-Люссака:
В том случае, когда известно состояние газа при постоянном давлении и двух разных температурах, закон допустимо записывать таким образом:
По итогам химических реакций атомы не исчезают и не возникают. В результате таких процессов происходит их перегруппировка. Количество атомов до реакции и после ее протекания не меняется, что отличает их от молекул. Данное условие учитывают, расставляя стехиометрические коэффициенты в уравнениях химических реакций.
Коэффициенты в уравнениях реакций демонстрируют числа объемов газов, которые реагируют и образовываются. К примеру, 2 объема водорода и 1 объем кислорода дают 2 объема пара воды:
2 H 2 + O 2 = 2 H 2 O
V ( Н 2 ) : V ( N 2 ) : V ( N H 3 ) = 3 : 2 : 1
С другой стороны, данные соотношения справедливы лишь в случае веществ, которые участвуют в одной и той же химической реакции. Когда реагент принимает участие в двух параллельных реакциях, его химические количества в данных процессах не связаны и могут принимать любые значения.
n — количество газа.
Выразить молярный объем газов можно в л/моль:
В данной таблице использованы следующие обозначения:
Молярный объем – таблица, формулы (химия, 8 класс)
При изучении химических веществ важными понятиями являются такие величины, как молярная масса, плотность вещества, молярный объем. Так, что же такое молярный объем, и в чем его отличие для веществ в разном агрегатном состоянии?
Молярный объем: общая информация
Чтобы вычислить молярный объем химического вещества необходимо молярную массу этого вещества разделить на его плотность. Таким образом, молярный объем вычисляется по формуле:
где Vm – молярный объем вещества, М – молярная масса, p – плотность. В Международной системе СИ эта величина измеряется в кубический метр на моль (м 3 /моль).
Рис. 1. Молярный объем формула.
Молярный объем газообразных веществ отличается от веществ, находящихся в жидком и твердом состоянии тем, что газообразный элемент количеством 1 моль всегда занимает одинаковый объем (если соблюдены одинаковые параметры).
Объем газа зависит от температуры и давления, поэтому при расчетах следует брать объем газа при нормальных условиях. Нормальными условиями считается температура 0 градусов и давление 101,325 кПа.
Молярный объем 1 моля газа при нормальных условиях всегда одинаков и равен 22,41 дм 3 /моль. Этот объем называется молярным объемом идеального газа. То есть, в 1 моле любого газа (кислород, водород, воздух) объем равен 22,41 дм 3 /м.
Молярный объем при нормальных условиях можно вывести, используя уравнение состояния для идеального газа, которое называется уравнением Клайперона-Менделеева:
где R – универсальная газовая постоянная, R=8.314 Дж/моль*К=0,0821 л*атм/моль К
Объем одного моля газа V=RT/P=8.314*273.15/101.325=22.413 л/моль, где Т и Р – значение температуры (К) и давления при нормальных условиях.
Рис. 2. Таблица молярных объемов.
Закон Авогадро
В 1811 году А. Авогадро выдвинул гипотезу, что в равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковой число молекул. Позже гипотеза подтвердилась и стала законом, носящим имя великого итальянского ученого.
Рис. 3. Амедео Авогадро.
Закон становится понятен, если вспомнить, что в газообразном виде расстояние между частицами несопоставимо больше, чем размеры самих частиц.
Таким образом, из закона Авогадро можно сделать следующие выводы:
Следствие из закона Авогадро и понятие молярного объема основаны на том, что моль любого вещества содержит одинаковое число частиц (для газов – молекул), равное постоянной Авогадро.
Чтобы узнать число молей растворенного вещества содержится в одном литре раствора, необходимо определить молярную концентрацию вещества по формуле c=n/V, где n – количество растворенного вещества, выражаемое в молях, V – объем раствора, выражаемый в литрах С – молярность.
Что мы узнали?
В школьной программе по химии 8 класса изучается тема «Молярный объем». В одном моле газа всегда содержится одинаковый объем, равный 22,41 кубический метр/моль. Этот объем называется молярным объемом газа.