в чем суть репродукции вирусов
В чем суть репродукции вирусов
Вирусы являются внутриклеточными инфекционными агентами. Весь репликативный цикл вируса осуществляется с исполь зованием метаболических и генетических ресурсов клеток. Поэтому патогенез вирусных инфекций, в первую очередь, следует рассматривать на молекулярном и клеточном уровнях (В.И. Покровский, О.И. Киселев, 2002). Вместе с тем, инфекционный процесс, вызванный вирусами, развивается в пределах того или иного органа или ткани, так как большинство вирусов обладают достаточно высокой органной или тканевой тропностью. Поэтому характер развития внутритканевых процес сов при вирусных инфекциях, с одной стороны, определяется, как правило, цитопатическим действием вируса на клетки данной ткани и органа, а с другой стороны, реакцией внутритканевых и органных систем защиты от вирусной инфекции. Последние не редко носят деструктивный характер и усугубляют течение забо левания и его последствия. Поэтому понимание патогенеза вирусных инфекций представляется исключительно важным для создания рациональных схем лечения, основанных на гармоничном сочетании симптоматического лечения и противовирусной химиотерапии.
В клинической практике важное значение имеют процессы, вызванные вирусной инфекцией, виремией – (степень «вирусной нагрузки» прямо коррелирует с явлениями общего токсикоза, тяжестью состояния пациента, лихорадкой; тесным взаимодействием с иммунной системой), реакция которой в значительной степени определяет характер течения инфекционного процесса и его исход; присоединением бактериальной инфекции и развитием осложнений. Смешанные инфекции представляют собой опасный путь развития процесса.
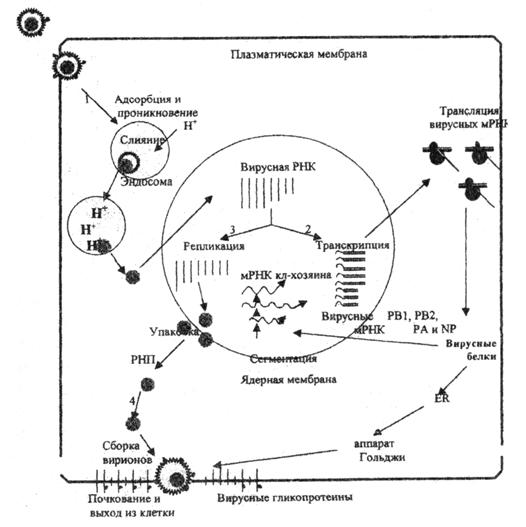
Стадии репликативного цикла вируса гриппа представлены на рис. 1. Такой же репликативный цикл свойствен большинству РНК- и ДНК-содержащих вирусов, кроме тех, кото рые обладают особыми механизмами хронизации процесса, латенции и способностью к интеграции в клеточный геном (например, ВИЧ, гепатит С, вирус папилломы и.т.). Ключевыми стадиями репликативного цикла вируса являются проникновение в клетки, декапсидация, активация процессов транскрипции и трансляции, собственно репликация вирусного генома и созревание зрелых вирусных частиц с выходом нового потомства инфекционного вируса.
Для проникновения вируса в клетку, необходимо: высокое сродство к вирусоспецифическому рецептору; множественность рецепторов; эффективность слияния вируса с клетками при инфицировании; способность к образованию синцития, к образованию гигантских синпластов, состоящих из множества слившихся клеток, в которых вирусный нуклеопротеид без эндоцитоза беспрепятственно переходит от одной зараженной клетки к множеству других через цитоплазму.
Такими свойствами из респираторных вирусов обладает респираторно-синцитиальный вирус, а среди ретровирусов – вирус иммунодефицита человека.
Стадии жизненного цикла вируса гриппа и соответствующие ингибиторы репродукции в известной степени могут быть экстраполированы на многие другие вирусы, за исключением тех, жизненный цикл которых включает интеграцию в клеточный геном. В процессе репликации вирусов обычно происходит селективная блокада трансляции клеточных мРНК и активация экспресси клеточных генов, кодирующих провоспапительные лимфокины. Многократные раунды репликации вирусного генома приводят к истощению энер гетических ресурсов клеток и пула предшественников азотистых оснований. Повышенное содержание провоспалительных лимфокинов приводит к развитию воспалительной реакции и локально му генерированию свободных радикалов, оказывающих, в свою очередь, повреждающее действие на клетки и ткани через перекисное окисление липидов клеточных мембран, инактивацию жизненно важных ферментов. Поэтому одним из важнейших факторов патогенности вирусов является их репликативный потенциал: чем активнее происходит репликация, тем сильнее цитопатическое действие вирусов на клетки и пораженную ткань (орган).
Значительный вклад в цитопатическое действие вирусов вносит репродукция вирусов в митохондриях, что сопровождается нарушением функций этих органоидов, падением продукции АТФ и индукцией опосредованного митохондриями пути апоптоза.
Впервые возможность репродукции вирусов в митохондриях была доказана выдающимся отечественным вирусологом В.М. Ждановым. Узкий тропизм вирусов, в известной степени, спасителен для организма, так как инфекционный процесс ограничен одним органом.
Это обстоятельство позволяет, проводит рациональную симптоматическую терапию, направленную на защиту данной ткани или органа и ориентировать противовирусные средства в данный орган, например, легкие.
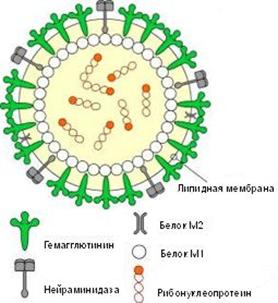
Возбудители гриппа относятся к семейству ортомиксовирусов (Orthomyxo-viridae) и являются пневмотропными вирусами. Схематическое строение вируса гриппа представлено на рис. 2.1. Геном вируса складывается из 8-ми фрагментов однонитчатой РНК, которые кодируют
10 вирусных белков. Фрагменты РНК имеют общую белковую оболочку, соединяющую их, образуя антигенно-стабильный рибонуклеопротеид (S-антиген), который определяет принадлежность вируса к серотипу А, В или С. Снаружи вирус покрыт двойным липидным слоем с внутренней стороны которого находится слой мембранного белка.
Рис. 1. Репликативный цикл вируса гриппа (В.И.Покровский, О.И.Киселев, 2002)
Представлены 4 основные фазы репликативного цикла вируса гриппа: 1 – адсорбция и проникновение вируса в клетку хозяина; 2 – транскрипция вирусной РНК и трансляция вирусных белков; 3 – репликация вирусной РНК и 4 – самосборка вирионов и последующий выход их из клетки.
Над оболочкой вируса поднимаются два типа «шипов» (гликопротеины) – гемаглютинин (Н) и нейраминидаза (N) – поверхностные антигены вируса гриппа. Гемаглютинин – полипептид, назван так благодаря способности гемолизировать эритроциты. Он имеет высокую изменчивость и иммуногенность, обеспечивая прикрепление вируса к клетке. Нейраминидаза – этогликопротеидный комплекс, который определяет ферментативную активность, отвечает за способность вирусной частицы проникать в клетку хозяина и выходить из нее после размножения.
Рис. 2. Схематическое строение вируса гриппа
Гемаглютинин и нейраминидаза являются факторами агрессии вируса гриппа. Интенсивность интоксикации при гриппе определяется свойствами гемаглютинина, а нейраминидаза обладает выраженным иммунодепресивным действием. Оба поверхностных антигена характеризуются выраженной способностью к изменчивости, в результате чего появляются новые антигенные варианты вируса. Гемаглютинины 1, 2, 3 типов и нейраминидазы 1, 2 типов содержат вирусы, которые поражают человека. Другие антигены характерные для вирусов гриппа животных (свиней, собак, лошадей, многих видов птиц и др.).
Вирусы гриппа А. Эти возбудители более вирулентны и контагиозны, чем вирусы гриппа В и С. Это обусловлено тем, что вирус А содержит 2 типа нейраминидазы (N1, N2) и 4 –гемаглютинина (H0, H1, H2, H3); вирус В – 1 и 1 соответственно, поэтому он имеет лишь антигенные варианты внутри одного серотипа; вирус С содержит только гемаглютинин и не содержитнейраминидазу, но он имеет рецептор, который разрушает энзим. Вирусу С не свойственная изменчивость.
Одновременно циркулируют и имеют эпидемическое распространение 2 подтипа вируса гриппа А H3N2 и H1N1. На сегодняшний день во всем мире доминирует вариант А/Сидней/05/97, А/Берн/07/95 и А/Пекин/262/95. Характерной чертой современных вирусов гриппа А (H3N2) является изменение ряда их биологических свойств: тяжело размножаются в куриных эмбрионах, не агглютинируют эритроциты кур, взаимодействуют только с эритроцитами человека или морской свинки, имеют низкую иммуногенную активность.
Вирусы гриппа В выделяются только от людей. По вирулентности и эпидемиологической значимости они уступают вирусам гриппа А. По антигенным свойствам гемаглютинин инейраминидазу вируса В можно разделить на 5 подтипов. Их изменчивость носит более постепенный и медленный характер, что объясняет эпидемиологические особенности вируса гриппа В (эпидемии возникали 1 раз в 3-4 года до 1988 г.). В мире сейчас циркулируют 2 варианта вируса гриппа В: В/Пекин/184/93 (Европа, Америка, Африка, Австралия) и В/Виктория/2/87 (Юго-Восточная Азия). Характерной чертой современных вирусов гриппа А и В является их высокая чувствительность к ингибиторам гемаглютинирующей и инфекционной активности, которые содержатся в сыворотке крови нормальных животных.
Для вирусов гриппа С характерна значительно большая стабильность антигенных и биологических свойств. По ряду биологических характеристик эти возбудители отличаются от других представителей семейства ортомиксовирусов. Им присуща низкая репродуктивная активность в разных клеточных системах и наличие других, чем у вирусов гриппа А и В, рецепторов на поверхности эритроцитов. Рецептор-деструктирующая активность связана не с нейраминидазой, как у вирусов гриппа А и В, а с ферментом нейраминат-0-ацетилестеразою.
Сложность этиологии усиливают факты выделения от людей вирусов, которые не свойственные человеку. Гены вируса гриппа (H5N1), выделенные в 1997 году от человека в Гонконге, оказались подобными генам птичьего вируса, который преодолел межвидовой барьер. Оказалось, что человеческие и птичьи вирусы гриппа были реасортантами (рекомбинантные штаммы), которые получили внутренние гены РВ1 и РВ2 от перепелиного вируса гриппа А (H9N2) – штаммы А/перепел/Гонконг/61/97.
Вирус гриппа не растет на обычных питательных средах. Его можно выделить из материала, который получен от больного в первые дни болезни (смывы из носоглотки, мокроты), путем заражения культур или клеток куриных эмбрионов.
Традиционно считалось, что человеческий организм освобождается от возбудителя в ближайшие дни после выздоровления. Однако постепенно накапливались косвенные свидетельства, которые опровергают эту точку зрения. И в 1985 г. были получены прямые доказательства формирования длительной персистенции вируса гриппа. У одного человека удалось многократно выделять вирус гриппа в течение 9-ти месяцев и дольше. Возможность пожизненной персистенции вируса в организме человека продолжает изучаться.
1. Грипп и другие респираторные вирусные инфекции / под ред. О.И. Киселева, И.Г. Мариничева, А.А. Сомининой. – СПб. – 2003.
2. Дриневский В.П., Осидак Л.В., Цыбалова Л.М. Острые респираторные инфекции у детей и подростков // Практическое руководство под редакцией О.И. Киселева. – Санкт-Петербург. – 2003.
3. Железникова Г.Ф., Иванова В.В., Монахова Н.Е. Варианты иммунопатогенеза острых инфекций у детей. – Санкт-Петербург. – 2007. – 254 с.
4. Ершов Ф.И. Грипп и другие ОРВИ // Антивирусные препараты. Справочник. – М., 2006. –С. 226-247.
5. Ершов Ф.И., Романцов М.Г. Антивирусные средства в педиатрии. – М., 2005. – С.159-175.
6. Ершов Ф.И., Киселев О.И. Интерфероны и их индукторы (от молекул до лекарств). – М., 2005. – С. 287-292.
7. Иванова В.В. Острые респираторно-вирусные заболевания // Инфекционные болезни у детей. – М., 2002.
8. Онищенко Г.Г., Киселев О.И., Соминина А.А. Усиление надзора и контроля за гриппом как важнейший элемент подготовки к сезонным эпидемиям и очередной пандемии. – М., – 2004. – С.5-9.
9. Об утверждении стандарта медицинской помощи больным гриппом, вызванным идентифицированным вирусом гриппа (грипп птиц) // Приказ Минздравсоцразвития №460 от 07.06.2006 г.
10. Романцов М.Г., Ершов Ф.И. Часто болеющие дети: Современная фармакотерапия. – М., 2006. – 192 с.
11. Стандартизированные принципы диагностики, лечения и экстренной профилактики гриппа и других острых респираторных инфекций у детей / под ред. О.И. Киселева. – СПб. – 2004. – С. 82-95.
12. Лекарственные средства в фармакотерапии патологии клетки / под редакцией Т.Г. Кожока.-М., 2007.
В чем суть репродукции вирусов
Поиск новых биологически активных соединений растительного происхождения для лечения и профилактики иммуносупрессии, инфекционных заболеваний, онкологии и метаболических заболеваний остается активной частью фармацевтических исследований [15]. В последние годы на рынке появилось более 40 новых препаратов природного происхождения, прошедших полный путь от исследования до клинических испытаний [2]. Такое внимание исследователей к природным соединениям обусловлено в первую очередь меньшей токсичностью растительных препаратов и более широким спектром действия. Некоторые лекарственные соединения растительного происхождения обнаружили способность эффективно блокировать развитие различных вирусов, включая вирус простого герпеса, гриппа, вирус иммунодефицита человека, вирусы гепатита С и В и многие другие [4, 8, 17, 19,].
Целью данного сообщения является систематизация данных по действию различных соединений растительного происхождения, способных ингибировать репродукцию вирусов.
Основой противовирусной терапии является воздействие на вирус или его составляющие компоненты на той или иной стадии репродукции. Весь процесс репродукции вирусов может быть условно разделен на три фазы [15]. Первая фаза охватывает события, которые ведут к адсорбции и проникновению вируса в клетку, освобождению его внутренних структурных компонентов и модификации его таким образом, что он способен вызвать инфекцию. Вторая фаза репродукции связана со сложными процессами, в течение которых происходит экспрессия вирусного генома. Заключительной стадией репродукции является выход вирусного потомства из клетки путем почкования или за счет лизиса, причем в последнем случае клетка погибает [12]. Имеющийся на сегодняшний день арсенал противовирусных средств способен оказывать воздействие на любой из этапов репродукции вируса.
Адсорбция и проникновение вируса в клетку
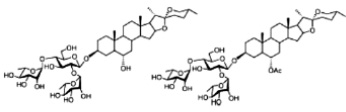
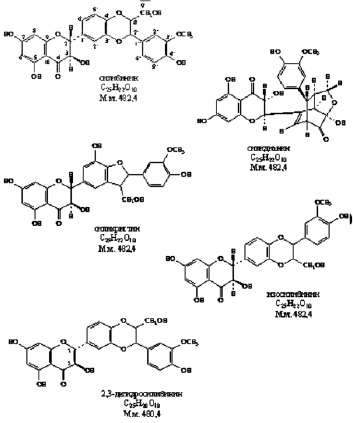
Взаимодействие вируса с клеткой начинается с процесса адсорбции, т.е. прикрепления вирусных частиц к клеточной поверхности. Этот процесс протекает при наличии соответствующих рецепторов на поверхности клетки и «узнающих» их субстанций на поверхности вируса. Прикрепление вируса к клетке происходит в два этапа, один из которых неспецифический, другой ‒ специфический. Поэтому химиотерапия этого этапа инфекции может быть также разделена на специфическую и неспецифическую. Неспецифическая стадия блокирования адсорбции вируса в первую очередь связана с электростатическими взаимодействиями между вирусом и клеткой, поэтому использование полисахаридов и некоторых пептидов, выделенных из растений и несущих большой отрицательный заряд, эффективно ингибирует адсорбцию вирусов. В подобных препаратах необходимы, как минимум, две сульфатные группы на один моносахарид. При этом противовирусная активность возрастает с возрастанием молекулярной массы в интервале от 1 до 10 kD. При меньших, а также больших массах полисахаридов противовирусная активность резко снижена. Не менее интересной группой химических соединений, подавляющих адсорбцию вирусов, можно назвать тритерпеновые сапонины, которые в силу своих структурных особенностей, связываясь с холестерином мембраны, способны изменять пространственную структуру мембраны клетки [13]. Установлено, что наличие у подобных препаратов трех сахарных остатков 3-O-β-хакотриозила увеличивает противовирусную активность соединений. Другой группой препаратов, блокирующих репликацию вирусов, являются полифенольные соединения, не только изменяющие заряд поверхности клетки, но и препятствующие специфической сорбции вируса на рецепторы (рис. 1).
Рис. 1. Соединения, блокирующие стадию адсорбции вируса [4, 8, 13]
Освобождение внутреннего компонента вируса
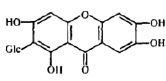
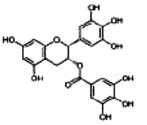
После проникновения вириона в клетку происходит целый комплекс превращений вируса, смысл которых заключается в удалении вирусных защитных оболочек, препятствующих экспрессии вирусного генома. Этот процесс сопровождается рядом характерных особенностей: исчезает инфекционность вируса, появляется чувствительность к нуклеазам, возникает устойчивость к нейтрализующему действию антител. Основной группой растительных соединений, способных подавлять репродукцию вирусов на этой стадии, являются аналоги силимарина, лютеолина и кверцетина (рис. 2) [4, 20, 21].
Рис. 2. Соединения, блокирующие освобождение внутреннего компонента вируса
Экспрессия вирусного генома и сборка вирусных частиц
Экспрессия вирусного генома и сборка вирионов являются самыми сложными этапами, включающими транскрипцию нуклеиновых кислот, трансляцию белков, посттрансляционные модификации вирусных белков, репликацию нуклеиновых кислот, сборку вирусных частиц. Этот этап репродукции вирусов успешно блокируется 2 основными группами растительных соединений: ингибиторами РНК полимераз и ингибиторами посттрансляционных модификаций белков. К таким препаратам относятся алпизарин, госсипол, эпиген и др (рис. 3).
Механизм действия подобных препаратов связан с образованием ацил-ферментных производных и основан на блокировании одной из трех основных областей, критичных для активности аспарагиновой протеазы вируса: каталитическое ядро фермента, содержащее пару Asp-Thr/Ser-Gly триад, мобильная flap-область и домен димеризации на N- и С-концах протеазы [1, 10, 14].
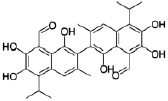
Рис. 3. Соединения, блокирующие экспрессию вирусного генома
Выход вирусного потомства
Завершающим этапом репродукции вируса является выход вирионов из инфицированной клетки. Этот процесс может протекать с помощью почкования вируса и лизиса клетки. Лизис клетки, как правило, сопровождается гибелью клетки. Блокировать такой механизм выхода вируса практически невозможно.
Выход из клетки путем почкования осуществляют вирусы с липопротеиновой оболочкой. При этом способе клетка может длительное время сохранять жизнеспособность и продуцировать вирусное потомство, пока не произойдет полное истощение ее ресурсов. Одним из механизмов блокирования этого этапа репродукции вируса является использование ингибиторов ферментативной активности вируса, участвующей в почковании вируса. Разработка препаратов группы ингибиторов фермента вируса гриппа – нейраминидазы (NA) ‒ является успешным достижением современной вирусологической науки последних лет – так называемого «рационального лекарственного дизайна», поскольку при синтезе данного препарата были использованы современные знания третичной структуры NA как антигена и фермента [3, 6].
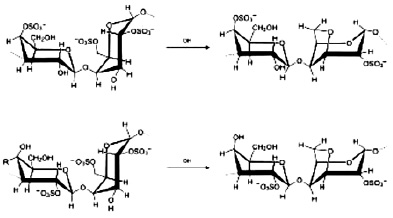
Препараты с антинейраминидазным действием «имитируют» структуру натуральных субстратов каталитического сайта NA (рис. 4), что «привлекает» вирус к большему взаимодействию с ними [5, 18]. К подобным соединениям относятся коричные и оксикоричные кислоты, галлаты и др.
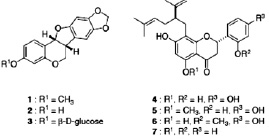
Рис. 4. Структура ингибиторов нейраминидазы [7, 9, 16]
На сегодняшний день практическая медицина обладает достаточно внушительным арсеналом противовирусных средств, способных подавлять репродукцию вируса на любой стадии процесса. Однако, несмотря на определенные успехи, достигнутые в вирусной химиотерапии, клиническая практика сталкивается с серьезной проблемой появления вариантов вируса, устойчивых к тем или иным препаратам.
Изучение растительных препаратов, обладающих антивирусными свойствами (алпизарин, эпиген, протефлазид, госсипол), показало, что за счет разных механизмов действия препаратов (противовирусное и иммуностимулирующее) появление вирусов, устойчивых к данным препаратам, не наблюдается. Большое разнообразие биологически активных соединений, находящихся в растениях, позволяет рассчитывать на возможность получения новых высокоактивных препаратов, обладающих способностью блокировать различные вирусы, в том числе, резистентные к существующим коммерческим химиопрепаратам. Подобные препараты, сочетающие в себе свойства иммуностимулирующих и противовирусных соединений, можно рекомендовать для лечения и профилактики инфекционных заболеваний, ассоциированных с иммунодефицитным состоянием, в том числе таких, как грипп, ВИЧ, гепатит С и др. [11, 17].
Рецензенты:
Саятов М.Х., д.б.н., академик НАН РК, профессор, главный научный сотрудник, РГП «Институт микробиологии и вирусологии» КН МОН РК, г. Алматы;
Жуматов К.Х., д.б.н., профессор, главный научный сотрудник, РГП «Институт микробиологии и вирусологии» КН МОН РК, г. Алматы.
ПРИМЕНЕНИЕ КУЛЬТУР КЛЕТОК ДЛЯ ВИРУСОЛОГИЧЕСКИХ ИССЛЕДОВАНИЙ
Р.Я. Подчерняева, М.В. Мезенцева, И.А. Суетина, О.А. Лопатина. Г.Р. Михайлова,
А.Д. Петрачев, Л.А. Потапова, О.В. Бакланова, Е.Л. Фирсова, О.М. Гринкевич,
Т.Н. Притчина, М.Н. Щетвин, Л.И. Руссу
ФГБУ «НИИ вирусологии им. Д.И. Ивановского» Минздрава России, Москва, cells@rambler.ru
Оптимизированный состав этих сред представляет собой определенные концентрации ферментативных гидролизатов, растворенных в сбалансированных растворах Эрла или Хенкса, в которые дополнительно добавлены витамины, микроэлементы и отдельные аминокислоты. Показано, что для пролиферации клеток МДСК (клетки почки собаки) при культивировании с соевой средой достаточно добавление только 2% эмбриональной бычьей сыворотки (FBS), а для пролиферации клеток Vero (клетки почки африканской зеленой мартышки) требуется добавление 5% FBS. Таким образом, использование соевой среды позволяет снизить количество сыворотки, необходимой для успешного культивирования этих клеток с 10% до 2—5%. Надо отметить, что морфология и кариология клеток МДСК и Vero не менялась при использовании соевой среды (6—8). Для проведения биотехнологических исследований на современном уровне желательно для культивирования клеток применять полностью бессывороточные среды. Список таких сред, как правило, широко представлен во многих каталогах, но, к сожалению, их цена слишком высока. Поэтому мы провели работу с применением отечественной бессывороточной среды «Гибрис-2» производства ООО «ПанЭко».
Адаптация клеток к этой среде проводилась поэтапно. Так, для получения адаптированной линии клеток МДСК к среде «Гибрис-2» было проведено 4 пассажа с 3% FBS, 3 пассажа с 2% FBS, 5 пассажей с 1% FBS и 6 пассажей без сыворотки. Показано, что индекс пролиферации (ИП), идентичный контрольным значениям, был отмечен только в присутствии 1—2% FBS, а культивирование без сыворотки не приводило к контрольным показателям. Возможно, требуется большее количество пассажей для полной адаптации клеток к бессывороточной среде (9,10). С целью оптимизации работы с нативными сыворотками было исследовано влияние сывороток северных оленей, суягных овец, свиней и морских котиков на пролиферативную активность 2-х клеточных линий — ЛЭЧ (клетки легких эмбриона человека) и Vero. Контролем служили эксперименты с использованием сыворотки FBS.
Было показано, что сыворотки из крови северных оленей можно успешно использовать для культивирования клеток Vero, которые наиболее часто применяются для биотехнологических целей. Однако вопрос стандартизации условий культивирования клеток в зависимости от наличия доброкачественных сывороток или их заменителей не утрачивает своего значения. Поэтому, были проведены исследования по получению и применению так называемых ростстимулирующих белков (РБ), выделенных из сывороток северных оленей, суягных овец и свиней с помощью водного раствора полиэтиленгликоля с M.м. 4000—8000 Д, который способствует также удалению ряда контаминирующих агентов. РБ представлены главным образом альбуминовой и α-глобулиновой фракциями, которые являются белковыми факторами роста, влияющими на пролиферацию клеток.
Изучена пролиферативная активность 7 клеточных линий после 5-ти последовательных пассажей в среде с РБ из сывороток свиней, суягных овец и оленей без добавления сыворотки FBS и с 2% FBS. Показано, что для получения показателей индекса пролиферации (ИП), равнозначных с контролем, все же необходимо добавление 2% сыворотки FBS. Показатели ИП разных клеточных линий различались незначительно. Лучшие показатели ИП наблюдались в экспериментах с РБ из сывороток оленей и свиней (11,12). При работе с культурами клеток не менее важным является применение ферментов для диспергирирования или отделения клеток от субстрата при их пересевах. Для этих целей, как известно, можно применять трипсин или химопсин.
Недостатком этих ферментов является то, что сырье для их получения не стандартизовано и не исключает наличия в них патогенных примесей. Поэтому, совместно с сотрудниками НПО «Вектор», мы провели изучение полученного ими препарата «Коллаза», который представляет собой комплекс протеолитических ферментов с коллагенолитической активностью, выделенных из экологически чистого гепатопанкреаса Камчатского краба с помощью хроматографической очистки и ультрафильтрации. При применении этого фермента по сравнению с трипсином количество жизнеспособных клеток было в 2—2,5 раза больше и требовалось более короткое время воздействия. При этом морфология культивируемых клеток 10 изученных линий оставалась без изменения. Таким образом, использование «Коллазы» при культивировании оказалось более эффективным, чем использование трипсина. Существенной проблемой при работе с клеточными культурами является микробная контаминация клеток, т.к. она влияет на метаболизм клеток, вызывает хромосомные аберрации и изменяет клеточные функции.
Частым контаминантом клеточных культур оказывается вирус бычьей диареи (ВД), относящийся к роду Pestivirus семейства Flaviviridae и являющийся возбудителем вирусной диареи — болезни слизистых крупного рогатого скота. Этот вирус может проникать в клетки из нативных сывороток крупного рогатого скота и даже FBS, добавленных в ростовую среду (13). Так, с помощью метода ПЦР было выявлено наличие ВД в коммерческих FBS, полученных из различных фирм (ПАНЭКО, ООО Биолот, Gibco, Biowest, HyClone, Amimed, Sigma). В сыворотках FBS фирмы ПАНЭКО ВД обнаруживается как до, так и после прогревания в водяной бане при 56°С в течение 30 и даже 60 минут (14). Мы проводили определение ВД с помощью метода ПЦР в клеточных линиях из нашей коллекции.
Иследовались диплоидные клетки легкого и фибробласты эмбриона человека, клетки онкогенных и лимфобластоидных линий человека, перевиваемые клетки обезьян, крупного рогатого скота, собаки, свиньи, крыс, мышей, хомячка, кролика, кошки, овцы, хорька и кур. Клетки хранились в жидком азоте в течение различного периода. Было показано, что диплоидные клетки человека и ряд перевиваемых клеток барана, свиньи, хомячка, обезьян и человека не были контаминированы ВД. Однако в 30% клеточных линий из 83-х изученных был выявлен ВД, причем чаще всего в более поздних закладках. Очевидно, при культивировании этих клеток использовались сыворотки, содержащие этот вирус (15). Одним из пунктов паспорта клеточной линии является чувствительность к репродукции вирусов. Изучение чувствительности разных клеточных линий к определенным вирусам крайне важно для приготовления противовирусных вакцин.
Вирусам свойственен определенный круг хозяев, узкий для одних видов и очень широкий для других. Генетический аппарат вирусов представлен как ДНК, так и РНК в одно- или двунитевой, линейной или циркулярной, моно- или фрагментарной формах. К РНК- содержащим вирусам позвоночных относятся 20 видов вирусов (арена, артери, астро, бирна, борна, бунья, геле, дельта, калици, корона, нода, ортомиксо, парамикса, рабдо, рео, ретро, тога, фило и флави вирусы), включая субвирусные агенты вероиды, сателлиты и прионы. К ДНК-содержащим вирусам позвоночных относятся 11 видов вирусов (адено, анелмо, асфар, гепадна, герпес, иридо, паппилома, парво, покс, полиома и цирко вирусы). Название этих видов вирусов связано либо с их морфологией, либо с местом их изоляции. Интерес к проблеме поиска клеточных линий, чувствительных к различным ДНК- и РНК-содержащим вирусам, позволил нам суммировать различные данные и представить их в виде таблиц 1—4 (16,17).