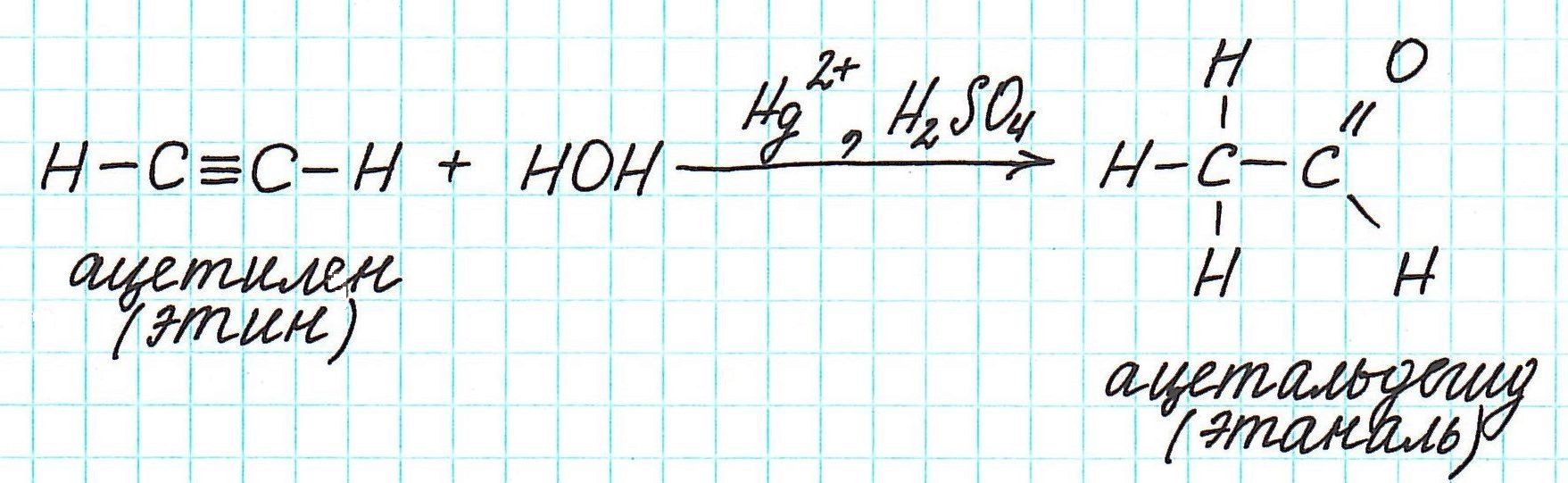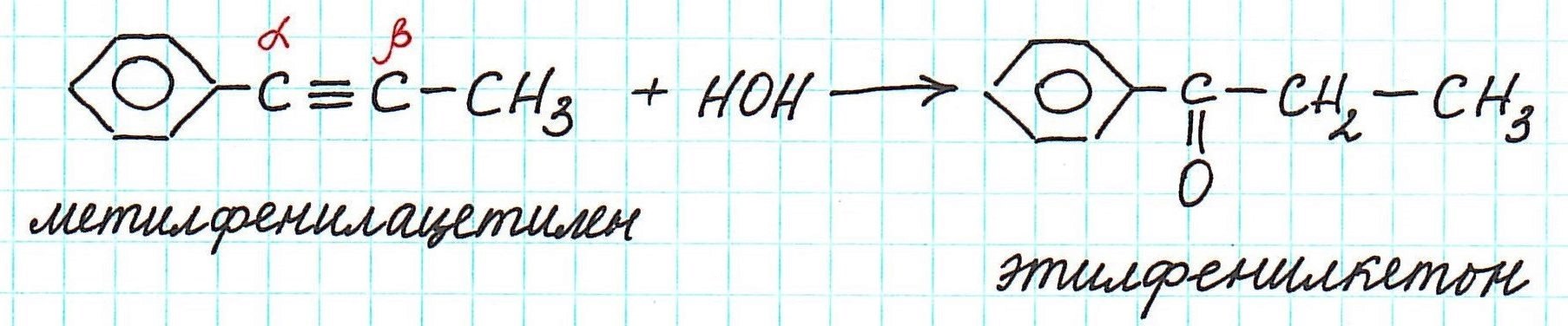в чем суть реакции кучерова
РЕАКЦИЯ КУЧЕРОВА
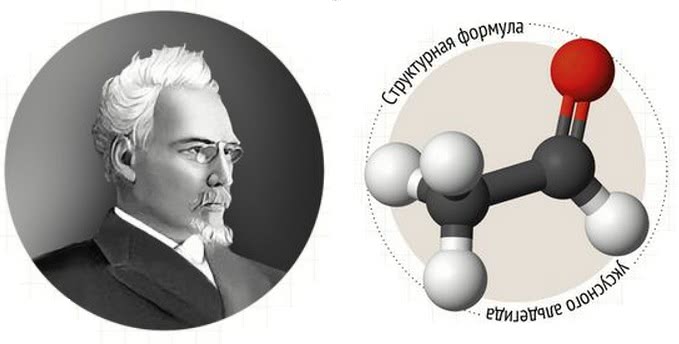
Реакция Кучерова для ацетилена (1881 г) стала основой промышленного получения уксусного альдегида как исходного сырья в синтезе многих органических соединений.
Кучеров Михаил Григорьевич (1850 – 1911) – российский химик-органик, внесший значительный вклад в развитие органического синтеза.
Взаимодействие ацетилена с водой (гидратация) приводит к образованию уксусного альдегида (ацетальдегида):
Механизм реакции Кучерова для ацетилена
Несмотря на кажущуюся простоту процесса, механизм его до сих пор не совсем ясен.
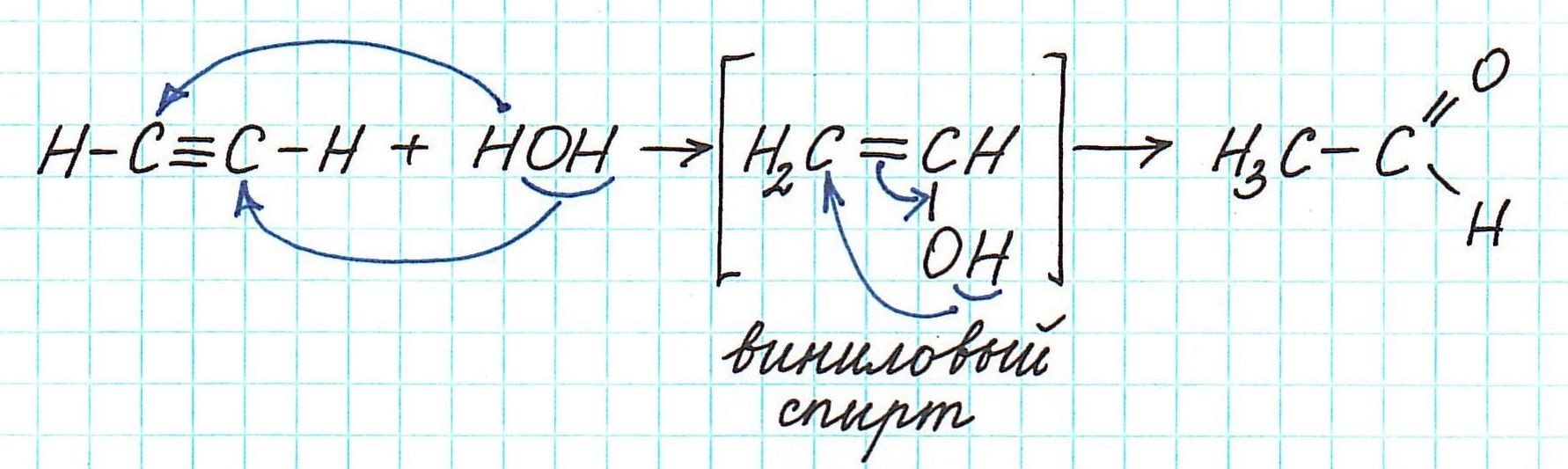
Однако достоверно известно, что одной из промежуточных стадий является образование неустойчивых непредельных спиртов (енолей). Их молекулы содержат гидроксильную группу –ОН у атома углерода с двойной связью.
Например, реакция Кучерова для ацетилена проходит следующим образом:
Механизм реакции Кучерова для гомологов ацетилена
Алкины ряда R ̶ C≡CH при гидратации всегда образуют метилкетоны: R ̶ C(O) ̶ CH3. Реакция получения ацетона (диметилкетона) как раз является таким примером.
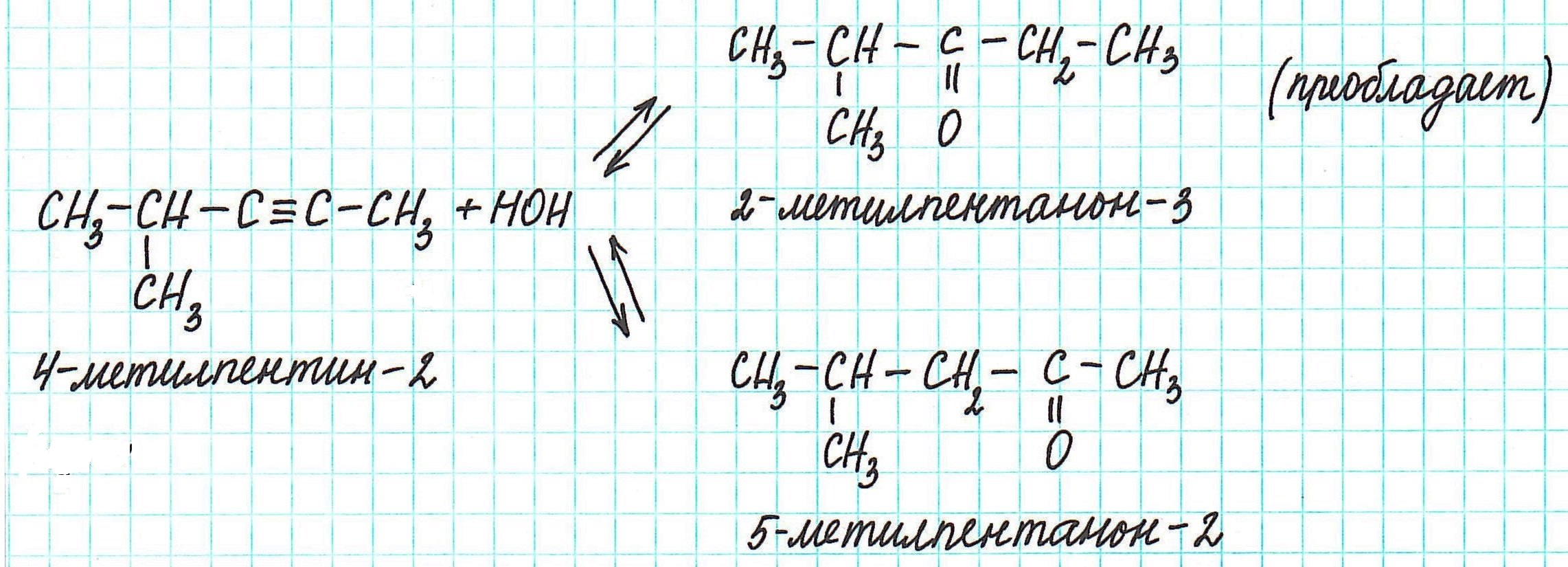
Алкины ряда R1 ̶ C≡C ̶ R2 при гидратации в зависимости от строения R1 и R2 могут давать смесь кетонов с явным преобладанием одного из них:
Как определить, какой кетон будет преобладать?
Молекула 4-метилпентина-2 содержит третичный атом углерода. Ближний к нему атом углерода с тройной связью находится в α-положении к нему, следующий – в β-положении. Образование карбонильной группы, характерной для кетонов, происходит в основном у углерода в α-положении.
Еще пример:
Итак, реакция Кучерова для ацетилена приводит к образованию ацетальдегида; реакция Кучерова для гомологов ацетилена приводит к образованию кетонов.
Реакция Кучерова
Неброскую ценность этой кислой жидкости люди осознали давным-давно. Ее использовали как лекарство и приправу к пище, применяли в приготовлении красок. Много веков подряд уксус получали из скисшего вина, не особо интересуясь причинами таких превращений, пока французский микробиолог Луи Пастер в середине XIX века не выявил главных участников процесса – это были бактерии уксусно-кислого брожения и кислород.
Со временем появились и другие способы получения уксусной кислоты – например, сухая перегонка дерева. А еще один, принципиально новый метод открыл в 1881 году русский химик М. Г. Кучеров, сотрудник Лесного и земледельческого института.
Михаил Григорьевич Кучеров был одним из тех строптивых отпрысков, которые разочаровывают родителей, выбирая свой путь не по отцовской указке, а потом производят на этом пути революцию. Он родился весной 1850 года в семье коллежского секретаря, мелкого дворянина, владевшего маленьким имением в Полтавской губернии. В 12 лет Михаил поступил в Петропавловскую Полтавскую военную гимназию, где стал одним из лучших учеников, а после ее окончания в 1968 году был зачислен в Михайловское артиллерийское училище в Петербурге. Но хватило его всего на несколько месяцев: Кучеров отчислился по собственному желанию и поступил в Земледельческий институт вольным слушателем «по предмету химии». В те годы, как сейчас говорят, набирала популярность новая химическая лаборатория, созданная в институте усилиями А. Н. Энгельгардта – химика, публициста и общественника с передовыми взглядами. Здесь Кучеров быстро освоил количественный анализ и включился в научно-исследовательскую работу. Он перевелся в студенты, а уже через три года защитил диплом «О составе сивушных масел различного происхождения» и поступил на работу лаборантом химической лаборатории.
Началась «белая полоса»: в журнале Русского химического общества вскоре появилась первая работа М. Г. Кучерова «О получении и исследовании синеродистого дифенила и его производных». В 1876 году он женился, в 1880-м стал ассистентом кафедры химии Лесного института (в который реорганизовался Земледельческий институт).
Работая над сложным органическим веществом, Кучеров выяснил, что под действием окиси ртути оно дает уксусный альдегид (от которого уксусная кислота отличается одним лишним атомом кислорода). По своему составу и строению это вещество было близко к газу ацетилену, и Кучеров предположил, что именно с помощью ацетилена можно получить уксусный альдегид.
Кстати, а что такое ацетилен? Далеким от химии, но наблюдательным обывателям он знаком по большим белым баллонам с красной надписью. Именно с его помощью ведется автогенная сварка и резка черных металлов: при сжигании ацетилена выделяется такое количество тепла, что температура может достигать 3100 °С. Ацетилен обнаружен на Уране и Нептуне, а на Земле практически не встречается. Довольно долго его добывали простым и довольно опасным способом – заливали водой карбид, сейчас в основном используют термический крекинг газа метана.
В 1885 году Михаил Григорьевич получил за свое открытие премию Русского физико-химического общества. (Этим же обществом через 20 лет была учреждена премия имени Кучерова, присуждавшаяся начинающим исследователям-химикам.) То была справедливая оценка коллег, но ведь истинный смысл работы ученого – не наука ради науки, а применение открытий в жизни. Надо сказать, что на конец XIX – начало ХХ века пришелся подъем в российской культуре и науке, который знаменовал вступление страны в эпоху индустриализации, ее вклад в мировую революцию в естествознании, которая происходила благодаря открытиям в физике, биологии, физиологии, географии и других дисциплинах. Достижения в металлургии и химии способствовали тому, что в начале ХХ века Европа и Америка начинали переход с паровых двигателей на двигатели внутреннего сгорания. Новые способы добычи нефти – главного сырья для современных двигателей – были изобретены именно русскими учеными. При этом Россия еще долго использовала паровые двигатели. И примерно по той же схеме сложилась судьба открытия Кучерова. В царской России работы ученого по достоинству не оценили, и промышленный синтез ацетальдегида впервые был освоен в Канаде и Германии в 1914 году, уже после его смерти.
В 1884-м Кучеров похоронил двух дочерей и жену, оставшись с тремя маленькими детьми – старшему было пять лет. Заработок и прежде не позволял семье барствовать, а теперь для детей нужно было нанимать няню. Кучеров поступает на службу в качестве младшего техника Технического комитета при департаменте неокладных сборов Министерства финансов, чтобы следующие 25 лет сочетать труд ученого с работой техника, а потом заведующего специальной химической лабораторией того же Министерства. Теперь в его работу входили исследования прикладного характера – очистка спиртов, определение примесей. Вот здесь достижения Кучерова оценили сразу: его способ определения сивушного масла в спиртах получил премию Минфина и сразу стал официальным в акцизной практике. В 1895 году ученого командировали в Англию, Францию и Австрию – знакомиться с устройством лабораторий, организованных для нужд финансового ведомства, а главное – с тем, как иностранцы борются с фальсификацией вин и пищевых продуктов в целом.
Насколько велико практическое значение реакции Кучерова, выяснилось, когда по его методу в заводских масштабах начали получать большое количество уксусного альдегида. Как пишет один из современных исследователей истории химии: «Высокие заводские корпуса, в которых осуществляется гидратация ацетилена в уксусный альдегид, — это своеобразные памятники выдающемуся русскому химику-органику».
Сам Кучеров значение своего открытия для будущего прекрасно понимал и продолжал исследования в этой области всю жизнь. Ледяная (чистая) уксусная кислота, получаемая с помощью окисления ацетальдегида, используется в сотнях отраслей промышленности: из нее изготовляют ацетон, необходимый в производстве кинопленки, при крашении тканей, изготовлении фармацевтических препаратов, каучука, камфоры, янтаря и т. д. На основе конденсации ацетальдегида производят много новейших химических препаратов. Из ацетальдегида получают искусственные смолы для производства пластмасс, а также обычный этиловый спирт.
В лаборатории и промышленности уксусную кислоту используют как реакционную среду для окисления органических веществ, в медицине – как основу для лекарств (например, аспирина и уксуснокислых солей алюминия и свинца, которые применяются при лечении воспалительных заболеваний в качестве вяжущих средств). Она используется в книгопечатании и крашении; при получении лекарственных и душистых веществ; в качестве растворителя (например, в производстве ацетилцеллюлозы, ацетона). И конечно, без 3–9-процентного уксуса не обойтись в пищевой промышленности и на любой кухне – при солении, мариновании, для ароматизации продуктов и в качестве приправы.
Сегодня реакцию Кучерова на практике применяют редко, поскольку продукты ее содержат примеси ртути – катализатора. Ее заменяют безртутными процессами; но до середины ХХ века (а во многих случаях и до сих пор) она была основой промышленных способов производства уксусного альдегида и важнейших химических продуктов. И по-прежнему реакция Кучерова имеет большое будущее как основа для возникновения новых отраслей производства.
Несмотря на свои научные заслуги, Михаил Григорьевич Кучеров за всю жизнь не получил официальных ученых степеней и звания ординарного профессора – видимо, потому, что дружил с профессорами Лесного института – Энгельгардтом, Соколовым и Лачиновым: они находились под негласным надзором полиции, а Энгельгардт даже год просидел в Петропавловской крепости, после чего высылался из Петербурга вместе с П. А. Лачиновым. Надо сказать, что и к занятиям со студентами в Лесном институте Кучеров поначалу был допущен только частным образом. В штат его зачислили только спустя полгода, и лишь через 20 лет Кучеров был утвержден доцентом, а затем – исполняющим обязанности экстраординарного (сверхштатного) профессора.
Лектором он был отличным, увлекался сам и умел увлечь студентов, ценивших в нем не только профессионала, но и друга, который поддерживал их во времена борьбы за свободную высшую школу. Через 18 лет после присуждения премии Русского физико-химического общества (той самой, которой коллеги отметили вклад реакции Кучерова в будущее промышленности) он вернул эту сумму (500 рублей!) президенту химического общества Н. Н. Бекетову с пожеланием использовать материальный состав награды еще раз для поддержки молодых исследователей.
Талант химика и широта души дополнялись у Кучерова талантом художника и музыканта. Он мог целиком спеть арию, а его живописные работы одобрял художник Бенуа. Картина ученого «Художественная лаборатория» до сих пор хранится в Лесотехническом университете. С 1911 года, когда Михаила Григорьевича Кучерова не стало, и до 2014-го она оставалась единственным произведением искусства, увековечившим его память. А этой весной на главном здании Петербургского государственного лесотехнического университета установили мемориальную доску в честь химика, занимающего одно из первых мест в истории органического синтеза, и его открытия, сделанного в этих стенах.
Гидратация алкинов по Кучерову
Вы будете перенаправлены на Автор24
Механизм гидратации ацетилена
Установлено, что кроме солей ртути гидратацию алкинов катализируют соли трехвалентного золота, одновалентной меди, одновалентного серебра и трехвалентного рутения. Механизм реакций Кучерова достаточно сложен, до конца не изучен и содержит еще много неясных моментов. В частности, неясна роль ионов металлов (йонов ртути в классической реакции) и путь образования винил-катионов в качестве промежуточных частиц.
Енолы
Готовые работы на аналогичную тему
Исследования химиков показали, что всегда при извлечении соединения с енольной структурой получают изомерные ей соединения с карбонильной структурой. Между енольной и карбонильной структурами существует равновесие:
Структурные изомеры, между которыми существует равновесие, называют таутомерами, а явление существования такой изомерии называют таутомерия.
Гидратация гомологов ацетилена
Гидратация гомологов ацетилена приводит к образованию кетонов. Присоединение воды к алкинам-1 происходит по правилу Марковникова. Например, при гидратации пропина образуется диметилкетон (ацетон):
Катализируемые кислотами и ионами ртути (II) реакции присоединения воды по месту тройной связи алкинов протекает строго по правилу Марковникова. Следовательно, гидратация как терминальноых, так и нетерминальных алкинов всегда приводит к кетонам, например для циклических и линейных алкинов:
Алкины
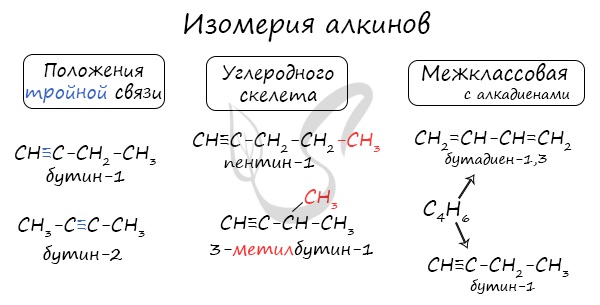
Номенклатура и изомерия алкинов
Названия алкинов формируются путем добавления суффикса «ин» к названию алкана с соответствующим числом: этин, пропин, бутин и т.д.
При составлении названия алкина важно учесть, что главная цепь атомов углерода должна обязательно содержать тройную связь. Нумерация атомов углерода в ней начинается с того края, к которому ближе тройная связь. В конце названия указывают атом углерода у которых начинается тройная связь.
Для алкинов характерна изомерия углеродного скелета, положения тройной связи, межклассовая изомерия с алкадиенами.
Пространственная геометрическая изомерия для них невозможна, ввиду того, что каждый атом углерода, прилежащий к тройной связи, соединен только с одним единственным заместителем.
Получение алкинов
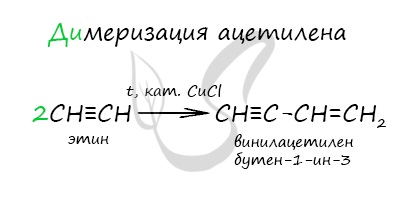
При нагревании метана до 1200-1500 °C происходит димеризация молекул метана, в ходе чего отщепляется водород.
Осуществляется напрямую, из простых веществ. Протекает на вольтовой (электрической) дуге, в атмосфере водорода.
2C + H2 → (t, вольтова дуга) CH≡CH
В результате разложения карбида кальция образуется ацетилен и гидроксид кальция II.
Получение гомологов ацетилена возможно в реакциях дегидрогалогенирования дигалогеналканов, в которых атомы галогена расположены у одного атома углерода или у двух соседних атомов.
Химические свойства алкинов
Водород присоединяется к атомам углерода, образующим тройную связь. Пи-связи (π-связи) рвутся, остается единичная сигма-связь (σ-связь).
CH≡C-CH3 + H2 → (t, Ni) CH2=CH-CH3 (в реакции участвует 1 моль водорода)
CH≡CH + 2H2 → (t, Ni) CH3-CH3 (в реакции участвует 2 моль водорода)
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу.
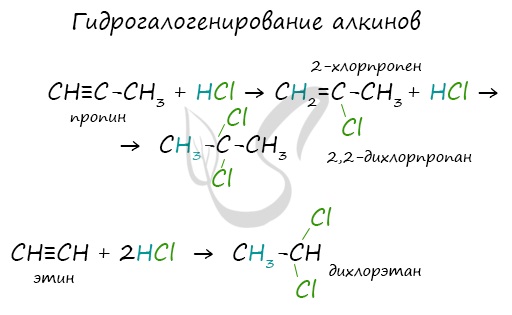
Алкины вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
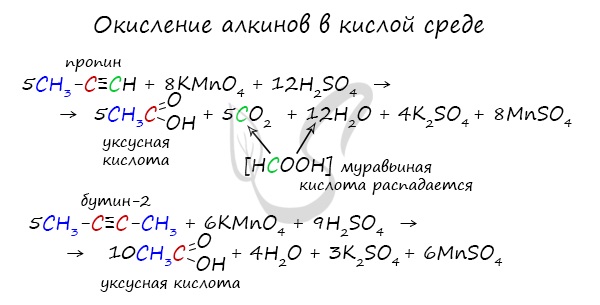
Только в реакции с ацетиленом образуется уксусный альдегид. Во всех остальных реакциях (с гомологами ацетилена) образуются кетоны.
Так, при окислении пропина, образуется уксусная кислота и муравьиная кислота, окисляющаяся до угольной кислоты, которая распадается на углекислый газ и воду.
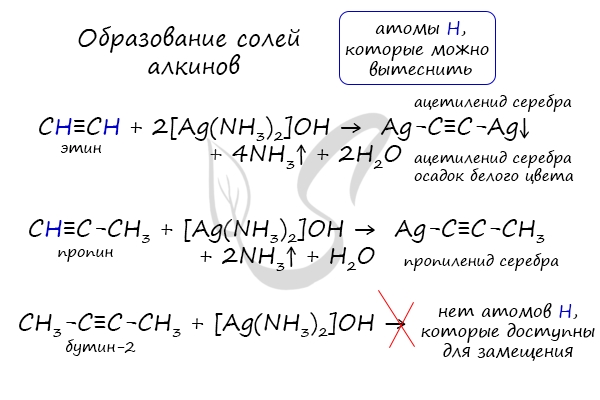
В случае если тройная связь прилежит к краевому атому углерода, то имеющийся у данного атома водород может быть замещен атомом металла. Если тройная связь спрятана внутри молекулы, то образование солей невозможно.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Реакция Кучерова
Реакция Кучерова — реакция гидратации ацетиленовых соединений с образованием карбонильных соединений. При гидратации ацетилена образуется ацетальдегид, в случае замещенных ацетиленов — главным образом кетоны:
Содержание
Механизм реакции
Реакцию проводят в воде или спиртовом растворе. Катализаторами являются соли ртути (Hg 2+ ) в кислой среде, например, HgSO4 в H2SO4, (CH3COO)2Hg в CH3COOH, HgO + BF3, HgO + CF3COOH + эфират BF3 и др.
Присоединение воды к молекуле алкина протекает по правилу Марковникова. Ион Hg 2+ образует π-комплекс с молекулой алкина, к которой присоединяется молекула воды с промежуточным образованием нестойкого енола, изомеризующегося в карбонильное соединение:
Отклонение от правила Марковникова наблюдается в том случае, если в молекуле алкина есть электроноакцепторная группа. В этом случае образуется смесь продуктов:
Атом кислорода обычно присоединяется в то положение, которое наиболее удалено от электроноакцепторной группы, но при небольшой разнице в полярности заместителей в молекуле алкина также образуется смесь продуктов.
Применение
Реакция Кучерова лежит в основе промышленного способа получения ацетальдегида из ацетилена, но постепенно перестала использоваться из-за токсичности солей ртути. Тем не менее, она находит применение в препаративном синтезе органических веществ.