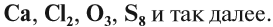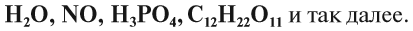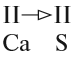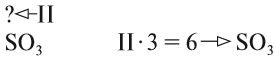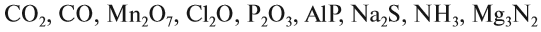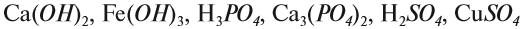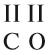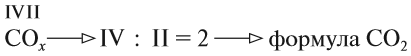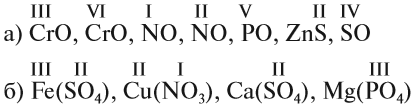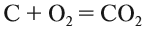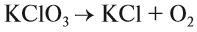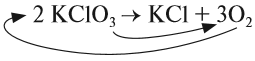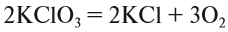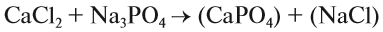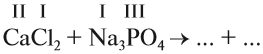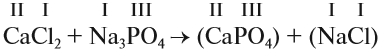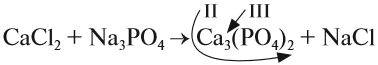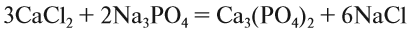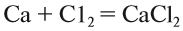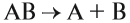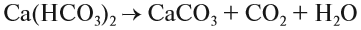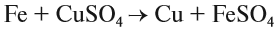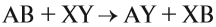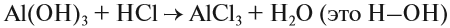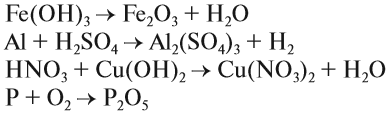в чем суть химии
ХИМИЯ
ХИМИЯ, наука о химических элементах, их соединениях и превращениях, происходящих в результате химических реакций. Она изучает, из каких веществ состоит тот или иной предмет; почему и как ржавеет железо, и почему олово не ржавеет; что происходит с пищей в организме; почему раствор соли проводит электрический ток, а раствор сахара – нет; почему одни химические изменения происходят быстро, а другие – медленно. Главная задача химии – выяснение природы вещества, главный подход к решению этой задачи – разложение вещества на более простые компоненты и синтез новых веществ. Используя этот подход, химики научились воспроизводить множество природных химических субстанций и создавать материалы, не существующие в природе. На химических предприятиях уголь, нефть, руды, вода, кислород воздуха превращаются в моющие средства и красители, пластики и полимеры, лекарства и металлические сплавы, удобрения, гербициды и инсектициды и т.д. Живой организм тоже можно рассматривать как сложнейший химический завод, на котором тысячи веществ вступают в точно отрегулированные химические реакции.
ЭЛЕМЕНТЫ И СОЕДИНЕНИЯ
Элементы
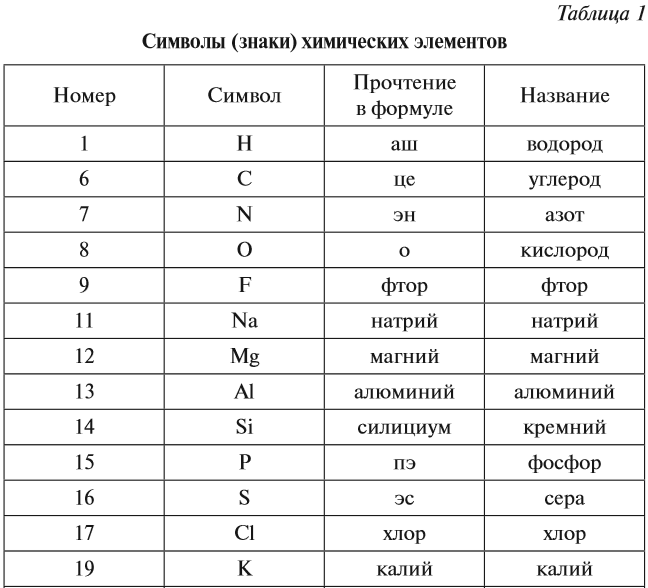
Исследование сложного вещества начинается с попыток разложить его на более простые. Простейшая форма материи, в которой сохраняется определенная совокупность физических и химических свойств, называется химическим элементом. Химические элементы – это частицы вещества, представляющие собой совокупность атомов с одинаковым зарядом ядра. Водород, кислород, хлор, натрий, железо – все это элементы. Элемент нельзя разложить на более простые составляющие обычными методами: с помощью тепла, света, электричества или под действием другого вещества. Для этого нужны колоссальное количество энергии, специальное оборудование (например, ускоритель частиц) или высокие температуры, сравнимые с температурами в недрах Солнца. Из 109 известных элементов в природе существует девяносто два элемента, остальные получены искусственно. Все они систематизированы в периодической таблице элементов, где каждому элементу соответствует свой порядковый номер, называемый атомным номером (см. ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ; ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ). В табл. 1 перечислены первые 103 элемента в алфавитном порядке. Из этого ограниченного набора элементов и состоят миллионы химических веществ.
| Элемент | Символ | Атомный номер | Атомная масса |
| Азот | N | 7 | 14,0067 |
| Актиний | Ac | 89 | (227) |
| Алюминий | Al | 13 | 26,98154 |
| Америций | Am | 95 | (243) |
| Аргон | Ar | 18 | 39,948 |
| Астат | At | 85 | (210) |
| Барий | Ba | 56 | 137,33 |
| Бериллий | Be | 4 | 9,01218 |
| Берклий | Bk | 97 | (247) |
| Бор | B | 5 | 10,811 |
| Бром | Br | 35 | 79,904 |
| Ванадий | V | 23 | 50,9415 |
| Висмут | Bi | 83 | 208,9804 |
| Водород | H | 1 | 1,0079 |
| Вольфрам | W | 74 | 183,85 |
| Гадолиний | Gd | 64 | 157,25 |
| Галлий | Ga | 31 | 69,723 |
| Гафний | Hf | 72 | 178,49 |
| Гелий | He | 2 | 4,0026 |
| Германий | Ge | 32 | 72,59 |
| Гольмий | Ho | 67 | 164,9304 |
| Диспрозий | Dy | 66 | 162,50 |
| Европий | Eu | 63 | 151,96 |
| Железо | Fe | 26 | 55,847 |
| Золото | Au | 79 | 196,9665 |
| Индий | In | 49 | 114,82 |
| Иод | I | 53 | 126,9045 |
| Иридий | Ir | 77 | 192,22 |
| Иттербий | Yb | 70 | 173,04 |
| Иттрий | Y | 39 | 88,9059 |
| Кадмий | Cd | 48 | 112,41 |
| Калий | K | 19 | 39,0983 |
| Калифорний | Сf | 98 | (251) |
| Кальций | Ca | 20 | 40,078 |
| Кислород | O | 8 | 15,9994 |
| Кобальт | Co | 27 | 58,9332 |
| Кремний | Si | 14 | 28,0855 |
| Криптон | Kr | 36 | 83,80 |
| Ксенон | Xe | 54 | 131,29 |
| Кюрий | Cm | 96 | (247) |
| Лантан | La | 57 | 138,9055 |
| Лоуренсий | Lr | 103 | (260) |
| Литий | Li | 3 | 6,941 |
| Лютеций | Lu | 71 | 174,967 |
| Магний | Mg | 12 | 24,305 |
| Марганец | Mn | 25 | 54,9380 |
| Медь | Cu | 29 | 63,546 |
| Менделевий | Md | 101 | (258) |
| Молибден | Mo | 42 | 95,94 |
| Мышьяк | As | 33 | 74,9216 |
| Натрий | Na | 11 | 22,98977 |
| Неодим | Nd | 60 | 144,24 |
| Неон | Ne | 10 | 20,179 |
| Нептуний | Np | 93 | 237,0482 |
| Никель | Ni | 28 | 58,69 |
| Ниобий | Nb | 41 | 92,9064 |
| Нобелий | No | 102 | (259) |
| Олово | Sn | 50 | 118,710 |
| Осмий | Os | 76 | 190,2 |
| Палладий | Pd | 46 | 106,42 |
| Платина | Pt | 78 | 195,08 |
| Плутоний | Pu | 94 | (244) |
| Полоний | Po | 84 | (209) |
| Празеодим | Pr | 59 | 140,9077 |
| Прометий | Pm | 61 | (145) |
| Протактиний | Pa | 91 | 231,0359 |
| Радий | Ra | 88 | 226,0254 |
| Радон | Rn | 86 | (222) |
| Рений | Re | 75 | 186,207 |
| Родий | Rh | 45 | 102,9055 |
| Ртуть | Hg | 80 | 200,59 |
| Рубидий | Rb | 37 | 85,4678 |
| Рутений | Ru | 44 | 101,07 |
| Самарий | Sm | 62 | 150,36 |
| Свинец | Pb | 82 | 207,2 |
| Селен | Se | 34 | 78,96 |
| Сера | S | 16 | 32,066 |
| Серебро 2) | Ag | 47 | 107,8682 |
| Скандий | Sc | 21 | 44,9559 |
| Стронций | Sr | 38 | 87,62 |
| Сурьма | Sb | 51 | 121,75 |
| Таллий | Tl | 81 | 204,383 |
| Тантал | Ta | 73 | 180,9479 |
| Теллур | Te | 52 | 127,60 |
| Тербий | Tb | 65 | 158,9254 |
| Технеций | Tc | 43 | [97] |
| Титан | Ti | 22 | 47,88 |
| Торий | Th | 90 | 232,0381 |
| Тулий | Tm | 69 | 168,9342 |
| Углерод | C | 6 | 12,011 |
| Уран | U | 92 | 238,0289 |
| Фермий | Fm | 100 | (257) |
| Фосфор | P | 15 | 30,97376 |
| Франций | Fr | 87 | (223) |
| Фтор | F | 9 | 18,998403 |
| Хлор | Cl | 17 | 35,453 |
| Хром | Cr | 24 | 51,9961 |
| Цезий | Cs | 55 | 132,9054 |
| Церий | Ce | 58 | 140,12 |
| Цинк | Zn | 30 | 65,39 |
| Цирконий | Zr | 40 | 91,224 |
| Эйнштейний | Es | 99 | (252) |
| Эрбий | Er | 68 | 167,26 |
| 1) В расчете на атомную массу изотопа углерода 12 С, равную 12,0000. В круглых скобках указано массовое число наиболее долгоживущего нуклида. 2) См. также АТОМНАЯ МАССА. | |||
Соединения
Элементы, соединяясь друг с другом, образуют сложные вещества – химические соединения. Соль, вода, ржавчина, каучук – это примеры соединений. Соединение состоит из элементов, но обычно по своим свойствам и внешнему виду не напоминает ни один из них. Так, ржавчина образуется при взаимодействии газа – кислорода с металлом – железом, а сырьем для получения многих волокон служат уголь, вода и воздух. Именно индивидуальность свойств – одна из черт, отличающих соединение от простой смеси. Другая, и наиболее важная, характеристика соединения заключается в том, что элементы всегда соединяются между собой в определенных массовых соотношениях. Например, вода состоит из 2,016 массовых частей водорода и 16,000 массовых частей кислорода. Массовое соотношение между водородом и кислородом в водах Волги и льдах Антарктики одинаково и равно 1:8. Иными словами, каждое химическое соединение имеет вполне определенный состав, т.е. всегда содержит одни и те же элементы в одних и тех же массовых соотношениях. Это один из основных химических законов – закон постоянства состава.
Многие элементы образуют несколько соединений. Так, помимо воды известно еще одно соединение водорода и кислорода – пероксид водорода, который состоит из 2,016 частей водорода и 32 частей кислорода. Здесь водород и кислород находятся в массовом соотношении 1:16, что ровно вдвое отличается от их соотношения в воде. Этот пример иллюстрирует закон кратных соотношений: если два элемента образуют между собой несколько соединений, то массовые количества одного элемента, соединяющиеся с одним и тем же массовым количеством другого, относятся между собой как небольшие целые числа.
Атомы и молекулы
Понятия атомов и молекул – основные в химии. Атом – это мельчайшая частица элемента, обладающая всеми его свойствами, а молекула – мельчайшая частица соединения, обладающая его свойствами и способная к самостоятельному существованию. Атомистическая идея восходит к 6–5 вв. до н.э. и принадлежит древнегреческим философам Левкиппу и его ученику Демокриту. По их представлениям, вещество состоит из мельчайших неделимых частиц – атомов, созданных из одного и того же первичного материала. Правда, ни один из этих философов не определил, что это за материал. Впоследствии атомную теорию развил другой греческий философ, Эпикур (4–3 вв. до н.э.). Он утверждал, что атомы обладают весом и перемещаются в горизонтальном и вертикальном направлениях, взаимодействуя друг с другом. Аналогичные идеи высказывал римский поэт Лукреций в 1 в. до н.э., наблюдавший за пылинками, которые танцуют в солнечном луче. Наконец, в 1804–1810 английский химик и физик Дж.Дальтон разработал атомную теорию, которая включала законы кратных соотношений и постоянства состава. Однако убедительные доказательства существования атомов были получены только в 20 в. Когда Лукреций утверждал, что пылинки подталкиваются невидимыми потоками движущихся атомов, он был не так уж далек от истины: их танец действительно могут вызывать воздушные течения, но даже в неподвижном воздухе частички пыли или дыма находятся в постоянном движении. Этот эффект называют броуновским движением (см. также БРОУНОВСКОЕ ДВИЖЕНИЕ). Спустя два тысячелетия после Лукреция французский ученый Ж.Перрен, вооруженный микроскопом и математической теорией, изучил случайные блуждания суспендированных частичек краски и рассчитал число невидимых молекул, чьи удары заставляли их двигаться. После того, как атомы и молекулы удалось сосчитать, само их существование стало гораздо более убедительным.
Строение атома
Согласно современным представлениям, атом содержит центральное ядро, размеры которого очень малы по сравнению с атомом в целом. Ядро несет положительный электрический заряд и окружено диффузной оболочкой (облаком) из отрицательно заряженных электронов, которая и определяет размер атома. Диаметр атома – ок. 10 –8 см, диаметр ядра в 10 000 раз меньше и равен примерно 10 –12 см. У простейшего из атомов – атома водорода – в ядре всего одна частица – протон. Ядро атомов других элементов содержит более одного протона, а также нейтроны – частицы, близкие к протонам по массе, но не имеющие электрического заряда. Заряд ядра называют его атомным (или порядковым) номером. Атомный номер равен числу протонов в ядре и определяет химическую природу элемента. Так, атом с зарядом ядра +26 содержит 26 протонов в ядре и представляет собой элемент железо. Ядро атома железа окружают 26 электронов, поэтому атом в целом электронейтрален.
Суммарное число протонов и нейтронов в ядре называют массовым числом, поскольку в этих частицах сосредоточена практически вся масса атома. Число нейтронов, содержащихся в ядрах атомов данного элемента, в отличие от числа протонов, может варьировать. Атомы одного элемента, ядра которых содержат разное число нейтронов, называют изотопами. Слово «изотоп» греческого происхождения; оно означает «одно и то же место» – разные изотопы элемента занимают одну и ту же позицию в периодической таблице Менделеева (см. также ИЗОТОПЫ) и обладают очень близкими химическими свойствами. Так, у водорода (массовое число 1) есть изотоп дейтерий, в ядре которого один протон и один нейтрон (массовое число соответственно равно 2). Оба изотопа вступают в одни и те же химические реакции, но не всегда одинаково легко.
Термин «атомная масса» означает массу атома элемента, выраженную в единицах массы атома изотопа углерода 12 С, которую принято считать равной его массовому числу – 12,0000 (атомная масса изотопа близка к его массовому числу, но не равна ему, поскольку при образовании атомного ядра часть массы теряется в виде энергии). До 1961 атомные массы элементов определяли относительно среднего массового числа для смеси изотопов кислорода, равного 16,0000. Атомная масса элемента, существующего в природе в виде смеси изотопов, – это средняя величина атомных масс всех изотопов с учетом их распространенности в природе (см. также АТОМНАЯ МАССА). Молекулярная масса равна сумме масс атомов элементов, составляющих молекулу. Например, мол. масса воды равна сумме 2 · 1,008 (два атома водорода) + 16,0000 (один атом кислорода), т.е. 18,016.
Электронное облако
Физические и химические свойства атомов, а следовательно, и вещества в целом во многом определяются особенностями электронного облака вокруг атомного ядра. Положительно заряженное ядро притягивает отрицательно заряженные электроны. Электроны вращаются вокруг ядра так быстро, что точно определить их местонахождение не представляется возможным. Движущиеся вокруг ядра электроны можно сравнить с облаком или туманом, в одних местах более или менее плотным, в других – совсем разреженным. Форму электронного облака, а также вероятность нахождения электрона в любой его точке можно определить, решив соответствующие уравнения квантовой механики (см. также КВАНТОВАЯ МЕХАНИКА). Области наиболее вероятного нахождения электронов называют орбиталями. Каждая орбиталь характеризуется определенной энергией, и на ней может находиться не более двух электронов. Обычно вначале заполняются ближайшие к ядру самые низкоэнергетические орбитали, затем орбитали с более высокой энергией и т.д.
Существует четыре типа орбиталей, их обозначают s, p, d и f. На каждом уровне (слое) имеется одна s-орбиталь, которая содержит наиболее прочно связанные с ядром электроны. За ней следуют три p-орбитали, пять d-орбиталей и, наконец, семь f-орбиталей.
ХИМИЯ
Смотреть что такое «ХИМИЯ» в других словарях:
ХИМИЯ — (греч. chymeia, от chymos сок). Отрасль естествоведения, исследующая природу и свойства простых тел, частичное влияние этих тел друг на друга и соединения, являющиеся следствием этого влияния. Словарь иностранных слов, вошедших в состав русского… … Словарь иностранных слов русского языка
ХИМИЯ — ХИМИЯ, наука о веществах, их превращениях, взаимодействии и о происходящих при этом явлениях. Выяснением основных понятий, к рыми оперирует X., как напр, атом, молекула, элемент, простое тело, реакция и др., учением о молекулярных, атомных и… … Большая медицинская энциклопедия
ХИМИЯ — (возможно от греч. Chemia Хемия, одно из древнейших названий Египта), наука, изучающая превращения веществ, сопровождающиеся изменением их состава и (или) строения. Химические процессы (получение металлов из руд, крашение тканей, выделка кожи и… … Большой Энциклопедический словарь
ХИМИЯ — ХИМИЯ, отрасль науки, изучающая свойства, состав и структуру веществ и их взаимодействие друг с другом. В настоящее время химия представляет собой обширную область знаний и подразделяется прежде всего на органическую и неорганическую химию.… … Научно-технический энциклопедический словарь
ХИМИЯ — ХИМИЯ, химии, мн. нет, жен. (греч. chemeia). Наука о составе, строении, изменениях и превращениях, а также об образовании новых простых и сложных веществ. Химию, говорит Энгельс, можно назвать наукой о качественных изменениях тел, происходящих… … Толковый словарь Ушакова
химия — – наука о составе, строении, свойствах и превращениях веществ. Словарь по аналитической химии [3] • аналитическая химия коллоидная химия неорганическая химия … Химические термины
ХИМИЯ — совокупность наук, предмет к рых составляют соединения атомов и превращения этих соединений, происходящие с разрывом одних и образованием других межатомных связей. Различные химия, науки отличаются тем, что они занимаются либо разными классами… … Философская энциклопедия
Химия — Наука * История * Математика * Медицина * Открытие * Прогресс * Техника * Философия * Химия Химия Кто не понимает ничего, кроме химии, тот и ее понимает недостаточно. •Лихтенберг Георг (Lichtenberg) (Источник: «Афоризмы со всего мира.… … Сводная энциклопедия афоризмов
Химия — наука о веществах, их составе, строении, свойствах и законах превращений: коллоидная наука о дисперсных системах и поверхностных явлениях на границах раздела взаимодействующих фаз; физическая наука, объясняющая химические явления и… … Энциклопедия терминов, определений и пояснений строительных материалов
Урок 1. Основные понятия и законы предмета «Химия»
Простейшие понятия: вещество, молекула, атом, химический элемент
Что такое химия? Где мы встречаемся с химическими явлениями? Везде. Сама жизнь — это бесчисленное множество разнообразных химических реакций, благодаря которым мы дышим, видим голубое небо, ощущаем изумительный запах цветов…
Что изучает химия? Химия изучает вещества, а также химические процессы, в которых участвуют эти вещества.
Что такое вещество — понятно: это то, из чего состоит окружающий нас мир и мы сами. Но что такое химический процесс (явление)?
К химическим явлениям относятся процессы, в результате которых изменяется состав или строение молекул, образующих данное вещество. Изменились молекулы — изменилось вещество (оно стало другим!), — изменились его свойства:
Все эти изменения — следствие сложных и многообразных химических процессов. Итак,
химия — это наука о веществах и их превращениях.
При этом исследуются не всякие превращения, а только такие, при которых
В этом определении встречаются такие понятия, как «вещество», «молекула», «атом». Разберём их подробнее.
Вещество — это то, из чего состоят окружающие нас предметы. Каждому абсолютно чистому веществу (таких в природе, кстати, не существует) приписывают определённую химическую формулу, которая отражает его состав, например:
Выше приведены молекулярные формулы двух веществ. Следует отметить, что далеко не все вещества состоят из молекул, так как существуют вещества, которые состоят из атомов или ионов. Например, алмаз состоит из атомов углерода, а обычная поваренная соль — из ионов Na + и ионов Cl – (условная «молекула» — NaСl).
Наименьшая частица вещества, которая отражает его качественный и количественный состав, называется молекулой.
Молекулы состоят из атомов. Атомы в молекуле соединены при помощи химических связей. Каждый атом обозначается при помощи символа (химического знака):
Число атомов в молекуле обозначают при помощи индекса:
Но! Если атомы не связаны химической связью, то их число обозначают при помощи коэффициента:
Аналогично изображают число молекул:
Почему атомы водорода и кислорода имеют разное название, разный символ? Потому что это атомы разных химических элементов.
Химический элемент — это частицы с одинаковым зарядом ядер их атомов.
Что такое ядро атома? Почему заряд ядра является признаком принадлежности атома к данному химическому элементу? Чтобы ответить на эти вопросы, следует уточнить: изменяются ли атомы в химических реакциях? Из чего состоит атом*?
* Подробнее о строении атома будет рассказано в уроке 3.
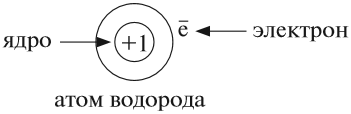
Атом не имеет заряда, хотя и состоит из положительно заряженного ядра и отрицательно заряженных электронов:
В ходе химических реакций число электронов любого атома может изменяться, но заряд ядра атома в химических реакциях НЕ МЕНЯЕТСЯ!
Поэтому заряд ядра атома — своеобразный «паспорт» химического элемента. Все атомы с зарядом ядра +1 принадлежат химическому элементу под названием «водород». Атомы с зарядом ядра +8 составляют химический элемент «кислород».
Каждому химическому элементу присвоен химический символ (знак), порядковый номер в таблице Менделеева (порядковый номер равен заряду ядра атома); определённое название и, для некоторых химических элементов, особое прочтение символа в химической формуле (табл. 1).
Подведём итог. Вещества состоят из молекул, молекулы состоят из атомов, атомы с одинаковым зарядом ядра относятся к одному и тому же химическому элементу.
Но, если вещество состоит из молекул, то любое изменение состава или строения молекулы приводит к изменению самого вещества, его свойств.
Вопрос. Чем отличаются химические формулы веществ: Н2О и Н2О2?
Хотя по составу молекулы этих веществ отличаются на один атом кислорода, сами вещества по свойствам сильно отличаются друг от друга. Воду Н2О мы пьём и жить без неё не можем, а Н2О2 — перекись водорода, пить нельзя, а в быту её используют для обесцвечивания волос.
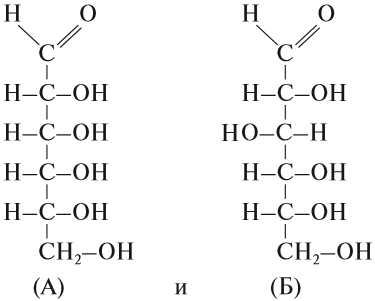
Вопрос. А чем отличаются химические формулы веществ:
Состав этих веществ — аллозы (А) и глюкозы (Б) — одинаков — С6Н12О6. Отличаются они строением молекул, в данном случае — расположением групп ОН в пространстве. Глюкоза — универсальный источник энергии для большинства живых организмов, а аллоза практически не встречается в природе и не может быть источником энергии.
Простые и сложные вещества. Валентность
Вещества бывают простые и сложные. Если молекула состоит из атомов одного химического элемента, — это простое вещество:
Если в состав вещества входят атомы только одного химического элемента — это простое вещество. Причём некоторые химические элементы образуют несколько простых веществ. Так, химический элемент кислород образует простое вещество «кислород» О2 и простое вещество «озон» О3*.
* В 2002 г. появилось сообщение о существовании ещё одного простого вещества кислорода — O4.
А химический элемент углерод образует четыре простых вещества, причём ни одно из них не называется «углерод». Эти вещества отличаются пространственным расположением атомов:
В четвертой модификации «углерода» — фуллерене — атомы углерода образуют сферу, т. е. молекулы фуллерена напоминают мячик.
Существование элемента в виде нескольких простых веществ называется аллотропией. Алмаз, графит, карбин, фуллерен — аллотропные модификации элемента «углерод», а кислород и озон — аллотропные модификации элемента «кислород».
Таким образом, не следует путать эти понятия: «химический элемент» и «простое вещество», а также «молекула» и «атом».
Очень часто в письменных записях слова «молекула» или «атом» заменяют соответствующими символами, но не всегда правильно. Так, нельзя писать: «В состав воды входит Н2», так как речь здесь идёт о химическом элементе водороде — Н. Нужно писать: «В состав воды входит (Н)». Аналогично, правильной будет запись: «При действии металла на раствор кислоты выделится Н2», т. е. вещество водород, молекула которого двухатомна.
Молекулы сложных веществ состоят из атомов разных химических элементов:
Как известно, в состав сложных веществ входят атомы разных химических элементов. Эти атомы соединяются между собой химическими связями: ковалентными, ионными, металлическими.
Способность атома образовывать определённое число ковалентных химических связей называется валентностью. (Подробнее см. урок 4 «Химическая связь».) Правильнее всего определять валентность по графическим или структурным формулам:
В таких формулах одна чёрточка обозначает одну ковалентную связь, т. е. «одну валентность». На практике чаще всего валентность определяют по молекулярной формуле, хотя здесь правильнее говорить о степени окисления элемента (см. урок 7). Иногда результат определения степени окисления соответствует реальному значению валентности, но бывают и неодинаковые результаты.
Задание 1.1. Определите «валентность» (степени окисления) атомов кальция и углерода по формуле СаС2. Совпадает ли полученный результат с реальным значением валентности?
В устойчивой молекуле не может быть «свободных», «лишних» валентностей! Поэтому для двухэлементной молекулы число химических связей (валентностей) атомов одного элемента равно общему числу химических связей атомов другого элемента.
Валентность атомов некоторых химических элементов постоянна (табл. 2).
Для других атомов валентность можно определить (вычислить) из химической формулы вещества.
Строго говоря, по нижеизложенным правилам определяют не валентность, а степень окисления (см. урок 7). Но поскольку в некоторых соединениях числовые значения этих понятий совпадают, то иногда по формуле можно определять и валентность.
При этом следует учитывать изложенное выше правило о химической связи.
Сделаем практические выводы.
1. Если один из атомов в молекуле одновалентен, то валентность второго атома равна числу атомов первого элемента (см. на индекс!):
2. Если число атомов в молекуле одинаково, то валентность первого атома равна валентности второго атома:
3. Если у одного из атомов индекс отсутствует, то его валентность равна произведению валентности второго атома на его индекс:
4. В остальных случаях ставьте валентности «крест-накрест», т. е. валентность первого атома равна числу атомов второго элемента и наоборот:
Задание 1.2. Определите валентности элементов в соединениях:
Вначале укажите валентности атомов, у которых она постоянна! Аналогично определяется валентность атомных групп (ОН), (РО4), (SО4) и так далее.
Задание 1.3. Определите валентности атомных групп (в формулах выделены курсивом):
Обратите внимание! Одинаковые группы атомов (OH), (РО4), (SO4) имеют одинаковые валентности во всех соединениях.
Зная валентности атома или группы атомов можно составить формулу соединения. Для этого пользуются правилами:
Задание 1.4. Составьте химические формулы соединений:
Уравнения химических реакций
Вещества, состав которых отражают химические формулы, могут участвовать в химических процессах (реакциях). Графическая запись, соответствующая данной химической реакции, называется уравнением химической реакции. Например, при сгорании (взаимодействии с кислородом) угля происходит химическая реакция:
Запись показывает, что один атом углерода С, соединяясь с одной молекулой кислорода O2, образует одну молекулу углекислого газа СО2. Число атомов каждого химического элемента до и после реакции должно быть одинаково! Это правило — следствие Закона сохранения массы вещества: масса исходных веществ равна массе продуктов реакции. Закон был открыт в 18-м веке М. В. Ломоносовым и, независимо от него, А. Л. Лавуазье.
Выполняя этот закон, необходимо в уравнениях химических реакций расставлять коэффициенты так, чтобы число атомов каждого химического элемента не изменялось в результате реакции. Например, при разложении бертолетовой соли КClO3, получается соль КСl и кислород О2:
Число атомов калия и хлора одинаково, а кислорода — разное. Уравняем их:
Теперь изменилось число атомов калия и хлора до реакции. Уравняем их:
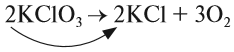
Теперь между правой и левой частями уравнения можно поставить знак равенства:
Полученная запись показывает, что при разложении двух молекул КClO3 получается две молекулы КСl и три молекулы кислорода O2. Число молекул показывают при помощи коэффициентов.
При подборе коэффициентов необязательно считать отдельные атомы. Если в ходе реакции не изменился состав некоторых атомных групп, то можно учитывать число этих групп, считая их единым целым:
Последовательность действий такова:
1. Определим валентность исходных атомов и группы PO4:
2. Перенесём эти числа в правую часть уравнения:
3. Составим химические формулы полученных веществ по валентностям составных частей:
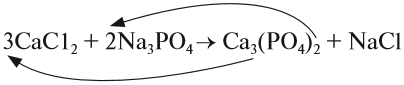
4. Обратим внимание на состав «самого сложного» соединения: Ca3(PO4)2 и уравняем число атомов кальция (их три) и число групп РО4 (их две):
5. Число атомов натрия и хлора до реакции теперь стало равным шести; доставим соответствующий коэффициент:
Эти правила образуют Алгоритм составления уравнений химических реакций обмена, так как, пользуясь этой последовательностью, можно уравнять схемы многих химических реакций, за исключением более сложных окислительно-восстановительных реакций (см. урок 7).
Химические реакции бывают разных типов. Основными являются:
1. Реакции соединения:
Здесь из двух и более веществ образуется одно вещество:
2. Реакции разложения:
Здесь из одного вещества получаются два вещества и более веществ:
3. Реакции замещения:
Здесь реагируют простое и сложное вещества, образуются также простое и сложное вещества, причём простое вещество замещает часть атомов сложного вещества:
4. Реакции обмена:
Здесь реагируют два сложных вещества и получаются два сложных вещества. В ходе реакции сложные вещества обмениваются своими составными частями:
Существуют и другие типы химических реакций.
Задание 1.5. Расставьте коэффициенты в предложенных выше примерах.
Задание 1.6. Расставьте коэффициенты и определите тип химической реакции:
Выводы
Вещества бывают простые и сложные. Состав веществ показывают при помощи химических формул. Формулы веществ составляют, учитывая валентности составных частей этих веществ. Запись химического процесса при помощи формул называется уравнением химической реакции. Химические реакции бывают разных типов: обмена, замещения, разложения, соединения и другие.