в чем состоит роль сурфактанта
Медицинские интернет-конференции
Языки
Функции белков сурфактанта в лёгких
Козлов А.Е., Микеров А.Н.
Резюме
Поверхность альвеолярного эпителия в лёгких покрыта сурфактантом, необходимым для обеспечения дыхания и адекватной иммунной защиты. Лёгочный сурфактант состоит из липидов (90%) и ряда белков, имеющих различные функции. Сурфактантные белки представлены белками SP-A, SP-D, SP-B и SP-C. В данном обзоре обсуждаются основные функции сурфактантных белков.
Ключевые слова
Обзор
Лёгкие выполняют две главные функции в организме: обеспечение дыхания и функционирование механизмов иммунной защиты. Корректное выполнение данных функций связано с лёгочным сурфактантом.
Сурфактант в лёгких синтезируется альвеолярными клетками II типа и секретируется в альвеолярное пространство. Сурфактант покрывает поверхность альвеолярного эпителия и состоит из липидов (90 %) и белков (10 %), составляя липопротеидный комплекс. Липиды представлены в основном фосфолипидами. Дефицит и/или качественные изменения состава легочного сурфактанта описаны при туберкулезе, респираторном дистресс-синдроме новорожденных, пневмонии и других заболеваниях. 1.
Сурфактантные белки представлены белками SP-A, (Surfactant Protein A, 5,3%), SP-D (0,6 %), SP-B (0,7 %), и SP-C (0,4%). 4.
Функции гидрофильных белков SP-A и SP-D связаны с иммунной защитой в легких. Эти белки связывают липополисахарид грамотрицательных бактерий и агрегируют различные микроорганизмы, влияют на активность тучных, дендритных клеток, лимфоцитов и альвеолярных макрофагов. SP-A ингибирует созревание дендритных клеток, тогда как SP-D увеличивает способность альвеолярных макрофагов к захвату и презентации антигенов, стимулируя адаптивный иммунитет [7,8].
Функции гидрофобных белков SP-B и SP-C связаны с обеспечением возможности дыхания. Они снижают поверхностное натяжение в альвеолах и способствуют равномерному распределению сурфактанта на поверхности альвеол. [9].
Повреждение и замещение сурфактанта при респираторном дистресс-синдроме взрослых.
Институт проблем хирургии, Сан Антонио, Техас. (e-mail: alershov@e-mail.ru)
Abstract. Yershov AL. Surfactant alteration and replacement in acute respiratory distress syndrome. Review.
Inactivation of pulmonary surfactant may be important in acute lung injury and acute respiratory distress syndrome. Mechanisms of surfactant alterations in ARDS include: 1) lack of surface-active compounds (phospholipids, apoproteins) due to reduced generation/release by diseased type II cells of alveoli or to increased loss of material (this feature includes changes in the relative composition of the surfactant phospholipid and/or apoprotein profiles); 2) inhibition of surfactant function by plasma protein leakage; 3) «incorporation» of surfactant phospholipids and apoproteins into polymerizing fibrin upon hyaline membrane formation; and 4) damage/inhibition of surfactant compounds by inflammatory mediators (proteases, oxidants, nonsurfactant lipids). Treatment of surfactant dysfunction by instilling exogenous surfactants may improve gas exchange and pulmonary mechanics. Surfactants used for treatment vary in their attributes and effects, so when various surfactants are considered for therapy, resistance to inactivation is an important consideration. In addition to the classical goals of replacement therapy defined for preterm infants (rapid improvement in lung compliance and gas exchange), this approach will have to consider its impact on host defense competence and inflammatory and proliferative processes when applied in adults with respiratory failure.
1. Краткие сведения о физиологическая роли сурфактанта в норме и при остром повреждении легких
1. Биологические структуры, схожие с сурфактантом легких, были обнаружены во внутреннем ухе (орган Корти), евстахиевой трубе и в почках. В настоящем обзоре речь идет о сурфактанте легких.
2. Слово «сурфактант» является аббревиатурой английской фразы «поверхностно активное вещество»
3. В англоязычной литературе: acute lung injury ( ALI )
Метаболизм. Сурфактант синтезируется в альвеолоцитах II типа и клетками Клара [59, 40], где он может накапливаться в виде осмиофильных (следовательно, имеющие липидную природу) пластинчатых телец, а затем секретироваться в просвет альвеол путем экзоцитоза (см. рис 1). В ходе секреции изначальная, пространственно «скрученная» структура сурфактанта (имеющая название «пластинчатые тельца»), преобразуется путем «разворачивания» в тубулярный миелин и охватывает в виде монослоя липидов и протеинов внутреннюю поверхность альвеолы на границе сред воздух/жидкость. Синтезируются молекулы фосфатидилхолина преимущественно по цитидил-трифосфатному пути, этот процесс регулируется ферментами фосфорилхолинцитидилтрансфераза и холинфосфотрансфераза. SP гликозилируются 5 в аппарате Гольджи, а затем соединяются с фосфолипидами. В ходе циклических изменений площади внутренней поверхности альвеол, связанных с дыхательными движениями, пленка сурфактанта постепенно разрушается и превращается в небольшие пузырьки (везикулы), которые либо захватываются альвеоцитами II типа для ресинтеза, либо полностью удаляются из респираторной зоны за счет фагоцитоза альвеолярными макрофагами [90, 92]. Синтез новых порций сурфактанта и утилизация везикул происходят достаточно быстро. Однако, если кровоток через какой-то участок легкого прекращается (например, в результате эмболии), то ранее синтезированный сурфактант подвергается быстрому разрушению, а продукция свежих порций приостанавливается [23, 63].
5. Гликозилирование белков основано на способности глюкозы, фруктозы и галактозы вступать в реакции гликозилирования с аминогруппами, входящими в структуру белков, липидов и нуклеиновых кислот.
При центрифугировании в плотных средах сурфактант может быть разделен на две фракции: так называемые «крупные агрегаты» (large aggregates of surfactant, LAs), состоящие из секретированных пластинчатых телец и тубулярного миелина, а также на фракцию с меньшей плотностью, названную «малыми агрегатами» сурфактанта (small aggregates of surfactant, SAs), представленную везикулярными образованиями. В то время, как крупные агрегаты (LAs) содержит SP и обладает ценными биофизическими свойствами в здоровых легких, малые агрегаты (SAs) содержит незначительное количество SP и в опытах проявляет слабо выраженную биологическую активность как in vivo, так и in vitro [8].
При патологических процессах в легких в респираторных зонах могут появляться другие ферменты (отличающиеся от конвертазы), также способные инициировать превращение LАs
Функция. Как указывалось выше, основная функция сурфактанта – снижение сил поверхностного натяжения на внутренней стенке альвеолы в зоне взаимодействия сред воздух/жидкость.
Поверхностным натяжением называется сила, измеряемая обычно в динах, действующая в поперечном направлении на воображаемый отрезок длиной 1 см на поверхности жидкости. Эта сила обусловлена тем, что межмолекулярное сцепление внутри жидкости гораздо сильнее, чем на границе ее раздела с газом. Поэтому всегда имеет место однонаправленный процесс к максимальному уменьшению поверхности жидкости. Хорошим примером этого явления служит образование мыльных пузырей. Их стенки стремятся максимально сократиться, и в результате образуется сферическая поверхность, площадь которой при данном объеме минимальна. Внутри такого пузыря действует давление, равное по закону Лапласа 



При отсутствии механизмов противодействия силам поверхностного натяжения, величина 
Механизм воздействия сурфактанта на поверхностное натяжение заключается в следующем. Образование тонкого слоя сурфактанта на жидкости, покрывающей наружную поверхность альвеолярного эпителия, определяется неоднородными физико-химическими свойствами молекул ДПХФ, обладающих как гидрофобными, так и гидрофильными окончаниями. Действующие между ними силы молекулярного отталкивания противодействуют силам притяжения между молекулами воды, обуславливающими поверхностное натяжение. Его уменьшение при снижении площади поверхности объясняется более плотным примыканием друг к другу молекул ДПФХ, за счет чего сила взаимного отталкивания между молекулами становится больше.
Коллабированию альвеол могут сопутствовать или предшествовать явления легочного отека, обусловленного как повышением гидростатического давления, действующего перпендикулярно альвеолярно-капиллярному барьеру, так и повышением порозности альвеолярно-капиллярной стенки [54].
Сурфактант начинает синтезироваться у плода человека в достаточных количествах на 27-29 неделе внутриутробного развития. При рождении недоношенного ребенка на более ранних сроках беременности отсутствие сурфактанта приводит к резкому возрастанию сил поверхностного натяжения в альвеолах, что значительно повышает энерготраты во время дыхания и способствует быстрой утомляемости дыхательной мускулатуры. В этой ситуации обычно возникает необходимость в проведении ИВЛ, однако, её применение в ряде случаев может вызвать дальнейшее ухудшение ситуации за счет вентилятор-индуцированной травмы легких. В указанной ситуации применение экзогенного сурфактанта является патогенетически оправданным методом лечения и способно повысить эффективность ИВЛ, а также уровень выживаемости среди недоношенных новорожденных.
При нормальном функционировании мукоцилиарного клиренса сурфактант также способствует удалению инородных микрочастичек, попавших со вдыхаемым воздухом в просвет альвеолы [70, 18].
Изменения в системе сурфактанта при повреждении легких
Анализ бронхоальвеолярной лаважной жидкости (БАЛЖ), полученной у больных РДСВ, а также в экспериментальных моделях, всегда выявляет наличие выраженных изменений в системе эндогенного сурфактанта [21, 95, 86]. В частности, описано снижение уровня ДПФХ, фосфатидилглицерола, сурфактант-ассоциированных протеинов [54]; установлено изменение пропорций между вариантами агрегатов сурфактанта: снижение функционально активной (LA) и повышение неактивной (SA) фракции [66].
При РДСВ изменяются и физиологические свойства сурфактанта: он теряет эластические свойства, быстрее разрушается в ходе циклических растяжений в процессе дыхания и в меньшей степени воздействует на силы поверхностного натяжения внутри альвеолы [62]. В самое последнее время были опубликованы данные, свидетельствующие о высокой предрасположенности к развитию РДСВ у лиц, имеющих структурные, генетически детерминированные, изменения в SP-В [ 25, 56 ]. Интересно, что эта генетическая предрасположенность к РДСВ в большей мере свойственна женщинам [25 ]. Возможно, эти данные объясняют известный факт, что АRDS развивается лишь у сравнительно небольшой части больных, имеющих один или даже сочетание нескольких факторов риска возникновения этой тяжелой патологии.
2. Терапия препаратами экзогенного сурфактанта при остром повреждении легких
и респираторном дистресс-синдроме взрослых.
За последние два десятилетия опубликовано большое количество весьма противоречивых данных по эффективности применения экзогенного сурфактанта у больных ОПЛ и РДСВ [74, 75, 29, 30, 36]. Большей частью это описания отдельных наблюдений или исследования в небольших группах больных и экспериментальных моделях [70, 30]. До настоящего момента было проведено явно недостаточное число контролируемых рандомизированных клинических исследований эффективности экзогенного сурфактанта при РДСВ, отвечающих современным стандартам [1, 27, 74, 49, 50].
В одном из таких немногих исследований [1] синтетический сурфактант “Exosurf” (GlaxoSmithkline, США; 13,5 мг/мл ДПФХ) вводился больным в виде аэрозоля в дозе 112 мг/кг/день на протяжение 5 дней. Исследование было проведено на 725 пациентах с РДСВ на фоне сепсиса. В ходе применения влияния “Exosurf” статистически значимого уменьшения количество дней, проведенных без ИВЛ в течение первых 28 суток заболевания, и снижения уровня летальности выявить не удалось. Процент умерших больных оказался равным в исследуемой и контрольной группах (по 41%).
Еще одно достаточно крупное исследование было связано с клиническим испытанием рекомбинантного сурфактанта “Venticute” (Byk Pharmaceuticals, Германия). Предварительная апробация препарата на небольшой группе пациентов с РДСВ продемонстрировала вполне обнадеживающие результаты [75]. В связи с этим, в 2001 году был проведен расширенный этап клинических испытаний “Venticute” [74]. Исследование проводилось параллельно в США, Европе и в Южной Африке. Доза препарата составила 200 мг/кг в расчете на фосфолипиды. В отчетах всех стран-участниц международного эксперимента в результате применения “Venticute” было отмечено статистически значимое улучшение оксигенации, однако достоверных изменений в уровне летальности и сроках пребывания больных на ИВЛ получить не удалось. Однако, при последующем обобщающем анализе всего собранного материала, полученного в ходе лечения и наблюдения 448 пациентов, было установлено, что пациенты со вторичным вариантом РДСВ, т.е. возникшем на фоне предшествующего бактериального или химического поражения легких (пневмония, аспирация), после проведения лечения “Venticute” имели статистически значимое снижение уровня летальности. Одновременно это достаточно широкое и хорошо контролируемое исследование показало клиническую приемлемость метода терапии экзогенным сурфактантом, а также отсутствие серьезных осложнений в ходе использования “Venticute” для больных РДСВ. Последнее обстоятельство подтвердило данные о безопасности экзогенного сурфактанта для больных РДСВ, полученные ранее в других исследованиях [91].
Можно предполагать, что результаты проведенной работы выглядели несколько обескураживающими для производителей “Venticute” и организаторов международного исследования. Однако, отсутствие убедительного снижения летальности и сроков пребывания больных на ИВЛ вовсе не следует однозначно трактовать как проявление полной неэффективности препаратов экзогенного сурфактанта. Скорее эти результаты указывают на необходимость более глубокого изучения всех сложных механизмов, вовлеченных в патогенез РДСВ, а также на недостаточный учет в ходе эксперимента различных внешних и внутренних факторов, влияющих на эффективность терапии сурфактантом. То есть, требуется более рациональный и индивидуальный подход к применению препаратов данной группы [49].
Понимание необходимости оптимизировать назначение коммерческих препаратов сурфактанта при РДСВ закономерно привело к поиску обстоятельств, повышающих или снижающих эффективность данного вида терапии. В настоящее время среди этих разнообразных факторов наиболее значимыми представляются:
Патогенетические особенности развития РДСВ
Под собирательным понятием «РДСВ» в настоящее время объединены схожие клинические проявления, возникающие при очень неоднородных по этиопатогенезу заболеваниях и патологических состояниях. Вот только беглое и далеко неполное перечисление причин, способных привести к возникновению РДСВ [19, 67, 82, 57]:
Pelosi P. с соавт. в недавно опубликованном обзоре [67], а также в своей более ранней работе [22] подчеркивает целесообразность выделения как минимум двух вариантов РДСВ: 1) возникающего вследствие прямого повреждения легких (pulmonary ARDS, ARDSp) и 2) представляющего собой вторичный процесс как следствие тяжелого внелегочного патологического состояния ( extrapulmonary ARDS, ARDSexp). В упомянутом обзоре обоснована правомерность такого подхода на примере объективно существующих различий, касающихся патофизиологии развития этих двух форм ARDS, путей биохимической и иммунной активации патологических процессов в легких; отличий морфологических, гистологических и рентгенологических данных, полученных в этих подгруппах больных, а также отмечена целесообразность дифференцировать подходы к выбору режимов ИВЛ, защищающих легкие и индивидуализировать проведение лекарственной терапии.
Схожий подход к выделению двух вариантов РДСВ содержится и в работе корейских исследователей [55]. Так, например, они установили, что показатель PaO2/FIO2 при проведении ИВЛ в положении лежа на животе у больных ARDSexp улучшался на 63% за 30 минут, в то время как у больных ARDSp этот показатель вырос лишь на 23% и на это ушло 2 часа.
С учетом впечатляющего разнообразия причин, вызывающих РДСВ и вариабельности ответа в разных подгруппах пациентов на проводимое лечение (даже на положение туловища больного при ИВЛ), сложно рассчитывать на однородные результаты при унифицированном, недифференцированном подходе к назначению экзогенного сурфактанта. Подтверждением этому может служить сообщение Seeger W. с соавт. [72 ] о достоверно меньшей летальности при применении экзогенного сурфактанта больным с первично-легочной формой РДСВ ( ARDSp ).
Следует отметить, что стремление к выделению патофизиологических вариантов РДСВ появилось сравнительно недавно и поддерживается не всеми специалистами, работающими в данной области. Весьма критичное отношение к такому подходу изложено в работе Callister M.E. и Evans T.W. [10], которые считают, что выделение различных форм РДСВ требует более взвешенного подхода и должно опираться, в числе прочих показателей, на различия в уровне летальности в подгруппах больных.
Особенности качественного состава экзогенного сурфактанта
Характеристика некоторых коммерческих препаратов сурфактанта, производимых в настоящее время представлена в таблице 1. Обобщение опубликованных данных, по использованию различных вариантов экзогенного сурфактанта при РДСВ, позволяет сделать следующие выводы: более высоким терапевтическим эффектом обладают протеин-содержащие лекарственные формы [79, 73], а внутри этой группы препаратов – изготовленные на основе БАЛЖ [49]. Так, например, применение препарата “bLES” (Канада), исходным сырьем для которого служит БАЛЖ крупного рогатого скота, в экспериментальной модели приводило к более значимому улучшению газообмена, по сравнению с препаратом “Survanta” (США), изготовленным из легочной ткани крупного рогатого скота [50] Следует отметить, что эти два препарата существенно отличаются по содержанию липидов (см табл. 1). Это обстоятельство, по-видимому, также может сказываться на эффективности их применения.
Кроме различий в содержании липидов, терапевтическую эффективность экзогенного сурфактанта может определять концентрация SP, особенно – SP-B и SP-C. Сравнительно недавно проведенные эксперименты на животных показали вполне сопоставимую терапевтическую эффективность при РДСВ экзогенного сурфактанта “Venticute” (Германия), содержащий рекомбинантный SP-C в сочетание c ДПФХ и другими липидами, и “bLES”, основанного на липидной вытяжке из натурального сурфактанта крупного рогатого скота [31].
В тоже время при применении препаратов экзогенного сурфактанта, изготовленных на основе биологического сырья, необходимо учитывать теоретическую возможность переноса патогенных микроорганизмов, что практически исключено при использовании синтетических заменителей сурфактанта. По-видимому, вероятность заражения препаратами экзогенного сурфактанта весьма незначительная, описания подобных случаев в доступной литературе не нашлось. Основной технологической проблемой получения препаратов экзогенного сурфактанта животного происхождения является определенный дефицит сырья, однако появление синтетических аналогов с хорошими терапевтическими свойствами позволяет обойти это препятствие.
Способы введение сурфактанта и его дозировка
Различные методики применения сурфактанта преследуют общую цель – доставить адекватную дозу препарата в альвеолы без сопутствующего существенного угнетения дыхательной функции легких и ухудшения общего состояния больного. В настоящее время в клинической практике и в экспериментальных моделях используются следующие основные способы назначения сурфактанта:
Каждый из представленных способов имеет свои преимущества и недостатки, однако, медленное (капельное) введение препарата через катетер, установленный в эндотрахеальной трубке по мнению одного из крупнейших специалистов в этой области Lewis JF [49] является методом выбора для больных с достаточно тяжелыми вариантами РДСВ. Эта рекомендация обосновывается легкостью применения указанного способа и возможностью ввести значительные объемы сурфактанта за сравнительно небольшой период времени. В качестве альтернативы капельному введению сурфактанта у больных с умеренно выраженными формами ОПЛ и РДСВ может быть рекомендовано назначение аэрозольных форм препарата [51] . Недавно в Японии было проведено экспериментальное исследование [16], оценивавшее возможность пролонгировать действие аэрозоля экзогенного сурфактанта за счет последующего (через 15 минут) назначения аэрозоля декстрана. На экспериментальной модели РДСВ авторам работы удалось показать, что ингалированный декстран в просвете альвеол способен предотвращать ингибирование белками плазмы экзогенного сурфактанта и приводит к достоверному продлению его клинического эффекта.
Терапевтическая и экономическая эффективность различных способов применения коммерческих форм сурфактанта в настоящее время находится в стадии изучения.
Влияние проводимой ИВЛ. Многочисленные экспериментальные и клинические исследования, проведенные в последнее десятилетие указывают на достаточно сложное взаимодействии различных режимов ИВЛ и экзогенного легочного сурфактанта [88, 39, 41, 42, 87]. Значительная часть экспериментальных работ свидетельствует о том, что назначение экзогенного сурфактанта на фоне проведения «защитной» стратегии ИВЛ приводит не только к более заметному улучшению газообменной функции поврежденных легких, но и сопровождается выраженными изменениями в метаболизме легких и показателях легочной механики [35]. Так, например, на экспериментальной модели РДСВ было установлено, что во время прессоциклической ИВЛ с высоким пиковым давлением вдоха (PIP) введение экзогенного сурфактанта “bLES” (100 mg/kg) способно существенно повышать уровень TNF- a и IL- d в перфузате, оттекающем от легких; однако этот эффект не был связан с активацией альвеолярных макрофагов, а скорее определялся раскрытием ранее ателектазированных альвеол и перерастяжением альвеоцитов. Комментируя это сообщение можно заключить, что авторы описывают достаточно хорошо известную ателектотравму легких. Тем не менее, несмотря на подъем концентрации провоспалительных цитокинов, в ходе использования “bLES” были отмечены улучшение легочного комплайнса и повышение дыхательного объема [76].
Интересно, что применение препарата « Alveofact» (препарат, близкий к « Survanta») в дозе 60 mg/kg у двухлетней девочки, с РДСВ на фоне инфекционной внелегочной патологии, оказало на концентрацию цитокинов прямо противоположный эффект: артериовенозная разница по TNF- a и IL- d у ребенка снизилась за счет артериального компонента. Этот эффект авторы наблюдения [80] связали с ингибирующим влиянием экзогенного сурфактанта на активацию полиморфно-ядерных нейтрофилов в сосудистом русле легких. Представленные в этой работе данные хорошо согласуются с рекомендациями Vazquez de Anda GF с соавт. [83] по использованию экзогенного сурфактанта для лечения вентилято-ассоциированной травмы легких в целях снижения концентрации провоспалительных цитокинов.
По-видимому, по аналогии с эндогенным сурфактантом, при проведении «повреждающих» режимов ИВЛ большая часть экзогенного сурфактанта достаточно быстро теряет свои свойства за счет конверсии LAs
Выбор времени начала терапии экзогенным сурфактантом больных РДСВ
К настоящему времени стало вполне очевидным, что в тех случаях, когда РДСВ является составной частью тяжелой полиорганной патологии, назначение препаратов указанной группы малоэффективно [49].
К сожалению, в доступной литературе отсутствует информация по целесообразности профилактического назначения экзогенного сурфактанта у больных с высоким риском развития РДСВ. Экспериментальные и клинические данные по выбору оптимальных сроков начала терапии экзогенным сурфактантом немногочисленны и сводятся к рекомендациям по возможно более раннему применению препаратов, уже на начальных стадиях развития РДСВ [68, 44, 39]. Также было показано, что на более поздних стадиях развития РДСВ при назначении экзогенного сурфактанта более целесообразно использовать бронхоскопический путь введения препарата с предшествующим проведением бронхоальвеолярного лаважа [24].
3. Перспективные направления в изучении терапевтической роли
препаратов экзогенного сурфактанта при патологии легких.
Несмотря на сравнительно скромные результаты, полученные в ходе проведения рандомизированных исследований по использованию экзогенного сурфактанта у больных с РДСВ, препараты этой группы продолжают оставаться весьма перспективными для клинического применения. Представляется, что повышение терапевтической эффективности уже созданных препаратов сурфактанта будет лежать через индивидуализацию дозы и оптимизацию сроков начала терапии.
Вероятно, в перспективе заслуживает более подробного изучения целесообразность профилактического применения препаратов данной группы у лиц с высоким риском развития РДСВ.
Заслуживает внимания сочетанное применение экзогенного сурфактанта и других лекарственных средств, в частности – антибиотиков, при лечении пневмонии. Пока немногочисленные данные позволяют предположить, что такая комбинация у больных с пневмонией, нуждающихся в ИВЛ, снижает риск возникновения некоторых побочных эффектов при введении антибиотиков через дыхательные пути. Кроме того, это сочетание позволяет более эффективно «доставлять» антибактериальные препараты к коллабированным альвеолам в зоне активного воспалительного процесса [34]. По-видимому, этот эффект достигается за счет облегчения процессов рекрутирования ателектазированных альвеол под влиянием экзогенного сурфактанта и последующего вовлечения ранее коллабированных участков легких в дыхательный цикл.
Подводя итог, следует сказать, что, несмотря на достаточно длительный срок промышленного производства, терапевтический потенциал препаратов экзогенного сурфактанта использован еще далеко не полностью. Можно прогнозировать, что с учетом высокой уязвимости эндогенного сурфактанта как при первичных процессах внутри легких, так и при вторичных повреждениях на фоне ведущей патологии других органов, интерес к этому методу лечения будет закономерно возрастать. Немаловажное обстоятельство – высокая распространенность (и, соответственно, социальная значимость) синдрома ОПЛ, при котором терапевтическое применение экзогенного сурфактанта продолжает считаться одним из наиболее перспективных направлений. По последним данным в США частота возникновения ОПЛ составляет 64,2 случая на 100 тыс населения (что, к слову, не отличается от данных по развивающимся странам), а уровень летальности составляет 40% [32, 26].
Повышению эффективности лечения с использованием препаратов сурфактанта будет способствовать дальнейшее накопление знаний о его биологической роли и совершенствование подходов к клиническому применению.
Таблица 1
Названия, состав и фирмы-производители некоторых коммерческих форм сурфактанта, допущенных для применения в ходе лечения ARDS (цитируется с дополнениями по Lewis JF, 2003).
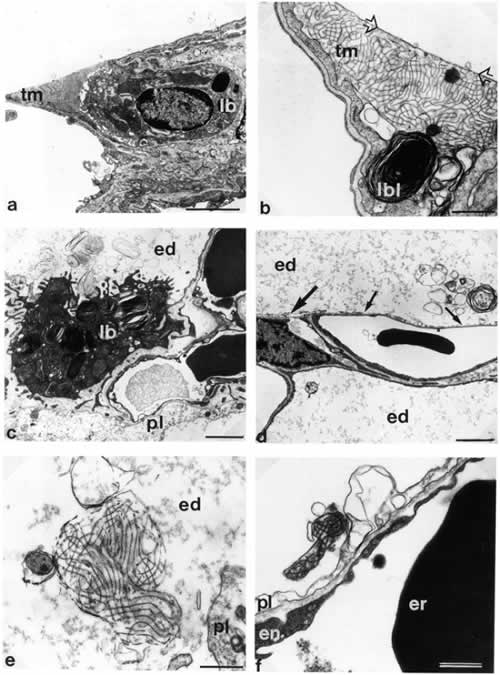
Рисунок 1.
Микрофотографии альвеолоцитов II типа и вариантов внутриальвеолярного сурфактанта у крысы в здоровых легких (a, b) и при эксприментальном отеке легких (с-f).
а) Нормальная ультраструктура альвеолоцита II типа. Обозначены: внутриклеточный сурфактант, храняшийся в ламеллярных тельцах (lb), внутриклеточный миелин ™. Шкала в правом нижнем углу = 2 µm.
b) Тубулярный миелин ™ плотно контактирует с клеточной мембраной, примыкающей как к базальной мембране (стрелки), так и граничащей с просветом альвеолы. lbl – ламеллярные тельца. Шкала = 0,5 µm.
c) Фокальный внутриальвеолярный отек. Набухание альвеолоцитов I типа (pI). Альвеолоцит II типа с незначительным набуханием митохондрии и ламеллярными тельцами обычных размеров (lb). Различные формы сурфактанта в просвете альвеолы (в отечной жидкости): напоминающие ламеллярные тельца, мультламеллрные, униламиллярные. Шкала = 2 µm.
d) Альвеолярная стенка с частичным набуханием (толстая стрелка) и фрагментацией (тонкая стрелка) альвеолоцита I типа. Просвет альвеолы заполнен отечной жидкостью (ed). Мультиламеллрные и униламеллярные формы сурфактанта. Шкала = 2 µm.
e) Тубулярный миелин в просвете альвеолы (в отечной жидкости), признаки его дезинтеграции. pI = набухание альвеолоцита I типа. Шкала = 0,5 µm.
f ) Дезинтеграция тубулярного миелна в той же модели, но зонах легких без внешних признаков отека: pI = набухание альвеолоцита I типа; en = эндотелий капилляра; er = эритроцит. Шкала = 0,5 µm.
(Цитируется с разрешения автора по Ochs M et al. Am. J. Respir. Crit. Care Med. 1999 160(2): 718-24)