в чем содержится таллий
Отравление таллием
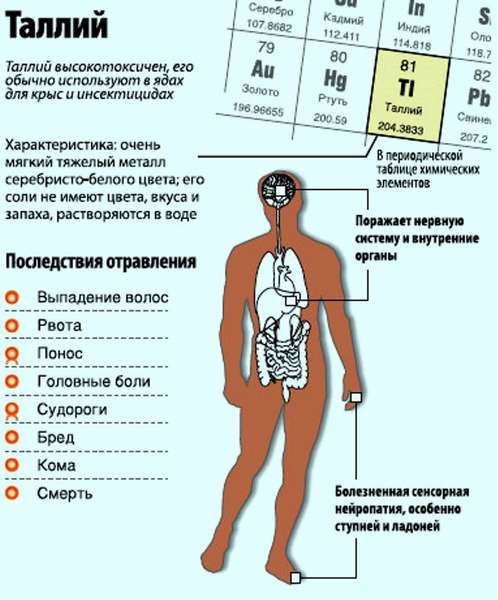
Таллий является редко встречающимся металлом на Земле. Но случаи отравления им не так уж и редки. Отравление таллием протекает тяжело, зачастую приводит к летальному исходу. Сравнить по токсичности можно со свинцом и мышьяком, опасен, как и кристаллический фенол. Более токсичен, чем ртуть, находящаяся перед таллием в таблице Менделеева. Следует познакомиться поближе с этим опасным металлом.
Каковы же его свойства и характеристики?
У вещества порошковая консистенция, бело-серебристой расцветки. Применяется обширно, особенно находясь в составе противоядий от грызунов. Для проведения радиологического обследования сердца используются соли таллия, а также сульфат таллия, как и в роли катализатора для фейерверков и в изготовлении оптических линз.
Этот химический элемент располагается в третьей группе таблицы Менделеева и имеет голубой оттенок. Бывает он одно- и трёхвалентным, более токсичным ядом считается одновалентный элемент. В природе он присутствует мало и не концентрированно, потому добывают его при обработке и добыче солей тяжёлых металлов (например, из свинца). В жирной и водной среде соединения таллия практически не растворяются.
Существует таллий в следующих состояниях:
Также этот элемент встречается в человеческом организме, роль его полноценно еще не изучена. Ученые предполагают, что в организм он попадает вместе с растительной пищей. Содержится он также в:
Оксид таллия, как и прочие его соединения, распределяется по организму равномерно. Меньше всего его в кишечнике, волосяном покрове и зубах, в большом объеме отмечается в жировых тканях, чуть больше в мышцах и жирах. Гидроксид таллия или в другой форме в организме должен быть в пределах 0,1 мг, норма повышается до 0,5 мг при большой мышечной массе.
Какова токсикогенетика этого вида отравления?
Острое отравление таллием может произойти из-за намеренного и случайного попадания в организм больших порций солей металла. Парами и пылью металлов можно получить повреждения дыхательной системы, поражение происходит и при контактах с кожным покровом.
Ядам легко впитываться в кровь, и большая часть оседает в сердечных мышцах, почках, слюнных железах и печени. Сравнительно малой являются отложения в мозге и жировых тканях. Выводится элемент в основном через желудок. Около месяца составляет срок полувыведения яда.
Как же происходит интоксикация?
Отравление солями таллия опасно тем, что он способен не только нарушать структуру клеток, но также и накапливаться в ней. Он способен изменять свойства молекул, так как способен взаимодействовать с различными энедогенными лигандами. Также он может образовывать связи с низкомолекулярными соединениями. Накапливаясь в клетках кожи, вещество поражает их.
Оксид таллия, находясь в организме, выбирает мишенью транспортные системы биомембран, работу ферментов, а также структурные белки. Повреждения происходит также и лизосом, эндоплазматического ретикулума. Механизмы работы биологически активных веществ нарушаются.
Каковы же симптомы?
Отравление таллием происходит при употреблении веществ с содержащимся таллием в количестве более 1 грамма. Летальный исход наступает при приёме дозы в 600 мг. Есть разница во временных рамках проявления симптоматики отравлений, как хронических, так и острых, но можно отследить и общие схожие проявления.
В течение первых 3-4 часов могут проявиться первые симптомы:
В течение следующих 7 суток поражается нервная система, проявляется это в следующих симптомах:
Гидроксид таллия и прочие соли также со временем вызывают нарушения в работе всех систем организма.
Если отравление в хронической стадии, то симптоматика весьма расплывчата, проявиться может на последних стадиях. В основном присутствуют нарушения функционирования желудочно-кишечного тракта. Такое состояние характеризуется следующей симптоматикой:
Как диагностировать?
Чтобы получить информацию о наличии таллия в организме, нет смысла использовать рентген, так как он в данном случае незаметен, используется для диагностирования рентгенограмма. При попадании в организм этого вещества в значительных дозах, его концентрация варьируется в пределах 300-2000 мкг/л, а экскреция за сутки превосходит 10-20 мкг. Оксид таллия в организме также можно заметить при помощи электроэнцефалограммы, заметные небольшие изменения, также в периферических нервах замедляется нервная проводимость.
Варианты лечения
В желудке и кишечнике таллий впитывать помогает прусский голубой, который в кристаллической решетке заменяет таллий калием, благодаря чему он не всасывается в кровь. Употребить нужно 250 мг/кг однократно. Для очищения желудка применяют цитрат магния или маннитол (в качестве слабительных препаратов).
Последствия отравления и профилактические меры
Оксид таллия в организме сверх нормы может привести к тяжелым последствиям, а также нарушить нормальное функционирование организма. Необходимо избегать прямых контактов с веществами, которые содержат в своем составе гидроксид таллия или другие его производные.
Интоксикация имеет не разовые последствия, а более серьезные, ведь таллий очень токсичен. Развиться может бесплодие, число врожденных пороков, импотенция, гормональные нарушения и нарушения психики, хроническими заболеваниями дыхательной системы и желудочно-кишечного тракта. Летальный исход возможен от инфаркта или же инсульта.
Если подвести итоги, то отравление таллием, как высокотоксичным элементом, очень опасно. Отравиться можно не только в производственных условиях, но и в бытовых. Все системы в организме разрушаются под его воздействием, особенно страдает нервная и мышечная системы.
Лечение необходимо начинать сразу же. В первую очередь необходимо ввести прусскую синь, эффективный антидот. Также следует всегда осуществлять профилактические меры и осторожность, особенно на производстве.
Видео
Насколько тяжелым может быть отравление таллием? Ответ на этот вопрос вы найдете, посмотрев видеосюжет.
Это вещество – самый популярный химический элемент в художественной литературе. Именно таллием убивают друг друга персонажи детективов Агаты Кристи. Его, как и мышьяк, окрестили «ядом наследников».
Однако вещество востребовано металлургами, врачами, учеными.
Что представляет собой
Таллий – это элемент периодической системы №81 с примечательными свойствами:
Главная характеристика таллия – токсичное вещество номер один на планете.
Есть и радиоактивные изотопы. Для их полураспада хватает пяти минут, созданы лабораторно.
Международное обозначение – Thallium (Tl).
Как был обнаружен
История открытия металла связана с именами двух ученых, обнаруживших его одновременно (1861-1862 годы):
Металл назван благодаря зеленой окраске линий спектра и пламени. По этому параметру опознается среди других элементов.
Древнегреческий термин θαλλος означает «зеленая веточка».
Как представлен в природе
Месторождений таллия на планете не существует: элемент рассеян по толще других пород либо образует собственные минералы.
Его находят в разных локациях:
Таллиевые минералы (семь наименований) – редкость.
Тонна земной коры содержит 0,7 г таллия.
Технология получения
Таллий как металл извлекают из пыли, выносимой доменными газами на металлургических комбинатах. Главные компоненты – железо и известняк. Плюс толика никеля, цинка, кадмия, индия. А также астата, теллура, свинца, других элементов.

Процесс производства многоступенчат:
Далее применяют электролиз:
Металл получают плавкой в печи, заполненной водородом, при 360-410°С.
Физико-химические характеристики
Таллий – не совсем типичный металл. Кристаллическая структура меняется в зависимости от температуры. Модификаций три, « рубиконом » служат температуры 234°C и 25°C.
При минус 270,7°C металл становится сверхпроводником.
Кубик таллия с ребром 1 см весит 11,85 грамма.
| Свойства атома | |
|---|---|
| Название, символ, номер | Та́ллий / Thallium (Tl), 81 |
| Атомная масса (молярная масса) | [204,382; 204,385] а. е. м. (г/моль) |
| Электронная конфигурация | [Xe] 4f14 5d10 6s2 6p1 |
| Радиус атома | 171 пм |
| Химические свойства | |
| Ковалентный радиус | 148 пм |
| Радиус иона | (+3e) 95 (+1e) 147 пм |
| Электроотрицательность | 1,62 (шкала Полинга) |
| Электродный потенциал | Tl←Tl+ −0,338 В Tl←Tl3+ 0,71 В |
| Степени окисления | 3, 1 |
| Энергия ионизации (первый электрон) | 588,9 (6,10) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 11,849 г/см³ |
| Температура плавления | 577 K (304 °C, 579 °F) |
| Температура кипения | 1746 K (1473 °C, 2683 °F) |
| Уд. теплота плавления | 4,31 кДж/моль |
| Уд. теплота испарения | 162,4 кДж/моль |
| Молярная теплоёмкость | 26,3 Дж/(K·моль) |
| Молярный объём | 17,2 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | гексагональная |
| Параметры решётки | a=3,456 c=5,525 |
| Отношение c/a | 1,599 |
| Температура Дебая | 96,00 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 38,9 Вт/(м·К) |
| Номер CAS | 7440-28-0 |
Где используется
Металл нашел применение у промышленников, ученых, врачей:
Хранят таллий под слоем кипяченой воды, парафина либо в герметично закрываемой емкости.
Таллий в истории отравлений
Историей зафиксировано два громких криминальных инцидента с таллием в «главной роли».
Таллиевое безумие в Австралии
Внимание к себе привлекла жительница Сиднея Ивонна Флетчер. Эта мать двоих детей обрела репутацию «черной вдовы»: оба ее мужа умерли с одинаковыми симптомами. Вину и средство убийства (таллий из крысиного яда) доказали.
«Мститель» из Таганрога
Место и время действия – авиазавод в Таганроге (Ростовская область, Россия), 2017-2018 годы.
Инженер Шульга, «обидевшись», травил сослуживцев – 34 человека. Он добавлял к закупаемой бутилированной воде – 19-литровые емкости – изготовленное лично вещество.
Все остались живы, но пострадали.
Влияние на человека
Таллий, его соединения отнесены к первому классу опасности. То есть абсолютно токсичны.
По стандартам РФ, кубометр воды не должен содержать больше 0,0001 мг таллия. Кубометр воздуха на специализированных предприятиях – 0,01 мг.
В организм человека металл попадает с пищей, воздухом или через кожу.
Явный признак отравления – выпадение волос. Другие симптомы:
Таллий химический элемент
Таллий (лат. thallium), tl, химический элемент iii группы периодической системы Менделеева, атомный номер 81, атомная масса 204,37; на свежем разрезе серый блестящий металл; относится к редким рассеянным элементам.
Т. открыт в 1861 У. Круксом в шламе сернокислотного производства спектроскопическим методом по характерной зелёной линии в спектре (отсюда название: от греч. thall o s — молодая, зелёная ветка). В 1862 французский химик К. О. Лами впервые выделил Т. и установил его металлическую природу.
Конфигурация внешней электронной оболочки атома tl 6 s 2 6 p 1 ; в соединениях имеет степень окисления +1 [tl (i)] и + 3 [tl (iii)]. Т. взаимодействует с кислородом и галогенами уже при комнатной температуре, с серой и фосфором при нагревании. Хорошо растворяется в азотной, хуже в серной кислотах, не растворяется в галогенводородных, муравьиной, щавелевой и уксусной кислотах.
Закись Т. и соли tl (i) нитрат, сульфат, карбонат — растворимы; хромат, бихромат, галогениды (за исключением фторида), а также окись Т. — малорастворимы в воде. tl (iii) образует большое число комплексных соединений с неорганическими и органическими лигандами.
Галогениды tl (iii) хорошо растворимы в воде. Наибольшее практическое значение имеют соединения tl (i).
Получение. В промышленных масштабах технический Т. получают попутно при переработке сульфидных руд цветных металлов и железа. Его извлекают из полупродуктов свинцового, цинкового и медного производств. Выбор способа переработки сырья зависит от его состава.
Например, для извлечения Т. и др. ценных компонентов из пылей свинцового производства проводится сульфатизация материала в кипящем слое при 300—350 °С. Полученную сульфатную массу выщелачивают водой, и из раствора экстрагируют Т. 50%-ным раствором трибутилфосфата в керосине, содержащим йод, а затем реэкстрагируют серной кислотой (300 г/л ) с добавкой 3%-ной перекиси водорода.
Из реэкстрактов металл выделяют цементацией на цинковых листах. После переплавки под слоем едкого натра получают Т. чистотой 99,99%.
Для более глубокой очистки металла применяют электролитические рафинирование и кристаллизационную очистку.
Применение. В технике Т. применяется, главным образом, в виде соединений. Монокристаллы твёрдых растворов галогенидов tibr — tli и tlcl — tlbr (известные в технике как КРС-5 и КРС-6) используют для изготовления оптических деталей в приборах инфракрасной техники; кристаллы tlcl и tlcl—tlbr — в качестве радиаторов счётчиков Черенкова.
tl 2 o входит в состав некоторых оптических стекол; сульфиды, оксисульфиды, селениды, теллуриды — компоненты полупроводниковых материалов, использующихся при изготовлении фотосопротивлений, полупроводниковых выпрямителей, видиконов. Водный раствор смеси муравьино- и малоновокислого Т. (тяжёлая жидкость Клеричи) широко применяют для разделения минералов по плотности. Амальгама Т., затвердевающая при –59 °С, применяется в низкотемпературных термометрах. Металлический Т. используют для получения подшипниковых и легкоплавких сплавов, а также в кислородомерах для определения кислорода в воде.
 |
 |
| Кристалическая структура: гексагональная |
У человека ежесуточное поступление Т. с продуктами питания и водой составляет около 1,6 мкг, с воздухом — 0,05 мкг. Биологическая роль Т. в организме не выяснена. Умеренно токсичен для растений и высоко токсичен для млекопитающих и человека.
Отравления Т. и его соединениями возможны при их получении и практическом использовании. Т. проникает в организм через органы дыхания, неповрежденную кожу и пищеварительный тракт.
Выводится из организма в течение длительного времени, преимущественно с мочой и калом. Острые, подострые и хронические отравления имеют сходную клиническую картину, различаясь выраженностью и быстротой возникновения симптомов. В острых случаях через 1—2 сут появляются признаки поражения желудочно-кишечного тракта (тошнота, рвота, боли в животе, понос, запор) и дыхательных путей. Через 2—3 нед наблюдаются выпадение волос, явления авитаминоза (сглаживание слизистой оболочки языка, трещины в углах рта и т.
д.). В тяжёлых случаях могут развиться полиневриты, психические расстройства, поражения зрения и др. Профилактика профессиональных отравлений: механизация производственных процессов, герметизация оборудования, вентиляция, использование средств индивидуальной защиты.
Лит.: Химия и технология редких и рассеянных элементов, под ред. К. А. Большакова, т. 1, [М., 1965]; 3еликман А. Н., Меерсон Г. А., Металлургия редких металлов, М., 1973; Таллий и его применение в современной технике, М., 1968; Тихова Г.
С., Дарвойд Т. И., Рекомендации по промышленной санитарии и технике безопасности при работе с таллием и его соединениями, в сборнике: Редкие металлы, в. 2, М., 1964; Воwen Н. y. М., trace elements in biochemistry, l.—n. y., 1966.
Израэльсон З. И., Могилевская О. Я., Суворове. В. Вопросы гигиены труда и профессиональной патологии при работе с редкими металлами, М., 1973.
Физико-химические свойства таллия и его соединений
Таллий представляет собой серебристо—белый мягкий металл, который был открыт спектроскопическим методом в 1861 г. W.Grookes и независимо от него A.. Lamy в 1862 г. по характерной зеленой пинии в спектре (tallos — зеленая почка). Химические свойства таллия определяются его принадлежностью к побочной группе a-переходных металлов III группы элементов таблицы Менделеева.
Атомный вес таллия 204,39, атомный номер 81, плотность 11,85 г/см°. Температура плавления 303 С, температура кипения 1460°С.
Упругость паров таллия при температуре 825°С — 1, при 983 С — 10, при 1040°С — 20. при 1457°С — 760 мм-рт. ст. В химических соединениях он выступает как одновалентный или трехвалентный металл, образуя два рода соединений — закисные и окисные. На воздухе таллий покрывается пленкой закиси; при 100°С быстро окисляется с образованием TI2O и Tl2O3. С хлором, бромом и йодом реагирует при комнатной температуре. При взаимодействии со спиртами образует алкоголяты.
Легко растворяется в HNO3, Существуют соли и одно- и трехвалентного таллия (В.К. Григорович, 1970). Таллий является редким рассеянным элементом. Характер распределения его в природе определяется близостью по химическим свойствам и размерам ионных радиусов к щелочным металлам, а также к калькофильным элементам.
Промышленное значение как источники сырья для получения таллия имеют товарные концентраты сульфидов (сфалерит, галенит, пирит и марксцит). Таллий не извлекается непосредственно из руд и концентратов, содержащих его в количествах не выше тысячных долей процента.
Сырьем для промышленного его получения служат отходы и полупродукты производства цветных металлов. Содержание таллия в этих материалах колеблется в значительных пределах (от сотых допей процента до целых) и зависит не только от содержания таппия в исходном сырье, но и от характера производства и принятой технологии получения основного металла.
Таким образом, извлечение таллия связано с комплексной переработкой сырья и осуществляется попутно с получением других металлов. При низкой концентрации таллия в перерабатываемом cырье технология его производства на первой стадии сводится обычно к получению концентрата таппия, который затем перерабатывается на технический металл или его сопи.
В Советском Союзе производство таллия организовано на ряде свинцовых и цинковых заводов (Т.И. Дарвойд с соавт., 1968).
Окислы таллия
| Цвет | Черная с различными оттенками | Бурая и черная |
| Плотность | 9,52 | 9,56 и 10,0 |
| Температура плавления | ||
| Температура кипения | ||
| Теплота образования |
Захись и окись таллия при повышенных температурах возгоняются.
Окись в воде не растворяется, при нагревании диссоциирует; закись легко растворяется в воде с образованием сильной щелочи — Tl(OH), с этиловым спиртом образует алкоголят (C2H5)TlO.
ТlO взаимодействует с Si02, разъедая стекло и фарфор. Гидроокись — Тl(OН)3 — осаждается щелочами из растворов солей трехвалентного таллия, в воде она не растворяется и медленно растворяется в минеральных кислотах.
Соли таллия
Галоидные соединения. Таллий образует с хлором, бромом и йодом одновалентные и трехвалентные соединения, но применяются пока в основном одновалентные.
ст.) при температуре
645°- 100
807°- 760
663°- 100
823°- 760
Характерными свойствами этих соединений являются низкая растворимость в воде, значительная упругость паров, повышенная светочувствительность.
Галоидные соли таллия обычно получают осаждением из водных растворов его солей. В качестве осадите лей используют галоидные соли калия и натрия.
Сухой хлорид таллия представляет собой порошок белого цвета, бромид имеет светло-желтый, а йодид ярко-желтый цвет; плавленый же хлорид таллия бесцветен, а бромид и йодид окрашены в те же цвета, что и порошки.
Галоидные соли таллия мало растворимы в спирте, ацетоне и бензине; кислоты (азотная и серная) растворяют галоидные соли, особенно при нагревании, с частичным разложением их.
Сульфат таллия. TI2SO4-белое кристаллическое вещество, растворимое в воде (при 20 С-48,7 г/л), с сульфитами других металлов образует двойные соли, температура плавления 645°С.
Карбонат таллия — углекислый закисный таллий — TI2CO3 — кристаллический порошок белого цвета. Молекулярный вес 468,75; мало растворим в холодной воде и хорошо растворяется в кипящей.
Водный раствор имеет сильно щелочную реакцию, температура плавления 272-273°С, при плавлении образуется красно-коричневая масса, которая после охлаждения приобретает желтый цвет.
Молекулярный вес безводного препарата 1009,56 (по международным атомным весам 1961 г.).
Таллий и его соединения используются в различных областях науки и техники. Ценность этого металла определяется рядом полезных свойств, которые делают его незаменимым во многих процессах и приборах.
В настоящее время существуют (Т.Н. Дарвойд с соавт., 1968) две наиболее перспективные в отношении масштабов потребления области использования таллия: производство тяжелых жидкостей и производство оптических стекол. Из наиболее часто применяемых в промышленности соединений таллия можно назвать следующие.
1. Монокристаллы КРС-5 и КРС-6 — это уникальные оптические материалы, обладают высокой прозрачностью в далекой инфракрасной области спектра, сочетающейся с влагостойкостью. Эти кристаллы широко используются в приборах инфракрасной техники, в том числе в приборах, работающих в атмосферных условиях, где применение других известных кристаллов (NaCl, Csl и др.) невозможно.
2. Закись таллия — компонент для выработки некоторых марок оптических стекол с необычными оптическими постоянными.
3. Тяжелая жидкость Клеричи — водный раствор смеси солей таллия, по сравнению с другими тяжелыми жидкостями имеет самый высокий удельный вес (4,25), большую подвижность и способность смешиваться с водой в любых пропорциях.
Жид-, кость Клеричи уже несколько десятилетий широко используется при минералогических анализах и геопого-минерапогических исследованиях горных пород и руд.
5. Монокристаллы Т1С1 — используются в качестве радиаторов спектрофотометрических счетчиков Черенкова, применяющихся для регистрации частиц высоких энергий.
6. Сульфиды, селениды и теллуриды таллия — компоненты многих сложных полупроводников (цитопроводникн, термоматериалы, стеклообразные полупроводники).
Некоторые из них используются при изготовлении полупроводниковых приборов (полупроводниковые выпрямители, фотосопротивления, видиконы).
7. Ацетат и сульфат таллия — в отдельных случаях применяют в производстве отрав для грызунов (целиопаст и др.), инсектицидов и пестицидов.
8. Карбонат таллия — применяется для изготовления стекол, искусственных драгоценных камней и в пиротехнике; нитрат — в производстве светящихся красок.
В связи с тем, что работники ряда производств имеют контакт с таллием, безусловный интерес представляют вопросы биологического и токсического действия таллия и его соединений на людей.
А также существуют токсические вещества, позволяющие ликвидировать соперника быстро или, наоборот, спровоцировать хроническое заболевание.
Цианистый калий известен почти всем, в начале XX века опасный порошок был распространённым способом избавления от нежелательных лиц.
Пострадавший проходит несколько стадий интоксикации. Вначале ощущается першение в горле, затем начинается тошнота и рвота, возможно онемение глотки.
Со временем нарастает общая слабость, возникает чувство страха, а пульс замедляется. Впоследствии отмечаются такие признаки, как судороги и потеря сознания. Как правило, при попадании достаточной дозы яда внутрь человек погибает в течение 4 часов.
В список опасных ядов при неправильном применении вошли следующие лекарства:
Лекарство «Феназепам» назначается медиками в качестве средства против бессонницы, панических атак и стресса.
Как и многие другие средства, «Феназепам» несовместим с алкоголем — этим и пользуются преступники, так как совместное употребление этих таблеток и спиртных напитков приводит к остановке дыхания и смерти.
Но заполучить описываемый препарат нелегко, так как он отпускается исключительно по врачебному рецепту.
Летальный исход наступает при употреблении внутрь 2 гг. сырья, чемеричная вода отрицательно влияет на работу сердца и артериальное давление. Так, снабжение головного мозга кислородом постепенно уменьшается.
Как правило, алкоголь ускоряет поглощение яда и признаки интоксикации чемеричной водой развиваются уже через 20 минут после принятия средства. Начинается рвота, а также отмечаются такие симптомы, как сильная жажда, замедление сердечного ритма, нарушение рассудка.
Смерть наступает в среднем через 8 часов, такое лекарство позволяет преступникамотравить человека без определения точной причины летального исхода.
Капли «Корвалол» можно приобрести в любой аптеке, что делает их доступным и действенным медикаментом для отравления.
Смертельная доза препарата зависит от веса и возраста человека, в среднем она составляет 150 капель.
Интоксикация характеризуется длительным сном, снижением артериального давления и расширением зрачков.
Особенно опасно совместное употребление этого препарата с алкоголем, в таком случае появляется тахикардия, кожные покровы синеют.
Отравить человека медленно с помощью капель «Корвалол», скорее всего, не получится, летальный исход возникает в течение суток, чем пользуются различные асоциальные элементы общества.
Химические соединения таллия
Свойства таллия и его соединений
Краткая историческая справка о таллии
Таллий открыт в 1861 г. английским физиком Круксом в камерном иле сернокислотных заводов. Он был обнаружен по характерной зеленой линии в спектре.
Таллий относится к третьей группе Периодической системы.
Атомная масса 204,89
Плотность, г/см3 11,83
Температура плавления, °С 303
Температура кипения, °С 1406
α-таллий устойчив до 230 °С, выше этой температуры устойчива β-модификация.
Таллий — мягкий металл серебристо-белого цвета, легкоплавкий.
Вместе с тем он имеет высокую температуру кипения.
На воздухе при обычной температуре быстро покрывается черной пленкой оксида таллия Тl2O, замедляющей дальнейшее окисление, выше 100 ºС металл быстро окисляется с образованием смеси Тl2O и Т12O3.
В воде таллий медленно корродирует в присутствии кислорода.
Металл растворяется в азотной, медленней в серной кислоте.
В соляной кислоте таллий малорастворим вследствие образования защитной пленки хлорида таллия. В растворах щелочей таллий не растворяется.
С хлором, бромом и иодом металл реагирует уже при комнатной температуре.
Для таллия характерны соединения, в которых он имеет степень окисления +1; менее устойчивы соединения, отвечающие степени окисления +3.
Соединения со степенью окисления таллия +1 по ряду свойств подобны соединениям щелочных металлов и серебра.
Tl2O — tпл=330 ºС, растворяется в H2O c образованием TlOH.
Tl2O3 — tпл=716 ºС, черно-бурый, при температуре больше 716 ºС разлагается на Tl2O.
Tl2S – tпл=450 ºС, плохо растворяется в HCl, при температуре выше 600ºС легко окисляется.
Сходство со щелочными металлами проявляется в образовании одновалентным таллием хорошо растворимого гидроксида TlOН, обладающего свойствами сильного основания; образовании растворимых сульфата, карбоната, ферроцианида и двойных сульфатов типа квасцов.
Сходство с серебром состоит в образовании таллием малорастворимых галогенидов (растворимость убывает в ряду ТlС1-Т1Вг-Т1I); образовании малорастворимых хроматов Тl2СrO4 и Тl2Сr2O7 и сульфида Tl2S.
Однако в отличие от ионов серебра, ионы Т1+ не образуют аммиачных комплексов. Для окисления ионов Т1+ до Т13+ в водных растворах используют такие сильные окислители, как хлор или перманганат калия.
Т1(ОН)3 осаждается из растворов при рН = 3 — 4.
При работе с таллием необходимо учитывать токсичность его соединений.
Таллий и его соединения используют в различных областях техники:
Инфракрасная оптика.
Используется бромид и иодид таллия (хлорид таллия) для изготовления окон, линз, призм, кювет оптических приборов, работающих в инфракрасной области спектра.
Полупроводниковая электроника. Соединения таллия обладают хорошими изоляционными свойствами, применяются для изготовления транзисторов и изоляционных покрытий.
Приборостроение. Радиоактивный изотоп Т1240 (период полураспада 2,7 года) применяют в качестве источника β-излучения в дефектоскопах для контроля качества материалов, измерения толщины изделий и покрытий.
Сплавы.
Таллий входит в состав некоторых подшипниковых сплавов на основе свинца. Легирование таллием свинцовых сплавов повышает их коррозионную стойкость.
Сельское хозяйство. Сульфат таллия используют как ядохимикат.
Таллий
В истории открытия химических элементов немало парадоксов.
Случалось, что поисками еще неизвестного элемента занимался один исследователь, а находил его другой. Иногда несколько ученых «шли параллельным курсом», и тогда после открытия (а к нему всегда кто-то приходит чуть раньше других) возникали приоритетные споры.
Иногда же случалось, что новый элемент давал знать о себе вдруг, неожиданно. Именно так был открыт элемент №81 – таллий. В марте 1861 г. английский ученый Уильям Крукс исследовал пыль, которую улавливали на одном из сернокислотных производств. Крукс полагал, что эта пыль должна содержать селен и теллур – аналоги серы. Селен он нашел, а вот теллура обычными химическими методами обнаружить не смог.
Тогда Крукс решил воспользоваться новым для того времени и очень чувствительным методом спектрального анализа. В спектре он неожиданно для себя обнаружил новую линию светло-зеленого цвета, которую нельзя было приписать ни одному из известных элементов. Эта яркая линия была первой «весточкой» нового элемента. Благодаря ей он был обнаружен и благодаря ей назван по-латыни thallus – «распускающаяся ветка». Спектральная линия цвета молодой листвы оказалась «визитной карточкой» таллия.
В греческом языке (а большинство названий элементов берут начало в латыни или в греческом) почти так же звучит слово, которое на русский переводится как «выскочка».
Таллий действительно оказался выскочкой – его не искали, а он нашелся…
Элемент со странностями
Больше 30 лет прошло после открытия Крукса, а таллий все еще оставался одним из наименее изученных элементов. Его искали в природе и находили, но, как правило, в минимальных концентрациях.
Лишь в 1896 г. русский ученый И.А. Антипов обнаружил повышенное содержание таллия в силезских марказитах.
О таллии в то время говорили как об элементе редком, рассеянном и еще – как об элементе со странностями. Почти все это справедливо и в наши дни.
Только таллий не так уж редок – содержание его в земной коре 0,0003% – намного больше, чем, например, золота, серебра или ртути. Найдены и собственные минералы этого элемента – очень редкие минералы лорандит TlAsS2, врбаит Tl(As, Sb)3S5 и другие.
Но ни одно месторождение минералов таллия на Земле не представляет интереса для промышленности. Получают этот элемент при переработке различных веществ и руд – как побочный продукт. Таллий действительно оказался очень рассеян.
И странностей в его свойствах, как говорится, хоть отбавляй. С одной стороны, таллий сходен со щелочными металлами. И в то же время он чем-то похож на серебро, а чем-то на свинец и олово. Судите сами: подобно калию и натрию, таллий обычно проявляет валентность 1+, гидроокись одновалентного таллия TlOH – сильное основание, хорошо растворимое в воде.
Как и щелочные металлы, таллий способен образовывать полииодиды, полисульфиды, алкоголяты… Зато слабая растворимость в воде хлорида, бромида и иодида одновалентного таллия роднит этот элемент с серебром.
А по внешнему виду, плотности, твердости, температуре плавления – по всему комплексу физических свойств – таллий больше всего напоминает свинец.
И при этом он занимает место в III группе периодической системы, в одной подгруппе с галлием и индием, и свойства элементов этой подгруппы изменяются вполне закономерно.
Помимо валентности 1+, таллий может проявлять и естественную для элемента III группы валентность 34-.
Как правило, соли трехвалентного таллия труднее растворить, чем аналогичные соли таллия одновалентного. Последние, кстати, изучены лучше и имеют большее практическое значение.
Но есть соединения, в состав которых входит и тот и другой таллий. Например, способны реагировать между собой галогениды одно- и трехвалентного таллия.
И тогда возникают любопытные комплексные соединения, в частности Tl1+ [Tl3+Cl2Br2]–. В нем одновалентный таллий выступает в качестве катиона, а трехвалентный входит в состав комплексного аниона.
Подчеркивая сочетание различных свойств в этом элементе, французский химик Дюма писал: «Не будет преувеличением, если с точки зрения общепринятой классификации металлов мы скажем, что таллий объединяет в себе противоположные свойства, которые позволяют называть его парадоксальным металлом».
Далее Дюма утверждает, что среди металлов противоречивый таллий занимает такое же место, какое занимает утконос среди животных. И в то же время Дюма (а он был одним из первых исследователей элемента №81) верил, что «таллию суждено сделать эпоху в истории химии».
Эпохи таллий пока не сделал и не сделает, наверное.
Но практическое применение он нашел (хотя и не сразу). Для некоторых отраслей промышленности и науки этот элемент по-настоящему важен.
Применение таллия
Таллий оставался «безработным» в течение 60 лет после открытия Крукса.
Но к началу 20-х годов нашего столетия были открыты специфические свойства таллиевых препаратов, и сразу же появился спрос на них.
В том же 1920 г. в журнале «Physical Review» появилась статья Кейса, который обнаружил, что электропроводность одного из соединений таллия (его оксисульфида) изменяется под действием света.
Вскоре были изготовлены первые фотоэлементы, рабочим телом которых было именно это вещество. Особо чувствительными они оказались к инфракрасным лучам.
Другие соединения элемента №81, в частности смешанные кристаллы бромида и иодида одновалентного.