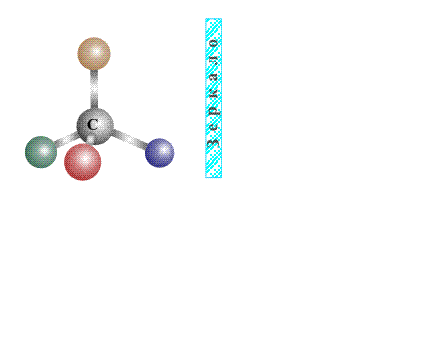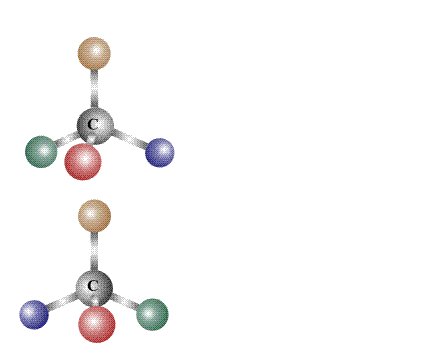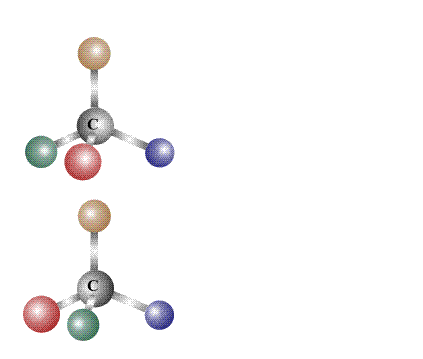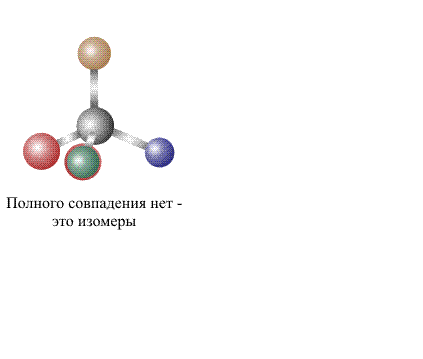
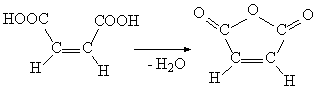в чем изомеры одинаковы и чем они различаются
Разница между изомерами
Изомеры – важнейшее понятие органической химии. Вещества, обладающие одинаковым составом и молекулярной массой, могут отличаться строением и соединением в их составе идентичных элементов. Эти элементы содержатся в равном количестве, но отличаются пространственным расположением групп атомов или просто атомов. Такие вещества принято называть изомерами.
На примере самых простых изомеров – бутана и изобутана (вернее, их структурных формул), обладающих абсолютно одинаковой молекулярной формулой C4 H10, легко можно понять, о чем идет речь. Структурная формула бутана выглядит так: CH3-CH2— CH2-CH3, а изобутана CH3-CH(CH3)-CH3. Пространственное расположение атомов углерода и водорода, а также их порядок соединения, в бутане и изобутане разное.
Кроме того, радикальная группа –CH3 в изобутане (которая отсутствует в бутане) привязана ко второму атому углерода и образует ответвление. Наличие радикальной группы –CH3 в изобутане обуславливает появление в нем же группы –CH. В бутане же все группы атомов связаны линейно, к тому же он располагает, в отличие от изобутана, двумя группами –CH2.
Определение
Изомеры – особые химические соединения, наделенные одинаковой формулой и составом, но различающиеся строением и свойствами. Изомеры в основном присущи органическим соединениям.
Если молекулы двух соединений с идентичными составами при совмещении в пространстве не совпадают полностью, то их считают изомерами. Свойства изомеров зависят не от их составов, а от их химического строения, точнее, от того порядка, в котором соединены атомы, входящие в состав молекул, и от взаимного влияния атомов друг на друга.
Сравнение
Изомеры, обладая одинаковыми составами, имеют разные физико-химические свойства. Обусловлено это тем, что атомы в молекулах располагаются в неодинаковом порядке. Структурные изомеры отличаются строением углеводородного скелета, либо различным местоположением кратных связей или функциональных групп, что ведет к различным физико-химическими свойствам.
Стереоизомеры (цис- и трансизомеры) обладают одинаковым порядком связей между атомами и различным их расположением в пространстве. Свойства стереоизомеров заметно отличаются.
Например, вещества — обладатели формулы С2Н6O – это два абсолютно разных изомерных органических соединения: диметиловый эфир (газ, минимально растворимый в воде) и этиловый спирт (жидкость, кипящая при температуре 78° С). Они относятся совершенно к разным классам (эфиры и спирты) органических соединений. Их химические свойства значительно отличаются.
Виды изомерии в органической химии
Изомерия в химии — что это за явление
В современной естественной науке важно обращать внимание на такое явление как изомерия. Без понимания свойств веществ-изомеров почти невозможно изучать законы и закономерности химии.
Впервые на явление изомерии обратили внимание двое ученых в 1823 году. Ю. Либих и Ф. Велер поспорили из-за различий в свойствах фульмината серебра (AgCNO). Ученые заметили, что у циановокислого и гремучего серебра одна и та же формула.
Подробнее явление изучил Й. Берцелиус. Исследовав винную и виноградные кислоты (у обеих формула C 4 H 6 O 6 ) он в 1830 году ввел термин «изомерия». Его предположение заключалось в следующем: вещества с одинаковым составом могут различаться из-за разного распределения атомов в молекуле.
Наконец, во второй половине XIX века Я. Вант-Гофф открыл пространственную изомерию, а А. Бутлеров — структурную изомерию. Так сформировалась современная теория изомерии.
Определение понятия
Изомерия — явление, суть которого заключается в существовании химических соединений, которые одинаковы по качественному и количественному составу, но различаются по строению или расположению атомов в пространстве. Вследствие этого они обладают разными физическими и химическими свойствами.
Из данного определения следует определение веществ-изомеров.
Изомеры — это химические соединения с одинаковым составом, но разные по строению или пространственному расположению атомов и свойствам.
Как правило, большое количество изомеров характерно для представителей широко известного класса аминокислот. За счет различных заместителей при α-углеродном атоме им также свойственна и оптическая изомерия, которая будет рассмотрена далее.
Виды изомерии в органической химии
В классификации изомерии выделяют два основных типа изомеров:
Структурная изомерия
Структурные изомеры — вещества, которые одинаковы по качественному и количественному составу, но различающиеся строением, т. е. порядком расположения атомов. Структурные изомеры имеют одинаковые молекулярные, но разные структурные формулы.
Выделяют несколько видов изомерии по структуре молекулы.
1. Изомерия углеродной цепи.
Углеродная цепь или углеродный скелет представляет собой остов молекулы, состоящий из углеродных атомов. Если порядок соединения атомов углерода в молекуле отличается, то вещества являются структурными изомерами по углеродной цепи.
2. Валентная изомерия.
Валентные изомеры различаются распределением химических связей внутри молекулы. К примеру, для бензола ( C 6 H 6 ), помимо стандартной молекулы в форме плоского шестиугольника, известно еще три валентных изомера. Они представлены на изображении ниже.
3. Изомерия положения функциональной группы.
В молекулах органических соединений, не относящихся к классу углеводородов, можно выделить две составляющие части: углеводородный фрагмент (радикал) и функциональная группа.
4. Межклассовая изомерия.
Межклассовые изомеры — вещества, имеющие одинаковый количественный и качественный состав, но относящиеся к различным классам органических соединений. Поскольку молекулы таких изомеров содержат различные функциональные группы, такой вид изомерии также называют изомерией функциональной группы.
5. Изомерия положения кратной связи
Подобно изомерии положения функциональной группы, изомеры данного вида отличаются расположением элемента в углеродной цепи. В данном случае такой элемент — кратная связь. Рассмотрим изомеры бутена по положению двойной связи:
СН–СН–СН=СН — это бутен-1
СН–СН=СН–СН — это бутен-2
Пространственная изомерия (стереоизомерия)
Структурные формулы пространственных изомеров могут быть одинаковыми, но молекулы при этом будут отличаться расположением атомов в пространстве, т.е. будут иметь различные пространственные формулы. Химики выделяют два вида пространственной изомерии:
Рассмотрим подробнее каждый из типов.
1. Оптическая изомерия (энантиомерия).
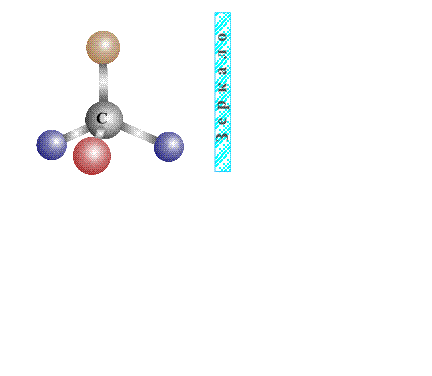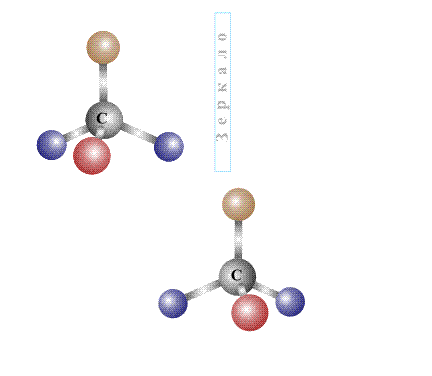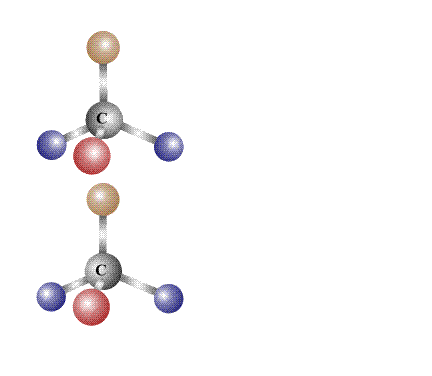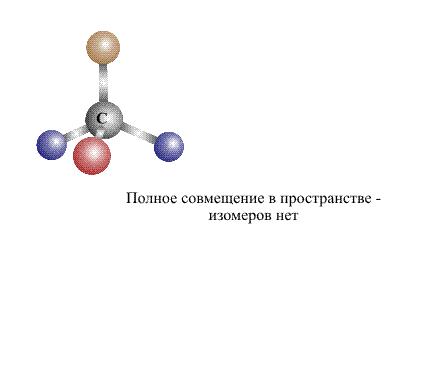
Оптическую изомерию также называют зеркальной. Оптические изомеры (энантиомеры) — это молекулы, которые являются зеркальными отражениями друг друга. Такой вид изомерии возникает, когда у одного атома углерода появляется четыре разных заместителя. Эти атомы углерода называются ассиметрическими, или хиральными (от греч. хиро — рука, поскольку наши руки также являются зеркальными отражениями друг друга). Таким образом оптические изомеры различаются порядком расположения заместителей вокруг асимметричного центра. На практике такие изомеры различаются по направлению вращения плоскости поляризации плоскополяризованного света. Один из оптических антиподов является правовращающим (вращает плоскость поляризации вправо, его обозначают знаком «+»), а другой — левовращающим (вращает плоскость поляризации влево, обозначают знаком «−»).
Оптическая изомерия характерна для многих классов природных органических соединений (углеводов, аминокислот). Например, на рисунке представлены оптические изомеры аминокислоты аланина:
2. Геометрическая изомерия.
Геометрическая изомерия также называется цис,транс-изомерией, показывает разное положение заместителей относительно цикла или двойной связи.
Когда заместители находятся по одну сторону двойной связи (плоскости цикла), то вещество называют цис-изомером. Если заместители расположены по разные стороны, то речь идет о транс-изомерах. Пример — это цис-бутен-2 и транс-бутен-2.
На изображении ниже транс-бутен-2 представлен слева, а цис-бутен-2 — справа.
У одного и того же вещества могут быть разные типы изомеров. Так, многим представителем класса алкенов свойственны межклассовая, геометрическая и изомерия углеродного скелета. Среди альдегидов встречается структурная изомерия — углеродного скелета и межклассовая. Для циклоалканов характерна межклассовая изомерия, цис-, транс-изомерия и др.
Изомер – определение, типы, пример и тест
Определение изомера
Изомеры – это две молекулы с одинаковой молекулярной формулой, но структурно различающиеся. Следовательно, изомеры содержат одинаковое количество атомов для каждого элемента, но расположение атомов отличается. Несмотря на одинаковую молекулярную формулу, физические свойства каждого молекула может отличаться, особенно если функциональные группы, связанные с каждой молекулой, различны. Изомеризация – это процесс, при котором одна молекула превращается в другую молекулу с одинаковыми атомами. Это может происходить спонтанно или может потребоваться реакция для достижения этого эффекта.
Типы изомеров
Существует два основных типа изомеров: структурные изомеры и стереоизомеры (показаны ниже).
Структурные изомеры
Структурные изомеры различаются в отношении специфического присоединения атомов и функциональных групп. Таким образом, в зависимости от конкретных изомеров, они не могут быть отнесены к одной и той же функциональной группе, и они будут иметь разные названия IUPAC. Типы структурных изомеров включают в себя цепные изомеры (например, углеводородные цепи, демонстрирующие различные схемы разветвления); положение изомеров, которые различаются в зависимости от расположения функциональной группы на цепи; функциональные группы изомеров, в которых функциональная группа дополнительно разделена на различные функциональные группы; и скелетные изомеры, которые имеют различные углеродные цепи. Другим типом структурного изомера является таутомер. Таутомеры самопроизвольно преобразуются между двумя структурными изомерами и проявляют различные свойства в зависимости от конкретной изоформы. Иногда конверсия таутомеров может быть настолько быстрой, что выделение обоих невозможно.
стереоизомеры
Стереоизомеры относятся к изомерам, которые имеют одинаковую структуру связи, но различаются в отношении геометрического положения функциональных групп и атомов. Типы стереоизомеров состоят из энантиомеров, диастереомеров и конформационных изомеров. Энантиомеры являются зеркальными изображениями, которые содержат хиральные центры и не являются наложенными. Диастереомеры не являются зеркальными изображениями, которые могут содержать или не содержать хиральные центры. Конформационные изомеры показывают различные вращения вокруг одинарных связей.
Пример изомера
Есть несколько примеров изомеров, описанных следующим образом:
Метоксиэтан и пропанол
Химическая структура C3H8O существует в виде нескольких изомеров пропанола, а также изомера метоксиэтана. Два изомера пропанола состоят из пропан-1-ола и пропан-2-ола (также известного как изопропиловый спирт), которые отличаются размещением атома кислорода либо на концевом атоме углерода, либо на центральном атоме углерода, соответственно. Метоксиэтан также является изомером C3H8O, но представляет собой простой эфир, так как атом кислорода находится в центре молекулы, а не связан с одним атомом углерода.
Метилацетилен и аллен
Метилацетилен и аллен являются примером изомеров C3H4, которые различаются в зависимости от типа связи, проявляемой молекулами. Метилацетилен имеет одну тройную связь и одну одинарную связь между атомами углерода, а аллен имеет две двойные связи между атомами углерода.
Фульминат и цианат
Фульминат и цианат являются примером изомеров CNO. Фульминат демонстрирует расположение, в котором N связан как с атомами С, так и с О, тогда как в цианате и О, и N связаны с центральным атомом С.
Глюкоза и фруктоза
Глюкоза и фруктоза являются примером изомеров C6H12O6, которые различаются в зависимости от положения атома кислорода с двойной связью. В глюкозе О расположен на первом С, тогда как он расположен на втором С во фруктозе (структуры каждого показаны ниже).
Фармацевтические примеры
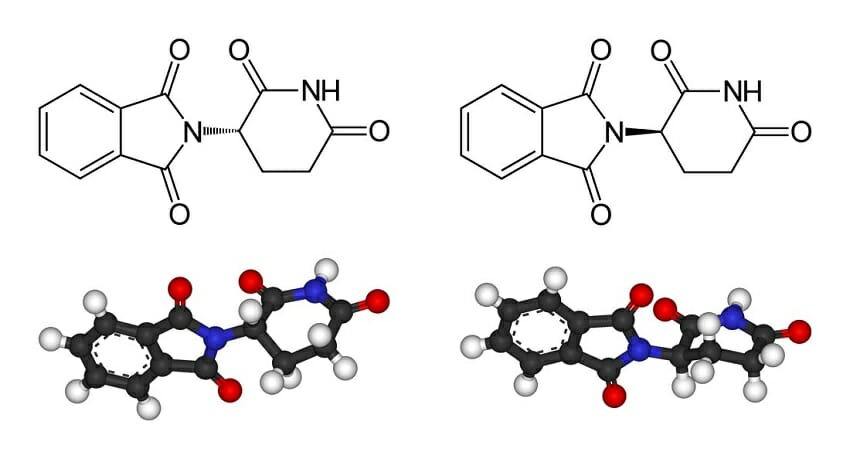
Изомеры чрезвычайно важны при разработке фармацевтических препаратов, поскольку обычно только один изомер конкретной молекулы будет оказывать желаемый эффект. Например, только один изомер ибупрофена будет связываться с необходимой мишенью в организме человека и вызывать облегчение боли. Точно так же цисплатин является эффективным противоопухолевым препаратом, в то время как его изомер, трансплатин, вообще не оказывает противоракового действия. Один из самых известных примеров – талидомид (на фото ниже). Хотя один изомер талидомида является сильнодействующим средством для подавления утреннего недомогания, он был доставлен в соотношении 50:50 со своим стереоизомером, который был ответственен за врожденные дефекты, наблюдаемые у детей, родившихся в 1950-х годах, от матерей, которые принимали препарат.
Ферментативные реакции
викторина
1. Изомеры с одинаковой структурой связи, но геометрическим положением атомов и функциональных групп, известны как:A. Структурные изомерыB. стереоизомерыC. таутомерыD. Цепные изомеры
Ответ на вопрос № 1
В верно. Стереоизомеры отличаются от структурных изомеров, потому что они имеют одинаковую структуру основной связи, но атомы и функциональные группы имеют тенденцию вращаться или располагаться по-разному в пространстве.
2. Молекулы А, В и С являются изомерами. Фермент А связывается с изомером А с образованием изомера В и наоборот, но Фермент А не может связываться с изомером С. Фермент А является примером:A. ИзомеразаB. СтереоизомерC. Структурный изомерD. Конверсионный изомер
Ответ на вопрос № 2
верно. Изомеразы – это специализированные ферменты, которые превращают молекулу в ее изомер. Однако не все изомеры способны связываться с ферментом из-за физической структуры молекулы.
3. Изомеры важны в биологических системах, потому что:A. Различные изомеры могут оказывать различное влияние на организм. XXB. Конкретные изомеры могут потребоваться для ферментативных реакцийC. Фармацевтическая разработка должна учитывать все потенциальные изомеры, чтобы избежать потенциальных вредных побочных эффектов, вызванных непреднамеренным взаимодействием изомеров молекулы при доставке пациентам.D. Все вышеперечисленноеE. Только А и БF. Ни один из вышеперечисленных
Ответ на вопрос № 3
D верно. Поскольку физическая структура часто различается между изомерами, разные изомеры могут по-разному связываться с различными рецепторами или ферментами в организме, вызывая тем самым дифференциальные эффекты. Это может представлять потенциальную проблему в фармацевтической промышленности, если лекарство содержит смесь его изомеров, поскольку такие молекулы могут вызывать непреднамеренные эффекты.
ИЗОМЕРИЯ
ИЗОМЕРИЯ (греч. isos – одинаковый, meros – часть) – одно из важнейших понятий в химии, главным образом, в органической. Вещества могут иметь одинаковый состав и молекулярную массу, но различное строение и соединения, содержащие в своем составе одни и те же элементы в одинаковом количестве, но различающиеся пространственным расположением атомов или групп атомов, называют изомерами. Изомерия является одной из причин того, что органические соединения так многочисленны и разнообразны.
Изомерия была впервые обнаружена Ю.Либихом в 1823, который установил, что серебряные соли гремучей и изоциановой кислот: Ag-О-N=C и Ag-N=C=O имеют одинаковый состав, но разные свойства. Термин «Изомерия» в 1830 ввел И.Берцелиус, предположивший, что различия в свойствах соединений одинакового состава возникают из-за того, что атомы в молекуле расположены в неодинаковом порядке. Представления об изомерии окончательно сформировались после создания A.M.Бутлеровым теории химического строения (1860-е). Основываясь на положениях этой теории, он предположил, что должно существовать четыре различных бутанола (рис. 1). К моменту создания теории был известен лишь один бутанол (СН3)2СНСН2ОН, получаемый из растительного сырья.
Рис. 1. Изомеры бутанола
Последовавший затем синтез всех изомеров бутанола и определение их свойств стали убедительным подтверждением теории.
Согласно современному определению два соединения одинакового состава считают изомерами, если их молекулы нельзя совместить в пространстве так, чтобы они полностью совпадали. Совмещение, как правило, проделывают мысленно, в сложных случаях используют пространственные модели, либо расчетные методы.
Есть несколько причин возникновения изомерии.
СТРУКТУРНАЯ ИЗОМЕРИЯ
Обусловлена, как правило, различиями в строении углеводородного скелета либо неодинаковым расположением функциональных групп или кратных связей.
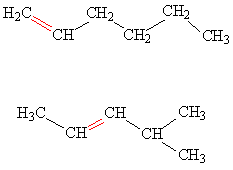
Изомерия углеводородного скелета.
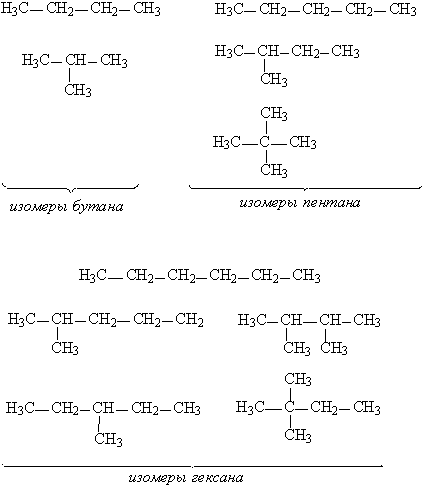
Насыщенные углеводороды, содержащие от одного до трех атомов углерода (метан, этан, пропан), не имеют изомеров. Для соединения с четырьмя атомами углерода С4Н10 (бутан) возможно существование двух изомеров, для пентана С5Н12 – трех изомеров, для гексана С6Н14 – пяти (рис.2):
Рис. 2. Изомеры простейших углеводородов
С увеличением числа атомов углерода в молекуле углеводорода количество возможных изомеров резко возрастает. Для гептана С7Н16 существует девять изомеров, для углеводорода С14Н30 – 1885 изомеров, для углеводорода С20Н42 – свыше 366 000.
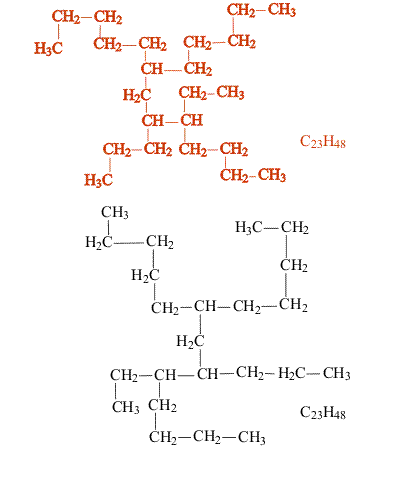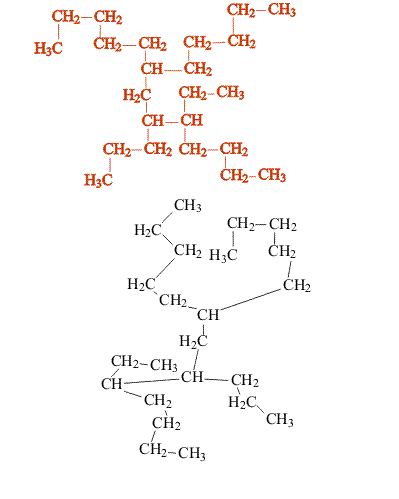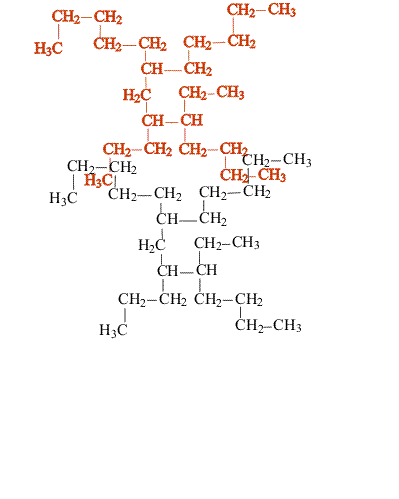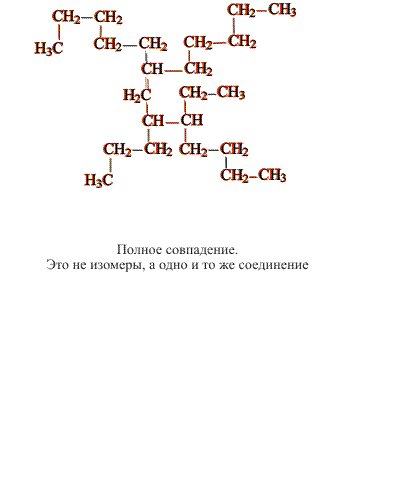
В сложных случаях вопрос о том, являются ли два соединения изомерами, решают, используя различные повороты вокруг валентных связей (простые связи это допускают, что в определенной степени соответствует их физическим свойствам). После перемещения отдельных фрагментов молекулы (не допуская при этом разрыва связей) накладывают одну молекулу на другую (рис. 3). Если две молекулы полностью совпадают, то это не изомеры, а одно и то же соединение:
Изомеры, отличающиеся структурой скелета, обычно имеют разные физические свойства (температура плавления, температура кипения и т.п.), что позволяет отделить один от другого. Изомерия такого типа существует и у ароматических углеводородов (рис. 4):
Рис. 4. Ароматические изомеры
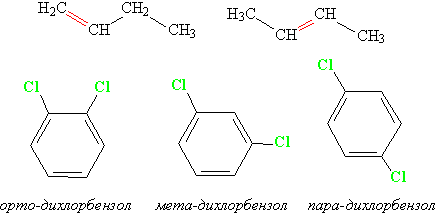
Изомерия положения.
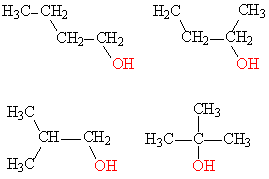
Другой вид структурной изомерии – изомерия положения возникает в тех случаях, когда функциональные группы, отдельные гетероатомы или кратные связи расположены в различных местах углеводородного скелета. Структурные изомеры могут принадлежать к разным классам органических соединений, поэтому они могут различаться не только физическими, но и химическими свойствами. На рис. 5 показаны три изомера для соединения С3Н8О, два из них – спирты, а третье – простой эфир
Рис. 5. Изомеры положения
Нередко различия в строении изомеров положения столь очевидны, что не требуется даже мысленно совмещать их в пространстве, например, изомеры бутена или дихлорбензола (рис. 6):
Рис. 6. Изомеры бутена и дихлорбензола
Иногда структурные изомеры сочетают признаки изомерии углеводородного скелета и изомерии положения (рис. 7).
Рис. 7. Сочетание двух видов структурной изомерии
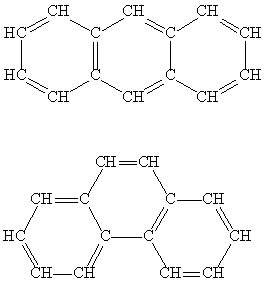
В вопросах изомерии теоретические рассмотрения и эксперимент взаимосвязаны. Если рассмотрения показывают, что изомеров быть не может, то эксперименты должны показывать то же. Если вычисления указывают на определенное число изомеров, то их может быть получено столько же, или меньше, но не больше – не все теоретически рассчитанные изомеры могут быть получены, поскольку межатомные расстояния или валентные углы в предполагаемом изомере могут выходить за пределы допустимого. Для вещества, содержащего шесть групп СН (например, бензол), теоретически возможно 6 изомеров (рис. 8).
Рис. 8. Изомеры бензола
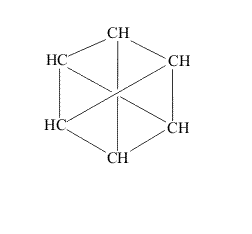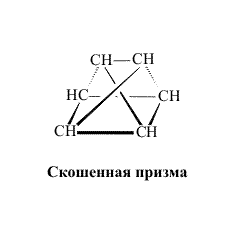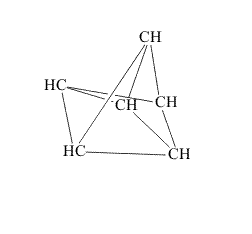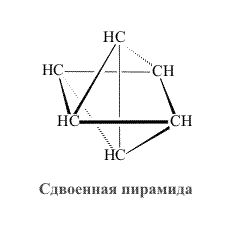
Первые пять из показанных изомеров существуют (второй, третий, четвертый и пятый изомеры были получены спустя почти 100 лет, после того, как было установлено строение бензола). Последний изомер, скорее всего, никогда не будут получен. Представленный в виде шестиугольника, он наименее вероятен, его деформации приводят к структурам в форме скошенной призмы, трехлучевой звезды, незавершенной пирамиды и сдвоенной пирамиды (незавершенному октаэдру). Каждый из этих вариантов содержит либо весьма различающиеся по величине связи С-С, либо сильно искаженные валентные углы (рис. 9):
Химические превращения, в результате которых структурные изомеры превращаются, друг в друга, называют изомеризацией.
Стереоизомерия
возникает благодаря различному расположению атомов в пространстве при одинаковом порядке связей между ними.
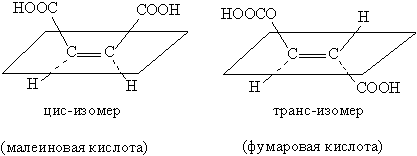
Один из видов стереоизомерии цис-транс-изомерия (цис – лат. по одну строну, транс – лат. через, по разные стороны) наблюдается в соединениях, содержащих кратные связи или плоские циклы. В отличие от простой связи, кратная связь не позволяет вращать вокруг нее отдельные фрагменты молекулы. Для того чтобы определить тип изомера, через двойную связь мысленно проводят плоскость и далее анализируют то, как размещаются заместители относительно этой плоскости. Если одинаковые группы находятся по одну сторону плоскости, то это цис-изомер, если по разные стороны – транс-изомер:
Физические и химические свойства цис— и транс-изомеров иногда заметно отличаются, в малеиновой кислоте карбоксильные группы –СООН пространственно близки, они могут реагировать (рис. 11), образуя ангидрид малеиновой кислоты (для фумаровой кислоты такая реакция не идет):
Рис. 11. Образование ангидрида малеиновой кислоты
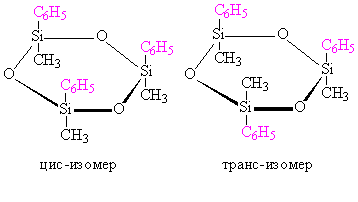
В случае плоских циклических молекул проводить мысленно плоскость не требуется, так как она уже задана формой молекулы, как, например, в циклических силоксанах (рис. 12):
Рис. 12. Изомеры циклосилоксана
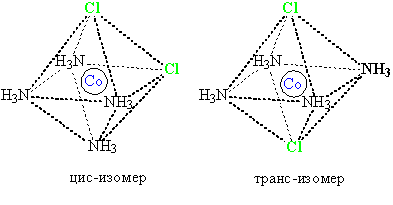
В комплексных соединениях металлов цис-изомером называют соединение, у которого две одинаковые группы, из тех, что окружают металл, находятся рядом, в транс-изомере, они разделены другими группами (рис. 13):
Рис. 13. Изомеры комплекса кобальта
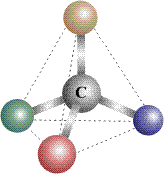
Второй вид стереоизомерии – оптическая изомерия возникает в тех случаях, когда два изомера, (в соответствии с определением, сформулированным ранее, две молекулы, не совмещаемые в пространстве) представляют собой зеркальное отражение друг друга. Таким свойством обладают молекулы, которые могут быть представлены в виде одиночного атома углерода, имеющего четыре различных заместителя. Валентности центрального атома углерода, связанного с четырьмя заместителями, направлены к вершинам мысленного тетраэдра – правильного четырехгранника (см. ОРБИТАЛЬ) и жестко закреплены. Четыре неодинаковых заместителя изображены на рис. 14 в виде четырех шариков с различающейся окраской:
Рис. 14. Атом углерода с четырьмя различными заместителями
При любой взаимной ориентации в пространстве двух таких молекул нельзя добиться полного совпадения при совмещении, согласно определению, это изомеры. Важно отметить, что если у центрального атома углерода не четыре, а только три различающихся заместителя (то есть, два из них одинаковы), то при отражении в зеркале такой молекулы оптический изомер не образуется, поскольку молекулу и ее отражение можно совместить в пространстве (рис. 16):
Помимо углерода, в роли асимметрических центров могут выступать другие атомы, у которых ковалентные связи направлены к углам тетраэдра, например, кремний, олово, фосфор.
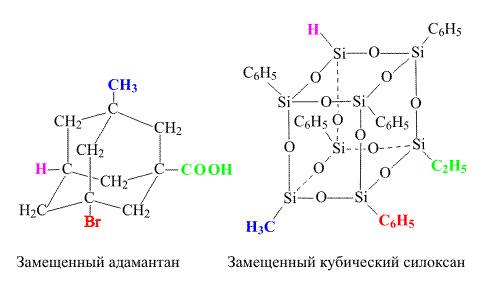
Оптическая изомерия возникает не только в случае асимметрического атома, она также реализуется в некоторых каркасных молекулах при наличии определенного количества различных заместителей. Например, каркасный углеводород адамантан, имеющий четыре различных заместителя (рис. 17), может иметь оптический изомер, при этом вся молекула играет роль асимметрического центра, что становится очевидным, если каркас адамантана мысленно стянуть в точку. Аналогично, силоксан, имеющий кубическую структуру (рис. 17), также становится оптически активным в случае четырех различных заместителей:
Рис. 17. Оптически активные каркасные молекулы
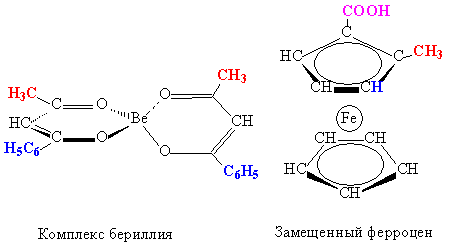
Возможны варианты, когда молекула не содержит асимметрического центра даже в скрытом виде, но может быть сама в целом несимметрична, при этом тоже возможны оптические изомеры. Например, в комплексном соединении бериллия два циклических фрагмента расположены во взаимоперпендикулярных плоскостях, в таком случае достаточно двух различных заместителей для получения оптического изомера (рис. 18). Для молекулы ферроцена, имеющего форму пятигранной призмы, для той же цели нужно три заместителя, атом водорода в этом случае играет роль одного из заместителей (рис. 18):
Рис. 18. Оптическая изомерия несимметричных молекул
В большинстве случаев структурная формула соединения позволяет понять, что именно следует в ней изменить, чтобы сделать вещество оптически активным.
При синтезах оптически активных стереоизомеров обычно получают смесь право- и левовращающих соединений. Разделение изомеров проводят путем взаимодействия смеси изомеров с реагентами (чаще природного происхождения), содержащих асимметрический реакционный центр. Некоторые живые организмы, в том числе бактерии, преимущественно усваивают левовращающие изомеры.
В настоящее время разработаны процессы (называемые асимметрическим синтезом), позволяющие целенаправленно получать определенный оптический изомер.
Существуют реакции, позволяющие превратить оптический изомер в его антипод (см. ВАЛЬДЕНОВСКОЕ ОБРАЩЕНИЕ).