в чем измеряется осмотическое давление
Все, что вы хотели бы знать об осмотическом давлении воды
Словосочетание «осмотическое давление» можно увидеть в различной научной литературе, учебниках по физике или химии. О нем часто говорят при упоминании о растворах различных веществ, о концентрации.
Что несет в себе данное определение? От чего зависит осмотическое давление воды – об этом данная статья.
Что это такое?
Осмотическое давление – это величина, при которой процесс осмоса завершается. Осмос, в свою очередь, это переход молекул веществ из одного раствора в другой.
Обычно они перемещаются от менее концентрированного, с небольшим содержанием вещества, к более концентрированному. Движение происходит через тонкую стенку – мембрану.
Простой пример:
Когда оно достигнет определенной отметки, процесс осмоса прекратится. Это и есть осмотическое давление.
Как и когда было открыто?
Данное явление впервые было открыто и описано в 1748 году. Этим занимался французский ученый-физик Жан-Антуан Нолле.
Его эксперимент выглядел следующим образом:
От чего зависит параметр?
Другой ученый Вант-Гофф из Нидерландов в 1886 году выявил зависимость осмотического давления от некоторых параметров.

При этом параметр не зависит от происхождения вещества и жидкости.
Полученные выводы Вант-Гофф описал уравнением: π = RCT. Оно описывает зависимость осмотического давления от температуры и содержания частиц вещества.
Получается, что для возникновения осмотического давления необходимо наличие двух смесей различной концентрации, а также полупроницаемая пленка — мембрана.
Как измеряют?
Измерения в лабораторных условиях проводят при помощи специального прибора – осмометра. При этом определение осуществляется двумя методами:
| Как проходит измерение? | Статический метод | Динамический метод |
| Измерения проводятся, когда смесь достигает равновесия: частицы прекращают движение. | Базируется на измерении скорости движения молекул сквозь подвижную мембрану. | |
| Как определяется величина осмотического давления? | Определяется по высоте столба раствора в приборе – осмометре. | Вычисляется математически по значениям, полученным от прибора. |
| Отличительная особенность | Основные недостатки: сложность выявления момента равновесия, большие временные затраты. | Основные преимущества: малые затраты времени, высокая точность результата. |
Единственное, важное условие осуществления эксперимента – грамотный подбор мембраны.
В лабораторных условиях чаще всего используют:
Значение
Осмотическое давление играет важную роль в природной среде и жизнедеятельности человека:
Применение знаний для обратного осмоса на практике
Положения, описанные выше, легли в основу другого явления – обратный осмос: подвижная перегородка, наподобие сита, пропускает молекулы определенного размера.
Получается, что растворы определенной концентрации способны «перебегать» через перегородку, а крупные частицы — нет.

Полезное видео
Что такое осмос и осмотическое давление, подскажет видео:
Заключение
Таким образом, знание определения осмоса и его законов может быть полезно во многих отраслях человеческой жизни, в частности – в медицине, промышленности, биологии.
Осмотическое давление
Из Википедии — свободной энциклопедии
Осмотическое давление (обозначается π) — избыточное гидростатическое давление на раствор, отделённый от чистого растворителя полупроницаемой мембраной, при котором прекращается диффузия растворителя через мембрану (осмос). Это давление стремится уравнять концентрации обоих растворов вследствие встречной диффузии молекул растворённого вещества и растворителя.
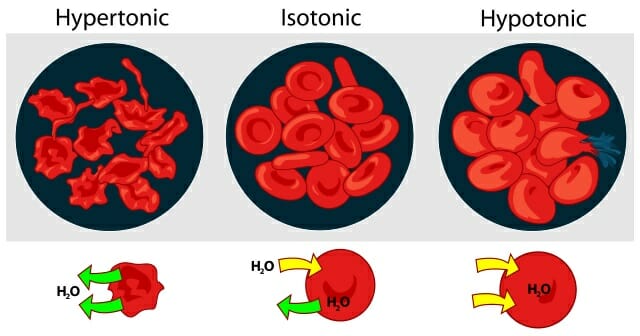
Мера градиента осмотического давления, то есть различия водного потенциала двух растворов, разделённых полупроницаемой мембраной, называется тоничностью. Раствор, имеющий более высокое осмотическое давление по сравнению с другим раствором, называется гипертоническим, имеющий более низкое — гипотоническим.
Если же подобный раствор находится в замкнутом пространстве, например, в клетке крови, то осмотическое давление может привести к разрыву клеточной мембраны. Именно по этой причине лекарства, предназначенные для внутривенного введения, растворяют в изотоническом растворе, содержащем столько хлорида натрия (поваренной соли), сколько нужно, чтобы уравновесить создаваемое клеточной жидкостью осмотическое давление. Если бы вводимые лекарственные препараты были изготовлены на воде или очень сильно разбавленном (гипотоническом по отношению к цитоплазме) растворе, осмотическое давление, заставляя воду проникать в клетки крови, приводило бы к их разрыву. Если же ввести в кровь слишком концентрированный раствор хлорида натрия (3—10 %, гипертонические растворы), то вода из клеток будет выходить наружу, и они сожмутся. В случае растительных клеток происходит отрыв протопласта от клеточной оболочки, что называется плазмолизом. Обратный же процесс, происходящий при помещении сжавшихся клеток в более разбавленный раствор, — соответственно, деплазмолизом.
Осмотическое давление и его измерение



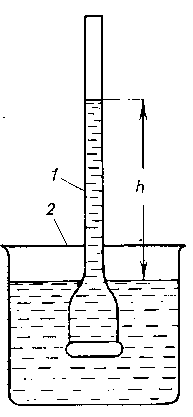
Прибор, применяемый для количественного изучения осмоса, называется осмометром. Простейший осмометр представляет собой сосуд 1, дно которого является полупроницаемой перегородкой. К сосуду приварен тонкий капилляр. Сосуд 1 содержит разбавленный раствор сахара. Полупроницаемая перегородка (дно сосуда 1) может пропускать только молекулы воды (но не молекулы сахара!). Если сосуд 1 опустить в стакан 2, заполненный водой, то молекулы воды будут диффундировать в сосуд 1, где концентрация молекул воды меньше, чем в стакане 2.
Сила (на единицу площади), заставляющая растворитель переходить через полупроницаемую перегородку в раствор (находящийся при том же внешнем давлении, что и растворитель), называется осмотическим давлением.
Рис 1. Простейший прибор для измерения осмотического давления: 1 – внутренний стакан; 2 – внешний стакан.
Вследствие осмоса уровень раствора в сосуде 1 повышается, создавая дополнительное давление, которое препятствует осмосу. При некоторой высоте h столба жидкости в сосуде 1 дополнительное давление достигает такой величины, при которой осмос прекращается. Устанавливается равновесие между раствором данной концентрации и чистым растворителем, разделёнными полупроницаемой перегородкой. Увеличивая извне давление в сосуде 1, можно заставить воду переходить из сосуда 1 во внешний сосуд 2. При этом концентрация раствора в сосуде 1 будет возрастать до тех пор, пока не достигнет значения, соответствующего увеличенному давлению; установится новое равновесие между раствором и растворителем.
равновесию между раствором заданной концентрации и чистым растворителем, разделёнными полупроницаемой перегородкой, соответствует определённое гидростатическое давление в сосуде с раствором.
Гидростатическое давление, равное высоте h, препятствующее односторонней диффузии растворителя, численно равно осмотическому давлению πосм раствора.
В 1887 г ботаник Пфеффер экспериментально установил две закономерности, которым подчиняется осмотическое давление неэлектролита.
1. В разбавленных растворах неэлектролита при данной температуре осмотическое давление прямо пропорционально концентрации
2. При одной и той же концентрации С (моль/л) осмотическое давление разбавленного раствора прямо пропорционально абсолютной температуре
Вант-Гофф обратил внимание на аналогию между законами Пфеффера и газовыми законами Гей-Люссака и Бойля-Мариотта. Анализируя числовые данные, он пришел к выводу, что величину осмотического давления можно вычислять по следующей формуле:
где С – концентрация вещества в растворе, R – универсальная газовая постоянная, Т – абсолютная температура.
Это выражение носит название закона Вант-Гоффа для осмотического давления. Приведём формулировку закона, данную Вант-Гоффом:
Осмотическое давление разбавленного раствора неэлектролита равно тому давлению, которое производило бы растворённое вещество, если бы оно при той же температуре находилось в газообразном состоянии и занимало объём, равный объёму раствора.
Однако, несмотря на сходство с уравнением состояния идеальных газов, аналогия между осмотическим и газовым давлением случайна.
В биологических жидкостях (моча, плазма, слюна, молоко и др.) в больших количествах содержатся неорганические и органические вещества в виде молекул, ионов и коллоидных частиц. Их суммарная концентрация носит название осмотической концентрации (или осмолярности). и именно эта величина должна быть использована в уравнении Вант-Гоффа.
Осмолярная концентрация – суммарное молярное количество всех кинетически активных, т.е.э способных к самостоятельному движению, частиц, содержащихся в 1 литре раствора, независимо от их формы, размера и природы.
Осмолярная концентрация раствора связана с его молярной концентрацией через изотонический коэффициент cосм =ic(x). Это очень важно учитывать при приготовлении физиологических растворов. Осмотические свойства тканей следует учитывать также и в медицине при внутривенных вливаниях лекарств. Вводимый раствор не должен быть токсичным, а кроме того, необходимо, чтобы его осмотическое давление было таким же, как у кровяной плазмы, иначе говоря, вводимый раствор должен иметь такое же осмотическое давление. Например, так называемый физиологический раствор, который можно вводить человеку внутривенно в больших количествах, является изотоническим раствором хлорида натрия. При приготовлении физиологических растворов необходимо учитывать их осмотические свойства.
Роль осмотических явлений в различных физиологических процессах чрезвычайно велика. Постоянство осмотического давления (изоосмия) тех или иных физиологических сред (плазма, внутриклеточная жидкость, моча и т.д.) представляют собой фундаментальное физико-химическое требование гомеостаза. Осмотическое давление плазмы крови человека составляет около 8 атмосфер, у рыб ≈ 15, у отдельных растений может достигать 100, а у прорастающих семян – до 400 атмосфер. Столь высокие значения осмотического давления достигаются за счёт суммарного эффекта растворённых неорганических веществ. В плазме наиболее значимым компонентом является NaCl.
На долю ВМС – белков – приходится незначительная часть от общего давления, называемая онкотическим давлением. Величина онкотического давления крови, вызываемого альбуминами и глобулинами, составляет 0,03 – 0,04 атм. Однако эта незначительная составляющая от общего осмотического давления играет принципиальную роль в некоторых физиологических процессах.
Осмотический метод применим также для определения молекулярной массы высокомолекулярных соединений. Зависимость осмотического давления растворённого вещества от его концентрации описывается соотношением
где g – масса вещества в граммах, М – молярная масса полимера.
Для электролитов, в растворах которых при диссоциации молекул увеличивается число частиц, Вант-Гофф предложил использовать изотонический коэффициент i, который учитывает изменение числа частиц в растворе. Физический смысл этого коэффициента следующий:
i = число всех частиц в растворе/число исходных частиц
Для растворов неэлектролитов i = 1, а для растворов электролитов вследствие диссоциации их молекул i > 1:
Если в растворе идёт процесс ассоциации частиц, то i Снаруж.; πосм(внутр.) > πосм(наруж.).
В результате эндосмоса вода диффундирует в клетку, происходит набухание клетки с появлением напряженного состояния клетки, называемого тургор. В растительном мире тургор помогает растению сохранять вертикальное положение и определённую форму.
Если разница в концентрациях наружного и внутреннего раствора достаточно велика, а прочность оболочки клетки небольшая, то эндосмос приводит к разрушению клеточной мембраны и лизису клетки. (Напомним, что лизис это разрушение, распад, растворение клеток).
Эндосмос является причиной гемолиза (гематолиза) – разрушения эритроцитов крови с выделением в окружающую среду гемоглобина. В норме гемолиз завершает жизненный цикл эритроцитов (приблизительно 125 суток) и происходит в организме человека и животных непрерывно. Патологический гемолиз происходит под влиянием гемолитических ядов, холода, некоторых лекарственных веществ и других факторов.
Кроме эндосмоса возможен экзосмос:
экзосмос – это движение растворителя из осмотической ячейки в окружающую среду.
В результате экзосмоса вода диффундирует из клетки в плазму и происходит сжатие и сморщивание оболочки клетки, называемое плазмолизом. Экзосмос имеет место, если клетка оказывается в гипертонической среде. Явление экзосмоса наблюдается, например, при посыпании ягод или фруктов сахаром, а овощей, мяса, рыбы – солью. При этом происходит консервирование продуктов питания благодаря уничтожению микроорганизмов вследствие их плазмолиза.
Любое нарушение осмотического давления в тканях вызывает различные заболевания (так, например, отёки связаны с нарушением осморегуляции).
Временные нарушения осмотических свойств тканей вызывают различные физиологические ощущения. Например, чувство жажды, возникающее после приёма большого количества солёной пищи, связано с тем, что при этом возрастает содержание солей в клеточном соке организма. Потребность организма в воде для уменьшения осмотического давления тканевых растворов проявляется в виде чувства жажды. Известно, что в период сильной жары туристам и солдатам во время походов, а также рабочим горячих цехов дают солёное питьё (а ещё лучше поваренную соль). Этот, на первый взгляд, парадокс объясняется весьма просто. При сильной жаре с потом из организма удаляется значительное количество солей. Поскольку содержание солей в поте выше, чем в клеточном соке тканей человека, это приводит к нарушению осморегуляции, и осмотическое давление тканей становится ниже нормального. Однако организм на любое отклонение (как на повышение, так и на понижение осмотического давления) отвечает одинаковой реакцией – чувством жажды. Человек пьёт воду, но она только усиливает жажду. Чтобы избавиться от жажды, надо увеличить осмотическое давление тканей, то есть ввести в них не воду, а дополнительное количество солей.
Основную задачу осморегуляции выполняют почки. Осмотическое давление мочи в норме значительно выше, чем плазмы крови, что обеспечивает активный транспорт из крови в почку. Осморегуляция осуществляется под контролем ферментативных счистем. Нарушение их деятельности приводит к патологическим процессам. Так, например, при нефрите осмотическое давление у мочи может оказаться ниже, чем у крови, что вызовет обратный транспорт веществ.
Осмотическое давление – определение, уравнение и примеры
Определение осмотического давления
Осмотическое давление можно рассматривать как давление, необходимое для предотвращения распространения воды через барьер осмос, Другими словами, это относится к тому, как сильно вода «проталкивается», чтобы пройти через барьер, чтобы распространиться на другую сторону.
Осмотическое давление определяется растворенное вещество концентрация – вода будет «стараться» диффундировать в область с высокой концентрацией растворенного вещества, такого как соль, чем в область с низкой концентрацией.
В действительности, конечно, осмотическое давление – это не «желание» воды двигаться, а скорее продолжение естественного закона, согласно которому вся материя со временем будет случайным образом распределяться. Когда концентрации веществ различны в двух областях, и области имеют контакт друг с другом, случайное движение частиц заставит вещества диффундировать до решение равномерно по всей области.
Осмос является особенным диффузия воды через полупроницаемую мембрану. Таким образом, в случае осмоса растворенные вещества не могут двигаться, потому что они не могут проходить через мембрану. Однако вода может двигаться, и это происходит – проходя через мембрану в область с более высокой концентрацией растворенного вещества.
Это очень важный фактор в биологии, потому что внутриклеточная среда отличается от внеклеточной среды. Если изменяется внеклеточная среда, это может привести к попаданию воды в наши клетки.
Некоторые организмы, такие как растения, которые используют осмотическое давление для перемещения воды, воспользовались этим принципом. Но это также может угрожать здоровью клеток и организмов, когда во внеклеточной среде слишком много или слишком мало воды по сравнению с внутренней частью клетки.
Уравнение осмотического давления
Осмотическое давление может быть рассчитано с использованием следующего уравнения:
Важно отметить, что π не равно 3.14… в этом уравнении!
Вместо этого здесь «π» – символ, используемый для обозначения осмотического давления. Вы можете думать об этом уравнении как о решении для «π» так же, как о решении для X.
В символе «π» нет ничего особенного, кроме того, что на международном уровне химики согласились обозначать осмотическое давление.
М – молярная концентрация растворенного вещества. Молярная концентрация относится к фактическому количеству атомов, ионов или молекул растворенного вещества.
Это важно, потому что именно количество частиц определяет, как частицы взаимодействуют при осмосе, а не объем или вес.
Сколько моль – единица измерения частиц – весит, или сколько он занимает, будет варьироваться в зависимости от молекулярного веса и плотности растворенного вещества.
R – идеальная газовая постоянная.
Хотя постоянная идеального газа была создана для обозначения газов и их диффузии и поведения, она также применима к жидкостям.
В химии и жидкости, и газы считаются «жидкостями» – частицами, которые могут свободно диффундировать, в отличие от твердых тел, частицы которых удерживаются на месте прочными связями.
Т – температура в градусах Кельвина.
Один градус Кельвина равен одному градусу Цельсия, но между двумя измерительными системами есть важное различие.
Температура является мерой энергии в молекулах. При более высоких температурах молекулы движутся быстрее; при более низких температурах они движутся медленнее. Вот почему температура так важна для этого уравнения: чем быстрее частицы подвергаются случайному молекулярному движению, тем быстрее они будут диффундировать.
В градусах Цельсия «ноль градусов» считается точкой замерзания воды. Это произвольное число, выбранное учеными, потому что замерзание воды является обычным явлением. Температура по Цельсию может быть положительной (выше нуля) или отрицательной (ниже нуля).
Но в Кельвине «ноль градусов» – это температура, при которой не происходит молекулярного движения. На самом деле это абсолютный ноль – невозможно стать холоднее, чем «отсутствие молекулярного движения».
В результате Кельвин используется во многих химических уравнениях, потому что это абсолютная мера тепла. Если вещество находится при 300 градусах Кельвина, вы точно знаете, сколько тепла находится в веществе: всего 300 Кельвинов.
Примеры осмотического давления
Увядшие растения
Многие растения фактически используют осмотическое давление для поддержания формы своих стеблей и листьев.
Если вы сохранили растения в горшках, вы, вероятно, знаете, что ваши растения могут очень быстро увядать, если их не поливать. Но в течение нескольких минут после полива они могут взбодриться!
Это происходит потому, что стебли и листья многих растений по существу «надуваются» осмотическим давлением – соли в клетках заставляют воду всасываться через осмос, делая клетку упругой и упругой.
Если воды недостаточно, растение будет увядать, потому что его клетки становятся «спущенными». В научном плане они «гипертонический »- что означает« концентрация растворенного вещества слишком высока ».
Растения также могут демонстрировать силу осмотического давления по мере роста.
Возможно, вы видели растения, растущие сквозь асфальт, или корни деревьев, растущие сквозь кирпичи или бетон.
Это также стало возможным благодаря осмотическому давлению: по мере роста растений их клетки поглощают больше воды. Медленное, но неумолимое давление воды, движущейся через растительная клетка Мембраны действительно могут протолкнуть асфальт!
Эффекты обезвоживания – и чрезмерного увлажнения
Мы все знаем об опасности обезвоживания, когда недостаток воды может вызвать опасные последствия для нашего организма. Чего мы не могли бы понять, так это того, что эти эффекты напрямую связаны с осмотическим давлением.
Когда наши тела не имеют достаточного количества воды, вода может фактически выйти из наших клеток в наши кровь, Это может привести к тому, что концентрации солей и других растворенных веществ в наших клетках станут слишком высокими, что повлияет на клеточную функцию.
Когда мы пьем воду, вода попадает в организм через наши кровяные потоки и способна диффундировать обратно в наши клетки через осмос, восстанавливая их правильную функцию.
Возможно и обратное: на самом деле можно умереть, выпив слишком много воды.
Трудно случайно «передозировать» воду, но в экстремальных случаях, таких как соревнования по питью воды, можно выпить столько воды, что слишком много ее диффундирует в ваши клетки. В крайних случаях это может вызвать отек головной мозг.
Быстрая регидратация после тяжелой дегидратации может быть опасной по той же причине. Рекомендуется проводить регидратацию медленно, потому что внезапное заполнение обезвоженных клеток большим количеством воды может привести к их взрыву!
На рисунке ниже показано, как обезвоживание – или чрезмерное увлажнение – может влиять на наши клетки крови, вызывая их усыхание или взрыв:
викторина
1. Что из следующего НЕ верно для осмоса?A. Это относится конкретно к движению воды через полупроницаемую мембрану.B. Это может произойти только там, где есть мембрана, которая проницаема для воды.C. Это может относиться к любому диффузионному процессу с участием воды.D. Ни один из вышеперечисленных.
Ответ на вопрос № 1
С верно. Осмос относится только к диффузии воды через полупроницаемую мембрану. Другие типы диффузии, такие как диффузия без мембраны, не являются осмосом.
2. Что из следующего НЕ является переменной в уравнении для осмотического давления?A. π – значение 3.14…B. М – молярная концентрация растворенного вещества.C. Р – Закон идеального газа.D. Т – температура раствора в градусах Кельвина.
Ответ на вопрос № 2
верно. Это хитрый! Хотя символ «π» появляется в уравнении для осмотического давления, здесь он НЕ означает значение «3.14…», используемое в геометрии.
Вместо этого он просто используется как символ, представляющий решение вашего уравнения – осмотическое давление вашего решения. Здесь значение «π» является тем, каким оказывается осмотическое давление.