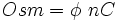в чем измеряется осмолярность
ОФС.1.2.1.0003.15 Осмолярность
Содержимое (Table of Contents)
ОФС.1.2.1.0003.15 Осмолярность
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
Взамен ГФ XII, ч. 1, ОФС 42-0047-07
Осмолярность – это характеристика растворов, выражающая их осмотическое давление через суммарную концентрацию кинетически активных частиц в единице объема раствора (мОсм/л).
Существующие инструментальные методы позволяют определять не осмолярность, а осмоляльность – концентрацию кинетически активных частиц на килограмм растворителя (мОсм/кг).
Кинетически активные частицы – это молекулы, ионы или ионные комплексы одного или нескольких растворенных веществ, свободно распределенные во всем объеме растворителя и обладающие способностью к хаотическому перемещению внутри раствора.
Осмолярность и осмоляльность характеризуют создаваемое растворами осмотическое давление.
Осмолярность является одной из важнейших характеристик инфузионных растворов. На этикетках растворов для инфузий должно быть указано теоретическое значение их осмолярности. В случае, когда теоретическая осмолярность не может быть рассчитана, указывают среднее значение осмоляльности для данного лекарственного средства.
Теоретическая осмолярность может быть рассчитана по формуле:
Сосм – осмолярность раствора, миллиосмоль на литр (мОсм/л);
m – содержание вещества в растворе, г/л;
M – молярная масса вещества, г;
n – суммарное число ионов, образующихся из одной молекулы растворенного вещества в результате диссоциации (n = 1 для недиссоциирующих веществ, n = 2, 3 для веществ, образующих при растворении соответствующее количество ионов).
На практике, количество частиц (n) несколько меньше теоретически рассчитанного и приближенно может быть описано формулой:

n — реальное количество частиц, образующихся при растворении данного вещества;
nо — теоретически рассчитанное количество частиц (n=1,2,3…);

Коэффициент 
Растворы, равные по осмолярности 0,9 % раствору натрия хлорида, называют изотоническими. Для изотонических растворов теоретически рассчитанные значения осмолярности находятся в пределах 239 – 376 мОсм/л.
Осмолярность растворов, состоящих из нескольких компонентов, может быть определена как сумма осмолярностей всех компонентов.
Концентрацию инфузионных растворов принято выражать как массо-объемную (в г/л), поэтому удобным представляется рассчитывать содержание кинетически активных частиц в миллиосмолях на литр (осмолярность), а не на килограмм (осмоляльность) раствора.
Различиями между значениями осмолярности и осмоляльности растворов с осмолярностью, близкой к осмолярности 0,7-1,1 % раствора натрия хлорида или ниже, можно пренебречь (теоретическое значение осмотического давления 0,9 % раствора натрия хлорида – 308 мОсм/л; экспериментальное значение – 286 мОсм/л); для более концентрированных растворов (например, 10 % раствора натрия хлорида) осмолярность может быть определена по формуле:
С(мОсм/л) = С(мОсм/кг) ∙ ρ (3)
где: ρ – плотность раствора, кг/л.
Примечания. 1. Расчет теоретических границ осмолярности проводят следующим образом: минимальное значение – осмолярность раствора, содержащего минимально допустимые количества ингредиентов; максимальное значение – осмолярность раствора, содержащего максимально допустимые количества ингредиентов.
Определение осмоляльности водных растворов
Для определения осмоляльности могут быть использованы следующие методы: криоскопический, мембранная и паровая осмометрия.
Криоскопический метод
Метод основан на понижении точки замерзания растворов по сравнению с точкой замерзания чистого растворителя.
1 осмоль на килограмм воды понижает точку замерзания на 1,86 °С. Измерение этих изменений лежит в основе криоскопического метода.
Данная зависимость может быть выражена следующей формулой:
Сосм — осмоляльность раствора (мОсм/кг)
Т2 — температура замерзания чистого растворителя (˚С);
Т1 — температура замерзания испытуемого раствора (˚С);
К — криометрическая постоянная растворителя (для воды: 1,86).
В настоящее время определение осмоляльности растворов проводится с использованием автоматических криоскопических осмометров.
Необходимое количество испытуемого раствора помещают в ячейку прибора. Далее проводят измерение согласно инструкции, прилагаемой к прибору. При необходимости прибор калибруют с помощью стандартных растворов натрия или калия хлорида, которые перекрывают определяемый диапазон осмоляльности (таблица 1).
Таблица 1 – Стандартные справочные значения понижения температуры замерзания и эффективности осмотической концентрации водных растворов натрия и калия хлоридов
| Аналитическая концентрация соли р, г/кг Н2O | Понижение температуры замерзания DТзам., К | Эффективная (осмотическая) концентрация mэф, ммоль/кг Н2O |
| Растворы натрия хлорида | ||
| 5,649 | 0,3348 | 180 |
| 6,290 | 0,3720 | 200 |
| 9,188 | 0,5394 | 290 |
| 9,511 | 0,5580 | 300 |
| 11,13 | 0,6510 | 350 |
| 12,75 | 0,7440 | 400 |
| 16,00 | 0,9300 | 500 |
| Растворы калия хлорида | ||
| 7,253 | 0,3348 | 180 |
| 8,081 | 0,3720 | 200 |
| 11,83 | 0,5394 | 290 |
| 12,25 | 0,5580 | 300 |
| 14,78 | 0,6696 | 360 |
| 20,71 | 0,9300 | 500 |
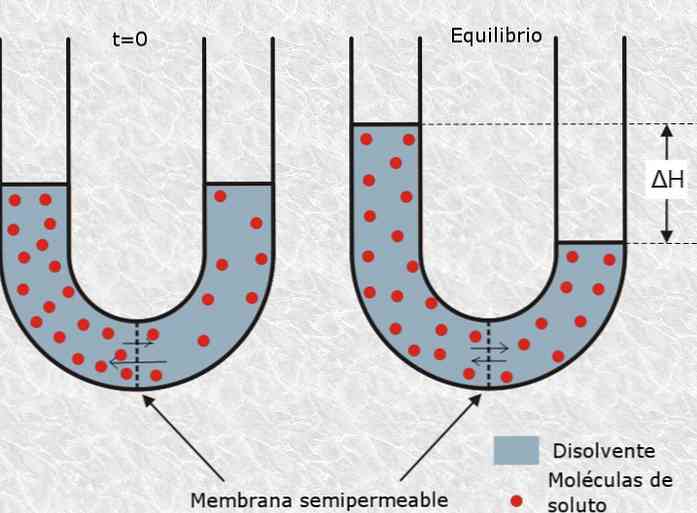
Метод мембранной осмометрии
Метод основан на использовании свойства полупроницаемых мембран избирательно пропускать молекулы веществ.
Движущей силой процесса является процесс осмоса. Растворитель проникает в испытуемый раствор до установления равновесия; возникающее при этом дополнительное гидростатическое давление приближенно равно осмотическому давлению и может быть рассчитано по формуле:

Осмоляльность может быть рассчитана по формуле:
где R – универсальная газовая постоянная (8,314 Дж/мольК)
T – абсолютная температура (˚K).
Примечание. Данный метод применим только для растворов высокомолекулярных веществ (10 4 – 10 6 г/моль). При анализе растворов, содержащих электролиты и другие низкомолекулярные вещества, будет определяться только осмотическое давление, создаваемое высокомолекулярными компонентами раствора.
Определение осмоляльности испытуемого раствора проводят с помощью мембранного осмометра. Предварительную калибровку прибора и измерения проводят в соответствии с инструкцией к прибору.
Метод паровой осмометрии
1 осмоль на килограмм воды понижает давление пара на 0,3 мм рт. ст. при температуре 25 °С. Измерение этих изменений лежит в основе метода паровой осмометрии.
Метод основан на измерении разности температур, которая возникает на термисторах, помещенных в измерительную ячейку, насыщенную парами растворителя в случае, если на один из них нанесена капля чистого растворителя, а на другой — испытуемого раствора. Разница температур возникает по причине конденсации паров растворителя на капле раствора, так как давление пара растворителя над этой поверхностью меньше. При этом температура капли раствора повышается за счет экзотермического процесса конденсации до тех пор, пока давление пара над каплей раствора и давление чистого растворителя в ячейке не сравняются. При нанесении на оба термистора чистого растворителя разность температур равна нулю. Разность температур практически пропорциональна моляльной концентрации раствора.
Определение осмоляльности испытуемого раствора проводят с помощью парового осмометра. Предварительную калибровку прибора и измерения проводят в соответствии с инструкцией к прибору.
Осмоляльность
Осмоти́ческая концентра́ция — суммарная концентрация всех растворённых частиц.
Может выражаться как осмолярность (осмоль на литр раствора) и как осмоляльность (осмоль на кг. растворителя).
Осмоль — единица осмотической концентрации, равная осмоляльности, получаемой при растворении в одном кг. растворителя одного моль неэлектролита. Соответственно, раствор неэлектролита с концентрацией 1 моль/л имеет осмолярность 1 осмоль/литр.
Осмолярность электролита зависит от его концентрации, коэффициента диссоциации и числа ионов, на которые он диссоциирует:
От осмолярности зависят так называемые коллигативные свойства растворов: депрессия точки замерзания (чем выше осмолярность, тем ниже температура замерзания раствора), повышение точки кипения (чем выше осмолярность, тем выше температура кипения) и осмотическое давление.
См. также
Полезное
Смотреть что такое «Осмоляльность» в других словарях:
Гипокалиемия — МКБ 10 E … Википедия
Грудно́е молоко́ — (синоним женское молоко) секрет молочных желез женщины, имеющий видобиологическую специфичность. Является наилучшим видом пищи для обеспечения полноценного развития ребенка первого года жизни. В течение первых дней лактации выделяется молозиво,… … Медицинская энциклопедия
Гиперосмолярные растворы в комплексе лечения больных с внутричерепными кровоизлияниями — Одной из важных задач интенсивной терапии больных с внутричерепными кровоизлияниями, находящихся в критическом состоянии, является коррекция повышенного внутричерепного давления [1][2][3]. Увеличение внутричерепного давления (ВЧД) приводит к… … Википедия
Гемодилюция управляемая — I Гемодилюция управляемая (греч haima кровь + лат. dilutio разведение) дозированное разбавление циркулирующей крови кровезамещающими средствами. Улучшает реологические свойства крови, уменьшает агрегацию ее форменных элементов, ускоряет удаление… … Медицинская энциклопедия
Диурез — I Диурез (diuresis; греч. diureō выделять мочу) количество мочи, выделенное за определенный промежуток времени (сутки, час, минуту). У здорового взрослого человека суточный Д. составляет до 75% от количества выпитой жидкости. Минимальный объем… … Медицинская энциклопедия
Гадовист — Действующее вещество ›› Гадобутрол* (Gadobutrol*) Латинское название Gadovist АТХ: ›› V08CA09 Гадобутрол Фармакологическая группа: Магнитно резонансные контрастные средства Нозологическая классификация (МКБ 10) ›› G999* Диагностика болезней… … Словарь медицинских препаратов
Изокал — Латинское название Isocal Фармакологическая группа: Биологически активные добавки к пище (БАДы) Нозологическая классификация (МКБ 10) ›› E46 Белково энергетическая недостаточность неуточненная ›› E61 Недостаточность других элементов питания… … Словарь медицинских препаратов
Кабивен периферический — Действующее вещество ›› Аминокислоты для парентерального питания+Прочие препараты [Жировые эмульсии для парентерального питания + Декстроза + Минеральные соли] (Aminoacids for parenteral nutrition+Other medicines [Fat emulsions + Dextrose +… … Словарь медицинских препаратов
Кабивен центральный — Действующее вещество ›› Аминокислоты для парентерального питания+Прочие препараты [Жировые эмульсии для парентерального питания + Декстроза + Минеральные соли] (Aminoacids for parenteral nutrition+Other medicines [Fat emulsions + Dextrose +… … Словарь медицинских препаратов
Клинутрен Оптимум — Латинское название Clinutren Optimum Фармакологическая группа: Средства для энтерального и парентерального питания Нозологическая классификация (МКБ 10) ›› E46 Белково энергетическая недостаточность неуточненная ›› Z98.8 Другие уточненные… … Словарь медицинских препаратов
Формула осмолярности, как ее вычислить и разница с осмоляльностью
осмолярность является параметром, который измеряет концентрацию химического соединения в литре раствора, если он способствует коллигативному свойству, известному как осмотическое давление указанного раствора.
В этом смысле осмотическое давление раствора относится к количеству давления, необходимому для замедления процесса осмоса, которое определяется как избирательное прохождение частиц растворителя посредством полупроницаемой или пористой мембраны из раствора. от более низкой концентрации к более концентрированной.
Кроме того, единицей измерения количества растворенных частиц является осмол (символом которого является Осм), который не является частью Международной системы единиц (СИ), используемой почти во всем мире. Поэтому концентрация растворенного вещества в растворе определяется в единицах осмолей на литр (Осм / л).
формула
Как упоминалось ранее, осмолярность (также известная как осмотическая концентрация) выражается в единицах, определенных как осм / л. Это связано с его взаимосвязью с определением осмотического давления и измерением диффузии растворителя с помощью осмоса..
На практике осмотическая концентрация может быть определена как физическая величина с использованием осмометра..
Таким образом, для расчета этого параметра измерения используется следующая формула, которая учитывает все факторы, которые могут повлиять на это свойство..
В этом уравнении осмолярность определяется как сумма, полученная в результате умножения всех значений, полученных по трем различным параметрам, которые будут определены ниже..
Определение переменных в формуле осмолярности
Во-первых, это осмотический коэффициент, представленный греческой буквой φ (фи), который объясняет, как далеко удаляется решение идеального поведения, или, другими словами, степень неидеальности, которую растворенное вещество проявляет в решении.
Проще всего, φ относится к степени диссоциации растворенного вещества, которая может иметь значение от нуля до единицы, где максимальное значение единицы представляет собой диссоциацию 100%; то есть абсолют.
В некоторых случаях, таких как сахароза, эта величина превышает единицу; в то время как в других случаях, таких как влияние солей, влияние электростатических взаимодействий или сил вызывает осмотический коэффициент со значением, меньшим единицы, даже если происходит абсолютная диссоциация.
С другой стороны, значение n указывает количество частиц, в которых молекула может быть диссоциирована. В случае ионных частиц в качестве примера приведен хлорид натрия (NaCl), значение n которого равно двум; тогда как в неионизированной молекуле глюкозы значение n равно единице.
Наконец, значение с представляет концентрацию растворенного вещества, выраженную в мольных единицах; и нижний индекс i относится к идентичности конкретного растворенного вещества, но он должен быть одинаковым при умножении трех факторов, упомянутых выше, и, таким образом, получении осмолярности.
Как рассчитать?
В случае ионного соединения KBr (известного как бромид калия), если у вас есть раствор с концентрацией, равной 1 моль / л KBr в воде, предполагается, что он имеет осмолярность, равную 2 осмоль / л..
Аналогично для раствора с концентрацией, равной 1 моль / л BaCl2 (известный как хлорид бария) в воде, он имеет осмолярность, равную 3 осмоль / л.
С другой стороны, неионные вещества не подвергаются такой диссоциации и генерируют один осмол на каждый моль растворенного вещества. В случае раствора глюкозы с концентрацией, равной 1 моль / л, это равняется 1 осмоль / л раствора.
Различия между осмолярностью и осмоляльностью
Осмол определяется как количество частиц, которые растворяются в объеме, равном 22,4 л растворителя, при температуре 0 ° С и которые вызывают образование осмотического давления, равного 1 атм. Следует отметить, что эти частицы считаются осмотически активными.
В этом смысле свойства, известные как осмолярность и осмоляльность, относятся к одному и тому же измерению: концентрация растворенного вещества в растворе или, другими словами, содержание общих частиц растворенного вещества в растворе..
Принципиальное различие, которое установлено между осмолярностью и осмоляльностью, заключается в единицах, в которых каждый представлен:
Осмолярность выражается в количестве вещества на объем раствора (то есть, осмоль / л), тогда как осмолярность выражается в количестве вещества на массу растворителя (то есть, осмоль / кг раствора)..
На практике оба параметра используются безразлично, даже проявляя себя в разных единицах, из-за того, что между суммарными величинами разных измерений существует незначительная разница.
Осмолярность крови (плазмы): суть, анализ, норма и отклонения
Осмолярность крови (ОСК) подразумевает осмолярность плазмы, поскольку именно в ней растворены осмотически активные вещества. Осмолярность плазмы крови – это совокупность всех растворенных в одном ее литре кинетически активных частичек (анионов, катионов, органических соединений).
Какие они – осмотически активные вещества, которые определяют показатель, называемый осмолярностью крови? Прежде всего, это катионы натрия (Na+), которые вместе с анионами хлора (Cl-) обусловливают осмотическую активность плазмы, а также анион гидрокарбоната (НСО3-). Осмотически активные ионы свободно проходят через капиллярную стенку, попадают внутрь сосуда, где забирают молекулы воды (Н2О) и уносят ее в межклеточное (интерстициальное) пространство. Например, всего один ион натрия способен захватывать до 300 молекул Н2О.
Осмолярность плазмы крови – значимый лабораторный показатель, применяемый в клинической лабораторной диагностике для выявления ОПН (острая почечная недостаточность) на ранних этапах ее развития, когда другие биохимические тесты (creat – креатинин, urea – мочевина) еще «молчат».
Нормы осмолярности для ликвора, крови, мочи и всего организма
Нормальные значения осмолярности таких биологических жидкостей, как, кровь, вернее, ее сыворотка (плазма), а также спинномозговая жидкость (ликвор) мало отличаются, чего нельзя сказать о моче, в которой нормы данного параметра превосходят в 2 – 4 раза.
Таблица 1. Нормальные значения осмолярности различных биологических сред организма
| Биологическая среда | Границы нормы |
|---|---|
| Плазма (сыворотка) крови | 280 – 300 мосм/л |
| Цереброспинальная жидкость (ликвор) | 270 – 290 мосм/л |
| Урина (моча) | 600 – 1200 мосм/л |
| ИО (индекс осмолярности) | 2,0 – 3,5 |
| КСВ (клиренс свободной воды) | (-1,2) – (-3,0) мл/мин |
Числовые показатели осмолярности крови у детей, хотя и не столь существенно, но все же отличны от таковых у взрослых (таблица 2). ОСК (норма) у детей начинает изменяться, начиная с 9-месячного возраста. К году она достигает 280 – 300 мосм/л (норма взрослого человека), оставаясь в данных пределах, независимо от возраста человека – до конца жизни.
Таблица 2. Норма осмолярности плазмы крови у детей
Следует заметить, что приведенные выше нормы для взрослых и детей могут отличаться от таковых в других лабораториях. В связи с этим пациентам нужно в первую очередь ориентироваться на границы нормальных значений, обозначенные в бланке анализа конкретной лаборатории.
Факторы, которые поддерживают значения осмолярности
Катионы натрия и другие осмотически активные вещества создают осмотическое давление (ОД) в водных пространствах организма.
Натрий – внеклеточный катион (Na+), рост его концентрации в плазме в любом случае приведет к увеличению ОД. При этом будет стимулирован питьевой центр (центр жажды) и повысится производство антидиуретического гормона (АДГ) – вазопрессина. Влияние вазопрессина на V2-рецепторы канальцев почек повысит обратное всасывание воды и ее задержку в организме.
При снижении содержания этого внеклеточного катиона можно ожидать обратный эффект: питьевой центр подавляется, производство антидиуретического гормона падает, мочевыделение – усиливается. Подобные изменения в ту или иную сторону концентрации ионов натрия обычно (за исключением отдельных случаев) идут параллельно колебаниям значений осмолярности плазмы крови.
Определенную роль в данном случае играют белки и, хотя само по себе ОД, которое создают протеины незначительно, оно существенным образом влияет на обмен воды между внутрисосудистым водным пространством и интерстициальной частью. Немаловажными факторами влияния в изменениях осмолярности плазмы крови можно назвать глюкозу и мочевину. И особенно их эффект заметен при развитии патологических процессов, поэтому для расчета теоретической осмолярности у больного берут кровь на определение уровня:
Получив значения концентраций перечисленных показателей, производят расчет теоретической осмолярности крови по формуле:
Осмолярность плазмы (сыворотки) = 2 х натрий (Na, ммоль/л) + мочевина (CH4N2O, ммоль/л) + глюкоза (C6H12O6, ммоль/л).
Другие показатели, связанные с ОСК
Таким образом, осмолярность крови (плазмы или сыворотки) – важный параметр, свидетельствующий о сохранении либо расстройстве динамического равновесия воды в организме. Его измеряют с помощью специального лабораторного оборудования или рассчитывают по формуле после проведения необходимых биохимических анализов (натрий, мочевина, глюкоза).
Кроме описываемого объекта исследования (осмолярность), в таблице, расположенной выше, приведены и другие лабораторные тесты: клиренс свободной воды (КСВ – довольно чувствительный и важный показатель концентрационной способности почек) и индекс осмолярности (ИО – соотношение осмолярности мочи и плазмы крови). Они имеют прямое отношение к определению функциональных способностей почек при развитии острой почечной недостаточности (ОПН) и также рассчитываются по формулам.
Правда, и это пока не все: существует еще один показатель, имеющий отношение к осмолярности, который называется осмотическим окном. Норма его – менее 6 мосм/л. Осмотическое окно измеряется в мосм/л или мосм/кг, рассчитывается, исходя из значений ОСК, полученной при осмометрии – фактической, и ОСК, выведенной по формуле – теоретической:
Осмотическое окно = ОСК факт. – ОСК теорет.
Например, 287 мосм/кг – 284 мосм/кг = 3 мосм/кг (соответствует норме). Если осмотическое окно больше 6, но меньше 10 мосм/л, то врачи подозревают развитие кето-, лактат- либо почечного ацидоза. Если же уровень данного показателя пересекает 10 мосм/л и стремится к повышению, то появляются основания думать о тяжелом отравлении (этиловым или метиловым спиртом, а также другими органическими веществами, которые способны влиять на ОСК).
Помощь осмометрии и расчета осмолярности в диагностике и лечении
Определение осмолярности крови и мочи, расчет индекса осмолярности и клиренса свободной воды по формуле – исследования отнюдь не простые. Различные способы осмометрии (метод повышения точки закипания, метод депрессии точки замерзания) используются не каждым лечебным учреждением и представляют собой сложные лабораторные анализы. Однако в медицине осмолярность крови считается важным диагностическим критерием, поскольку этот индикатор позволяет установить ряд патологических состояний или даже прогнозировать их (развитие ОПН), когда классические показатели пока не реагируют. Очевидно, что в первую очередь это касается тяжелых заболеваний почек. Концентрации креатинина и мочевины, исследуемые в подобных ситуациях, изменятся лишь спустя некоторое время (ОПН – от 3 до 4 суток), когда половина структурных единиц почки, занятых производством мочи (нефронов), выйдет из строя и не сможет осуществлять свое функциональное назначение. Определение осмолярности плазмы и мочи, индекса осмолярности и клиренса свободной воды позволит прогнозировать и/или выявлять развитие острой почечной недостаточности уже на 1 – 2 сутки.
Таким образом, данный показатель будет применен и окажет помощь в диагностике:
Кроме этого, от данного лабораторного теста будет помощь в лечении заболеваний, требующих проведения трансфузионно-инфузионных мероприятий (оценка эффективности терапии), а также гипоосмолярных гипергидратаций и коматозных состояний, сопровождаемых повышением осмолярности плазмы крови.
О чем свидетельствует анализ?
Как разобраться в полученных на руки анализах? Наверное, это возможно, если попробовать руководствоваться приведенными ниже ориентирами:
Между тем, все не так просто, поскольку, ориентируясь на концентрацию натрия, можно столкнуться с парадоксальными ситуациями, которые следует учитывать, к примеру: натрий в крови и ОСК снижаются, а осмолярность мочи растет. При этом в чрезмерно концентрированной моче отмечается увеличение содержания Na+. Подобные обстоятельства могут быть обусловлены влиянием такого этиологического фактора, как СНСАДГ (синдром несоответствия секреции антидиуретического гормона), при котором производство АДГ не зависит от того, насколько организм нуждается в воде. И получается, что для полноты картины, свидетельствующей о состоянии организма, необходимо определить количество натрия в крови и моче, а также провести анализ на осмолярность данных биологических сред. Кроме этого, в бланке анализа должен присутствовать и такой показатель, как сахар крови (гипергликемия увеличивает ОСК) и мочевина.
Безусловно, есть и другие примеры несоответствия некоторых показателей между собой, однако эта информация может только запутать пациента. А речь идет только об осмолярности крови…