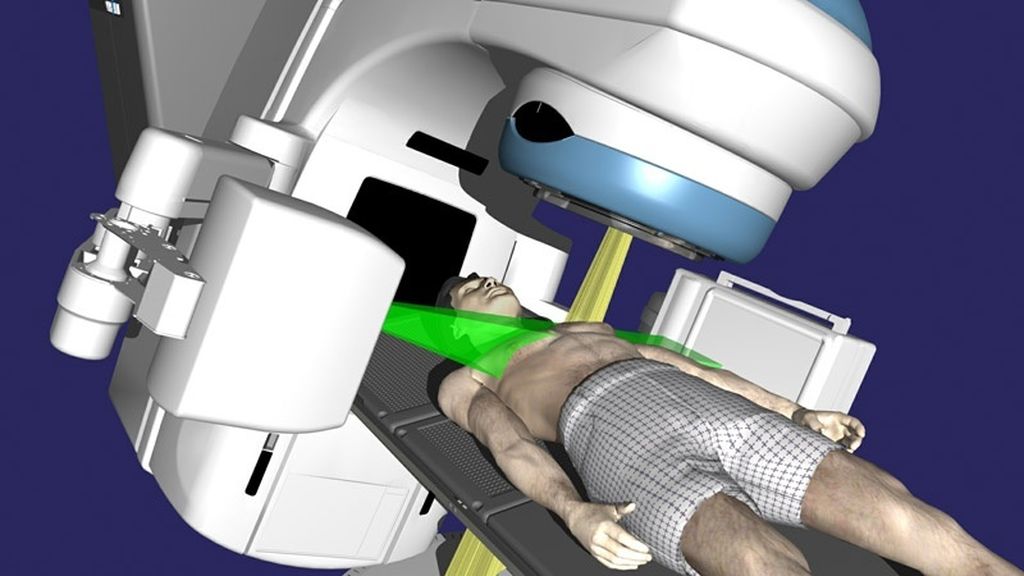
в чем измеряется облучение при лучевой терапии
Мощность дозы рентгеновского излучения
Содержание
В чём измеряется мощность дозы рентгеновского излучения и как происходит радионуклидное накопление в человеческом организме?
Какой объем накопленного ионизирующего облучения критичен для здоровья?
Системные и внесистемные единицы измерения
В процессе научного открытия и последующего изучения источников ионизирующего излучения и радиоактивности возникла необходимость во введении специальных единиц измерения. Первыми такими единицами стали Кюри и Рентген. Изначально в мировой практике исследования радиоактивного фона полностью отсутствовала систематизация, поэтому сегодня первичные единицы измерения принято называть внесистемными.
В настоящее время подавляющим большинством государств принята единая интернациональная система измерения (CI). В Российской Федерации переход на CI был начат в январе 1982 года. Предполагалось, что он будет завершен к январю 1990 года, но политические и экономические события в стране существенно затянули данный процесс. Тем не менее, вся современная дозиметрическая аппаратура выпускается с учётом градуирования в новых единицах измерения.
За несколько десятилетий активного изучения и практического применения рентгеновского излучения было введено большое количество различных единиц измерения дозы: Бэр, Грэй, Беккерель, Рад, Кюри и многие другие. Они используются в различных системах измерения и сферах радиологии. В контексте рентгенодиагностики наиболее часто употребляемые – Зиверт и Рентген.
Области применения Рентгена и Зиверта
Рентген сегодня считается устаревшей единицей измерения. Сфера её применения за последние годы существенно сузилась. Чаще всего она теперь используется для отображения общего излучения, тогда как размер полученной человеком дозы обозначается Зивертами.
Еще одно современное применение единицы измерения Рентген – определение характеристик рентгеновского аппарата, в том числе уровня излучаемой им проникающей радиации.
Для объективной и максимально точной оценки воздействия радиоактивного фона на человеческий организм используется понятие – эквивалентная поглощенная доза. ЭПД дает возможность определить количественную величину поглощенной организмом энергии. Анализ проводится с учетом биологической реакции отдельных тканей тела на ионизирующее излучение. При определении показателей применяется единица измерения – Зиверт. Она равна примерно 100 Рентген.
Тысячные и миллионные доли Зиверта/Рентгена
Мощность получаемой дозы облучения при прохождении рентгенодиагностики в десятки раз ниже показателя в 1 зиверт. Многократно ниже данной единицы измерения и естественный фон облучения. Поэтому для проведения более корректных замеров были введены такие понятия, как миллизиверт (мЗв) и микрозиверт (мкЗв). Один зиверт равен тысяче миллизиверт, или одному миллиону микрозиверт. Аналогичные значения применяются и по отношению к Рентгену.
Мощность дозы принято отображать в виде количественной части полученного облучения за определённый временной промежуток. Наиболее распространенные единицы времени: секунды, минуты и часы. Следовательно, часто используемые показатели: зв/ч, мзв/, р/ч, мр/ч и так далее.
Допустимый объём накопленного в организме облучения
Доза облучения при воздействии на человеческий организм имеет накопительное свойство. Учеными определен критический порог накопленных на протяжении жизни Зивертов в организме, превышение которого чревато негативными последствиями. Безопасный объем накопленного облучения находится в диапазоне от 100 до 700 миллизивертов.
Для коренных жителей высокогорных районов данные показатели могут быть немного выше.
Основные источники накопления в организме радионуклидных соединений
Ионизирующее излучение происходит вследствие инерционного высвобождения магнитных волн при активном взаимодействии атомов. Источники ионизирующего излучения делятся на природные и искусственные.
Природные ионизирующие излучения
К числу природных источников излучения в первую очередь относится естественный радиационный фон. В различных районах планеты фиксируется разный уровень радиации. На его размер оказывают прямое влияние следующие факторы:
Оптимальным для жизни считается радиационный фон 0,2 микрозиверта в час (или 20 микрорентген в час). Верхний порог допустимого уровня: 0,5 микрозивертов в час (50 микрорентген в час).
В зоне радиационного фона до 10 мкЗв/ч (1 мР/ч) возможно безопасное нахождение на протяжении 2-3 часов. Более продолжительное пребывание способно повлечь критические последствия.
Источники накопления дозы естественного излучения в организме
Среднестатистическая накапливаемая в человеческом организме доза естественного излучения составляет примерно 2–3 мЗв в год. Она складывается из следующих показателей:
Одним из источников природного ионизирующего излучения является сам человеческий организм, производящий собственные отложения радионуклидных соединений. Среднестатистический уровень одного только скелета колеблется от 0,1 до 0,5 мЗв.
Искусственные ионизирующие излучения
К источникам искусственного ионизирующего облучения в первую очередь относятся медицинские аппараты, применяемые во время проведения рентгеновской диагностики или терапии. В разных видах рентгеновского обследования различная величина эквивалентной поглощенной дозы. Также на мощность дозы облучения влияет срок выпуска и эксплуатационная нагрузка используемого рентген аппарата.
Рентгеновская аппаратура последнего поколения подвергает человеческий организм облучению в несколько десятков раз ниже, чем предшествовавшие модели. Современные цифровые аппараты практически безопасны.
Размер доз облучения при рентгенодиагностике
Мощность дозы рентгеновского излучения в современных аппаратах по сравнению с их предыдущими модификациями:
При рентгеноскопической диагностике происходит визуальное обследование органов с оперативным выводом необходимой информации на монитор компьютера. В отличие от фотографического метода, данный тип диагностики подвергает пациента меньшей дозе облучения за равную единицу времени. Но в некоторых случаях обследование может проводиться более длительное время.
При диагностике продолжительностью до 15-ти минут средняя мощность полученной дозы колеблется от 2 до 3,5 мЗв.
Во время проведения диагностики желудочно-кишечного тракта человек получает дозу облучения до 6-ти миллизивертов. При компьютерной томографии – от 2-х до 6-ти миллизивертов (мощность получаемой дозы напрямую зависит от диагностируемых органов).
При проведении сравнительного анализа получаемой человеком дозы ионизирующего облучения от аппаратов рентгенодиагностики и повседневном пребывании в привычной окружающей среде учёными были получены следующие данные:
Согласно законодательству Российской Федерации по радиационной безопасности допустимой нормой рентгеновского облучения (средняя годовая эффективная доза) является обобщенная доза в 70 мЗв, полученная в течение 70-ти лет жизни.
Что такое лучевая терапия? Словарь радиотерапевта
Елена Ивановна Тюряева, онколог и радиотерапевт НМИЦ онкологии им. Н.Н. Петрова, рассказала о возможностях современной лучевой терапии и ее значении в борьбе с онкологическими заболеваниями.
Когда появилась лучевая терапия?
В 1896 году в Вене доктор Фройнд впервые в мире применил рентгеновское излучение не для диагностики заболевания, а для лечения поверхностно расположенного доброкачественного образования. Несколькими годами позднее супруги Пьер и Мария Кюри открыли радиоактивный радий, который стал использоваться для контактной радионуклидной терапии.
За 125 лет лучевая терапия, проделав огромный путь совершенствования, получила широкое применение и вышла на качественно новый уровень. По мнению экспертного сообщества, в настоящее время не менее 60-70 % всех онкологических пациентов нуждается в лучевой терапии.
Что такое лучевая терапия?
Лучевая терапия – это процесс использования ионизирующего излучения для лечения различных заболеваний, прежде всего, онкологических. Это один из самых высокотехнологичных методов терапии, объединяющий инженерно-технические разработки, физико-математические модели и достижения информационных технологий. Лучевая терапия требует специалистов-радиотерапевтов знаний в области биологии, анатомии, радиобиологии, лучевой диагностики и общей онкологии.
Цели лучевой терапии
Задача лучевой терапии – достижение максимально возможного воздействия на опухоль и зоны ее клинического и субклинического распространения с высокой степенью точности и минимальными последствиями для окружающих тканей и органов. Цель лучевой терапии – разрушение опухолевой массы, в идеале приводящее к ее ликвидации или уменьшению размеров и метастатического потенциала, замедлению роста, что способствует продлению жизни и улучшению ее качества.
Лучевая терапия может использоваться на разных этапах лечения:
Предоперационная лучевая терапия
Задача предоперационной лучевой терапии — максимальное уменьшение объема опухоли, предотвращение попадания опухолевых клеток в лимфатическую или кровеносную систему, снижение риска развития отдаленных метастазов. При большинстве типов опухолей наиболее часто используется тандем лучевой и химиотерапии. Такое комбинированное воздействие позволяет в дальнейшем выполнить радикальное вмешательство с полным удалением новообразование. В ряде случаев предоперационная лучевая/химиолучевая терапия может приводить к полному регрессу опухоли, таким образом оказываясь самостоятельным методом лечения. Достижение полного клинического регресса, доказанное рентгенологическими методами (КТ, МРТ, ПЭТ-КТ) и подкрепленное данными биопсии, увеличивает возможность отсрочки или отказа от операции. Так, для опухолей прямой кишки, с полным клиническим ответом на химиолучевую терапию, получила признание концепция «waitandsee», т.е. «жди и наблюдай», закрепленная в международных и национальных стандартах лечения.
Интраоперационная лучевая терапия
Интраоперационная лучевая терапия – это облучение ложа опухоли сразу же после удаления ее хирургическим путем, непосредственно в операционном поле. Это действенный метод снижения риска развития местного рецидива. Интраоперационная лучевая терапия используется при опухолях молочной железы, при саркомах мягких тканей и даже при новообразованиях ЖКТ. Этот метод очень эффективен, но не лишен недостатков. Во-первых, для ее проведения необходимы специальные мобильные и компактные лучевые установки, которые могут располагаться в операционной. Во-вторых, однократная доза облучения может оказаться недостаточной, а объем интраоперационно облучаемых тканей достаточно ограничен. Интраоперационная лучевая терапия не позволяет воздействовать на пути лимфоотока. Трудно обеспечить точность дозиметрического планирования. Лучевая процедура увеличивает время пребывания пациента под наркозом и общую продолжительность вмешательства. Поэтому чаще интраоперационная лучевая терапия является составной частью сочетанного облучения, этапом комплексного лечения.
Послеоперационная лучевая терапия
Послеоперационная лучевая терапия – это воздействие на зону удаленной опухоли и пути лимфооттока для того, чтобы предотвратить возможность распространения отдельных опухолевых клеток в ходе хирургического вмешательства, т.е. снижения рисков развития местных и отдаленных метастазов. Послеоперационная лучевая терапия бывает необходима и после обширных операций, и после малоинвазивных вмешательств. В настоящее время наиболее часто применяется в лечении рака молочной железы, сарком мягких тканей, опухолей головы и шеи.
Самостоятельная или дефинитивная лучевая терапия
Самостоятельная лучевая/химиолучевая терапия показана в тех случаях, когда ее эффективность сравнима с радикальным оперативным лечением, т.е. при раннем раке, или, напротив, когда радикальное вмешательство невозможно – при наличии общих противопоказаний или из-за распространенности опухоли. В настоящее время рассматривается в качестве альтернативного метода лечения ранних опухолей голосового отдела гортани, ряда новообразований кожи. Наибольшее применение нашла в лечении рака предстательной железы. В сочетании с химиотерапией успешно используется при ранних опухолях пищевода, анального канала. Химиолучевое лечение является ведущим методом лечения рака шейки матки.
Наконец, лучевая терапия применяется для устранения симптомов опухолевого заболевания, таких, как боль, нарушение глотания и др. (симптоматическая лучевая терапия) или сдерживания опухолевого процесса (паллиативная лучевая терапия).
Технология лучевой терапии
Последовательность лечебных мероприятий для каждого больного принимается на онкологическом консилиуме в составе хирурга-онколога, химиотерапевта и радиотерапевта. Определив показания к лучевому лечению, врач-радиотерапевт формулирует общий план лечения: продолжительность курса, режим фракционирования дозы (доза за один сеанс облучения), суммарную дозу облучения, необходимость одновременного химиолучевого лечения, применения радиомодификаторов. Проведению сеансов облучения предшествуетэтап предлучевой подготовки.
Предлучевая подготовка включает:
Компьютерная топометрия
Создание индивидуальной дозиметрической карты облучения начинается с компьютерной топометрии, которую проводит врач-рентгенолог совместно с радиотерапевтом. На компьютерном томографе-симуляторе, с теми же фиксирующими приспособления и в том же положении, в котором будет проводиться лечение, сканируется область анатомического расположения опухоли (грудная клетка, брюшная полость, головной мозг и т.д.). Оцениваются структурные и анатомические особенности — локализация опухоли, протяженность объема, взаимоотношение со смежными органами, плотность внутренних тканей. Во время этой процедуры на кожу больного выносятся графические ориентиры –метки для центрации пучков излучения, которые в дальнейшем позволят ускорить навигацию в процессе проведения сеансов лечения. Последовательность компьютерных сканов передается на планирующую станцию для создания индивидуального плана облучения.
Контуринг мишени и смежных органов
Дальше наступает этап обработки полученных изображений. Сканы импортируются в планирующую систему, где врач-радиотерапевт с помощью врача-рентгенолога производит выделение очертаний (оконтуривание) опухолевой мишени, всех смежных органов в каждом полученном скане. На основании совокупности объемных изображений в дальнейшем производится расчет дозных нагрузок в ходе лечения на опухоль и соседние органы с учетом их толерантности к облучению.
Дозиметрическое планирование
После завершения оконтуривания, оценки расположения опухоли и смежных органов, наступает этап дозиметрического планированиякурса лучевого лечения, который выполняется медицинскими физиками.Дозиметрическое планирование – это подбор количества и условий формирования пучков излучения, их пространственного размещения для того, чтобы подвести к опухоли максимально возможную терапевтическую дозу с минимальными последствиями для соседних органов. Современные медицинские ускорители, обладающие многолепестковыми коллиматорами, позволяют формировать поля сложной конфигурации, максимально точно соответствующие объему и форме облучаемой мишени, производя т.н. конформное облучение. Исходя из поставленных задач, оптимальный охват мишени может быть спланирован с использованием 3D многопольного облучения с объемно-модулируемой интенсивностью (IMRT) или дуговой модулируемой интенсивностью пучка излучения (VMAT).
На изображении представлен пример 3D многопольного излучения. Видно, что для облучения опухоли используется 3 пучка.
Средства иммобилизации пациента
Для того, чтобы осуществлять точную подачу ионизирующего излучения к облучаемой мишени, необходимо четко воспроизводить то положение, в котором шел процессе подготовки к лучевому лечению, т.е. компьютерная топометрия и дозиметрическое планирование. Это обеспечивается разнообразными средствами для укладки, иммобилизации пациента. Они могут быть в виде разных штатных дек с подголовниками, креплениями, валикамии подставками для рук, ног, таза. Есть и индивидуальные средства. Например, вакуумные матрасы и термопластические маски, фиксирующие индивидуальные формы тела пациента в положении облучения. Эти приспособления позволяют избегать смещения облучаемой зоны из-за непроизвольных движений пациента.
Виды лучевой терапии
Дистанционная лучевая терапия
При дистанционном облучении источник ионизирующего излучения находится на расстоянии — вне тела пациента и вне опухолевой мишени. В зависимости от типа излучающего аппарата дистанционная лучевая терапия включает в себя рентгенотерапию, телегамматерапию, электронную и протонную терапию. Наиболее распространенным вариантом дистанционной лучевой терапии в настоящее время является облучение высокоэнергетическими фотонами и пучками электронов на медицинских ускорителях электронов. Современные модели ускорителей с помощью компьютерного управления параметрами и геометрией пучка излучения обеспечивают максимальное соответствие формы очага-мишени и распределения в нем дозы облучения. Возможность формирования пучков тормозного (фотонного) и корпускулярного (электронного) излучения с различной мощностью — от 6 МэВ до 18-20 МэВ — позволяет облучать как поверхностные, так и расположенные глубоко в тканях тела объекты.
Особое внимание в настоящее время приковано к протонной терапии. Первый в России клинический центр протонной терапии был построен в Санкт-Петербурге. Преимущество метода состоит в особенности тяжелых заряженных частиц (протонов). Протоны максимально высвобождают энергию торможения в конце пути своего пробега, причем спад дозы от 90% до 20% происходит на дистанции 2-5 мм. Такая возможность концентрации дозы в конце пробега частицы позволяет не только наилучшим образом сконцентрировать дозу, но и минимизировать лучевую нагрузку на ткани по ходу пучка и за патологическим очагом. Протонная терапия актуальна в онкоофтальмологии, радионейрохирургии, и особенно для пациентов детского возраста. В настоящее время сфера применения протонной терапии расширяется, однако пока использование метода существенно ограничивается его высокой стоимостью.
Современной технологией дистанционного облучения является стереотаксическая лучевая терапия – метод высокопрецизионного крупнофракционного облучения опухолей размером не более 5 см. В отличие от радиохирургии, разработанной для лечения опухолей головного мозга, использующей однократное облучение, общее число фракций при стереотаксическом облучении варьирует от 1 до 5-6. Разовая очаговая доза составляет от 8 Гр до 20 Гр, суммарная эквивалентная поглощенная доза от 50 Гр до 150 Гр, что существенно выше, чем при классическом варианте фракционирования лучевой терапии. Гамма-нож — один из видов лучевых установок для стереотаксического облучения новообразований головного мозга. Ускорители с микролепестковыми коллиматорами позволяют производить стереотаксическое облучение любых очагов (головной мозг, предстательная железа, легкое, кости, печень, поджелудочная железа, лимфоузлы, мягкие ткани). При стереотаксическом облучении обязательно учитываются смещения очага, возникающие при дыхании. Для этого запись КТ-изображений при КТ-симуляции производится с синхронизацией дыхательного цикла (4D лучевая терапия).
Контактная лучевая терапия
При контактной лучевой терапии или брахитерапии, источник излучения вводится внутрь пораженного органа. Преимущества такого вида терапии – это короткий курс, высокая точность и низкая нагрузка на смежные органы, что очень важно для дальнейшего качества жизни пациентов. Для брахитерапии используются различные радиоактивные источники – изотопы кобальта (Co⁶⁰), иридия (Ir¹⁹²), цезия (Cs¹³⁶).
Контактная лучевая терапия имеет разновидности: аппликационная, внутриполостная, внутритканевая и радионуклиднаялучевая терапия.
Аппликационная лучевая терапия
При аппликационной лучевой терапии источник располагается на поверхности облучаемого наружного объекта (кожа).
Внутриполостная лучевая терапия
При внутриполостной лучевой терапии источник подводят напрямую к опухоли в полости органа. Наиболее часто применяется при раке прямой кишки, анального канала, пищевода, при внутрибронхиальных образованиях. Внутриполостная или внутрипросветная брахитерапия чаще используется как этап сочетанной лучевой терапии, до или после дистанционного облучения. Однако нередко брахитерапия как самостоятельный метод достаточна после малоинвазивных операций при ранних стадиях рака. При паллиативном лечении рака пищевода брахитерапия — эффективный способ устранения дисфагии (расстройства акта глотания).
Внутритканевая лучевая терапия
При внутритканевой лучевой терапии источник вводят в ткани самой опухоли. Внутритканевая брахитерапия наиболее распространена при опухолях предстательной железы, широко используется при облучении молочной железы, при опухолях головы и шеи и при новообразованиях в печени.
Радионуклидная лучевая терапия
Перспективы лучевой терапии
Основными векторами дальнейшего развития лучевой терапии являются усовершенствование методик визуально ориентированного подведения дозы, влияние на радиочувствительность опухолевых клеток с помощью радиомодификаторов, применений комбинаций лучевого лечения с новыми химио- и иммунотерапевтическими агентами.
Беседовала
Анастасия Башкова
практикант отдела по связям с общественностью НМИЦ онкологии им. Н. Н. Петрова
Санкт-Петербургский государственный университет
Высшая школа журналистики и массовых коммуникаций
В чем измеряется облучение при лучевой терапии
Должен ли я всегда проходить лечение в больнице?
Большинство лучевых терапий сегодня не требуют пребывания в стационарном отделении клиники. Пациент может ночевать дома и приходить в клинику амбулаторно, исключительно для проведения самого лечения. Исключением являются те виды лучевой терапии, которые требуют настолько масштабной подготовки, что идти домой просто не имеет смысла. То же касается и лечения, при котором необходимо хирургическое вмешательство, например, брахитерапия, при которой проводится облучение изнутри.
При некоторых сложных комбинированных химиолучевых терапиях также целесообразно оставаться в клинике.
Кроме того, возможны исключения при решении о возможном амбулаторном лечении, если общее состояние пациента не позволяет проводить лечение в амбулаторном режиме или если врачи считают, что регулярное наблюдение будет более безопасным для пациента.
Какую нагрузку я могу переносить во время лучевой терапии?
В конечном итоге и психическая ситуация оказывает свое влияние. Лечение на протяжении нескольких недель резко прерывает привычный ритм жизни, повторяется снова и снова, и уже само по себе утомительно и обременительно.
В целом, даже у пациентов с одним и тем же заболеванием медики наблюдают большие различия – некоторые не испытывают практически никаких проблем, другие отчетливо ощущают себя больными, их состояние ограничивают такие побочные эффекты, как усталость, головные боли или отсутствие аппетита, им необходимо больше покоя. Многие пациенты в целом чувствуют себя как минимум настолько хорошо, что в ходе амбулаторного лечения они ограничены при выполнении несложных дел только в умеренной степени, или же вовсе не ощущают никаких ограничений.
Разрешены ли более высокие физические нагрузки, например, занятия спортом или небольшие путешествия в перерывах между курсами лечения, должен решать лечащий врач. Тот, кто в период облучения хочет вернуться на свое рабочее место, также должен в обязательном порядке обсудить этот вопрос с врачами и кассой медицинского страхования.
На что мне следует обратить внимание в вопросе питания?
Влияние облучения или радионуклидной терапии на питание сложно описать в целом. Пациенты, которые получают высокие дозы облучения в области рта, гортани или горла, находятся абсолютно в другой ситуации, чем, например, пациенты с раком молочной железы, у которых пищеварительный тракт совершенно не попадает в лучевое поле и в случае с которыми лечение, в основном, проводится с целью для закрепления успеха операции.
Пациенты, у которых пищеварительный тракт не затрагивается в ходе лечения, обычно могут не опасаться возникновения каких – либо последствий со стороны питания и пищеварения.
Они могут питаться в обычном режиме, при этом, им необходимо обращать внимание на потребление достаточного количества калорий и на сбалансированное сочетание продуктов питания.
Как необходимо питаться при облучении головы или пищеварительного тракта?
В наблюдении и поддержке нуждаются особенно те пациенты, которые еще до начала облучения не могли нормально питаться, потеряли в весе и/или обнаруживали определенные дефициты. Вопрос о том, необходимо ли пациенту поддерживающее питание («Питание для космонавтов») или введение питательного зонда, решается в зависимости от индивидуальной ситуации, лучше всего до начала лечения.
Пациенты, у которых развивается тошнота или рвота, ассоциирующаяся по времени с облучением, должны обязательно поговорить со своими врачами на тему медикаментов, которые подавляют тошноту.
Помогают ли комплементарные или альтернативные лекарственные препараты, витамины и минеральные вещества справиться с последствиями облучения?
Из страха перед побочными действиями многие пациенты обращаются к средствам, о которых говорят, что они якобы могут защитить от лучевого поражения и возникновения побочных эффектов. Что касается продуктов, о которых спрашивают пациенты в информационной службе по раковым заболеваниям, то здесь мы приведем так называемый «список самых популярных препаратов», включающий комплементарные и альтернативные методы, витамины, минеральные вещества и другие биологически активные добавки.
Однако, подавляющее большинство из этих предложений вовсе не являются лекарственными препаратами и они не играют никакой роли в лечении рака. В частности, в отношении некоторых витаминов ведутся дискуссии о том, не могут ли они даже оказать отрицательное влияние на действие облучения:
Предполагаемая защита от побочных эффектов, которую предлагают так называемые поглотители радикалов или антиоксиданты, такие как витамин А, С или Е, как минимум теоретически, могла бы нейтрализовать необходимый эффект ионизирующего излучения в опухолях. То есть, защищенной была бы не только здоровая ткань, но и раковые клетки.
Первые клинические испытания на пациентах с опухолями головы и шеи, по всей видимости, подтверждают это опасение.
Могу ли я предотвратить повреждение кожи и слизистой оболочки при помощи правильного ухода?
Первые симптомы реакции часто похожи на легкий солнечный ожог. Если же образуются более интенсивные покраснения или даже волдыри, то пациентам следует обратиться к врачу, даже если врачебный прием не был назначен. В долгосрочной перспективе облученная кожа может изменить пигментацию, то есть, стать либо немного темнее, либо светлее. Могут разрушаться потовые железы. Однако, на сегодняшний день тяжелые повреждения стали очень редкими.
Как должен выглядеть уход за зубами?
Для пациентов, которым должно проводиться облучение головы и/или шеи, уход за зубами представляет собой особую проблему. Слизистая оболочка относится к тканям, клетки которых очень быстро делятся, и она страдает от лечения больше, чем, например, кожа. Маленькие болезненные ранки являются достаточно частыми. Риск развития инфекций возрастает.
Если это вообще возможно, перед началом облучения необходимо проконсультироваться со стоматологом, возможно даже в стоматологической клинике, которая имеет опыт в подготовке пациентов к проведению лучевой терапии. Дефекты зубов, если они есть, следует устранить до начала лечения, однако, часто это невозможно осуществить вовремя по практическим причинам.
Во время облучения специалисты рекомендуют чистить зубы тщательно, но очень осторожно, чтобы уменьшить количество бактерий в полости рта, несмотря на возможно поврежденную слизистую оболочку. Чтобы защитить зубы многие радиологи совместно с лечащими стоматологами проводят профилактику фтором с применением гелей, которые используются как зубная паста или же в течение некоторого времени воздействуют непосредственно на зубы через каппу.
Будут ли у меня выпадать волосы?
Выпадение волос при облучении может возникнуть только в том случае, если покрытая волосами часть головы находится в лучевом поле, а доза излучения является относительно высокой. Это касается и волосяного покрова на теле, который попадает в лучевое поле. Таким образом, адъювантное облучение груди при раке молочной железы, например, не влияет на волосы головы, ресницы или брови. Только рост волос в подмышечной области с пораженной стороны, которая попадает в поле излучения, может стать более скудным. Тем не менее, если волосяные фолликулы действительно повреждены, то до того момента, пока снова не появится видимый рост волос, может пройти полгода и больше. Каким образом должен выглядеть уход за волосами в это время, необходимо обсудить с врачом. Важной является хорошая защита от солнечных лучей для кожи головы.
Некоторые пациенты после облучения головы вынуждены считаться с тем, что на протяжении некоторого времени рост волос непосредственно в месте попадания лучей будет скудным. При дозах выше 50 Грей специалисты в области лучевой терапии исходят из того, что не все волосяные луковицы смогут снова восстановиться. До настоящего времени не существует эффективных средств для борьбы или профилактики этой проблемы.
Буду ли я «радиоактивным»? Должен ли я держаться подальше от других людей?
Это необходимо уточнить
Спросите об этом Ваших врачей! Они объяснят Вам, будете ли Вы вообще контактировать с радиоактивными веществами. При обычном облучении этого не происходит. Если Вы все-таки будете контактировать с такими веществами, Вы и Ваша семья получите от врачей несколько рекомендаций по защите от излучения.
Этот вопрос беспокоит многих пациентов, а также их близких, прежде всего, если в семье есть маленькие дети или беременные.
При «нормальной» чрескожной лучевой терапии сам пациент все же не является радиоактивным! Лучи пронизывают его тело и там отдают свою энергию, которую поглощает опухоль. Радиоактивный материал не используется. Даже тесный физический контакт полностью безопасен для родственников и друзей.
При брахитерапии радиоактивный материал может оставаться в теле пациента в течение непродолжительного времени. Пока пациент «испускает лучи» он, как правило, остается в больнице. Когда врачи дают «зеленый свет» для выписки, опасности для семьи и посетителей больше нет.
Имеются ли отдаленные последствия, которые я должен принимать в расчет даже через несколько лет?
Лучевая терапия: у многих пациентов после облучения не остается никаких видимых изменений на коже или внутренних органах. Тем не менее, им необходимо знать, что облученная однажды ткань на длительное время остается более восприимчивой, даже если это не очень заметно в повседневной жизни. Однако, если учитывать повышенную чувствительность кожи при уходе за телом, при лечении возможных раздражений, возникших вследствие воздействия солнечных лучей, а также при механических нагрузках на ткань, то обычно мало что может случиться.
При проведении медицинских мероприятий в области бывшего поля облучения, при заборах крови, физиотерапии и т.д., ответственному специалисту необходимо указать на то, что ему следует соблюдать осторожность. В противном случае даже при незначительных повреждениях существует опасность, что при отсутствии профессиональной обработки процесс заживления будет протекать неправильно и образуется хроническая рана.
Поражение органов
Не только кожа, но и каждый орган, который получил слишком высокую дозу излучения, может реагировать на облучение изменением тканей.
Сюда относятся рубцовые изменения, при которых здоровая ткань замещается менее эластичной соединительной тканью (атрофия, склерозирование), а функция самой ткани или органа утрачивается.
Поражается также и кровоснабжение. Оно или является недостаточным, так как соединительная ткань хуже снабжается кровью через вены, или же образуются множественные маленькие и расширенные венки (телеангиэктазии). Железы и ткани слизистых оболочек после облучения становятся очень чувствительными и по причине рубцовой перестройки реагируют на мельчайшие изменения залипанием.
Какие органы поражаются?
Как правило, поражаются только те области, которые действительно находились в лучевом поле. Если орган поражается, то рубцовая перестройка, например, в слюнных железах, ротовой полости и других отделах пищеварительного тракта, во влагалище или в мочеполовом тракте, при определенных обстоятельствах фактически приводит к утрате функций или к образованию создающих препятствия сужений.
Головной мозг и нервы также могут поражаться высокими дозами излучения. Если матка, яичники, яички или предстательная железа находились в траектории лучей, то способность к зачатию детей может быть утрачена.
Возможно также повреждение сердца, например, у пациентов с раковыми заболеваниями, в случае с которыми при облучении грудной клетки не было возможности обойти сердце.
Из клинических и доклинических исследований радиологам известны специфические для конкретных тканей дозы облучения, при использовании которых можно ожидать появления подобных или других тяжелых повреждений. Поэтому они пытаются, насколько это возможно, избегать таких нагрузок. Новые техники прицельного облучения облегчили эту задачу.
Если нельзя добраться до опухоли, не облучая попутно чувствительный орган, то пациенты вместе со своими врачами, должны совместно обдумать соотношение пользы и риска.
Вторичные раковые заболевания
В самом неблагоприятном случае отсроченные последствия в здоровых клетках приводят также к возникновению спровоцированных облучением вторичных опухолей (вторичных карцином). Они объясняются стойкими изменениями генетического вещества. Здоровая клетка может устранить такие повреждения, но только до определенной степени. При определенных условиях они все-таки передаются дочерним клеткам. Возрастает риск, что при дальнейшем делении клеток появится еще больше повреждений и в итоге возникнет опухоль. В целом, риск после облучений является небольшим. Зачастую может пройти несколько десятков лет, прежде чем такая «ошибка» действительно возникнет. Однако, большинство всех облученных пациентов с раковыми заболеваниями заболевают уже во второй половине своей жизни. Это необходимо учитывать при сравнении возможных рисков и пользы от лечения.
Кроме того, нагрузка при новых методах облучения намного меньше, чем при тех методах, которые применялись еще пару десятилетий назад. Например, у молодых женщин, которые по причине лимфомы получили обширное облучение грудной клетки, то есть, так называемое облучение через магнитное поле вокруг оболочки, как правило, несколько повышен риск развития рака молочной железы. По этой причине в рамках лечения лимфом врачи пытаются применять обширные облучения как можно реже. Среди пациентов с раком предстательной железы, которые проходили лучевую терапию до конца 80-х годов с использованием обычных для того времени методов, риск развития рака кишечника выше в сравнении со здоровыми мужчинами. Актуальное исследование американских ученых показывает, что примерно с 1990 года риск значительно снизился – применение более новых и намного более целенаправленных техник облучения сегодня ведет к тому, что у большинства мужчин кишечник больше совсем не попадает в лучевое поле.